Гепатоцеллюлярная карцинома (ГЦК) является самой частой первичной опухолью печени с агрессивным течением и неблагоприятным прогнозом. В случае поздней диагностики и несвоевременного лечения пятилетняя выживаемость не превышает 15 % [1]. ГЦК занимает 5-е место среди наиболее распространенных злокачественных опухолей и второе — по смертности от онкологических заболеваний [2–4].
Большая часть случаев ГЦК приходится на азиатские и африканские страны. Наиболее высокая заболеваемость ГЦК регистрируется в странах Ближнего Востока и Восточного Средиземноморья (120 случаев на 100 000 населения), хотя в Иране, Ливане, Турции и Йемене этот показатель является одним из самых низких в мире. В Северной Америке и Европе распространенность ГЦК относительно низкая — не более 5 случаев на 100 тыс. населения в год [4], однако последние десятилетия отмечены ростом заболеваемости. К примеру, в США за последние 30 лет частота ГЦК почти утроилась и данная опухоль является наиболее частой причиной смерти от рака [5].
В Украине в 2014 г. рак печени диагностирован у 1344 пациентов [6]. Согласно данным Национального канцер-регистра, в 2015 г. выявлен 1301 случай заболевания раком печени, что составляет 3,6 на 100 000 населения. Смертность от ГЦК составила 2,8 на 100 000 населения в год (1014 случаев). По данным базы GLOBOCAN 2012 г., которая поддерживается Международной организацией по исследованию рака, Украина имеет самые низкие показатели по заболеваемости и смертности от ГЦК (2,1 и 2,2 соответственно) среди 29 стран, включенных в упомянутый регистр [7–10]. С учетом того, что частота ГЦК напрямую коррелирует с распространенностью вирусных гепатитов в популяции (см. ниже), а Украина по этому показателю превосходит европейские страны в 2,8–45 раз, складывается впечатление, что заявленная частота ГЦК в Украине намного меньше реальной.
Факторы риска развития ГЦК
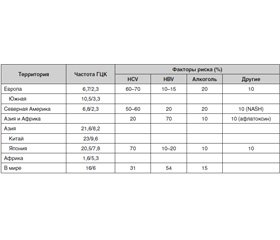
Основным фактором риска развития ГЦК является цирроз печени (ЦП), который диагностируют у 80 %, а по некоторым данным — у 90 % пациентов с ГЦК [11–13]. Поскольку главными этиологическими факторами развития цирроза являются вирусные гепатиты и жировая болезнь печени (алкогольная и неалкогольная), существует тесная связь между распространенностью этих заболеваний и частотой ГЦК в популяции (табл. 1) [14].
/24-1.jpg)
Факторами, увеличивающими риск развития ГЦК у больных гепатитом, являются мужской пол, коинфекция другими гепатотропными вирусами и ВИЧ. Например, при хроническом гепатите сочетанной этио–логии HBV + HCV кумулятивный риск развития ГЦК повышается примерно на 35 % [15]. Немаловажное значение имеет возраст, в котором происходит инфицирование гепатитом. Так, в Японии, где заражение гепатитом С происходит в зрелые годы, средний возраст больных с ГЦК составляет 70–80 лет. В странах Азии и Африки, где превалируют вирус гепатита В и вертикальный путь передачи, возраст больных составляет 40–50 лет, а по некоторым данным — от 19 до 35 лет [16, 17]. Среди популяции, средний возраст которой составляет 70 лет, заболеваемость ГЦК увеличивается на 1 % ежегодно [18].
Главным этиологическим фактором ГЦК является HBV-инфекция: примерно 55 % случаев ГЦК в мире и до 80 % — в эндемичных по HBV-инфекции регионах (Восточная Азия, Африка) обусловлено вирусом гепатита В [19]. Это связано с большей численностью популяции больных гепатитом В, чем гепатитом С, и, в меньшей степени, с возможностью развития ГЦК у HBV-инфицированных пациентов без цирроза. Риск развития ГЦК выше у HBeAg-положительных пациентов, с высокой вирусной нагрузкой, зависит от генотипа вируса и расовой принадлежности (выше у азиатов и африканцев) [20, 21]. Ежегодная заболеваемость ГЦК у носителей вируса без цирроза печени составляет 0,5 %, с циррозом — 2,5 % [22, 23].
Напротив, в Европе и Северной Америке основной причиной ГЦК является хронический гепатит С [24, 25]. В США примерно в половине случаев трансплантации печени, связанной с ГЦК, причиной опухоли был гепатит С и только в 15 % — гепатит В. У 5 % пациентов выявлены маркеры обоих вирусных гепатитов. При этом заболевании частота ГЦК возрастает по мере прогрессирования фиброза — от 0,5 % при стадии F0/F1 до 7,9 % при F4 (циррозе печени) [26–28]. 31,5 % больных с ГЦК умирает в первый год после установления диагноза [32].
Дополнительным доводом в пользу значимости вирусных гепатитов как этиологического фактора ГЦК является тот факт, что успешная противовирусная терапия существенным образом влияет на возможность развития опухоли: пятилетний кумулятивный риск ГЦК у больных, получивших лечение, снижается на 7,8 и 7,1 % при HCV- и HBV-инфекции соответственно [29, 30]. Однако даже у излечившихся от гепатита С пациентов, имевших изначально тяжелый фиброз или цирроз печени, опухоль может развиваться, в связи с чем такие больные должны проходить регулярные скрининговые обследования на ГЦК [31–33].
Следующим по значимости фактором риска развития цирроза и ГЦК является алкогольная болезнь печени. В США последняя является причиной около 15 % всех случаев ГЦК в стране [34]. У лиц, длительно и регулярно злоупотребляющих алкоголем, вероятность развития ГЦК увеличивается в 2–4 раза [35]. Повышенный риск развития цирроза отмечается при систематическом употреблении алкоголя женщинами в дозе более 10–20 г в сутки (в пересчете на этанол) и более 20–40 г — мужчинами. Постоянное ежедневное потреб–ление алкоголя, по сравнению с эпизодами пьянства, является более вредным.
Частоту ГЦК у больных с неалкогольным стеатогепатитом (НАСГ) оценивают на уровне 2,6 % в год. [36–38]. То есть неалкогольная жировая болезнь печени (НЖБП) гораздо реже приводит к развитию цирроза, а прогрессирование заболевания занимает намного больше времени, чем у больных вирусным гепатитом. Тем не менее, с учетом значительного превалирования НЖБП над вирусными гепатитами, НЖБП в настоящее время и в ближайшей перспективе будет ведущей причиной цирроза и ГЦК в США и некоторых азиатских странах. Риск ГЦК возрастает у больных с метаболическим синдромом и сахарным диабетом [39–41]. Есть данные, что курение может быть дополнительным фактором риска [42]. Как и при вирусных гепатитах, ГЦК диагностируют в основном у больных с циррозом печени, однако развитие опухоли возможно и у пациентов с тяжелым фиброзом.
Развитие ГЦК возможно и в исходе относительно редко встречающихся заболеваний печени, связанных с врожденными нарушениями метаболизма (наследственный гемохроматоз, хроническая гематопорфирия, дефицит α1-антитрипсина и болезнь Вильсона — Коновалова), аутоиммунном гепатите и первичном билиарном циррозе [43–46].
Скрининг на ГЦК
Своевременной можно признать исключительно доклиническую диагностику ГЦК, которая возможна только при целенаправленном скрининге на это заболевание. Категории пациентов и методика скрининга обсуждаются во многих публикациях, главными из которых, на наш взгляд, являются совместное руководство Европейской ассоциации по изучению печени (EASL) и Европейской организации по исследованию и лечению рака (EORTC) и рекомендации Американской ассоциации по изучению заболеваний печени (AASLD) [47–49].
При определении категорий пациентов, подлежащих скринингу, исходят из наличия у них факторов риска развития ГЦК, главным из которых является цирроз печени. Скрининг рекомендован пациентам:
— с циррозом печени, класс A и B по Чайлду — Пью;
— циррозом печени, класс С по Чайлду — Пью, ожидающим трансплантацию печени;
— активным гепатитом B без цирроза или с ГЦК в семейном анамнезе;
— хроническим гепатитом С и выраженным фиброзом печени (F3 по METAVIR);
— излеченным хроническим гепатитом С с выраженным фиброзом или ЦП [50, 64].
Главным методом скрининга на ГЦК является ультразвуковое исследование (УЗИ) печени, несмотря на то, что чувствительность метода варьирует, по данным разных авторов, от 33 до 96 % (табл. 2).
/25-1.jpg)
При диагностике ГЦК методом УЗИ исходят из того, что любое очаговое образование печени, выявленное на фоне цирроза, необходимо априори трактовать как злокачественное и проводить дополнительное обследование с помощью лучевых методов. Низкая чувствительность метода у некоторых больных связана с тем, что выявить очаговые образования на фоне цирротически измененной ткани печени довольно сложно, особенно при наличии выраженной узловой регенерации и небольшого размера опухоли [52]. Помимо этого, очаги ГЦК могут иметь разную эхоструктуру (гипо-, гиперэхогенные или мишеневидные образования), иногда напоминая регенеративные узлы при циррозе или гемангиомы. Чаще всего при УЗИ печени ГЦК размером менее 3 см представлена хорошо ограниченным гипоэхогенным образованием; очаги более 3 см отличаются наличием стеатоза, кальцификации, некротических изменений и кровоизлияний и лоцируются как гиперэхогенные.
Использование ультразвукового контрастного вещества (CEUS- contrast-enhancedultrasound) позволило повысить диагностическую точность УЗИ и снизило частоту последующего использования других методов визуализации и биопсии печени с целью окончательной верификации диагноза ГЦК. Однако чувствительность метода при обнаружении узлов малого размера такая же, как и у обычного УЗИ, в связи с чем CEUS не рассматривается в качестве метода скрининга на ГЦК в большинстве стран Евросоюза и США [53–56].
Пациентам, подлежащим скринингу на ГЦК, следует рекомендовать проведение УЗИ каждые 6 месяцев. Данные рекомендации основываются на том, что для увеличения размера опухоли в 2 раза требуется от 80 до 117 дней [57]. Более частое УЗИ (каждые 3 месяца) не дает преимуществ в выявлении очагов ГЦК малого размера [58], а увеличение интервалов между обследованиями до 9–12 месяцев, наоборот, снижает чувствительность метода с 70 до 50 % [59]. Кроме того, обследование каждые 6 месяцев обеспечивает наибольшую экономическую эффективность [60].
Хотя большинство исследователей сходятся во мнении, что УЗИ уступает по диагностической значимости лучевым методам — КТ и МРТ [61, 62], последние не используются для скрининга на ГЦК, что объясняется большей стоимостью метода, риском негативного кумулятивного влияния рентгеновского облучения (в случае использования КТ) и возможностью нарушения функции почек у больных с гепаторенальным синдромом при применении йодсодержащих контрастов [63].
Серологические маркеры
Серологические и генетические маркеры для диагностики ГЦК условно можно разделить на несколько групп: онкофетопротеины и гликопротеины (включая наиболее известный из них — альфа-фетопротеин (АФП), а также его L3-фракцию), дез-γ-карбоксипро–тромбин (DCP), глипикан-3 (GPC3); ростовые факторы и рецепторы к ним (например, трансформирующий фактор роста β — ТФР-β, опухоль-специфический фактор роста, фактор роста эндотелия, фактор роста гепатоцитов, или рассеивающий фактор и др.); молекулярные маркеры (микро-РНК и пр.) [64].
Альфа-фетопротеин и его изоформы
Чаще всего для серологической диагностики ГЦК используют альфа-фетопротеин (АФП). Необходимо иметь в виду, что частота так называемых АФП-позитивных ГЦК не превышает 80 % (в среднем 70 %), и только небольшая доля опухолей (10–20 %) может быть выявлена по изменению уровня АФП на ранних стадиях развития.
В том случае, когда за верхнюю границу нормы АФП принимают 20 нг/мл, чувствительность и специфичность показателя в диагностике ГЦК составляет 41–65 и 80–94 % соответственно. При использовании более высоких уровней верхней границы нормы (200 нг/мл) чувствительность падает до 22 % при возрастании специфичности. Ложноположительные результаты могут быть получены при активном течении основного заболевания печени (например, вирусного гепатита), при беременности, наличии отдельных эмбриогенных опухолей и злокачественных образованиях органов желудочно-кишечного тракта (ЖКТ). Ложноотрицательные результаты, как было отмечено выше, могут быть получены при малых размерах опухоли, которая экс–прессирует АФП в количестве, не превышающем ниж–нюю границу чувствительности метода. Примерно у 50 % больных уровень АФП не превышает 20 нг/мл, а у трети — 400 нг/мл даже при значительном объеме опухолевой ткани. И только у 1/5 больных уровень АФП коррелирует со стадией заболевания [65–67].
В связи с вышеизложенным АФП может рассматриваться только как дополнительный скрининговый маркер ГЦК. Чаще всего его используют в комбинации с УЗИ, что позволяет повысить частоту выявления ГЦК [68]. Стандартный интервал между обследованиями, как и при использовании только УЗИ, составляет 6 месяцев [50, 68, 69].
Дополнительное изучение строения и состава молекул сывороточного АФП позволило выявить гетерогенность данного маркера и выделить 3 его гликоформы (L1, L2 и L3) в зависимости от способности каждой из изоформ реагировать с агглютинином чечевицы (LCA-лектином). Экспрессия изоформы АФП-L1 наи–более характерна для доброкачественных заболеваний печени. Напротив, АФП-L3 обнаруживается лишь у больных с ГЦК. Так как уровень АФП-L3 и АФП не коррелирует, первый показатель может быть с успехом использован в диагностике ГЦК небольшого размера (до 2 см): чувствительность и специфичность его составляют 42,5 и 46,0 % соответственно [71].
Дез-γ-карбоксипротромбин (DCP, PIVKAII)
Данный маркер представляет собой измененный неактивный белок протромбин, индуцируемый отсутствием витамина К типа II (известный как PIVKA II). В случае злокачественной трансформации в гепатоцитах происходит нарушение витамин-К-зависимого пути карбоксилирования γ-глутаминовой кислоты, что ведет к образованию дез-γ-карбоксипротромбина (DCP). При наличии ГЦК уровень данного белка значительно превышает таковой у больных с хроническим гепатитом или ЦП. Ранее утверждалось, что чувствительность DCP зависит от размеров опухоли: так, в случае размеров новообразования более 5 см она сопоставима с чувствительностью АФП [72]. В последних исследованиях было установлено, что диагностическая точность определения уровня DCP выше, чем АФП, независимо от размеров опухоли (< 3 или 5 см), что делает DCP ценным биомаркером ГЦК [73].
Использование комбинации двух сывороточных маркеров (AFP + DCP) позволяет повысить диагностическую точность метода, в частности для оценки риска рецидива ГЦК в течение 6 месяцев после хирургического лечения. Концентрация DCP прямо пропорциональна размерам опухоли, степени сосудистой инвазии и в настоящее время рассматривается в качестве одного из перспективных показателей в ранней диагностике ГЦК наряду с АФП и его L3-изоформой [74].
Еще одним методом, увеличивающим чувствительность сывороточных биомаркеров в диагностике ГЦК, является их комбинированное использование. Одно–временное использование AFP, AFP-L3 и DCP повышает чувствительность до 94 % и специфичность до 86 %. Использование только DCP и AFP дает худшие результаты (61 и 83 % соответственно). Данные, приведенные в табл. 4, дают основание считать, что комбинация нескольких сывороточных маркеров повышает как специфичность, так (в особенности) и чувствительность диагностического теста на ГЦК. Однако остается неясным, имеет ли преимущество комбинация маркеров перед их раздельным определением в диагностике опухолей малого размера и прогнозе дальнейшего развития ГЦК.
Таким образом, ГЦК является одной из форм конечной стадии любого хронического прогрессирующего заболевания печени. Главным фактором, связанным с развитием ГЦК, является цирроз печени. Наличие одновременно нескольких заболеваний печени увеличивает риск развития ГЦК, однако точные механизмы, ведущие к канцерогенезу у конкретного пациента, неизвестны. Своевременная диагностика ГЦК предполагает выявление опухоли на доклинической стадии. Единственно возможным способом реализации этого положения является скрининг. Все национальные и континентальные руководства рассматривают периодическое ультразвуковое исследование печени как метод выбора для скрининга на ГЦК. Однако недостатком этого метода исследования является невысокая чувствительность в выявлении опухолей малого размера у больных с узловой цирротической трансформацией печени. Комбинированное использование УЗИ и альфа-фетопротеина повышает точность диагностики, однако незначительно увеличивает чувствительность метода в выявлении опухолей малого размера. Выходом может быть использование комбинированных сывороточных маркеров, в частности AFP-L3% + DCP + AFP. Одновременное исследование комбинации сывороточных маркеров и УЗИ печени, по всей видимости, является оптимальным подходом для раннего выявления ГЦК, однако требуются специальные исследования для уточнения чувствительности и специфичности данного метода диагностики.
Конфликт интересов. Не заявлен.
Список литературы
1. Siegel R. et al. Cancer statistics // CA. Cancer J. Clin. 2014; Vol. 64, № 1: P. 9-29.
2. Seyed Moayed Alavian, Hossein Haghbin. Relative Importance of Hepatitis B and C Viruses in Hepatocellular Carcinoma in EMRO Countries and the Middle East // A Systematic. Review He–pat. Mon. 2016 Mar; 16(3): e35106.
3. Ferlay J. et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN2012 // Int. J. Cancer. 2015; Vol. 136, № 5: P. E359-E386.
4. Tejeda-Maldonado J., García-Juárez I., Aguirre-Valadez J., González-Aguirre A., Vilatobá-Chapa M., Armengol-Alonso A. et al. Diagnosis and treatment of hepatocellular carcinoma // World J. Hepatol. 2015; № 7: P. 362-376.
5. El-Serag H.B., Kanwal F. Epidemiology of hepatocellular carcinoma in the United States: where are we? Where do we go? // Hepatology. 2014; 60: 1767-1775.
6. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. Рак в Україні, 2014–2015 // Бюл. Нац. Канцер-реєстру України. — 2016. — № 17. — 144 с.
7. Sunkara V., Hebert J.R. The application of the mortality-to-incidence ratio for the evaluation of cancer care disparities globally // Cancer. 2016; 122: 487-488.
8. Sunkara V., Hebert J.R. The colorectal cancer mortality-to-incidence ratio as an indicator of global cancer screening and care // Cancer. 2015; 121: 1563-1569.
9. Chen S.L., Wang S.C., Ho C.J., Kao Y.L., Hsieh T.Y., Chen W.J. et al. Prostate cancer mortality-to-incidence ratios are associated with cancer care disparities in 35 countries // Sci Rep. 2017; 7: 40003.
10. Wang S.C., Sung W.W., Kao Y.L., Hsieh T.Y., Chen W.J., Chen S.L. et al. The gender difference and mortality-to-incidence ratio relate to health care disparities in bladder cancer: national estimates from 33 countries // Scientific reports. 2017; 7: 4360.
11. Beasley R.P., Hwang L.Y., Lin C.C., Chien C.S. Hepatocellular carcinoma and hepatitis B virus. A prospective study of 22 707 men in Taiwan // Lancet. 1981; 2 (8256): 1129-33.
12. Amit G. Singal, Pillai A., Tiro A. Early detection, curative treatment, and survival rates for hepatocellular carcinoma surveillance in patients with cirrhosis: a meta-analysis // PLOS One 2014; 11 (4): e1001624.
13. Siegel R., Naishadham D., Jemal A. Cancer statistics 2013 // CA Cancer J. Clin. 2013; 63 (1): 11-30
14. EASL-EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma // Journal of Hepatology. 2012; Vol. 56: 908-943.
15. Perz J.F., Armstrong G.L., Farrington L.A., Hutin Y.J., Bell B.P. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide // J. Hepatol. 2006; 45(4): 529-38.
16. Parkin D.M. The global health burden of infection-associa–ted cancers in the year 2002 // Int. J. Cancer. 2006; 118(12): 3030-44.
17. Tejeda-Maldonado J., García-Juárez I., Aguirre-Valadez J., González-Aguirre A., Vilatobá-Chapa M., Armengol-Alonso A. et al. Diagnosis and treatment of hepatocellular carcinoma: an update // World J. Hepatol. 2015; 7: P. 362-376.
18. Rosenthal E., Poiree M., Pradier C. et al. Mortality due to hepatitis C-related liver disease in HIV-infected patients in France (Mortavic 2001 study) // AIDS. 2003; Vol. 17: P. 1803-1809.
19. Perz J.F., Armstrong G.L., Farrington L.A., Hutin Y.J., Bell B.P. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide // J. Hepatol. 2006; 45(4): 529-38.
20. Liaw Y.F., Sung J.J., Chow W.C. et al. Lamivudine for patients with chronic hepatitis B and advanced liver disease // N. Engl. J. Med. 2004; Vol. 351: P. 1521-1531.
21. Stewart C.J.R., Coldewey J., Stewart I.S. Comparison of fine needle aspiration cytology and needle core biopsy in the diagnosis of radiologically detected abdominal lesions // J. Clin. Pathol. 2002; 55: 93-97.
22. Arguedas M.R., Chen V.K., Eloubeidi M.A., Fallon M.B. Screening for hepatocellular carcinoma in patients with hepatitis C cirrhosis: a cost-utility analysis // Am. J. Gastroenterol. 2003; Vol. 98: P. 679-690.
23. Hashem B., El-Serag H.B. Epidemiology of hepatitis C-related hepatocellular carcinoma. medscape // Medscape Gastroentero–logy. 2007. http: //www.medscape.com/viewarticle/560012
24. Bosch F.X., Ribes J., Borras J. Epidemiology of primary liver cancer // Semin Liver Dis. 1999; 19: 271-285.
25. Bruix J., Sherman M. Management of hepatocellular carcinoma // Hepatology. 2005; 42: 1208-1236.
26. Wörns M.A., Weinmann A., Pfingst K. et al. Safety and efficacy of sorafenib in patients with advanced hepatocellular carcinoma in consideration of concomitant stage of liver cirrhosis // J. Clin. Gastroenterol. 2009; 43 (5): 489-95.
27. Yoshida H., Shiratori Y., Moriyama M. et al. Interferon thera–py reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and non-cirrhotic patients with chronic hepatitis C in Japan. IHIT Study Group. Inhibition of hepatocarcinogenesis by interferon therapy // Ann. Intern. Med. 1999; 131 (3): 174-81.
28. Department of Health and Human Services Centers for Di–sease Control and Prevention. National Health and Nutrition Examination Survey. Available at: www.cdc.gov/nchs/data/nhanes/databriefs/viralhep.pdf. Accessed: February 19, 2009.
29. Morgan R.L., Baack B., Smith B.D. et al. Eradication of hepatitis C virus infection and the development of hepatocellular carcinoma: a meta-analysis of observational studies // Ann. Intern. Med. 2013; 158 (5 Pt 1): 329-37.
30. Levy I., Greig P.D., Gallinger S. et al. Resection of hepatocellular carcinoma without preoperative tumor biopsy // Ann. Surg. 2001; Vol. 234: P. 206-209.
31. Gurusamy K.S., Wilson R., Koretz R.L. et al. Is Sustained Virological Response a Marker of Treatment Efficacy in Patients with Chronic Hepatitis C Viral Infection with No Response or Relapse to Previous Antiviral Intervention? // PLOS One. 2013; 8 (12): e83313.
32. Volk M.L., Marrero J.A. Early detection of liver cancer: diagnosis and management // Curr. Gastroenterol. Rep. 2008; 10: 60-66.
33. Fattovich G., Stroffolini T., Zagni I., Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors // Gastroentero–logy. 2004; 127 (5 Suppl. 1): S35-S50.
34. Shen Y.C., Hsu C., Cheng C.C. et al. A critical evaluation of the preventive effect of antiviral therapy on the development of hepatocellular carcinoma in patients with chronic hepatitis C or B: a novel approach by using meta-regression // Oncology. 2012; 82 (5): 275-89.
35. Shen Y.C., Hsu C., Cheng C.C. et al. A critical evaluation of the preventive effect of antiviral therapy on the development of hepatocellular carcinoma in patients with chronic hepatitis C or B: a novel approach by using meta-regression // Oncology. 2012; 82 (5): 275-89.
36. Mittal S., El-Serag H.B. Epidemiology of hepatocellular carcinoma: consider the population // J. Clin. Gastroenterol. 2013; 47 (1): S2-S6.
37. Torres D.M., Harrison S.A. Nonalcoholic steatohepatitis and noncirrhotic hepatocellular carcinoma // Semin Liver Dis. 2012; 32 (1): 30-8.
38. Wong R., Corley D.A. Racial and ethnic variations in hepatocellular carcinoma incidence within the United States // Am. J. Med. 2008; 121 (6): 525-31.
39. McGlynn K.A., London W.T. The global epidemiology of hepatocellular carcinoma: present and future // Clin. Liver Dis. 2011; 15(2): 223-43. doi: 10.1016/j.cld.2011.03.006.
40. Bruix J., Sherman M. Management of hepatocellular carcinoma // Hepatology 2005; 42: 1208-1236.
41. Takamatsu S., Noguchi N., Kudoh A. et al. Influence of risk factors for metabolic syndrome and non-alcoholic fatty liver disease on the progression and prognosis of hepatocellular carcinoma // Hepatogastroenterology. 2008; 55: 609-614.
42. Blonski W., Kotlyar D.S., Forde K.A. Non-viral causes of hepatocellular carcinoma // World J. Gastroenterol. 2010; Vol. 16: P. 3603-3615.
43. Fattovich G., Stroffolini T., Zagni I., Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors // Gastroentero–logy. 2004; 127(5 Suppl 1): S35-S50.
44. Manns M.P., Czaja A.J., Gorham J.D. et al. Diagnosis and ma–nagement of autoimmune hepatitis // Hepatology. 2010; 51: 2193-213.
45. Beaton M.D., Adams P.C. Prognostic factors and survival in patients with hereditary hemochromatosis and cirrhosis // Can. J. Gastroenterol. 2006; 20: 257-260.
46. Bartlett D.L., Di Bisceglie A.M., Dawson L.A. Cancer of the liver / DeVita J.V.T., Lawrence T.S., Rosenberg S.A. еds. // Cancer: Principles and Practice of Oncology. 8th ed: Wolters Kluwer; Lippincott Williams & Wilkins; 2008: 1129-1156.
47. Song do S., Bae S.H. Changes of guidelines diagnosing hepatocellular carcinoma during the last ten-year period // Clin. Mol. Hepatol. 2012; 18: 258-267.
48. Davenport M.S., Khalatbari S., Liu P.S. et al. Repeatability of diagnostic features and scoring systems for hepatocellular carcinoma by using MR imaging // Radiology. 2014; 272: 132-142.
49. Bruix J., Sherman M. American Association for the Study of Liver Disease. Management of hepatocellular carcinoma: an update // Hepatology. 2011; 53: 1020-1022
50. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma // J. Hepatol. 2012; 56: 908-43.
51. Hina Arif-Tiwari, Bobby Kalb, Surya Chundru et al. MRI of hepatocellular carcinoma: an update of current practices // Diagn. Interv. Radiol. 2014; 20: 209-21.
52. Singal A.G., Conjeevaram H.S., Volk M.L. et al. Effectiveness of hepatocellular carcinoma surveillance in patients with cirrhosis // Cancer Epidemiol Biomarkers Prev. 2012; 21: 793-9.
53. Digumarthy S.R., Sahani D.V., Saini S. MRI in detection of hepatocellular carcinoma (HCC) // Cancer Imaging. 2005; 5: 20-4.
54. Sporea I., Badea R., Popescu A. et al. Contrast-Enhanced Ultrasound (CEUS) for the evaluation of focal liver lesions — a prospective multicenter study of its usefulness in clinical practice // Ultraschall Med. 2014.
55. Sporea I., Martie A., Bota S. et al. Characterization of focal liver lesions using contrast enhanced ultrasound as a first line method: a large monocentric experience // J. Gastrointestin. Liver Dis. 2014; 23: 57-63.
56. Llovet J.M., Ducreux M. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma // J. Hepatol. 2012; 56: Р. 908-943.
57. Kubota K., Ina H., Okada Y., Irie T. Growth rate of primary single hepatocellular carcinoma: determining optimal screening interval with contrast enhanced computed tomography // Dig. Dis. Sci. 2003; 48: 581-6.
58. Trinchet J.C., Chaffaut C., Bourcier V. et al. Grouped’Etudeet de Traitement du CarcinomeHépatocellulaire (GRETCH). Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3- and 6-month periodicities // Hepatolo–gy. 2011; 54: 1987-97.
59. Sigal A., Volk M.L., WaljeeA. et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis // Aliment. Pharmacol. Ther. 2009; 30: 37-47.
60. Andersson K.L., Salomon J.A., Goldie S.J., Chung R.T. Cost effectiveness of alternative surveillance strategies for hepatocellular carcinoma in patients with cirrhosis // Clin. Gastroenterol. Hepatol. 2008; 6: 1418-24.
61. Yu N.C., Chaudhari V., Raman S.S. et al. CT and MRI improve detection of hepatocellular carcinoma, compared with ultrasound alone, in patients with cirrhosis // Clin. Gastroenterol. Hepatol. 2011; 9: 161-7.
62. Lee K.H., O’Malley M.E., Haider M.A., Hanbidge A. Triple-phase MDCT of hepatocellular carcinoma // AJR Am. J. Roentgenol. 2004; 182: 643-9.
63. Solomon R. Contrast-induced acute kidney injury: is there a risk after intravenous contrast? // Clin. J. Am. Soc. Nephrol. 2008; 3: 1242-3.
64. Yan-Jie Zhao, Qiang J.U., Guan-Cheng L.I. Tumor mar–kers for hepatocellular carcinoma (Review) // Molecular and clinical oncology. 2013; 1: 593-8.
65. Yamashita T., Forgues M., Wang W. et al. EpCAM and alpha-fetoprotein expression defines novel prognostic subtypes of hepatocellular carcinoma // Cancer Res. 2008; 68: 1451-61.
66. Villanueva A., Minguez B., Forner A. et al. Hepatocellular carcinoma: novel molecular approaches for diagnosis, prognosis, and therapy // Annu Rev. Med. 2010; 61: 317-28.
67. Hoshida Y., Nijman S.M., Kobayashi M. et al. Integrative transcriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma // Cancer Res. 2009; 69: 7385-92.
68. Lok A.S., Sterling R.K., Everhart J.E. et al. Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma // Gastroenterology. 2010; 138: 493-502.
69. Debruyne E.N., Delanghe J.R. Diagnosing and monitoring hepatocellular carcinoma with alpha-fetoprotein: new aspects and applications // Clin. Chim. Acta. 2008; 385: 19-26.
70. Zhang B.H. et al. // J. Cancer Res. Clin. Oncol. 2004; 130: 417-422.
71. Singhal A., Jayaraman M., Dhanasekaran D.N., Kohli V. Molecular and serum markers in hepatocellular carcinoma: predictive tools for prognosis and recurrence // Crit. Rev. Oncol. Hematol. 2012; 82: 116-40.
72. Nakamura S., Nouso K. et al. Sensitivity and specificity of des-gamma-carboxy prothrombin for diagnosis of patients with hepatocellular carcinomas varies according to tumor size // Am. J. Gastroenterol. 2006; 101: 2038-43.
73. Baek Y.H., Lee J.H., Jang J.S. et al. Diagnostic role and correlation with staging systems of PIVKA-II compared with AFP // Hepatogastroenterology. 2009; 56: 763-67.
74. Yamamoto K., Imamura H., Matsuyama Y. et al. AFP, AFP-L3, DCP and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathological variables of HCC // J. Gastroenterol. 2010; 45: 1272-82.

/24-1.jpg)
/25-1.jpg)
/26-1.jpg)