Вступ
У сучасній клінічній неврології фармакорезистент-ні лицьові симпаталгії мають важливе клініко-соціальне значення. Незважаючи на велику кількість робіт у цій галузі, чимало питань діагностики та патогенезу формування больових розладів залишаються не до кінця вивченими і потребують подальшого досконалого дослідження [1, 3, 4, 13]. У патогенезі больових процесів доведено роль нейроамінокислот у нейрогуморальному пошкодженні [10, 11, 14, 18]. На сьогодні діагностика з використанням серологічних біомаркерів фармакорезистентних лицьових симпаталгій та їх послідовне лікування посідають провідне місце в клінічній неврологічній і нейрохірургічній практиці й активно розробляються як зарубіжними, так й вітчизняними дослідниками [3, 8, 17]. Значна увага в цьому аспекті приділяється визначенню в крові рівня нейротрансмітерів і показників ГАМКергічного обміну: у багатьох експериментальних і клінічних працях показано, що глутамат і гамма-аміномасляна кислота (ГАМК) є модуляторами не тільки судомної та нейропластичної активності головного мозку, але й беруть участь у нейроексайтотоксичному процесі, прямо або опосередковано регулюють основні процеси формування больового порогу, агресію та тривогу, синаптичну пластичність, емоції, пам’ять. За даними літератури, невивченими залишаються питання функціонального стану ГАМКергічної системи у хворих із фармакорезистентними лицьовими симпаталгіями та їх вплив на формування тих чи інших неврологічних проявів, вираженість больового синдрому у даної категорії хворих [4, 7, 9, 12, 15, 16]. Визначення вмісту показників ГАМКергічного обміну, зокрема глутамату, аспартату та ГАМК, у сироватці крові цієї категорії хворих, їх порівняння та кореляційні взаємозв’язки з неврологічними даними та типом перебігу прозопалгій дасть можливість підвищити якість клінічної діагностики, визначити особливості патогенезу, розробити диференційно-діагностичні й, можливо, прогностичні критерії перебігу больового синдрому.
Метою даного дослідження було вивчення вмісту нейроамінокислот глутамату, аспартату та гамма-аміномасляної кислоти в сироватці крові хворих із фармакорезистентними лицьовими симпаталгіями та їх вплив на формування тих чи інших неврологічних прояв і вираженість больового синдрому.
Матеріали та методи
У даній роботі базовий вміст глутамату, аспартату та ГАМК у сироватці крові обстежених хворих було визначено методом високовольтного електрофорезу з послідовним кількісним аналізом виділених фракцій спектрофотометричним методом [2] на спектрофотометрі СФ-46. У пацієнта брали кров, відстоювали та екстрагували її. Екстракцію проводили 96% етиловим спиртом при кип’ятінні проб на водяній бані протягом 10 хвилин із подальшим центрифугуванням при 5 тис/об, надосадову рідину випарювали насухо при 60 ºС. Сухий залишок розчиняли у воді в співвідношенні 0,1 мл крові на 0,15 мл води та наносили на смуги хроматографічного паперу (l = 58 см; d = 8 см). У дослідженні було використано стандартні зразки ГАМК, глютамінової та аспарагінової амінокислот фірми Sigma (США). Концентрації стандартів — по 0,025–0,2 мкМ у пробі; об’єм — 0,01 мл. Електрофорез застосовували протягом 3 годин при Е = 600 V у піридин-оцтовому буфері. Після електрофорезу смуги хроматографічного паперу було висушено у потоці повітря упродовж 1–2 годин (до зникнення запаху піридину), забарвлення робили нінгідрином. Плями, відповідно до амінокислот, вирізали, нінгідрин екстрагували 60% спиртом з 0,005% CuSo4. Колориметрування проводили при λ = 540 проти контролю (ділянка хроматографічного паперу, екстрагована спиртом).
Математичний аналіз отриманого цифрового матеріалу здійснювали за допомогою комп’ютерного пакета для обробки й аналізу статистичної інформації Statistica 5.5.
Клініко-неврологічне дослідження хворих проводилося за єдиною загальноприйнятою схемою обстеження, що включало збір та оцінку анамнезу, детальний опис нападів, неврологічний статус і нейропсихологічне обстеження, яке проводили з метою кількісної та якісної оцінки болю [5]. Кількісну оцінку вираженості больового синдрому проводили за допомогою візуальної аналогової шкали [6]. Після типового інструктажу хворому давали декілька десятисантиметрових вертикальних шкал із сантиметровими та міліметровими позначками, де позначці «0» дорівнювало поняття «відсутність болю», «10» — «максимальний рівень болю». Хворі відмічали рискою на шкалах рівень болю. Слабовиражений больовий синдром ми відзначали у хворих із показниками 1–3 бали, помірно виражений — при 4–6 балах, виражений — 7–9 балів, занадто тяжкий — 10 балів, хворих з останнім показником балів у дослідженні не було.
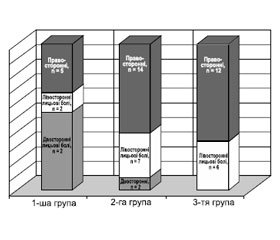
Під час дослідження обстежено хворих із фармакорезистентними лицьовими симпаталгіями (n = 56) з больовим синдромом різного ступеня вираженості та локалізації (рис. 1); у деяких обстежених спостерігались прості парціальні напади (3,57 % клінічних випадків). Серед досліджуваних пацієнтів було 29 (51,78 %) жінок та 27 (48,22 %) чоловіків віком від 26 до 58 років; середній вік обстежених хворих становив 36,1 ± 11,8 року. У контрольну групу увійшло 30 здорових осіб: серед них 15 (50 %) жінок і 15 чоловіків віком від 26 до 35 років, середній вік контрольної групи становив 27,50 ± 8,33 року. Всі хворі на момент обстеження проходили курс лікування в Інституті неврології, психіатрії та наркології й отримували базисну терапію протибольовими та судинними засобами у середньотерапевтичних дозах. Перебіг хвороби у даної категорії пацієнтів було розцінено як фармакорезистентний, хворі отримували стандартні протибольові засоби, такі як налбуфін (10 мг н/н), анальгін (500 мг н/н) з димедролом (20 мг н/н) та карбамазепін (600–1200 мг/добу), габапентин (300–600 мг/добу), що не мали вираженого терапевтичного ефекту. Фармакорезистентність — це неможливість досягнути повного або майже повного контролю больового пароксизму за допомогою адекватно підібраної терапії. Всі обстежені хворі були стійкими до різних методів консервативного лікування.
Результати та обговорення
Згідно з особливостями перебігу та ступенем вираженості больового синдрому всі досліджувані хворі були розподілені на три клінічні групи (за цифровою аналоговою шкалою). Клініко-неврологічна характеристика обстежених наведена у табл. 1.
/45-1.jpg)
До першої групи належали хворі з фармакорезистентними лицьовими симпаталгіями, негативним перебігом хвороби та дуже вираженим больовим синдромом (n = 15; 26,78 %), частими та вираженими больовими нападами. Під час дослідження було з’ясовано, що всі хворі цієї групи мають дуже виражені зміни вмісту глутамату, аспартату і ГАМК (табл. 2); рівень ГАМК у сироватці крові було вірогідно знижено на 2,87 мкмоль/л порівняно з контролем (p < 0,05), рівень глутамату крові було підвищено на 89,77 мкмоль/л порівняно зі здоровим контролем (p < 0,05). Вміст аспартату при цьому мав тенденцію до підвищення на 5,1 мкмоль/л порівняно з даними контролю (p > 0,05). Отримані результати свідчать про те, що перебіг хвороби у даної категорії хворих супроводжується певним підвищеним викидом медіаторів збудження, зокрема глутамату й аспартату, та зниженням рівня гальмування, що відображає низький рівень ГАМК. Аналіз ступеня відхилення від контрольних даних (t-критерій) рівнів виявив, що в групах порівняння спостережлива різниця між показниками за ГАМК була така: t = 3,2 і t = 1,09 і між показниками за глутаматом: t = 2,54 і t = 1,88 відповідно (p < 0,05).
Отже, у хворих із фармакорезистентними лицьовими симпаталгіями та вираженим больовим синдромом відзначається чітке підвищення рівня збуджуючих амінокислот: глутамату та аспартату в сироватці крові при порівнянні з контролем і зниження рівня ГАМК. Ці зміни є найбільш вираженими в цій групі пацієнтів.
Друга група складалася з хворих зі стабільним типом перебігу та вираженістю больового синдрому середньої інтенсивності (n = 23; 41,07 %). Під час дослідження було з’ясовано, що хворі цієї групи також мають зміни вмісту глутамату та ГАМК. Хворі 2-ї групи мали такі рівні нейроамінокислот у сироватці крові (табл. 1): рівень ГАМК у сироватці крові було статистично знижено порівняно з контролем на 3,02 мкмоль/л (p < 0,05), вміст глутамату мав тенденцію до зростання і був підвищений на 42,26 мкмоль/л порівняно зі здоровим контролем (p > 0,05). Вміст аспартату практично не відрізнявся від даних контролю (11,74 vs controls 7,51). Таким чином, у хворих 2-ї групи спостерігалось вірогідне зниження лише вмісту ГАМК у сироватці крові (p < 0,05), що також відображає зниження реакцій гальмування в цілому по даній групі хворих.
Отже, найбільш виражені функціонально-біохімічні зміни спостерігалися у ланці ГАМК-медіаторної системи, де основним шляхом утворення ГАМК, основного гальмового нейромедіатора у тканинах мозку, є синтез із глутамінової кислоти. Крім того, значне зниження вмісту гальмівних амінокислот відображає неефективність захисних механізмів гальмування в цілому, що має патогенетичне значення при формуванні фармакорезистентності больового синдрому.
Хворі 3-ї групи (n = 18; 32,15 %) з фармакорезистентними лицьовими симпаталгіями, рідкими больовими нападами неінтенсивного ступеня вираженості мали у сироватці крові рівні нейроамінокислот, які практично не відрізняються від даних контрольної групи: вміст ГАМК — 4,22 мкмоль/л vs controls 5,62 мкмоль/л; рівень глутамату — 120,45 мкмоль/л vs controls 116,97 мкмоль/л і зберігав тенденцію до високих показників (p > 0,05), рівень аспартату — 9,67 мкмоль/л vs controls 7,51 мкмоль/л у сироватці крові.
/45-2.jpg)
При клінічному неврологічному обстеженні хворих виявлено ознаки розсіяної неврологічної симптоматики, що вказує на ураження мезенцефальних та стовбурових структур головного мозку, яка була більш вираженою у хворих 2-ї групи. Серед об’єктивних органічних неврологічних симптомів частіше за інші зустрічались порушення черепно-мозкової іннервації та рефлекторно-рухової сфери у вигляді горизонтального ністагму (11 хворих 1-ї групи (1 гр.), 9 хворих 2-ї групи (2 гр.), 8 хворих 3-ї групи (3 гр.)), порушення іннервації зіниці (9 хворих 1 гр., 12 хворих 2 гр., 3 хворих 3 гр.), порушення чутливості в зоні іннервації VII черепно-мозкових нервів (8 хворих 1 гр., 16 хворих 2 гр., 7 хворих 3 гр.), порушення чутливості в зоні іннервації V черепно-мозкових нервів (6 хворих 1 гр., 6 хворих 2 гр., 2 хворих 3 гр.), асиметрія обличчя (13 хворих 1 гр., 11 хворих 2 гр., 12 хворих 3 гр.), збільшення сухожилкових рефлексів (12 хворих 1 гр., 7 хворих 2 гр., 5 хворих 3 гр.). У структурі неврологічних синдромів майже в усіх обстежених зустрічався синдром вегетативної дистонії (14 хворих 1 гр., 20 хворих 2 гр., 16 хворих 3 гр.).
Висновки
Отримані в дослідженні результати свідчать про те, що розвиток больових синдромів у хворих із фармакорезистентними лицьовими симпаталгіями супроводжується підвищеним викидом медіаторів збудження, а саме глутамату, та зниженням рівня гальмування, що відображає низький рівень ГАМК. Це наукове дослідження виявило вірогідне та значне зниження вмісту гальмівних нейроамінокислот, зокрема ГАМК, у хворих 1-ї та 2-ї груп (p < 0,05), що відображає неефективність захисних механізмів гальмування у хворих із прозопалгіями; також дослідження показало збільшення вмісту глутамату у сироватці крові хворих 1-ї групи (p < 0,05). Необхідним є подальше вивчення нейроамінокислотного дисбалансу у хворих із фармакорезистентними лицьовими симпаталгіями для розробки диференціально-діагностичних і прогностичних критеріїв перебігу та нових шляхів лікування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Болезни нервной системы: В 2 т. / Под ред. Н.Н. Яхно, Д.Р. Штульмана. — М.: Медицина, 2001. — 480 с.
2. Зайцева Г.Н., Тиленева Н.И. Метод хроматографического разделения аминокислот // Лабораторное дело. — 1958. — № 3. — С. 24-30.
3. Неврология / Под ред. М. Самуэльса: Пер. с англ. — М.: Практика, 1997. — 638 с.
4. Погодаев К.И. Эпилептология и патохимия мозга. — М.: Медицина, 1986. — 288 с.
5. Сапон Н.А. Нейропсихологические критерии оценки невропатического болевого синдрома // Український нейрохірургічний журнал. — 2005. — № 1. — С. 34-40.
6. Цымбалюк В.И. Оценка качества жизни нейрохирургических больных с болевым синдромом // Український нейрохірургічний журнал. — 2007. — № 4. — С. 57-60.
7. Ardeshirpour F., Hurliman E., Wendelschafer-Crabb G. Comparison of neurovascular characteristics of facial skin in patients after primary and revision rhytidectomies // JAMA Facial Plast Surg. — 2017. — Vol. 19, № 5. — P. 379-385.
8. Brisman R. Constant face pain in typical trigeminal neuralgia and response to gamma knife radiosurgery // Stereotact. Funct. Neurosurg. — 2013. — Vol. 91, № 2. — P. 122-128.
9. Fariello R., Morselli K., Lloud L. Neurotransmitters, seizures and epilepsy. — New-York: Raven Press, 1984. — 340 p.
10. Henry M.A., Fairchild D.D., Patil M.J. et al. Effect of a novel, orally active matrix metalloproteinase-2 and -9 inhibitor in spinal and trigeminal rat models of neuropathic pain // J. Oral Facial Pain Headache. — 2015. — Vol. 29, № 3. — P. 286-296.
11. Hokfelt T., Bartfai T., Bloom F. Neuropeptides: opportunities for drug discovery // The Lancet Neurology. — 2003. — Vol. 2, № 8. — P. 463-472.
12. Li M.J., Liu L.Y., Chen L., Cai J.,Wan Y., Xing G.G. Chronic stress exacerbates neuropathic pain via the integration of stress-affect-related information with nociceptive information in the central nucleus of the amygdale // Pain. — 2017. — Vol. 158, № 4. — P. 717-739.
13. Lunde H.M., Torkildsen O., Bo L., Bertelsen A.K. Botulinum toxin as monotherapy in symptomatic trigeminal neuralgia // Hea-dache. — 2016. — Vol. 56, № 6. — P. 1035-1039.
14. Naushad N., Dunn L.B., Muñoz R.F. Depression increases subjective stigma of chronic pain // J. Affect Disord. — 2018. — Vol. 3, № 229. — P. 456-462.
15. Perez H., Pinter A., Numez V. Modulation of GABA effects by endocrine factors in the corpus striatum of the rat // J. Physiol. Proc. — 2000. — Vol. 525. — P. 104P-105.
16. Perkin G.D. Neurology in general practice. — The United Kingdom: Dunitz Ltd., 2002. — 90 p.
17. Ranoux D., Martiné G., Espagne G. et al Delayed-onset post-craniotomy headache responsive to botulinum toxin A: a case series // Acta Neurochir. — 2017. — Vol. 159, № 8. — P. 1375-1378.
18. Woldeamanuel Y.W., O'Hare M., DeSouza D.D., Cowan R.P. Exacerbation of headache during dihydroergotamine for chronic migraine does not alter outcome // Neurology. — 2016. — Vol. 87, № 16. — P. 196-198.

/45-1.jpg)
/45-2.jpg)