Краткие сведения о болезни Паркинсона
Согласно современному определению, болезнь Паркинсона (БП) — хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением в них белка альфа-синуклеина и образованием особых внутриклеточных включений (телец Леви), которое проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психических, вегетативных, сенсорных и др.) [1, 40].
Болезнь Паркинсона охватывает 7–10 млн человек на земном шаре: примерно у одного из каждых 200 индивидуумов диагностируют данную патологию. 96 % случаев болезни возникает у пациентов старше 50 лет, в 1,5 раза чаще у мужчин, чем у женщин, в 85–90 % случаев она носит идиопатический характер (точная причина неизвестна). 15–25 % пациентов имеют родственников с болезнью Паркинсона [2–6].
Существует множество факторов, вносящих вклад в развитие заболевания. К ним относят факторы окружающей среды, такие как пестициды, лекарственные средства, вирусы, травмы головы, тяжелый стресс; особенности стиля жизни; генетические факторы — гены LRRK2, SNCA, Parkin, PINK1. Вклад разных факторов в разные периоды жизни человека неодинаков: у пациентов моложе 50 лет большее значение имеют генетические особенности, в то время как у пациентов старше 50 лет — факторы окружающей среды, особенности стиля жизни [6, 7].
Основным патогенетическим механизмом при болезни Паркинсона является дегенерация дофаминергических нейронов, расположенных в черной субстанции (substantia nigra) (рис. 1). В норме эта структура экскретирует достаточное количество дофамина, оказывающего тормозящее влияние на функциональное состояние полосатого тела (striatum). При болезни Паркинсона дегенерация дофаминергических ней-ронов приводит к нейромедиаторному дисбалансу и, как следствие, растормаживанию полосатого тела, что приводит к развитию клинически выраженных нарушений движения [8, 9].
Патогенетической особенностью при болезни Паркинсона являются белковые депозиты в виде телец Леви, обнаруживаемые в цитоплазме нейронов черной субстанции [10].
По мере прогрессирования болезни Паркинсона дегенерация нейронов и тельца Леви начинают встречаться и в других отделах головного и спинного мозга, а также на периферии [10–12].
Основные моторные симптомы при болезни Паркинсона соответствуют акрониму TRAP. Тремор (Т) проявляется в покоящейся конечности (чаще в дистальном отделе руки и ноги), уменьшается при ее движении, но усиливается при активных движениях другими конечностями. Его характерным признаком является то, что он наблюдается в покое. Ригидность (R) проявляется ощущением скованности или напряженности в мышцах. При попытке осуществить пассивное движение в конечности больного врач чувствует повышенное сопротивление этому движению, которое толчкообразно меняется (феномен «зубчатого колеса»). Ригидность вносит вклад в формирование такого симптома болезни, как «поза просителя» (сутулое положение тела). Следующая буква (А) включает в себя группу симптомов под названием «акинезия/брадикинезия». Брадикинезия — это общее замедление всех движений больного; к ней также относят гипомимию (выражение лица может стать маскоподобным), снижение частоты мигания век, махового движения рук, микрографию (медленный и затухающий почерк). Акинезию обычно диагностируют как симптом застывания — неспособность начать движение или появление внезапных остановок во время движения. Постуральная нестабильность (P) отражает неспособность больного поддерживать баланс тела, что часто приводит к падениям [13].
Моторные симптомы возникают сначала как односторонние, затем приобретают двусторонний характер. Первые три симптома (TRA) являются ранними, в то время как постуральная нестабильность (P), «поза просителя» и симптом застывания присоединяются позже [14]. Динамика моторных симптомов в зависимости от стадии болезни представлена на рис. 2.
Помимо моторных симптомов болезнь Паркинсона сопровождается также рядом немоторных симптомов, таких как расстройства настроения, когнитивное снижение/деменция, расстройства сна, боль, сенсорная дисфункция, дизавтономия и т.д. Они могут появляться за годы или даже за десятки лет до появления двигательных нарушений [16].
С учетом всего вышеизложенного неудивительно, что болезнь Паркинсона отрицательно влияет на качество жизни пациентов, ограничивая их физическую, психическую и социальную активность (рис. 3).
Ввиду отсутствия подтверждающих тестов диагноз болезни Паркинсона выставляют клинически. При этом должны быть исключены случаи атипичного паркинсонизма — деменции с тельцами Леви, множественной системной атрофии, прогрессирующего надъядерного паралича, кортикобазальной дегенерации. Об атипичном паркинсонизме свидетельствует отсутствие тремора, симметричность моторных симптомов с самого начала болезни, раннее начало падений, плохой ответ на леводопу, выраженная дизавтономия, быстрое прогрессирование болезни [18, 19].
Когда диагноз болезни Паркинсона установлен, можно попытаться спрогнозировать, как будет развиваться болезнь. Предикторами более доброкачественного (т.е. более медленного) течения являются более молодой возраст пациентов, наличие тремора в покое, женский пол. К предикторам более быстрого течения относят более старший возраст начала болезни, ригидность/брадикинезию с самого начала болезни, постуральную нестабильность/симптом застывания, плохой ответ на леводопу, деменцию, наличие сочетанной коморбидности (инсульт и пр.), мужской пол пациента [19, 20].
Своевременное начало лечения болезни Паркинсона обычно предусматривает замедление прогрессирования [21].
Общие принципы лечения болезни Паркинсона
Лечебные цели при болезни Паркинсона сводятся к тому, чтобы уменьшить выраженность моторных и немоторных симптомов, улучшить качество жизни пациентов, не вызывая при этом побочных эффектов [19].
В целом помощь при болезни Паркинсона сводится к нефармакологической, фармакологической и хирургической терапии. Нефармакологические подходы включают в себя образовательные программы для больных об их состоянии, психологическую/эмоциональную поддержку, диету, лечебную физкультуру, физиотерапию, помощь в связи с инвалидизацией, включая помощь с повседневными функциями. Фармакологическая терапия направлена на борьбу с моторными проявлениями болезни (TRAP и др.), а также с немоторными симптомами, например, депрессией, деменцией, бессонницей. Когда возможности консервативной терапии у больных исчерпаны, решается вопрос о хирургическом лечении — глубокой стимуляции мозга (ГСМ) [23]. Подбирая схему лечения, врач должен учитывать возраст начала болезни, особенности клинической симптоматики, степень функциональной инвалидизации, предпочтения пациента и его финансовые возможности [23–25].
В фармакотерапии моторных расстройств вот уже более 50 лет доминирует леводопа как наи–более эффективное симптоматическое средство и золотой стандарт, с которым сравнивают любые новые препараты. Леводопа представляет собой L-диоксифенилаланин (L-ДОФА), который проникает через гематоэнцефалический барьер и превращается в головном мозге в дофамин при участии фермента ДОФА-декарбоксилазы. В результате оставшиеся нейроны черной субстанции снова начинают выделять достаточное количество дофамина, затормаживают полосатое тело, и моторные проявления болезни Паркинсона уменьшаются или исчезают [2, 26]. Это ведет к повышению качества жизни и повседневной активности пациентов, что, в свою очередь, дает им возможность быть независимыми от помощи посторонних лиц и продлевает их трудовой возраст [27].
Важно учитывать тот факт, что после всасывания в кишечнике, еще до прохождения через гематоэнцефалический барьер, леводопа подвергается воздействию периферической ДОФА-декарбоксилазы, также с образованием дофамина. Отсюда он не может проникнуть в головной мозг, соответственно, не вносит вклад в лечение болезни Паркинсона, зато воздействует на периферические органы, например желудочно-кишечный тракт, вызывая тошноту и рвоту [2, 28].
В связи с этим леводопу никогда не вводят изолированно, а всегда комбинируют с ингибиторами периферической ДОФА-декарбоксилазы, например карбидопой. Карбидопа проявляет двойной эффект: препятствуя образованию дофамина на периферии, она устраняет тошноту и рвоту. Кроме того, неразрушенная леводопа в большем количестве поступает в головной мозг, преобразуясь там в большее количество дофамина, необходимого для борьбы с болезнью Паркинсона [2, 28].
Говоря далее о леводопе в рамках настоящего обзора, мы всегда будем подразумевать комбинацию леводопа/карбидопа.
По мере того как болезнь Паркинсона будет прогрессировать, все пациенты рано или поздно будут нуждаться в применении леводопы [25]. Препарат необходимо назначать в наиболее низкой эффективной дозе, для того чтобы как можно дольше получать адекватный терапевтический ответ [29]. Алгоритм фармакологического лечения моторных симптомов болезни Паркинсона представлен на рис. 4.
/78-1.jpg)
Общие принципы терапии сводятся к следующему [30, 31]. При начале болезни Паркинсона в более молодом возрасте (< 50 лет) или на ранних стадиях болезни, начавшейся в более старшем возрасте (> 50 лет), моторные симптомы обычно не нарушают качество жизни. Назначение леводопы этим группам пациентов не слишком целесообразно по двум причинам. С одной стороны, болезнь протекает более легко и может быть откорригирована более слабыми средствами, такими как агонисты дофаминовых рецепторов и ингибиторы МАО-Б. С другой — назначение леводопы сопряжено с развитием осложнений в виде моторных флуктуаций и дискинезий (особенно если препарат был назначен больным в более молодом возрасте (< 50 лет)).
Несмотря на начало лечения с агонистов дофаминовых рецепторов и/или ингибиторов МАО-Б, больные примерно через 2–3 года все равно начинают нуждаться в назначении леводопы.
На вопрос о том, возможно ли в вышеупомянутых подгруппах пациентов инициировать стартовую терапию с леводопы, положительно отвечают в том случае, когда моторные симптомы уже на ранних стадиях болезни ухудшают качество жизни и снижают уровень социальной активности пациента. С другой стороны, если выраженность моторных симптомов определяет темп течения заболевания, врач может решать вопрос о предпочтении леводопы перед агонистами дофаминовых рецепторов, ингибиторами МАО-Б или амантадином.
Если болезнь Паркинсона первично диагностирована на более поздних стадиях у лиц любого возраста или у лиц после 60–70 лет, то моторные симптомы обычно нарушают качество жизни. Поэтому лечение начинают с назначения леводопы. Поскольку леводопа со временем вызывает осложнения в виде моторных флуктуаций и дискинезий, то для коррекции последних в дополнение назначают агонисты дофаминовых рецепторов, ингибиторы МАО-Б, ингибиторы КОМТ. Если этого недостаточно, то подключают леводопу пролонгированного высвобождения.
При недостаточной эффективности такой тактики назначают периодические инъекции апоморфина (в Украине нет регистрации) или перорально амантадин. Впоследствии возможен переход на непрерывные инфузии апоморфина (в Украине нет регистрации), насосную доставку леводопы в тонкий кишечник (помпа с дуодопой, нет регистрации в Украине), глубокую стимуляцию головного мозга.
Леводопа/карбидопа пролонгированного высвобождения как средство борьбы с моторными флуктуациями и дискинезиями
Осложнения, возникающие при длительном лечении леводопой, делят на две большие группы: моторные флуктуации и дискинезии. Моторными флуктуациями называют феномен, когда на фоне действия препарата внезапно возникает неожиданный возврат моторных симптомов болезни Паркинсона. Дискинезиями называют насильственные движения различных частей тела, возникающие вследствие приема препарата (хорея, дистония, атетоз, миоклонус и т.д.) [32].
Некоторые из обсуждаемых осложнений представлены на рис. 5. Группа моторных флуктуаций представлена флуктуациями в конце дозы, пароксизмальными on/off-флуктуациями. Группа дискинезий представлена дискинезиями пика дозы, off-дискинезиями, бифазными дискинезиями.
/79-1.jpg)
Флуктуации в конце дозы характеризуются тем, что после приема леводопы отмечается ее положительный эффект, но незадолго до планового приема следующей дозы возникает возврат моторных симптомов болезни Паркинсона. Для пароксизмальных on/off-флуктуаций характерно непрогнозируемое выключение между периодами эффективности леводопы и периодами возврата моторных симптомов болезни Паркинсона. Дискинезии пика дозы сопровождаются возникновением непроизвольных движений у больного в тот момент, когда концентрация леводопой доставленного дофамина в головном мозге является максимальной. По аналогии, off-дискинезии возникают при снижении содержания дофамина в головном мозге. Бифазные дискинезии соответствуют следующей клинической картине: дискинезия — улучшение — дискинезия. При этом дискинезия возникает в момент повышения содержания дофамина в головном мозге, на пике дофамина у больного наблюдается улучшение, а затем при снижении содержания дофамина снова наблюдается дискинезия [32, 33].
Механизмы возникновения моторных флуктуаций и дискинезий [33, 34] связаны с особенностями патофизиологии болезни Паркинсона и влиянием принимаемого лечения. У здоровых людей в черной субстанции содержится достаточное количество нейронов, которые высвобождают дофамин так, что он непрерывно поступает к дофаминовым рецепторам полосатого тела. Во многом это связано со способностью нейронов запасать дофамин в синаптических везикулах, а затем его оттуда постепенно высвобождать. На ранних стадиях болезни Паркинсона непрерывность доставки дофамина продолжает поддерживаться.
На более поздних стадиях болезни количество нейронов снижается настолько, что они становятся неспособными запасать дофамин. Более того, тот дофамин, который в них имеется, они стремятся как можно быстрее высвободить в связи с его дефицитом. В связи с этим характер секреции дофамина меняется с непрерывного на пульсирующий: вскоре после приема леводопы в головном мозге образуется максимальная концентрация дофамина, который «штормообразно» высвобождается к дофаминовым рецепторам полосатого тела. В последующее время секреция дофамина не может поддерживаться в связи с отсутствием его синаптических запасов.
Описанные процессы усугубляются также и тем, что растет чувствительность дофаминовых рецепторов полосатого тела к дофамину в связи с его дефицитом. В результате влияние дофамина в «штормообразную» фазу становится еще более выраженным.
В целом все три процесса — отсутствие запасов дофамина, ускорение его секреции и повышение чувствительности к нему — обусловливают появление моторных флуктуаций и дискинезий при лечении леводопой. Возможно, что отсутствие запасов дофамина (невозможность его непрерывной секреции) вносит больший вклад в развитие моторных флуктуаций, когда внезапно проявляются симптомы болезни Паркинсона, в то время как ускорение секреции дофамина и повышение чувствительности к нему («штормообразный» эффект) больше способствует развитию дискинезий, как результат пульсирующей стимуляции дофаминовых рецепторов леводопой быстрого высвобождения.
Выше мы упоминали о том, что для борьбы с моторными флуктуациями и дискинезиями назначают агонисты дофаминовых рецепторов, ингибиторы МАО-Б, ингибиторы КОМТ. Если эффект недостаточен, то к леводопе быстрого высвобождения добавляют леводопу пролонгированного высвобождения либо полностью переключают лечение на леводопу пролонгированного высвобождения.
Дело в том, что леводопа пролонгированного высвобождения медленно всасывается из кишечника. Хотя она не может заставить нейроны головного мозга запасать дофамин, она создает альтернативное депо предшественника дофамина — леводопы — в кишечнике. Из этого депо леводопа постепенно поступает к дофаминергическим нейронам черной субстанции, превращается в них в дофамин и начинает непрерывно выделяться к полосатому телу. Видно, что «штормообразное» выделение медиатора с последующим его отсутствием становится невозможным. Одновременно уменьшается чувствительность дофаминовых рецепторов к дофамину, потому что теперь его достаточно. Поскольку все три процесса, которые были нарушены (отсутствие запасов дофамина, ускорение его секреции и повышение чувствительности к нему), устранены, то моторные флуктуации и дискинезии ослабляются или полностью исчезают [35, 36].
На рис. 5 видно, что леводопа пролонгированного высвобождения эффективна при таких нарушениях, как моторные флуктуации в конце дозы, дискинезии пика дозы, off-дискинезии (возникающими в том числе и в ночное время суток).
Сравнение леводопы/карбидопы пролонгированного высвобождения с леводопой/карбидопой быстрого высвобождения
У больных с ранними стадиями болезни Паркинсона, когда моторные симптомы не нарушают качество жизни, леводопу быстрого высвобождения и леводопу пролонгированного высвобождения обычно не назначают. Тем не менее потенциал клинической эффективности обеих форм леводопы реальнее представить на популяции больных с ранними стадиями болезни Паркинсона, когда чувствительность к леводопе еще не снижена и моторные флуктуации/дискинезии не мешают оценке ее фармакокинетики.
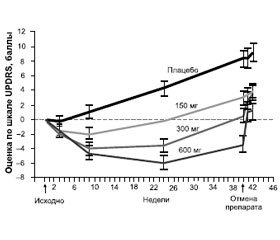
Так, назначение леводопы быстрого высвобождения 361 пациенту с ранней стадией болезни Паркинсона приводило к достоверному и дозозависимому снижению общего балла по шкале UPDRS (Unified Parkinson’s Disease Rating Scale — Унифицированная шкала для оценки болезни Паркинсона) по сравнению с плацебо (рис. 6). Авторы исследования пришли к выводу, что леводопа быстрого высвобождения либо замедляет прогрессирование болезни Паркинсона, либо оказывает пролонгированное влияние на симптомы болезни [37]. Хотя наибольшим действием обладала наивысшая доза леводопы, именно высокие дозы быстрее приводили к моторным флуктуациям (рис. 6). Поэтому врач должен стремиться назначить больному наименьшую, но достаточно эффективную дозу леводопы. На рис. 7 видно, что назначение леводопы пролонгированного высвобождения 45 пациентам с ранней стадией болезни Паркинсона, не получавшим ранее леводопы, приводило к достоверному и дозозависимому снижению общего балла по шкале NYUPDRS (New York University Parkinson’s Disease Rating Scale — Шкала для оценки болезни Паркинсона Нью-Йоркского университета) и баллов по отдельным симптомам [38].
/81-1.jpg)
Таким образом, из представленных исследований видно, что леводопа быстрого высвобождения и леводопа пролонгированного высвобождения эффективно борются с моторными симптомами болезни Паркинсона.
Сравнительная характеристика обеих форм леводопы представлена в табл. 1. В связи с более медленным всасыванием леводопы пролонгированного высвобождения (4–6 ч вместо 3–4 ч у обычной формы) ее биодоступность снижена на 30 %, что легко выравнивается фармкомпанией за счет того, что она увеличивает дозу леводопы на эти же 30 %. Леводопа пролонгированного высвобождения обеспечивает более стабильную концентрацию леводопы в плазме крови, что, как мы видели выше, способствует более стабильной концентрации дофамина в головном мозге. В результате уменьшается число моторных флуктуаций и дискинезий. После приема таблетки пролонгированной леводопы улучшение симптомов пациент чувствует позже, чем после приема обычной леводопы. Это связано с более медленным всасыванием пролонгированной формы. Если отсроченное начало эффекта беспокоит больного, целесообразно скомбинировать обе формы леводопы для оптимизации схемы лечения. Леводопа быстрого высвобождения поможет быстро облегчить симптомы (то есть даст более быстрый стартовый ответ на терапию), в то время как леводопа пролонгированного высвобождения позаботится об эффекте в дальнейшее время.
/81-2.jpg)
У пациентов без моторных флуктуаций леводопа пролонгированного высвобождения обеспечивает тот же терапевтический эффект, что и леводопа быстрого высвобождения, но с меньшей частотой дозирования (рис. 6, 7). Тем не менее, в соответствии с действующими рекомендациями, пока нет моторных флуктуаций и дискинезий, лечение под-держивают быстрой леводопой, и лишь при появлении этих осложнений переходят на пролонгированную форму. Общая оценка улучшений, даваемая пациентами и врачами, лучше у леводопы пролонгированного высвобождения. В связи с меньшей частотой дозирования комплайенс выше у пролонгированной формы.
Леводопа пролонгированного высвобождения эффективно борется с моторными флуктуациями в конце дозы, дискинезиями пика дозы, off-диски-незиями (возникающими и в ночное время суток). Пример подобного исследования представлен на рис. 8, где у 19 пациентов с поздней стадией болезни Паркинсона (> 12 лет) сравнивали между собой леводопу быстрого и пролонгированного высвобождения. Было выяснено, что леводопа пролонгированного высвобождения достоверно уменьшала количество off-периодов (моторных флуктуаций), требовала меньше доз препарата в течение дня, следовательно, с увеличением интервала дозирования [39].
Рассматривая безопасность обеих форм леводопы на поздних стадиях болезни Паркинсона, необходимо отметить, что профиль побочных эффектов у пролонгированных и быстрых таблеток был одинаков. Наиболее частыми побочными эффектами были головокружение, дискинезия (включая дистонию), голов-ная боль, галлюцинации, тошнота, рвота, гипотензия и спутанность сознания [29].
Выводы
Болезнь Паркинсона является хроническим прогрессирующим инвалидизирующим заболеванием, широко распространенным в мире. С каких бы лекарственных средств ни начиналось лечение, рано или поздно больному будет назначена леводопа/карбидопа быстрого высвобождения. Длительная терапия данным препаратом сопряжена с развитием таких неприятных осложнений, как моторные флуктуации и дискинезии. Причина кроется в том, что леводопа/карбидопа быстрого высвобождения приводит к пульсирующему высвобождению дофамина из черной субстанции.
Для борьбы с выявленными осложнениями назначают агонисты дофаминовых рецепторов, ингибиторы МАО-Б, ингибиторы КОМТ. Если этого недостаточно, добавляют в схему лечения леводопу/карбидопу пролонгированного высвобождения или полностью переключаются на нее. Она восстанавливает естественное равномерное высвобождение дофамина, прекращая его пульсирующие выбросы, что приводит к уменьшению или устранению моторных флуктуаций и дискинезий.
Леводопа/карбидопа пролонгированного высвобождения эффективно влияет на моторные флуктуации в конце дозы, дискинезии пика дозы, off-дискинезии (возникающие и в ночное время суток).
Эффективность леводопы/карбидопы быстрого и пролонгированного высвобождения в отношении моторных симптомов болезни Паркинсона является идентичной, с одинаковым профилем побочных эффектов. Комплайенс выше у леводопы/карбидопы пролонгированного высвобождения за счет меньшего числа доз, принимаемых в сутки.
Конфликт интересов. Не заявлен.
UA-LEVC-PUB-062018-004
Список литературы
1. Jankovic J. Parkinson's disease: clinical features and diagnosis // J. Neurol. Neurosurg. Psychiatry. — 2008. — V. 79, № 4. — P. 368-376.
2. Parkinson’s Foundation // http://parkinson.org
3. Statistics on Parkinsons Disease // https://reliawire.com
4. A systematic review of the worldwide prevalence and incidence of Parkinson's disease / Muangpaisan W., Mathews A., Hori H., Seidel D. // J. Med. Assoc. Thai. — 2011. — V. 94, № 6. — P. 749-755.
5. Are men at greater risk for Parkinson's disease than women? / Wooten G.F., Currie L.J., Bovbjerg V.E. et al. // J. Neurol. Neurosurg. Psychiatry. — 2004. — V. 75, № 4. — P. 637-639.
6. Harrison’s Principles of Internal Medicine. Chapter 449: Parkinson’s Disease and Other Movement Disorders // https://accessmedicine.mhmedical.com
7. Research on the Premotor Symptoms of Parkinson’s Di–sease: Clinical and Etiological Implications / Chen H., Burton E.A., Ross G.W. et al. // Environmental Health Perspectives. — 2013. — V. 121, № 11–12. — P. 1245-1252.
8. Hamani C., Lozano A.M. Physiology and pathophysiology of Parkinson's disease // Ann. N. Y. Acad. Sci. — 2003. — V. 991. — P. 15-21.
9. Module 2. Pathophysiology of Parkinson’s Disease // https://www.atrainceu.com
10. Weintraub D., Comella C.L., Horn S. Parkinson's disease-Part 1: Pathophysiology, symptoms, burden, diagnosis, and assessment // Am. J. Manag. Care. — 2008. — V. 14, № 2 (Suppl.). — P. S40-S48.
11. Wakabayashi K., Takahashi H. Neuropathology of autonomic nervous system in Parkinson's disease // Eur. Neurol. — 1997. — V. 38 (Suppl. 2). — P. 2-7.
12. Del Tredici K., Duda J.E. Peripheral Lewy body pathology in Parkinson's disease and incidental Lewy body disease: four cases // J. Neurol. Sci. — 2011. — V. 310, № 1–2. — P. 100-106.
13. Jankovic J. Parkinson's disease: clinical features and diagnosis // J. Neurol. Neurosurg. Psychiatry. — 2008. — V. 79, № 4. — P. 368-376.
14. Fahn S. Description of Parkinson's disease as a clinical syndrome // Ann. N. Y. Acad. Sci. — 2003. — V. 991. — P. 1-14.
15. How Parkinson’s Disease Progresses // https://www.webmd.com
16. Parkinson's disease: a review of non-motor symptoms / Rana A.Q., Ahmed U.S., Chaudry Z.M., Vasan S. // Expert Rev. Neurother. — 2015. — V. 15, № 5. — P. 549-562.
17. Using the SF-36 measure to compare the health impact of multiple sclerosis and Parkinson's disease with normal population health profiles / Riazi A., Hobart J.C., Lamping D.L. et al. // J. Neurol. Neurosurg. Psychiatry. — 2003. — V. 74, № 6. — P. 710-714.
18. Stamelou M., Hoeglinger G.U. Atypical parkinsonism: an update // Current Opinion in Neurology. — 2013. — V. 26, № 4. — P. 401-405.
19. Canadian Guidelines on Parkinson's Disease / Grimes D., Gordon J., Snelgrove B. et al. // Can. J. Neurol. Sci. — 2012. — V. 39, № 4 (Suppl. 4). — P. S1-S30.
20. Rizek P., Kumar N., Jog M.S. An update on the diagnosis and treatment of Parkinson disease // Canadian Medical Association Journal. — 2016. — V. 188, № 16. — P. 1157-1165.
21. Boland D.F., Stacy M. The economic and quality of life burden associated with Parkinson's disease: a focus on symptoms // Am. J. Manag. Care. — 2012. — V. 18, № 7 (Suppl.). — P. S168-S175.
22. Estimated life expectancy of Parkinson's patients compared with the UK population / Ishihara L.S., Cheesbrough A., Brayne C., Schrag A. // J. Neurol Neurosurg. Psychiatry. — 2007. — V. 78, № 12. — P. 1304-1309.
23. Parkinson’s Disease Foundation: Q&A — Sixth edition // http://parkinson.org
24. Jankovic J. Etiology and pathogenesis of Parkinson disease // https://www.uptodate.com
25. Parkinson’s Disease Foundation: Levodopa // http://parkinson.org
26. Münchau A., Bhatia K.P. Pharmacological treatment of Parkinson's disease // Postgrad. Med. J. — 2000. — V. 76, № 900. — P. 602-610.
27. Dolhun R. Levodopa 2.0: New Strategies to Even Out the Peaks and Valleys // The Michael J. Fox Foundation for Parkinson's Research. — 2015. — https://www.micha-eljfox.org
28. Hinz M., Stein A., Cole T. Parkinson’s disease: carbidopa, nausea, and dyskinesia // Clinical Pharmacology : Advances and Applications. — 2014. — V. 6. — P. 189-194.
29. Parkinson's Disease: Diagnosis and Management in Primary and Secondary Care // National Institute for Health and Clinical Excellence. — 2006.
30. Levacin®: Levodopa/Carbidopa — prolonged-release tablets for the symptomatic treatment of Parkinson’s Disease // Acino Pharma AG (Switzerland).
31. Parkinson’s disease in adults // National Institute for Health and Clinical Excellence. — 2017.
32. Tarsy D. Motor fluctuations and dyskinesia in Parkinson di-sease // https://www.uptodate.com
32. Jankovic J. Motor fluctuations and dyskinesias in Parkinson's disease: clinical manifestations // Mov. Disord. — 2005. — V. 20 (Suppl. 11). — P. S11-S16.
33. Флуктуации и дискинезии при болезни Паркинсона // https://laesus-de-liro.livejournal.com
34. Motor fluctuations in levodopa treatment: clinical pharmaco–logy / Stocchi F., Bonamartini A., Vacca L., Ruggieri S. // Eur. Neurol. — 1996. — V. 36 (Suppl. 1). — P. 38-42.
35. Margolesky J., Singer C. Extended-release oral capsule of carbidopa–levodopa in Parkinson disease // Therapeutic Advances in Neurological Disorders. — 2018. — V. 11. — Article ID 1756285617737728.
36. Nord M. Levodopa pharmacokinetics — from stomach to brain (A study on patients with Parkinson’s disease) // Linköping University medical dissertations. — 2017. — № 1567.
37. Levodopa and the progression of Parkinson's disease / Fahn S., Oakes D., Shoulson I. et al. // N. Engl. J. Med. — 2004. — V. 351, № 24. — P. 2498-2508.
38. An open multicenter trial of Sinemet CR in levodopa-naive Parkinson's disease patients / Olanow C.W., Nakano K., Nau–sieda P. et al. // Clin. Neuropharmacol. — 1991. — V. 14, № 3. — P. 235-240.
39. Results of long-term treatment with controlled-release levodopa/carbidopa (Sinemet CR) / Cedarbaum J.M., Silvestri M., Clark M. et al. // J. Neural Transm. Park. Dis. Dement. Sect. — 1990. — V. 2, № 3. — P. 205-213.
40. Рекомендації щодо діагностики та лікування хвороби Паркінсона / Карабань І.М. та ін. // Нейро News. — 2017. — № 9(92). — P. 34-58, № 10(93). — Р. 50-68.

/75-1.jpg)
/76-1.jpg)
/77-1.jpg)
/78-1.jpg)
/79-1.jpg)
/81-1.jpg)
/81-2.jpg)
/82-1.jpg)