Нейроэндокринная гиперплазия младенцев (neuroendocrine cell hyperplasia of infancy, NEHI) — редкое интерстициальное заболевание легких, характеризующееся гиперплазией пульмональных нейроэндокринных клеток, ранним появлением стойкого тахипноэ, гипоксемии, ретракции грудной клетки при дыхании, крепитации наряду с благоприятным течением и спонтанной регрессией симптомов к 24 месяцам жизни.
Пульмональные нейроэндокринные клетки (pulmonary neuroendocrine cells, PNEC) считаются наименее изученными. Известно, что гиперплазия PNEC участвует в патогенезе многих заболеваний, однако ее значение пока неизвестно. Пульмональные нейроэндокринные клетки расположены единично в респираторном эпителии (называемые нейроэпителиальными телами, neuroepithelial bodies, NEBs), тогда как сгруппированные — в дыхательных путях, часто находятся на бифуркации бронхов или бронхоальвеолярных каналах (каналах Ламберта). PNEC, в отличие от большинства клеток респираторной части легких, иннервируются и имеют микроворсинки, которые выступают в просвет дыхательных путей на их апикальной поверхности [1]. Единичные пульмональные нейроэндокринные клетки содержат секреторные гранулы и везикулы с плотной сердцевиной, в которых находятся различные амины и пептиды, включая гастринвысвобождающий пептид (gastrin-releasing peptide, GRP), серотонин (serotonin, 5-HT), пептид, связанный с геном кальцитонина (calcitonin gene-related peptide, CGRP), кальцитонин, субстанцию P, соматостатин, хромогранин A и синаптофизин (synaptophysin, SYP). Эти вещества высвобождаются физиологическими стимулами, такими как гипоксия, и многие из них обладают сильными, часто противоположными эффектами, которые еще предстоит выяснить. Десятилетия исследований пульмональных нейроэндокринных клеток показали их регуляторную функцию в легочном кровотоке, контроле бронхиального тонуса, модуляции иммунного ответа, поддержании пула стволовых клеток [2]. Кроме того, выявлен факт физиологической гиперплазии пульмональных нейроэндокринных клеток в легких фетального и неонатального периодов и их участия в дифференцировке, созревании и регенерации легких новорожденных. Численность PNEC в первый год жизни уменьшается [2]. Ни один другой тип клеток в легких не проявляет такого разнообразия функций.
История открытия NEHI. Гиперплазия нейроэндокринных клеток впервые описана в 2005 году в исследовании, включающем 15 младенцев с симптомами интерстициального заболевания легких (interstitial lung disease, ILD). У детей на первом году жизни отмечалось стойкое тахипноэ, гипоксемия, ретракция грудной клетки и крепитация. Биопсия легких у 15 детей показала минимальные и неспеци–фические изменения, несмотря на выраженные клинические симптомы. Изначально синдром описывался как персистирующее тахипноэ новорожденных. Последующие исследования показали, что единственным доказанным гистопатологическим изменением в легких было увеличение пульмональных нейроэндокринных клеток. Это открытие было подтверждено окрашиванием бомбезина методом иммуногистохимии с высокоспецифическими антисыворотками [2]. Уточнение патогенеза отразилось на диагнозе. Синдром приобрел название нейроэндокринная гиперплазия младенцев.
Патогенез NEHI. В патогенезе NEHI играет роль гиперплазия PNEC, которая по невыясненным причинам сохраняется у некоторых детей после рождения и является источником дыхательных нарушений. Доказано, что PNEC, продуцируя вазоактивные вещества (бомбезин, кальцитонин и серотонин), способствуют бронхо- и вазоконстрикции, эпителиальной дифференциации и пролиферации мезенхимальных клеток (гладких мышечных клеток и фибробластов), что и определяет клинику заболевания [3].
Эпидемиология. Заболевание возникает спорадически, однако не исключена возможность влияния генетических или экологических факторов, включая вирусные инфекции [6]. Большинство детей, формирующих NEHI, рождены в срок и, в отличие от пациентов с бронхолегочной дисплазией и диффузными нарушениями развития легких, не требуют интубации и респираторной поддержки сразу после рождения. Исследователи отмечают несущественное преобладание детей мужского пола.
Клинические критерии. Заболевание начинается с 1–14 месяцев, в среднем с 4 месяцев. Возможен дебют в периоде новорожденности. Предполагаемым триггером нейроэндокринной гиперплазии младенцев может быть острая респираторная вирусная инфекция [6]. У части детей с NEHI в перибронхиальных лимфоцитах обнаруживается вирус Эпштейна — Барр [5].
В 100 % случаев NEHI манифестирует с тахи–пноэ (обычно > 60 в 1 минуту), что схоже со многими интерстициальными заболеваниями [5, 6]. У части пациентов к тахипноэ присоединяется кашель (22 %), визинг (33 %), крепитация (44 %). У 89 % детей наблюдаются признаки гипоксии (SpO2 < 95 %). Большинство детей демонстрируют стагнацию физического развития [5, 6]. Часто диагностируется гастроэзофагеальный рефлюкс. Отметим, что в отличие от альвеолокапиллярной симплификации и бронхолегочной дисплазии для NEHI не характерна легочная артериальная гипертензия и какие-либо изменения со стороны сердца.
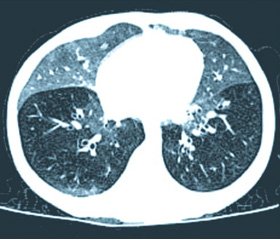
Дополнительные критерии. Результаты рентгенографии органов грудной клетки обычно малоинформативны. Типичную картину нейроэндокринной гиперплазии младенцев можно обнаружить при высокоразрешающей компьютерной томографии (ВРКТ) легких (рис. 1).
Патогномоничными являются участки затемнения по типу матового стекла в средней доле правого и язычковых сегментах левого легкого, а также паттерн мозаичной перфузии (симптом воздушной ловушки) более чем в 4 долях легких. Плетизмография демонстрирует повышенную функциональную остаточную емкость легких (FRC, z-score > 2), гипер–инфляцию и обструкцию периферических отделов дыхательных путей, не имеющую обратного развития после ингаляции сальбутамолом [5].
Наиболее характерным симптомом, отличающим нейроэндокринную гиперплазию младенцев от других интерстициальных заболеваний легких у детей до 2 лет, является нормальная альвеолярная структура без признаков фиброза в биопсийном материале (рис. 2). Подтверждает диагноз иммуногистохимическое исследование, при котором выявляется значительное количество (более 10 %) бомбезинположительных (нейроэндокринных) клеток в стенках респираторных бронхиол [5, 8].
В некоторых случаях наблюдается увеличение перибронхиальных лимфоцитов. Бронхи, бронхиолы и альвеолы не изменены. Воздушность альвеол в субплевральной области часто повышена [9]. Наряду с этим инвазивность биопсии легких обусловливает необходимость четких показаний к ее проведению. Поэтому V.C. Gomes и соавторы разработали алгоритм установки диагноза нейроэндокринной гиперплазии у младенцев, который представлен ниже (рис. 3) [7].
Дифференциальную диагностику нейроэндокринной гиперплазии младенцев обычно проводят с бронхолегочной дисплазией, диффузными нарушениями развития легких, мутацией протеинов сурфактанта, особенно ABCA3, Sp-B, Sp-C [5, 10, 11].
Лечение. Единственным эффективным методом поддерживающей терапии нейроэндокринной гиперплазии младенцев является кислородотерапия для предотвращения осложнений гипоксии. Оптимально поддержание SpO2 > 93 %. Лечение пер–оральными и ингаляционными глюкокортикостероидами, азатиоприном, а также ингаляционными бронходилататорами неэффективно [8, 11].
Прогноз заболевания обычно благоприятный. К 12–24 (в 20 % к 60) месяцам дети перестают быть кислородозависимыми, а клиническая симптоматика исчезает. Вероятно, NEHI может оказывать влияние на развитие легких и формирование некоторых заболеваний. В исследовании H. Lukkarinen et al. у 60 % обследованных пациентов в катамнезе формировалась бронхиальная астма [5]. Кроме того, до сих пор неизвестно, существует ли связь NEHI с идиопатической диффузной гиперплазией пульмональных нейроэндокринных клеток у взрослых, при которой наблюдаются множественные карциноидные островки и облитерирующий бронхиолит [11, 13].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Song H. Functional characterization of pulmonary neuroendocrine cells in lung development, injury, and tumorigenesis / H. Song, E. Yao, C. Lin et al. // PNAS. — 2012. — № 109 (43). — P. 17531-17536.
2. Braverman N.E. Peroxisome biogenesis disorders: Biological, clinical and pathophysiological perspectives / N.E. Braverman, M.D. D'Agostino, G.E. Maclean // Dev. Disabil. Res. Rev. — 2013. — № 17 (3). — P. 187-196.
3. Domnik N.J. Pulmonary neuroepithelial bodies as airway sensors: Putative role in the generation of dyspnea / N.J. Domnik, E. Cutz // Curr. Opin. Pharmacol. — 2011. — № 11 (3). — P. 211-217.
4. Deterding R. Evaluating infants and children with interstitial lung disease / R. Deterding // Semin. Respir. Crit. Care Med. — 2007. — № 28 (3). — P. 333-341.
5. Cutz E. Pulmonary neuroendocrine cell system in pediatric lung disease-recent advances / E. Cutz, H. Yeger, J. Pan // Pediatr. Dev. Pathol. — 2007. — № 10 (6). — P. 419-435.
6. Lukkarinen H., Pelkonen A., Lohi J. Neuroendocrine cell hyperplasia of infancy: a prospective follow-up of nine children / H. Lukkarinen, A. Pelkonen, J. Lohi // Arch. Dis. Child. — 2013. — № 98. — P. 141-144.
7. Gomes V.C.C. Diagnostic criteria and follow-up in neuroendocrine cell hyperplasia of infancy: a case series / V.C.C. Gomes, M.C.C. Silva, J.H.M. Filho // J. Bras. Pneumol. — 2013. — № 39 (5). — P. 569-578.
8. Кузнецова А.А. Нейроэндокринная гиперплазия у младенцев / Кузнецова А.А., Пахомова А.А., Петрова С.И. и соавторы // Педиатрия. — 2016. — № 7 (2). — P. 170-175.
9. Jiramethee N. Pulmonary Neuroendocrine Cell Hyperplasia Associated with Surfactant Protein C Gene Mutation / N. Jiramethee, D. Erasmus, L. Nogee // Case Reports in Pulmonology. — 2017. — № 19 (1). — P. 1-6.
10. Carr L.L. Diffuse Idiopathic Pulmonary Neuroendocrine Cell Hyperplasia and Neuroendocrine Hyperplasia of Infancy / L.L. Carr, J.A. Kern, G.H. Deutsch // Clin. Chest. Med. — 2016. — № 37. — P. 579.
11. Nevel R.J., Garnett E.T., Schaudies D.A., Young L.R. Growth trajectories and oxygen use in neuroendocrine cell hyperplasia of infancy // Pediatr. Pulmonol. — 2018. — № 53. — P. 656.
12. Houin P.R. Exacerbations in neuroendocrine cell hyperplasia of infancy are characterized by increased air trapping / P.R. Houin, R.R. Deterding, LR. Young // Pediatr. Pulmonol. — 2016. — № 51. — P. 9.
13. Caimmi S. Rispoli Neuroendocrine cell hyperplasia of infancy: an unusual cause of hypoxemia in children Italian / S. Caimmi, A. Licari, D. Caimmi et al. // Journal of Pediatrics. — 2016. — № 42. — P. 84.
/75-1.jpg)

/76-1.jpg)