Останнім часом у світі у зв’язку зі змінами клімату спостерігається зростання кількості повеней, у тому числі і великих, обумовлених інтенсивними дощами, таненням великої кількості снігу, цунамі. В той же час великі повені реєструвались і продовжують реєструватись і в країнах Європейського Союзу.
За даними Всесвітньої організації охорони здо–ров’я, за останні 30 років внаслідок затоплень у всьому світі загинуло понад 200 000 чоловік і постраждало понад 2,8 млрд осіб. У Європейському регіоні від повеней протягом останніх 10 років загинуло близько 1000 осіб та постраждало більше 3,4 млн осіб. У 1953 р. під час шторму були підтоплені низинні прибережні райони країн Північного моря. Оскільки це відбулось у нічний час, була зареєстрована значна кількість утоплених: у Нідерландах — 1836 осіб, у Великобританії — 307. За 2000–2011 рр. кількість загиблих від затоплення була найвищою серед населення країн Центральної Європи та колишніх радянських республік.
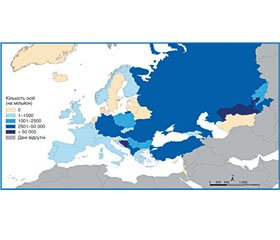
На рис. 1 подана кількість повеней у Європейському регіоні з 2000 по 2011 р. згідно з EM-DAT [1].
Кількість постраждалих від повеней у Європейському регіоні з 2000 по 2011 р. наведена на рис. 2.
Найчастіше за останні 100 років повені реєструвались у Північній та Північно-Східній Європі (Фінляндія, північ Російської Федерації, Швеція), в Ірландії, у Центральній та Східній Європі (Польща, альпійські річки), у країнах Південної Європи з атлантичними узбережжями (Португалія, Іспанія); рідше у великих частинах Південної Європи. У період 2000–2011 рр. значна кількість постраждалих від повеней зареєстрована в Боснії та Герцеговині, Узбекистані, Албанії, Чехії, Таджикистані, Македонії, Азербайджані, Чорногорії, Румунії, Туреччині.
За прогнозами надзвичайних ситуацій, що пов’я–зані з водою, очікуються великі регіональні та сезонні відмінності по країнах відносно частоти та кількості опадів. Так, загалом опади взимку більше реєструються в Північній Європі і менше — на півдні, особливо влітку. Останнім часом від повеней найбільше постраждали прибережні райони на Британських островах, у Центральній, Північній та Південній Європі. Очікується з ймовірністю 66 %, що сильні опади будуть продовжуватись все частіше у Європі. У північних районах це, імовірно, буде відбуватись, як правило, взимку. Але не виключається, що навіть влітку інтенсивність та частота надмірних дощів можуть також збільшитися.
Прибережні райони страждають унаслідок підвищення температури, рівня моря, сильних вітрів, штормів, значної кількості опадів. За даними звітів, реєструється збільшення повеней і в прибережних районах. З 1990 року спостерігається зростання кількості підтоплень прибережних територій, що, імовірно, буде з роками зростати. Крім того, очікується, що буде зростати і зона ризику підтоплень територій і на суходолі через зміни рівня моря. Прибережні повені можуть потенційно вплинути на економічну структуру, стан здоров’я значної кількості людей. Якщо, за оцінкою, в 1990 р. приблизно 1,2 мільярда осіб жили в прибережних районах, то, за прогнозами, очікується, що їх кількість може зрости до 1,8 мільярда в найближчі десятиліття. Дві третини загиблих від повеней були пов’язані з утопленням, а третина померла від травм, серцевих нападів, ураження електричним струмом, отруєнням чадним газом, пожежею. Також під час повеней захворюваність пов’язана з травмами, інфекціями, впливом хімічних речовин, отруєнням, порушенням психічного здоров’я. Травми можуть бути отримані також завдяки рептиліям, тваринам, комахам. Погіршення стану здоров’я може бути і внаслідок тривалого перебування у воді з температурою менше 24 °С. У той же час спалахи інфекційних захворювань зустрічаються рідко [2].
За даними М. Maegele зі співавт. (2005 р.), постраждалі отримують різноманітні поранення різних частин тіла, але переважно нижніх кінцівок. У постраждалих можуть бути численні переломи, розвиватись пневмонія або ранові інфекції, викликані високорезистентними патогенами. Так, особи, які пережили цунамі та повінь у 2004 р. у країнах Південно-Східної Азії та отримали травми під час неї і були евакуйовані у Європу, мали масштабне пошкодження м’яких тканин, велику кількість порізів та ран (від 2,3 до 60,0 см у діаметрі), забоїв, травматичні ушкодження голови, грудей і кінцівок (нижніх кінцівок — 88 %, верхніх кінцівок — 29 %, голови — 18 %), дві третини пацієнтів мали травми грудної клітки (пневмо-/гемопневмоторакс), внутрішньолегеневі контузії й ураження, а також у поєднанні з переломами кінцівок (відкритих, закритих — 47 %), що часто були заражені високорезистентними бактеріями [3].
Залежно від характеру катастрофи екстремальні фактори призводили до різного характеру ран (за чисельністю, площею ураженої шкіри, глибиною ушкодження, характером ураження кісток та суглобів, внутрішніх органів). Рани переважно були забруднені брудом, морською водою, піском, сміттям, екскрементами. Крім того, великий відсоток інфікованих ран пов’язаний із неадекватним та несвоєчасним очищенням ран від забруднюючих речовин. Установлено, що відстрочена медична допомога більше ніж через 24 години після отримання травми або раннє закриття рани були незалежними предикторами розвитку вторинної ранової інфекції серед жертв цунамі. Серед поранених під час цунамі, за даними аналізу, інфікувалось від половини до двох третин ран, як правило, протягом перших 72 годин після події, хоча багато ран були інфіковані і протягом перших 24 годин [4]. Також ризик інфікування рани збільшувався залежно від розміру рани і наявності відкритого перелому. Інфікування ран частіше зустрічалися на нижній, ніж на верхній, частині тіла [5]. Ризик інфікування рани збільшувався із збільшенням розмірів рани і при наявності відкритого перелому. У постраждалих також відзначена тенденція до зараження нозоко–міальними збудниками. Спектр клінічних проявів в інфікованих був широким, варіюючи від випадків тільки загоєння рани до розвитку тяжкого, небезпечного для життя некротизуючого фасціїту, сепсису (які вимагали радикальних хірургічних методів лікування), летального кінця.
Мета роботи: з урахуванням вірогідного зростання кількості повеней у країнах Європи та інших країнах світу збільшення міграції населення, у тому числі і в країни, де часто реєструються повені, цунамі, встановити різновиди та частоту збудників, які виявляються в постраждалих внаслідок повеней з інфікованих ран, органів дихання (як під час події, так і після них).
Проведений огляд літератури стосовно мікрофлори з інфікованих ран, органів системи дихання під час повеней та в період усунення їх наслідків.
У постраждалих під час надзвичайних подій рани, як правило, одразу були забруднені сумішшю бруду, розчиненого в морській та прісній воді, стічними водами, ґрунтом, сторонніми матеріалами (коралами, –піском, рослинами). Так, за даними P. Doung-ngern із співавт. (2009 р.), рани були забруднені брудом, піском, сміттям, морською водою і мали показник інфікування 66,5 % [5].
Більшість із тих, хто вижив після цунамі, хто тонув, могли залишатися у брудних умовах. Постраждалі могли лежати протягом декількох годин або днів у теплій або холодній, застійній воді, вдихали та ковтали солону воду. Значна кількість людей не отримувала негайної медичної допомоги протягом декількох годин.
Умови, що спостерігаються під час та після цунамі, можуть зробити надання медичної допомоги та лікування надзвичайно складними. Це може бути обумовлене: великою кількістю відносно рідкісних патогенів, які виявляються в післятравматичних великих ураженнях шкіри, м’яких тканин, внутрішніх травмах; множинною лікарською стійкістю збудників, атиповими бактеріями, грибковою інфекцією; обмеженими медичними ресурсами та складними надзвичайними умовами. У кожного, хто залишився живим після цунамі, повені, можливий високий ризик розвитку інфекції навіть через кілька місяців після події. При тяжких формах й атипових інфекціях можуть виникнути проблеми в діагностиці і лікуванні, навіть у досвідчених фахівців. Тому I. Uçkay зі співавт. (2008 р.) рекомендували необхідну ізоляцію осіб, які залишилися живими від стихійних лих, під час евакуації до медичного закладу та госпіталізації до тих пір, поки не стануть відомими результати всіх мікробіологічних досліджень [6].
Травми, що були отримані при перебуванні у воді, відрізняються від тих, які пов’язані з наземною травмою. Рани, отримані в морському середовищі, піддаються впливу бактерій, що рідко зустрічаються при травмах, отриманих на суші. До них належать види Vibrio spp., Aeromonas spp., Shewanella spp., Erysipelothrix rhusiopathiae, Mycobacterium marinum, Streptococcus iniae й інші мікроби [7]. Також і за даними інших дослідників, із ран, отриманих у морській воді, були виділені бактерії: Aeromonas, E. coli, Proteus, Klebsiella. Aeromonas був єдиним найбільш поширеним патогеном, виявленим у тих, хто вижив після цунамі, — 20 % інфекцій. Інші, як правило, грамнегативні бактерії, також значно поширені, особливо E. coli і Klebsiella pneumoniae, а також S. aureus, Proteus vulgaris і P. aeruginosa [4].
Після отримання травм під час повеней можуть виникати полімікробні асоціації при інфікуванні ран. Як вказують P. Doung-ngern зі співавт. (2009 р.), більшість ран (45 %) мали полімікробну інфекцію з грамнегативними збудниками, такими як Escherichia coli, Klebsiella pneumoniae, Proteus і Pseudomonas [5]. Особи, які пережили травми і які були в подальшому евакуйовані у Європу, мали травматичні ушкодження голови, грудей і кінцівок та часто були інфіковані високорезистентними бактеріями. M. Maegele зі співавт. (2005 р.) виявили безліч поширених збудників (Pseudomonas — 54 %, Enterobacteriae — 36 %, Aeromonas spp. — 27 %), а також і незвичайних ізолятів, які часто були мультирезистентними (Acinetobacter, Escherichia coli, що продукують бета-лактамази з розширеним спектром, — по 18 % кожен) [3]. При обстеженні постраждалих у Стокгольмі, Швеція, після цунамі у 2004 р. було встановлено, що грамнегативна флора була найбільш поширеною культурою з ран. Були виділені: Escherichia coli, різновиди Proteus, Klebsiella spp. і Pseudomonas aeruginosa, а також Myroides odoratus, Sphingomonas paucimobilis і Bergeyella zoohelcum [8, 9]. У травмованих із некротизуючим процесом був установлений мукормікоз, з рани виділені Apophysomyces elegans (Andresen D. et al., 2005) [11].
За даними Marc Maegele зі співавт. (2006 р.), при отриманні травм у прісних водоймах найбільш поширеними патогенами з ран були стафілококи і стрептококи, крім того, також із ран були виділені грамнегативні збудники (Pseudomonas, Aeromonas, Plesiomonas, Burkholderia), а також Leptospira, атипові мікобактерії й анаеробні бактерії. Aeromonas та Pseudomonas часто виділялись із ран з ураженням шкіри, м’яких тканин, легень, розвитком сепсису. Як вважають й інші дослідники, грампозитивна флора може бути занесена через воду, але MRSA, ESBL E. coli, S. maltophilia і Enterococci, швидше за все, були набуті в сортувальних установах при наданні медичної допомоги. У деяких випадках рани були дуже забруднені, та з них виділялись мультирезистентні збудники: із ран — E. faecalis і faecium, C. albicans, F. solani, A. fumigatus, P. aeruginosa і MRSA; із дихальних шляхів — A. baumannii, Alcaligenes xylooxidans, E. faecalis і faecium, K. pneumoniae, MRSA і S. maltophilia; із культур крові — Candida і E. faecium; із носових тампонів — E. faecium і A. fumigatus [10].
Після цунамі тяжкі ураження викликали багаторезистентні A. baumannii. Системні грибкові інфекції викликали Mucor і Fusarium, A. fumigatus, мукомор–ціоз (мукормікоз), що був викликаний Apophysomyces elegans, імовірно, збудник був отриманий під час травми або надання першої допомоги; а мукомор–ціоз, викликаний представниками цвілі Mucor (дуже поширені види цвілі), міг бути отриманий із ґрунту, рослинності, яка гниє, зруйнованих водою будівель [10]. Описано випадок, коли у постраждалого після цунамі у 2004 р. розвинулись масивні некрози м’язів, жирової тканини стегна в трьох несуміжних ділянках, а вже в подальшому був встановлений мукоморціоз (Apophysomyces elegans) [11].
При інвазивних інфекціях та з інфікованих поверхневих ран найчастіше виділялись рідкісні збудники (Vibrio spp., Aeromonas spp., Shewanella spp., Erysipelothrix rhusiopathiae, Mycobacterium marinum, Streptococcus iniae й інші мікроби) [7]. За даними J.H. Diaz (2014 р.), з інфікованих поверхневих морських ран та при інвазивних інфекціях найчастіше виділялась невелика кількість бактеріальних видів (Aeromonas hydrophila, Edwardsiella tarda, Erysipelothrix rhusiopathiae, Mycobacterium marinum, Vibrio vulnificus), а також бруцели, Chromobacterium violaceum, види Comamonas, Shewanella і Streptococcus iniae. У США серйозні і часті ранові інфекції виникали через V. vulnificus [12]. Розвитку некротизуючої пневмонії, шкірного і септичного меліоїдозу сприяли збудники виду Burkholderia [10]. При системних інфекціях виділялись мультирезистентні A. baumannii (чутливі тільки до ампіциліну/сульбактаму), E. faecalis (чутливі тільки до ампіциліну, карбапенемів і глікопептидів), E. faecium (чутливі тільки до глікопептидів), E. coli ESBL (чутливі до карбапенемів, амікацину, хінолінів), MRSA (чутливі до фосфоміцину, рифампіцину, лінезоліду і глікопептидів), С. maltophilia, Candida glabrata, Candida tropicalis (чутливі до офлоксацину) і цвілі, що були ідентифіковані як види Mucor, Fusarium solani, Aspergillus fumigatus.
Основними патогенами, отриманими місцево від риби, були Aeromonas hydrophila, Edwardsiella tarda, Erysipelothrix rhusiopathiae, Mycobacterium marinum, Streptococcus iniae, Vibrio vulnificus і Vibrio damsela [13].
Під час обстеження утоплених під час цунамі в дихальних шляхах виявляли аспірати з вмісту придонних вод, ґрунтового сміття. Подібно до ран, з верхніх і нижніх відділів дихальних шляхів був виділений багатий перелік як загальних збудників, а також і незвичайних, у тому числі і значна кількість мультирезистентних. У постраждалих, у яких розвинувся септичний шок та які потребували введення катехоламінів, із дихальних шляхів були виділені мультирезистентні A. baumannii, E. faecium (були чутливі тільки до глікопептидів), Klebsiella pneumoniае (чутливі тільки до амікацину), MRSA (чутливі до фосфоміцину, рифампіцину, лінезоліду і глікопептидів), Stenotrophomonas maltophilia (чутливі тільки до хінолінів). У осіб, у яких був виявлений синусит (нерідко реєструвався в постраждалих), були виділені мультирезистентні Acinetobacter, E. faecium, цвіль і Candida, Aeromonas, Klebsiella, E. coli і Proteus mirabilis, Plesiomonas shigelloides, Enteroccoci і P. mirabilis. A. baumanii були чутливі тільки до ампіциліну/сульбактаму, E. faecium чутливі тільки до глікопептидів. При сепсисі були виділені A. baumannii (чутливі тільки до ампіциліну/сульбактаму), E. faecalis (чутливі тільки до ампіциліну, карбапенемів і глікопептидів), E. faecium (чутливий тільки до глікопептидів), ESBL E. coli (чутливий до карбапенемів, амікацину, хінолонів), MRSA (чутливі до фосфоміцину, рифампіцину, лінезоліду і глікопептидів), S. maltophilia (чутливі до офлоксацину) [10].
Також, за даними інших дослідників, із ран, респіраторних шляхів і культур крові виявлялись мультирезистентні збудники: E. faecalis і faecium, C. albicans, F. solani, A. fumigatus, P. aeruginosa і MRSA — із ран; A. baumannii, Alcaligenes xylooxidans, E. faecalis і faecium, K. pneumoniae, MRSA і S. maltophilia — із дихальних шляхів; різновиди Candida і E. faecium — із культур крові; E. faecium і A. fumigatus — з носових тампонів. Зразки збудників із верхніх дихальних шляхів містили велику кількість різноманітних видів Acinetobacter, а також метицилін-стійких Staphylococcus aureus, Aeromonas hydrophilia, Pseudomonas та Candida albicans [5]. У постраждалих була додатково виявлена схильність до інфікування нозокоміальними патогенами.
Описаний випадок інфікування глибоких ран мультирезистентними A. baumannii, Stenotrophomonas maltophilia і Achromobacter xylosoxidans, Enterococcus faecium і Pseudomonas aeruginosa, а надалі в постраждалої з абсцесу в м’яких тканинах був виділений патоген Nocardia africanum, а ще пізніше з внутрішньомозкового абсцесу виділені Scedosporium apiospermum. У деяких резистентних до лікування випадках виявлялись Mycobacterium chelonae. Нетуберкульозні, мікобактеріальні інфекції слід враховувати в пізніх інфекціях, коли не було виявлено бактеріальних і стійких до антибіотиків збудників. Поверхневі інфекції ран, які отримані в морській воді, можуть призвести до глибокоінвазивних інфекцій і сепсису в пацієнтів з ослабленим імунітетом. В окремих випадках можуть розвиватись локалізований целюліт та інші різноманітні інфекції.
На стан здоров’я у вигляді різноманітних захворювань органів системи дихання (кашель, риніт, бронхіт, астма), подразнення очей та шкіри (атопічного дерматиту) впливало проживання в сирих будівлях після повені, навіть через 6 міс. після події. Найчастіше виділялись: Penicillium spp., Aspergillus spp., Acremonium spp., Phoma spp., Cladosporium spp., Chaetomium spp. і Stachybotrys spp. Також були виділені актиноміцети, мікобактерії та грамнегативні бактерії. Серед грибків частіше були виділені Aspergillus versicolor, Cladosporium spp., Fusarium spp., Ulocladium spp., Bacillus mycoides, Mucor spp., Exophiala spp., Stachybotrys spp. і Tritirachium spp. Виділення Aspergillus versicolor та Stachybotrys spp. сильно пов’язане з підвищеною вологістю в приміщеннях, і тому їх виділення вважається індикатором даного ушкодження приміщень [1].
При лікуванні в багатьох постраждалих, крім хірургічної обробки, застосовували також антибактеріальну терапію. При призначенні антибактеріальної терапії враховували те, що водні травми часто інфікувались грамнегативними полімікробними асоціаціями збудників, більшість із яких були стійкі до пеніцилінів 1-го і 2-го покоління і цефалоспоринів. За даними I. Uçkay зі співавт. (2008 р.), серед збудників інфікованих ран мультирезистентні грамнегативні бактерії були більш поширені, ніж грампозитивні. Реєструвалась висока поширеність бактерій, що продукують бета-лактамазу з розширеним спектром, грибкові інфекції, які тяжко лікуються в імунокомпетентних господарів. Дані збудники значно ускладнювали надання медичної допомоги та суттєво впливали на ефективність лікування [6]. O. Kallman зі співавт. (2005 р.) також вказували на те, що стійкість Escheri–chia coli, Klebsiella pneumoniae, Proteus mirabilis і Acinetobacter spp., виділених від постраждалих, до звичайних антибіотиків була вища порівняно з тією, що реєструвалась серед збудників у Швеції [8]. Тому J.H. Diaz зі співавт. (2015 р.) рекомендували при лікуванні всіх грамнегативних та мікобактеріальних морських інфекціях використовувати комбіновану антибактеріальну терапію [14].
За досвідом M. Maegele зі співавт. (2006 р.), всі пацієнти при лікуванні отримували емпіричну антибактеріальну терапію одразу після прибуття до стаціонару з використанням комбінації хінолонів і кліндаміцину.
Хінолони, зокрема групи III, ефективні проти як грампозитивних, так і грамнегативних організмів, у тому числі проти Enterobacteriaceae, ентеральних грамнегативних бактерій, стійких до пеніцилінів, цефалоспоринів та аміноглікозидів, також препарати справляють інгібуючий ефект проти Mycobacterium tuberculosis, Mycoplasma, Chlamydia, Legionella, Brucella і Pseudomonas. Установлено, що кліндаміцин ефективний проти стафілококів і стрептококів, а також анаеро–бів, проти Bacteroides, Corynebacteria і Mycoplasma. При встановленні збудників проводилась корекція терапії. Карбапенеми і глікопептиди часто використовувались при лікуванні мультирезистентних збудників E. faecium і faecium, MRSA, Aeromonas, ESBL, що продукують E. coli, P. aeruginosa, K. pneumoniae і S. maltophilia. При виявленні A. baumannii з множинною стійкістю призначався сульбактам. При MRSA, стійких до ванкоміцину, застосовувався лінезолід. Грибкові інфекції, у тому числі і C. albicans, лікувались вориконазолом [10].
У разі небезпечної для життя інфекції антибактеріальна терапія повинна була охоплювати і неферментуючі патогени [6].
Випадки перебігу поранень, розвитку ускладнень, лікування після події подані нижче (за даними літератури).
Описаний випадок, коли після повені в Таїланді в постраждалої розвинулась пневмонія, гостра дихальна недостатність, септичний шок, гостра ниркова недостатність, що потребувало штучної вентиляції легень, гемодіалізу. Були виділені (в культурах із бронхоальвеолярного лаважу, проведеного через 48 годин після втрати свідомості, бронхоспазму) Acinetobacter baumannii, стійкі до пеніцилінів, цефало–споринів, аміноглікозидів і триметоприму/сульфаметоксазолу, та Escherichia coli. Обидва штами бактерій були чутливими до іміпенем/циластатину та ципро–флоксацину. Через 2 тижні на фоні лікування ципрофлоксацином та іміпенем/циластатином зберігались гарячка, кашель. За допомогою КТ виявлений абсцес, з якого виділений Acinetobacter spр., стійкий до іміпенему/циластатину. На фоні лікування ампіцилін/сульбактамом через три тижні в пацієнта виявлено вже декілька легеневих абсцесів й емпієма. Шість тижнів проводилось лікування піперациліном/тазобактамом. Через місяць установлений спондилодисцит (T8-T9), викликаний Scedosporium apiospermum. Після операції лікування проводилось за допомогою вориконазолу (200 мг в/в двічі на день). Хвора одужала. Інша постраждала під час цунамі з глибокими ранами ніг, множинними переломами таза і розірваним сечовим міхуром знаходилась нерухомо в бруді протягом > 24 год. Після надання первинної хірургічної допомоги поранена доставлена в медичний стаціонар європейської країни. Із ран м’яких тканин були виділені мультирезистентні бактерії: A. baumannii (стійкий до всіх пеніцилінів, цефалоспоринів, аміноглікозидів, фторхінолонів, триметоприму, сульфаметоксазолу, чутливий тільки до колістину); Stenotropho–monas maltophilia (чутливий тільки до піперациліну/тазобактаму); Achromobacter xylosoxidans (чутливий до піперациліну/тазобактаму, іміпенему/циластатину, ципрофлоксацину). Також виділені пеніцилінрезистентні Enterococcus faecium і Pseudomonas aeruginosa. У зв’язку із задишкою проведена КТ, встановлена двобічна пневмонічна інфільтрація. Терапія проводилась піперациліном/тазобактамом протягом 14 днів. Із сечового міхура були виділені A. baumannii (чутливий тільки до колістину) і E. faecium. Через 2 тижні в пацієнтки на стегні розвинувся абсцес, був виділений Nocardia africanum. Проводилось лікування триметопримом/сульфаметоксазолом протягом 10 тижнів. Із 8-го тижня госпіталізації розвинулись гарячка, порушення свідомості. За даними КТ установлений внутрішньомозковий абсцес із гідроцефалією, із якого був виділений S. apiospermum, призначений вориконазол (4 мг/кг, в/в, двічі на добу) на 6 міс. із позитивним ефектом. У іншому випадку в постраждалого протягом трьох місяців після цунамі зберігалась відкрита рана в ділянці великогомілкової кістки (була виділена Mycobacterium chelonae, яка була чутлива до амікацину і кларитроміцину і стійка до іміпенему/циластатину, фторхінолонів і триметоприму/сульфаметоксазолу), а також абсцес головного мозку (викликаний Scedosporium apiospermum). Даний випадок цікавий тим, що відомо, що S. apiospermum є поширеним сапрофітним грибом, що рідко викликає інвазивні інфекції в імунокомпетентних господарів. В іншого пацієнта зі шкірною інфекцією була виділена M. chelonae (ці збудники швидко зростають, повсюдно поширені в ґрунті і водах, належать до числа найбільш стійких мікобактерій). Узагальнені інфекції, викликані цим збудником, спостерігаються головним чином у пацієнтів з ослабленим імунітетом; але є повідомлення і про ізольовані шкірні інфекції в імунокомпетентних пацієнтів [15]. Описані також менш часті інфекції — мукормікоз, Bacillus pseudomallei.
Зведені дані стосовно різновиду збудників та їх частоти виявлення з ран, пов’язаних із цунамі, подані в табл. 1 (Wuthisuthimethawee P. зі співавт., 2015 р.) [4].
Висновки
Спектр збудників інфікованих ран залежить від багатьох факторів, суттєвими з яких є такі: інфікування відбулось у морській воді чи прісній, в якому регіоні світу. При лікуванні слід враховувати значну кількість випадків із різноманітною асоціацією збудників та їх високу мультирезистентність. Постраждалі потребують тривалого спостереження.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/154-1.jpg)
/155-1.jpg)
/158-1.jpg)