Журнал «Медицина неотложных состояний» №4(91), 2018
Глутоксим как модулятор окислительно-восстановительного состояния глутатиона у септических пациентов с энцефалопатией
Авторы: Кобеляцкий Ю.Ю.(1), Мальцева Л.А.(1), Мосенцев Н.Ф.(2), Лисничая В.Н.(2)
(1) — ГУ «Днепропетровская медицинская академия», г. Днепр, Украина
(2) — КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова», г. Днепр, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Резюме
Актуальність. На даний час сепсис визначається як життєво небезпечна органна дисфункція, що викликана дисрегульованою відповіддю хазяїна на інфекцію (Sepsis-3). Одним із потенційно можливих шляхів для управління дисрегульованою відповіддю хазяїна на інфекцію є модуляція окислювально-відновного стану глутатіону з використанням препарату глутоксим. У нашій країні глутоксим зареєстрований як препарат для імунологічної корекції. Відновлений глутатіон (GSH) вважається одним із найважливіших нейтралізаторів активних форм кисню, а його співвідношення з окисленим глутатіоном (GSSG) можна використовувати як маркер окислювального стресу. Мета дослідження — оцінка клінічних ефектів, отриманих при використанні глутоксиму як модулятора окислювально-відновного статусу глутатіону, та його здатності поліпшувати якість життя у пацієнтів із сепсисом і септичною енцефалопатією. Матеріали та методи. Проспективне рандомізоване когортне дослідження було проведено у 30 пацієнтів з сепсисом і септичним шоком, які отримували глутоксим 60 мг/доба (група 2 — глутоксим), і 30 осіб, які не отримували глутоксим (група 1 — контроль). Оцінені концентрація лактату в плазмі, кліренс лактату, насичення центральної венозної крові киснем (ScvO2), показники дисфункції органів за SOFA. Для виявлення ознак септичної енцефалопатії та оцінки якості життя використовувались шкали Confusion Assessment Method for the Intensive Care Unit (CAM-ICU), Cognitive Failure Questionnaire (CFQ), Rancho Los Amigos Scale (RLAS). Постсептичний синдром (PSS) був проаналізований як стан, що спостерігається у пацієнтів, які вижили після сепсису, і характеризується фізичними та психологічними порушеннями. Результати. Рівень смертності у відділенні інтенсивної терапії (ВІТ) у групах спостереження не досягав рівня вірогідності (у групі глутоксиму — 20 % проти 30 % у контролі; p > 0,05). У групі 2 доля пацієнтів із стійкою дисфункцією органів на 5-й день була значно менша (SOFA — 1,66 ± 0,39 проти 2,33 ± 0,79 у групі 1; р = 0,043). Кліренс лактату був значно вищий у групі 2 (0,632 ± 0,093 ммоль/л/день проти 0,350 ± 0,064 ммоль/л/день у групі 1; р = 0,018). Кінетика лактату, що являє собою баланс між утворенням лактату і його елімінацією, у поєднанні з ScvO2 використовувалася як показник ресусцитації (83,6 ± 4,7 % проти 70,6 ± 3,1 % в обох групах; р = 0,028). Когнітивні порушення були виявлені у 16 пацієнтів у групі 2 проти 19 в групі 1 (р = 0,043). Симптоми PSS спостерігалися значно рідше в групі глутоксиму, такі як безсоння, порушення сну (16 проти 19; р = 0,093), поєднана біль у м’язах та суглобах (13 проти 18; р = 0,016), стійка дисфункція органів (5 проти 11; p = 0,024), зниження самооцінки (9 проти 15; p = 0,021), депресія (10 проти 16; р = 0,015). Отже, в період відновлення у близько 50 % пацієнтів, які вижили після сепсису, спостерігалися короткочасні або тривалі когнітивні та фізіологічні порушення, що в сукупності називаються постсептичним синдромом. Порушення можуть включати фізичні, психологічні, розумові проблеми та зниження якості життя, пов’язані зі здоров’ям, у септичних пацієнтів. Висновки. Призначення глутоксиму як додаткової терапії у пацієнтів з сепсисом не впливало на смертність у ВІТ. Ґрунтуючись на результатах цього дослідження, використання глутоксиму може бути запропоновано як додаткова терапія у септичних пацієнтів з енцефалопатією для зниження ризику розвитку постсептичного синдрому.
Актуальность. На данный момент сепсис определяется как угрожающая жизни органная дисфункция, вызванная дисрегулированным ответом хозяина на инфекцию (Sepsis-3). Одним из потенциально возможных путей для управления дисрегулированным ответом хозяина на инфекцию является модуляция окислительно-восстановительного состояния глутатиона с использованием препарата глутоксим. В нашей стране глутоксим зарегистрирован как препарат для иммунологической коррекции. Восстановленный глутатион (GSH) считается одним из наиболее важных нейтрализаторов активных форм кислорода, а его соотношение с окисленным глутатионом (GSSG) можно использовать в качестве маркера оксидативного стресса. Цель исследования — оценка клинических эффектов, полученных при использовании глутоксима как модулятора окислительно-восстановительного статуса глутатиона, и его способности улучшать качество жизни у пациентов с сепсисом и септической энцефалопатией. Материалы и методы. Проспективное рандомизированное когортное исследование было проведено у 30 пациентов с сепсисом и септическим шоком, которые получали глутоксим 60 мг/день (группа 2 — глутоксим), и 30 человек, которые не получали глутоксим (группа 1 — контроль). Оценены концентрация лактата в плазме, клиренс лактата, насыщение центральной венозной крови кислородом (ScvO2), показатели дисфункции органов по SOFA. Для выявления признаков септической энцефалопатии и оценки качества жизни использовались шкалы Confusion Assessment Method for the Intensive Care Unit (CAM-ICU), Cognitive Failure Questionnaire (CFQ), Rancho Los Amigos Scale (RLAS). Был проанализирован постсептический синдром (PSS) как состояние, которое наблюдается у пациентов, выживших после сепсиса, и характеризующееся физическими и психологическими нарушениями. Результаты. Различие в уровне смертности в отделении интенсивной терапии (ОИТ) в группах наблюдения не достигало уровня достоверности (группа глутоксима — 20 % против 30 % в контрольной группе; p > 0,05). В группе 2 доля пациентов со стойкой дисфункцией органов на 5-й день была значительно меньше (SOFA — 1,66 ± 0,39 против 2,33 ± 0,79 в группе 1; p = 0,043). Клиренс лактата был значительно выше в группе 2 (0,632 ± 0,093 ммоль/л/день против 0,35 ± 0,064 ммоль/л/день в группе 1; p = 0,018). Кинетика лактата, представляющая собой баланс между образованием лактата и его элиминированием, в сочетании с ScvO2 использовалась как показатель ресусцитации (83,6 ± 4,7 % против 70,6 ± 3,1 % в обеих группах; p = 0,028). Когнитивные нарушения были выявлены у 16 пациентов в группе 2 против 19 в группе 1 (p = 0,043). Симптомы PSS наблюдались значительно реже в группе глутоксима, такие как бессонница, нарушение сна (16 против 19; p = 0,093), сопряженные мышечные и суставные боли (13 против 18; p = 0,016), стойкая дисфункция органов (5 против 11; p = 0,024), снижение самооценки (9 против 15; p = 0,021), депрессия (10 против 16; p = 0,015). Следовательно, в период восстановления у около 50 % выживших пациентов после сепсиса наблюдаются краткосрочные или длительные когнитивные и физиологические нарушения, которые в совокупности называются постсептическим синдромом. Нарушения могут включать физические, психологические и умственные проблемы и снижение качества жизни, связанные со здоровьем, у септических пациентов. Выводы. Назначение глутоксима в качестве дополнительной терапии у пациентов с сепсисом не влияло на смертность в ОИТ. Основываясь на результатах этого исследования, использование глутоксима может быть предложено в качестве дополнительной терапии у септических пациентов с энцефалопатией для снижения риска развития постсептического синдрома.
Background. Sepsis is defined now as a life-threatening organ dysfunction caused by dysregulated host response to infection (Sepsis-3). One of the potential pathway for managing dysregulated host response to infection is modulation of glutathione redox state by means of glutoxim. In our country, glutoxim registered as a drug for immunological correction. Reduced glutathione is considered to be one of the most important scavenger of reactive oxygen species and its ratio with oxidized glutathione may be used as a marker of oxidative stress. The aim of this study was to evaluate the ability of glutoxim as a modulator of glutathione redox state to induce the good clinical effects and improve the quality of life in septic patients with encephalopathy. Materials and methods. A prospective, randomized cohort study was conducted in 30 patients with sepsis and septic shock, who received glutoxim 60 mg/day (group 2), and 30 persons, who did not (group 1 — control). The plasma concentration of lactate, clearance of lactate, saturation of central venous blood (ScvO2), the signs of organ dysfunction were evaluated using Sequential Organ Failure Assessment (SOFA). To detect the signs of septic encephalopathy and to evaluate the quality of life, we used: Confusion Assessment Method for the Intensive Care Unit, Cognitive Failure Questionnaire and Rancho Los Amigos Scale. Post-sepsis syndrome was analyzed as a condition that affects sepsis survivors with physical and psychological effects. Results. Mortality in the intensive care units was almost similar (in the glutoxim group — 20 vs 30 % in control group; p > 0.05). Proportion of patients with persistent organ dysfunction by day 5 was significantly smaller in group 2 (SOFA — 1.66 ± 0.39 vs 2.33 ± 0.79 in group 1; p = 0.043). Clearance of lactate was significantly higher in group 2 (0.632 ± 0.093 mmol/l/day vs 0.35 ± 0.064 mmol/l/day in group 1; p = 0.018). Lactate kinetics (a balance between lactate production and elimination) combined with ScvO2 was used as a resuscitation parameter (83.6 ± 4.7 % vs 70.6 ± 3.1 % in both groups; p = 0.028). Cognitive impairments was identified in 16 patients in group 2 vs 19 in group 1; p = 0.043. Symptoms of post-sepsis syndrome, such as insomnia, sleep disorders (16 vs 19; p = 0.093), concomitant muscle and joint pains (13 vs 18; p = 0.016), persistent organ dysfunction (5 vs 11; p = 0.024), low self-esteem (9 vs 15; p = 0.021), depression (10 vs 16, p = 0.015), were much less frequent in the glutoxim group. Consequently, about 50 % of sepsis survivors experience either short- or long-term cognitive and physical problems during their recovery period, which are collectively termed as post-sepsis syndrome. The difficulties may include physical, psychological and mental issues and reduced health-related quality of life in septic patients. Conclusions. Based on the results of this study, the use of glutoxim may be suggested as adjunctive therapy in septic patients with encephalopathy to reduce increased risk of post-sepsis syndrome.
Ключевые слова
глутоксим; глутатіон; сепсис; септична енцефалопатія, постсептичний синдром
глутоксим; глутатион; сепсис; септическая энцефалопатия; постсептический синдром
glutoxim; glutathione; sepsis; septic encephalopathy; post-sepsis syndrome
Введение
Ежегодно у более чем 19 млн человек развивается сепсис. Около 14 млн человек выживают в условиях стационара с различными прогнозами в будущем. Половина больных выздоравливают, треть умирают в течение года вследствие персистирующих органных расстройств, включая тяжелые когнитивные расстройства, такие как тревога (32 % пациентов), депрессия (29 %), посттравматические стрессовые расстройства (44 %). Около 40 % пациентов повторно госпитализируются в течение 90 дней после выписки в связи с развитием новых инфекций, острого повреждения почек или сердечно-сосудистых нарушений. У выживших больных с сепсисом часто наблюдаются когнитивные расстройства и функциональные физиологические нарушения [1]. У 34 % пациентов наблюдались тяжелые когнитивные расстройства, у 72,5 % — сложные нарушения качества жизни [2, 3]. В течение месяца после выписки лечение больных с сепсисом должно быть направлено на идентификацию новых физиологических, ментальных расстройств, составление программы продленного лечения, оценки необходимости повторной госпитализации при появлении инфекции, органных дисфункций [1, 4]. У пациентов, которые выздоровели после сепсиса, наблюдаются такие симптомы, как мышечная слабость, утомляемость, затрудненное глотание, спутанное мышление, снижение памяти, нарушение сна, печаль, уныние, тревога. Постсептический синдром (Post-sepsis Syndrome, PSS) наблюдается у 50 % выживших пациентов. PSS включает в себя физиологические и/или психологические продолжительные нарушения, такие как нарушение засыпания и длительности сна; ночные кошмары, яркие галлюцинации, панические атаки; сопряженные мышечные и суставные боли; выраженная утомляемость; плохая концентрация внимания; снижение ментальных (когнитивных) функций; снижение самоуважения и уверенности в себе; органные дисфункции (почечные, дыхательные, сердечно-сосудистые нарушения); ампутация конечностей [5].
Новая парадигма Sepsis-3 определяет сепсис как угрожающую жизни органную дисфункцию, вызванную дисрегулированным ответом хозяина на инфекцию. Такое определение дает основание для дальнейшего изучения механизмов дисрегуляции и способов управления этими механизмами. Ключевыми аспектами развития и течения септического процесса являются наличие инфекции; развитие дисрегулированного ответа на инфекцию, ведущего к органной дисфункции; прогрессирование тяжести органной дисфункции, ассоциированное с повышением летальности [6, 7].
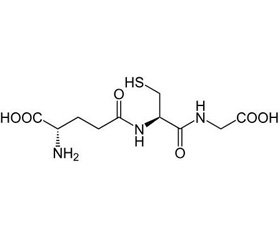
Глутатионовый статус — основной показатель уровня интоксикации организма. Глутатион — это трипептид γ-глутамилцистеинилглицин. Глутатион содержит пептидную связь между аминогруппой цистеина и карбоксильной группой боковой цепи глутамата. В клетке тиоловые группы находятся в восстановленном состоянии (SH) и восстанавливают любую дисульфидную связь (S-S), образующуюся между остатками цистеина внутриклеточных белков. При этом восстановленная форма глутатиона (GSH) превращается в окисленную (GSSG). GSSG восстанавливается под действием фермента глутатионредуктазы, который постоянно находится в клетке в активном состоянии и активируется при оксидативном стрессе. Соотношение GSH/GSSG используется как маркер оксидативного стресса [8]. Антиоксидантные свойства глутатиона определяются его способностью защищать клетку от токсического влияния свободных радикалов и определять окислительно-восстановительные характеристики внутриклеточной среды. Соотношение GSH/GSSG регулирует многие транскрипционные факторы и белковую активность, влияет на клеточный редокс-потенциал [9–11].
Цель исследования: определение эффективности и безопасности адъювантной терапии путем гармонизации глутатионового статуса с использованием глутоксима у больных с сепсисом и септическим шоком и септической энцефалопатией.
Материалы и методы
Проведено проспективное рандомизированное когортное исследование в отделении интенсивной терапии для больных с гнойно-септической патологией КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова».
В исследование включались больные с установленным или подозреваемым сепсисом, согласно определению Sepsis-3, среднего, высокого и очень высокого риска по шкале MEDS (Mortality in Emergency Department Sepsis Score) [12]. Пациенты были разделены на две группы. В группе 1 (контрольной) пациенты получали базисную терапию согласно Surviving Sepsis Campaign (SSC), в группе 2 (основной) пациенты дополнительно получали глутоксим (глутамил-цистеинил-глицин динатрия) в дозе 60 мг внутривенно однократно 1 раз в сутки [13, 14]. Основные клинические и демографические характеристики больных представлены в табл. 1.
/145-1.jpg)
Глутоксим — синтетический аналог гексапептида окисленного глутатиона, который присутствует как в клетке, так и во внеклеточном пространстве. Окисленный глутатион активирует ферменты второй фазы детоксикации ксенобиотиков, включая глутатион-S-трансферазу, глутатионредуктазу, глутатионпероксидазу, глюкозо-6-фосфатдегидрогеназу, гемоксигеназу-1 в цитозоле, микросомах и митохондриях. Действие ферментов второй фазы детоксикации ксенобиотиков направлено на восстановление окислительно-восстановительного баланса и антиоксидантную защиту, нейтрализацию электрофильных ксенобиотиков и выведение их из клеток. Глутатионовый статус — основной показатель уровня редокс-регуляции клеточных функций, который имеет ключевое значение для передачи сигналов между клетками и внутри клеток. Наиболее реактивно способной является окисленная форма глутатиона, которая отвечает за адаптационно-компенсаторные реакции организма. Пополнение пула GSSG в организме, когда запасы глутатиона истощаются, представляется одним из важных направлений адъювантной терапии при сепсисе. Нарушение глутатионового статуса способствует развитию многих тяжелых состояний у критических больных. На данный момент быстрых тестов для определения глутатионовой недостаточности не существует, поэтому одна из наиболее частых и ранних органных дисфункций — энцефалопатия, имеющая клинические проявления, в достаточной мере отражает состояние дисфункции глутатионового статуса [10, 11].
Больные контрольной группы (группа 2, n = 30) были сопоставимы с больными основной группы (группа 1, n = 30) по возрасту, характеру течения заболевания, сопутствующей патологии, органным нарушениям.
Оценка седации и возбуждения проводилась по SAS, оценка уровня сознания — по GCS (Glasgow Coma Scale). Интегральная оценка качества жизни проводилась по модифицированной шкале RLAS (Rancho Los Amigos Scale) до 28-го дня как процент пациентов в группах, достигших уровня 10 [12].
Для оценки определены конечные точки: выживаемость больных до 28-го дня; наличие персистирующих органных дисфункций (оценка по SOFA ≥ 2 баллов); оценка качества жизни по RLAS (как процент пациентов в группах, достигших уровня 10).
Промежуточные и суррогатные точки: уровень и клиренс лактата крови. Кинетика лактата как баланс между его продукцией и элиминацией — клиренс лактата представляется как объективный параметр эффективности ресусцитации [15]. В сочетании с сатурацией центральной венозной крови (ScvO2) кинетика лактата не только отражает тяжесть сепсиса, но и является руководством для выбора терапевтических подходов. ScvO2 отражает баланс между доставкой и потреблением кислорода (O2). Низкий ScvO2 определяет наличие неадекватной доставки кислорода (DO2), его высокое значение указывает на снижение потребления кислорода (VO2) и ассоциируется с повышением летальности у пациентов с дизоксией [6, 16–18]. К суррогатным точкам относятся также показатели, характеризующие септическую энцефалопатию.
Результаты и обсуждение
Результаты промежуточных, суррогатных и конечных точек представлены в табл. 2. Летальность в группах наблюдения была сопоставима: 20 % в группе глутоксима против 30 % в контрольной группе (p > 0,05). В группе 2 доля пациентов со стойкой дисфункцией органов на 5-й день была значительно меньше (SOFA — 1,66 ± 0,39 против 2,33 ± 0,79 в группе 1; p = 0,043). Клиренс лактата был значительно выше в группе 2 (0,632 ± 0,093 ммоль/л/день против 0,35 ± 0,064 ммоль/л/день в группе 1; p = 0,018). Кинетика лактата, представляющая собой баланс между образованием лактата и его элиминированием, в сочетании с ScvO2 использовалась как показатель ресусцитации (83,6 ± 4,7 % против 70,6 ± 3,1 % в обеих группах; p = 0,028).
Когнитивные нарушения были выявлены у 16 пациентов в группе 2 против 19 в группе 1 (p = 0,043). Симптомы PSS наблюдались значительно реже в группе глутоксима, такие как бессонница, нарушение сна (16 против 19; p = 0,093), сопряженные мышечные и суставные боли (13 против 18; p = 0,016), стойкая дисфункция органов (5 против 11; p = 0,024), снижение самооценки (9 против 15; p = 0,021), депрессия (10 против 16; p = 0,015). Следовательно, в период восстановления у около 50 % выживших пациентов после сепсиса наблюдаются краткосрочные или длительные когнитивные и физиологические нарушения, которые в совокупности называются постсептическим синдромом. Нарушения могут включать физические, психологические и умственные проблемы и снижение качества жизни, связанные со здоровьем у септических пациентов. Выраженность симптомов постсептического синдрома (PSS) и результаты оценки качества жизни представлены в табл. 3 [19–21].
Выводы
Основываясь на результатах этого исследования, использование глутоксима может быть предложено в качестве дополнительной терапии у септических пациентов с энцефалопатией для снижения риска развития постсептического синдрома.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Prescott H.C. Enhancing Recovery from Sepsis / H.C. Prescott, D.C. Angus // JAMA. — 2018. — № 319(1). — P. 62-75.
2. Ehlenbach W.J. Sepsis Survivors Admitted to Skilled Nur–sing Facilities: Cognitive Impairment, Activities of Daily Li–ving Dependence, and Survival / W.J. Ehlenbach, A. Gilmore-Bykovskyi, M.D. Repplinger, R.P. Westergaard // Crit. Care Med. — 2018. — № 46(1). — P. 37-44.
3. Putra B.E. The Mortality of Emergency Department Sepsis Score as a Predictor of 1-Month Mortality among Adult Patients with Sepsis: Weighing the Evidence / B.E. Putra, L. Tiah // ISRN Emergency Medicine. — 2013. — № 6. — ID 896802.
4. Shapiro N. Mortality in Emergency Department Sepsis (MEDS) score predicts 1-year mortality / N. Shapiro, M.D. Howell, D. Talmor, M. Donnino // Critical Care Med. — 2007. — № 35(1). — P. 192-198.
5. Prescott H.C. Postsepsis Morbidity / H.C. Prescott, D.C. Angus // JAMA. — 2018. — № 319(1). — P. 91.
6. Singer M. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) / M. Singer, C.S. Deutschman, C.W. Seymour, M. Shankar-Hari et al. // JAMA. — 2016. — № 315(8). — P. 801-810. — DOI: 10.1001.
7. Rhodes A. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016 / A. Rhodes, L.E. Evans, W. Alhazzani, M.M. Levy et al. // Intensive Care Med. — 2017. — № 43(3). — P. 304-377. — DOI: 10.1007/s00134-017-4683-6.
8. Zitka O. Redox status expressed as GSH:GSSG ratio as a marker for oxidative stress in pediatric tumor patients / O. Zitka, S. Skalickova, J. Gumulec, M. Masarik et al. // Oncol. Lett. — 2012. — № 4(6). — P. 1247-1253.
9. Chin D.C. A Low Glutathione Redox State Couples with a Decreased Ascorbate Redox Ratio to Accelerate Flowering in Oncidium Orchid / Chin D.C., Hsieh C.C., Lin H.Y., Yeh K.W. // Plant and Cell Physiol. — 2016. — № 57(2). — P. 423-436.
10. Garcia J. Regulation of mitochondrial glutathione redox status and protein glutathionylation by respiratory substrates / J. Garcia, D. Han, H. Sancheti, L.P. Yap et al. // J. Biol. Chem. — 2010. — № 285(51). — P. 39646-39654. — DOI: 10.1074/jbc.M110.164160.
11. Sanchez-Duarte E. Nicorandil improves post-fatigue tension in slow skeletal muscle fibers by modulating glutathione redox state / E. Sanchez-Duarte, X. Trujillo, C. Cortes-Rojo, A. Saavedra-Molina et al. // Journal of Bioenergetics and Biomembranes. — 2017. — № 49(2). — P. 159-170. — DOI: 10.1007/s10863-016-9692-6.
12. Сепсис-асоційована енцефалопатія / Мальцева Л.О., Кобеляцький Ю.Ю., Мосенцев М.Ф., Панін А.М., Карась Р.К., Ліснича В.М., Черненко В.Г.; під ред. Л.О. Мальцевої. — Дніпропетровськ: ТОВ «ЛізуновПрес», 2012. — 246 с. — ISBN 978-966-2575-18-7.
13. Goucalves-Pereira J. Dose modulation: A new concept of antibiotic therapy in the critically ill patients? / J. Goucalves-Pereira, J.A. Paiva // J. Crit. Care. — 2013. — № 28(4). — P. 341-346. — DOI: 10.1016/j.jcrc.2012.11.018.
14. Gando S. Is SIRS dead? The new definition of sepsis / S. Gando // Journal of Intensive Care. — 2016. — № 4. — 48.
15. Zhon X. Lactate and stepwise lactate kinetics can be used to guide resuscitation / X. Zhou, L. Dawei, S. Longxiang // Critical. Care. — 2017. — № 21. — P. 267.
16. Numata G. Usefulness of central venous saturation as a predictor of thiamine deficiency in critically ill patients: a case report / G. Numata, S. Kodera, H. Kiriyama, A. Nakayama et al. // J. of Intensive Care. — 2017. — № 5. — P. 61. — DOI: 10.1186/s40560-017-0255-7.
17. Hernandez G. Fourth Surviving Sepsis Campaign's hemodynamic recommendations: a step-forward or a return to chaos? / G. Hernandez, J. Teboul // Crit. Care. — 2017. — № 21. — P. 133.
18. Helmy T.A. Prognostic value of venous to arterial carbon dioxide difference during early resuscitation in critically ill patients with septic shock / T.A. Helmy, E.M. El-Reweny, F.G. Ghazy // IJCCM. — 2017. — № 21(9). — P. 589-593.
19. Bruck E. The impact of sepsis, delirium, and psychological distress of self-rated cognitive function in ICU survivors — a prospective cohort study / E. Bruck, A. Schandl, M. Bottai, P. Sackey // J. Intensive Care. — 2018. — № 6. — 2.
20. Минцер О.П. Параметрическая и непараметрические критерии различия / О.П. Минцер // Біль, знеболювання і інтенсивна терапія. — 2000. — № 1(10). — С. 69-75.
21. Минцер О.П. Непараметрические критерии различия для двух совокупностей / О.П. Минцер // Біль, знеболювання і інтенсивна терапія. — 2000. — № 2(11). — С. 68-75.

/145-1.jpg)
/146-1.jpg)