Вступ
Протягом останніх років інфекції сечової системи (ІСС) залишаються актуальною проблемою внутрішньої медицини [1]. ІСС загалом і пієлонефрит (ПН) зокрема є найпоширенішими захворюваннями в усіх країнах світу, на які припадає понад 150 млн випадків на рік, і за частотою звернень по медичну допомогу в амбулаторній практиці посідають 2-ге місце серед всіх інфекцій, поступаючись лише інфекціям дихальних шляхів [2, 3]. Щороку понад 10 % людей хворіють на ІСС. Згідно з даними різних авторів [4–6], упродовж життя 70 % жінок принаймні хоч раз у житті відмічають епізод ІСС, у 40 % спостерігається від 1 до 3 рецидивів ІСС на рік, а в 15 % пацієнтів має місце рецидивуючий перебіг захворювання [7]. Недуга переважно вражає осіб працездатного віку і призводить до тимчасової чи постійної втрати працездатності, серйозних структурних змін у нирках із відповідними наслідками, що зумовлює її медико-соціальне значення [5, 8, 9]. Даній патології притаманні гендерні й вікові особливості, що зумовлює необхідність урахування їх при розробці й плануванні лікувально-профілактичних заходів.
Незважаючи на успіхи, досягнуті протягом останніх років у лікуванні й профілактиці ПН, оптимізація терапевтичних схем лікування з метою мінімізації рецидивів і запобігання прогресуванню хронічної ниркової недостатності залишається актуальною медичною проблемою [10–13]. У переважній більшості випадків неефективність лікування пов’язують з розвитком бактеріальної полірезистентності через часте використання антибактеріальних препаратів, змінами в різних ланках імунної відповіді, метаболічними змінами, зокрема ендотоксикозом, мембранодеструктивними процесами, зумовленими активацією процесів перекисного окиснення ліпідів (ПОЛ), а також розвитком вторинного імунодефіциту [5, 14–16]. Проблема лікування хворих на ПН із порушеною функцією нирок залишається недостатньо вивченою, а літературні дані щодо лікування даної категорії пацієнтів обмежені застереженнями щодо доз антибактеріальних препаратів при порушенні функції нирок. Саме тому є обґрунтованим пошук терапевтичних схем, які б не лише мали добрий антибактеріальний ефект, а й чинили імуномодулюючу дію, а також впливали на інтенсивність мембранодеструкції, рецидивування хвороби й зменшували темпи зниження швидкості клубочкової фільтрації (ШКФ) у пацієнтів із порушеною функцією нирок.
Одним з перспективних напрямків є застосування препарату Канефрон Н, що має протизапальну, антимікробну, спазмолітичну, діуретичну дії, покращує нирковий кровообіг і, за деякими даними, при регулярному застосуванні сповільнює темпи зниження швидкості клубочкової фільтрації [17]. Однак дані щодо його ефективності в лікуванні хворих зі зниженою ШКФ вкрай обмежені.
Мета дослідження: оцінити динаміку клінічних симптомів, ШКФ і частоту рецидивів ПН у жінок із незначно й помірно зниженою функцією нирок при використанні препарату Канефрон Н і дослідити його вплив на метаболічні й імунні порушення.
Гіпотеза полягала в тому, що Канефрон Н у комбінації з антибактеріальними препаратами здатен істотно зменшувати кількість рецидивів ПН у жінок із незначно та помірно зниженою функцією порівняно із стандартним лікуванням з використанням антибактеріальних препаратів.
Дизайн дослідження: клінічне дослідження IV фази, відкрите, з активним контролем, проспективне, з використанням паралельних груп, рандомізоване, моноцентрове.
Матеріали та методи
Нами проведено комплексне обстеження 69 хворих жінок на базі нефрологічного відділення Тернопільської університетської лікарні в період 2013–2017 років. Усім пацієнткам було діагностовано хронічний пієлонефрит у період рецидиву. У всіх пацієнток була знижена ШКФ у діапазоні від 89 до 60 мл/хв. Вік хворих коливався від 18 до 60 років, у середньому становив 41,2 ± 9,8 року.
Критеріями включення пацієнток до дослідження були наявність клінічних ознак загострення пієлонефриту, ідентифікація бактеріального збудника при мікробіологічному дослідженні сечі, достатня мотивація, здатність дотримуватися правил участі в дослідженні й письмова інформаційна згода пацієнтки на участь у дослідженні.
Критеріями виключення з дослідження були: прийом будь-якого препарату чи будь-якого фітопрепарату протягом 3 місяців до включення в дослідження, вагітність, лактація, декомпенсовані захворювання або гострі стани, у тому числі гострий і хронічний гепатит, рівень аланінамінотрансферази (AлАT), що в понад 3 рази перевищував верхню межу норми, застійна серцева недостатність (клас III або IV за NYHA), епізод гострого пошкодження нирок протягом 6 місяців до включення в дослідження, наявність обструкції сечової системи, супутні пухлини нирок і сечових шляхів і/або зниження швидкості клубочкової фільтрації < 60 мл/хв, алкоголізм і наркоманія.
Усім хворим було проведено повне фізикальне обстеження, а також комплекс загальноприйнятих у нефрології методів лабораторно-інструментальних досліджень (загальний аналіз крові, загальний аналіз сечі, кількісне дослідження сечового осаду, добова протеїнурія, біохімічний аналіз крові із визначенням глюкози, сечовини, креатиніну як функціональних печінкових показників, визначали вміст білірубіну, аспартатамінотрансферази (АсАТ), аланінамінотрансферази, лужної фосфатази (ЛФ)). Функцію нирок оцінювали за ШКФ, яку визначали за формулою CKD-EPI (2012).
Мікробіологічне дослідження сечі включало ідентифікацію збудника за методом Bergey і визначення чутливості бактерій до антибіотиків методом стандартних дисків [18]. Кількісне визначення бактерій проводили за допомогою посіву сечі на тверді поживні середовища. Діагностично значущим вважали наявність > 104 колонієутворюючих одиниць в 1 мл сечі.
З метою виключення екстраренальної лейкоцитурії всі пацієнтки були оглянуті гінекологом та урологом, а також обстежені на предмет урогенітальних інфекцій (трихомоніазу, хламідіозу, мікоплазмозу, уреаплазмозу) за допомогою імуноферментного аналізу. Виявлення вказаної патології було критерієм виключення з дослідження.
Неускладненим ПН вважали інфекційно-запальний процес у здорової невагітної сексуально активної жінки. Рецидивуючим перебігом вважали наявність 3 і більше рецидивів на рік. Серед обстежених переважали пацієнтки з хронічним неускладненим пієлонефритом — 38 (55,1 %) проти 31 (44,9 %) хворої на хронічний ускладнений пієлонефрит, р < 0,05. Ускладнюючими факторами були: сечокам’яна хвороба у 2 жінок (2,8 %), вроджені аномалії розвитку — 1 (1,4 %) випадок, відсутність однієї нирки — 2 (2,8 %), нефроптоз ІІ ступеня — 4 (5,8 %), цукровий діабет — 6 (8,7 %), артеріальна гіпертензія — 7 (13,0 %) і в постменопаузальний вік — 8 (11,6 %) випадків. Тривалість захворювання пацієнток коливалась від 1 до 18 років і середньому становила 7,1 ± 0,7 року. Контрольну групу становили 20 практично здорових осіб.
Діагностика синдрому ендогенної інтоксикації проводилась шляхом виявлення клінічних ознак інтоксикації, а також за вмістом в крові й сечі середньомолекулярних пептидів (СМПер і СМПсечі), які визначались при фотоколориметруванні на довжині хвилі 254 і 280 нм (СМП254нм, СМП280нм) у реакції з трихлороцтовою кислотою [18], та еритроцитарного індексу ендогенної інтоксикації (ЕІЕІ), який ґрунтується на зміні сорбційної здатності мембран еритроцитів при ендотоксикозі.
Проведено дослідження сироваткового вмісту малонового діальдегіду (МДА) як показника інтенсивності ПОЛ шляхом спектрофотометричного визначення за методом Н.Д. Стальної [19]. Серед показників антиоксидантної системи захисту (АОСЗ) визначали сироватковий вміст супероксиддисмутази (СОД) в реакції з нітросинім тетразолієм [20], каталази — за швидкістю розкладання перекису водню [21], відновленого глутатіону (SH-груп) при взаємодії з 2-нітробензойною кислотою [22].
Серед показників клітинної й гуморальної ланок імунітету здійснено визначення відносного вмісту в плазмі крові Т-лімфоцитів (CD3+) і їх популяцій (Т-лімфоцитів з властивостями хелперів, CD4+; Т-лімфоцитів із властивостями супресорів, CD8+), імунорегуляторного індексу (співвідношення CD4+/CD8+), природних кілерів (NK-клітин, CD16+), В-лімфоцитів (CD72+). Популяційний склад лімфоцитів визначали методом непрямої імунофлюоресценції з використанням відповідних моноклональних антитіл. Функціональну активність В-лімфоцитів оцінювали за концентрацією сироваткових імуноглобулінів класів A, M, G. Їх визначення проводили методом радіальної імунодифузії й преципітації в агарі (Mancini G. et al., 1965). Концентрацію циркулюючих імунних комплексів (ЦІК) у сироватці крові визначали за методом Й.І. Хоткової і співавт. (1978).
Відповідно до застосованих схем лікування всіх хворих із рецидивуючим перебігом ПН було рандомізовано у 2 групи. Групи були порівнянні за віком, тривалістю захворювання та ШКФ. Першій групі (1-ша група, антибіотик + Канефрон Н), яка включала 35 хворих, було призначено антибактеріальну терапію й рослинний препарат Канефрон Н по 2 драже або 50 крапель 3 рази на день протягом 24 тижнів (6 місяців).
Друга група (2-га група, антибіотик), до якої входили 34 пацієнтки, отримувала лише антибактеріальну терапію, що призначалася з урахуванням чутливості до антибіотиків згідно з рекомендаціями Європейської асоціації урологів щодо лікування ІСС. Тривалість лікування становила 14 днів до досягнення нормалізації сечового осаду, при потребі тривала ще 7–10 днів.
Тривалість дослідження становила 28 тижнів: 24 тижні лікування і 4 тижні подальшого спостереження.
Клініко-лабораторні показники оцінювали при надходженні хворих у стаціонар, через 14 днів і повторно після проведення 24-тижневого курсу лікування. Ефективність лікування з використанням Канефрону Н оцінювали за наявністю рецидивів через рік спостереження.
Статистична обробка результатів проводилась методом варіаційної статистики за допомогою програми Microsoft Excel. Для порівняння кількісних показників незалежних груп у випадку нормального розподілу використовували критерій Стьюдента. Розраховували середні значення показників (М) та їх середні квадратичні відхилення (m). Різницю величин вважали вірогідною при значенні р < 0,05 [16].
Результати та обговорення
Домінуючими синдромами в клінічній картині ПН були: інтоксикаційний — у 66 (95,7 %) хворих, больовий — у 62 (89,9 %), дизуричний — у 58 (84,1 %) хворих. Сечовий синдром і бактеріурію при бактеріологічному дослідженні сечі було виявлено в усіх пацієнтів. При цьому серед найчастіших збудників хронічного ПН були Е.coli — 32 (46,4 %) випадки, Enterobacter faecalis — 22 (31,9 %), Staphylococus epidermidis — 14 (20,3 %), Staphylococus saprophyticus — 6 (8,7 %), Streptococus haemoliticus — 3 (4,3 %), Staphylococus aureus — 3 (4,3 %), Klebsiella pneumonia — 2 (2,9 %), Proteus mirabilis — 2 (2,9 %). У 21,7 % випадків було висіяно асоціацію мікроорганізмів, найчастіше E.coli та Enterobacter. Умовно-патогенні мікроорганізми в патологічному титрі (105) було виявлено в 17,7 % обстежених.
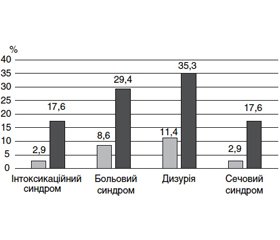
Вивчення динаміки клінічних проявів рецидиву ПН під впливом лікування, проведеного за різними схемами, показало, що при лікуванні за традиційним алгоритмом (лише антибіотиком) клінічні параметри інтоксикації зменшились порівняно з вихідним рівнем, проте не повернулись до норми. При такій схемі лікування утримувались больовий синдром, лейкоцитурія, дизуричний та інтоксикаційний синдроми в значної кількості пацієнтів (29,4; 17,6; 35,9 і 14,7 % відповідно) (табл. 1, рис. 1).
/38-1.jpg)
Значно кращі результати динаміки симптомів ПН продемонструвала схема лікування з додаванням Канефрону Н. Так, больовий синдром утримувався лише в 3 (8,6 %) осіб, дизуричний — у 4 (11,4 %), помірні симптоми інтоксикаційного синдрому — в 1 (2,9 %) хворого (р < 0,05 порівняно з групою стандартної терапії в усіх випадках). Лейкоцитурія за даними загального аналізу сечі мала місце в 1 (2,9 %) особи, за даними кількісного вивчення сечі не була відмічена в жодного хворого (рис. 2). Отже, додавання Канефрону Н чинило виражений сприятливий вплив на показники активності хронічного ПН: за умови його призначення спостерігалась більш швидка і більш виражена позитивна динаміка аналізів сечі (зменшення лейкоцитурії, бактеріурії), зменшення больового синдрому й дизурії, покращення загального стану й зменшення проявів інтоксикації.
Отже, комбіноване лікування із застосуванням Канефрону Н сприяло збільшенню частоти ерадикації бактеріального збудника порівняно з лише антибіотикотерапією (94,3 % проти 76,5 %, р < 0,05).
Дослідження печінкових трансаміназ до і після лікування підтвердило наше припущення щодо безпеки й відсутності гепатотоксичних ефектів обох використаних терапевтичних схем терапії. Функціональні печінкові показники в групі хворих, яких лікували із застосуванням Канефрону Н, і в групі стандартного лікування утримувалися в межах нормативних значень і не відрізнялися між собою: АлАТ після лікування в обох групах становила 0,342 ± 0,08 мкмоль/год × мл проти 0,37 ± 0,02 мкмоль/год × мл відповідно, р > 0,05; АсАТ — 0,306 ± 0,020 мкмоль/год × мл проти 0,309 ± 0,040 мкмоль/год × мл, р > 0,05; ЛФ — 1,038 ± 0,030 ум.од. проти 1,147 ± 0,070 ум.од., р > 0,05.
Вивчення ШКФ у групах хворих до і через 24 тижні після лікування підтвердило припущення щодо безпеки терапії: було продемонстровано, що дані показники вірогідно не змінювалися в обох групах хворих у процесі лікування, а також не відрізнялися між собою в групах хворих з різними схемами після лікування (антибіотикотерапія і антибіотик + Канефрон Н) (табл. 2).
Отримані дані дозволяють зробити висновок, що довготривале застосування Канефрону Н з метою протирецидивної терапії в жінок, хворих на ПН, із незначно й помірно зниженою функцією нирок є безпечним і не чинить несприятливого впливу на ШКФ.
Аналізуючи результати, отримані після лікування, щодо змін лабораторних маркерів інтоксикації, бачимо, що ендотоксемія в обох групах знизилась порівняно з вихідним рівнем, а виділення середньомолекулярних пептидів зі сечею вірогідно збільшилось після проведеного терапевтичного курсу (табл. 3).
/39-1.jpg)
При цьому більш виражене зменшення показників інтоксикації показала схема лікування, що включала комбінацію з Канефроном Н. У цьому випадку показники ендотоксемії значно знизились порівняно з вихідним рівнем інтоксикації й порівняно з даними пацієнтів, які отримували стандартну терапію (р < 0,01). У цій групі відмічено більш виражене наближення показників ендотоксемії до контрольних і посилення виведення СМП зі сечею: рівень СМПер254нм знизився з 533,7 ± 18,3 ум.од. до 382,0 ± 15,5 ум.од., р < 0,01; СМПер280нм — з 232,5 ± 7,2 ум.од. до 180,4 ± 6,7 ум.од., р < 0,01; ЕІЕІ — з 57,1 ± 2,3 % до 39,7 ± 2,0 %, р < 0,01; рівень СМПсечі254нм зріс з 185,4 ± 9,9 ум.од. до 349,7 ± 14,6 ум.од., р < 0,01, СМПсечі280нм — з 215,2 ± 3,4 ум.од. до 392,1 ± 10,5 ум.од., р < 0,01.
Аналіз показників ПОЛ-АОСЗ показав, що рецидив ПН супроводжується надмірною активацією процесів вільнорадикального окиснення, що проявлялося вірогідним збільшенням вмісту МДА і виснаженням показників АОСЗ: істотним зниженням активності СОД і каталази та рівня SH-груп. Аналіз результатів динаміки показників мембранодеструкції й антиоксидантного захисту після проведеного лікування демонструє зниження активності процесів ПОЛ порівняно з вихідним рівнем в обох лікувальних групах. Проте найбільш виражена динаміка простежується в групі хворих, яким до лікування додавали Канефрон Н. Так, у групі комбінованого лікування рівень МДА знизився з 5,90 ± 0,07 мкмоль/л до 2,48 ± 0,16 мкмоль/л (р < 0,01) і максимально наблизився до норми порівняно з традиційною схемою, при застосуванні якої мала місце позитивна, але менш помітна динаміка даного показника (5,72 ± 0,27 мкмоль/л і 4,83 ± 0,2 мкмоль/л, р < 0,05) і зберігалася вірогідна різниця з контролем (табл. 4, рис. 3).
/40-2.jpg)
/40-1.jpg)
Відмічені вірогідні позитивні зрушення показників активності АОСЗ у групах із різними лікувальними схемами. Активність СОД, каталази й рівень SH-груп вірогідно зростали в результаті лікування із застосуванням Канефрону Н (СОД — з 39,7 ± 0,9 ум.од.
до 59,5 ± 1,7 ум.од., каталаза — з 22,3 ± 1,5 % до 32,6 ± 1,9 %, SH-групи — з 54,2 ± 0,8 ммоль/л до 67,4 ± 2,1 ммоль/л відповідно, р < 0,01) порівняно з лікуванням за звичайною схемою (СОД — з 38,8 ± 1,7 ум.од. до 48,1 ± 1,2 ум.од., р < 0,01, каталаза — з 23,1 ± 2,1 % до 26,4 ± 2,3 %, p1 > 0,05; SH-групи — з 54,0 ± 1,9 ммоль/л до 58,5 ± 2,6 ммоль/л, р > 0,05). Результати показників АОСЗ, отримані після лікування, у групах комбінованої терапії вірогідно (р < 0,01) відрізнялись від даних групи традиційного лікування.
Отримані результати свідчать про мембраностабілізуючий і антиоксидантний ефект препарату Канефрон Н.
Стан загального імунітету у хворих із рецидивом ПН характеризувався зниженням абсолютної кількості Т-лімфоцитів (CD3+ — 40,5 ± 0,5 % проти 65,2 ± 4,8 % у здорових, р < 0,01), головним чином за рахунок Т-хелперів (CD4+ — 27,0 ± 0,5 % проти 38,8 ± 3,2 % у контролі, р < 0,01) і підвищенням рівня В-лімфоцитів (CD72+ — 10,9 ± 0,5 % проти 10,1 ± 0,4 % у здорових, р > 0,05) і циркулюючих імунних комплексів, що свідчило про наявність хелперного варіанту імунодефіцитного стану на тлі активації гуморальної ланки.
Аналізуючи зміни імунних показників у процесі лікування, проведеного за різними схемами, знаходимо, що відбулась вірогідна активація клітинної ланки імунітету в усіх лікувальних групах порівняно з вихідним рівнем. Показники вмісту клітин з маркерами CD3+, CD4+ та CD8+ зростали більш істотно (р < 0,01) у групі пацієнтів, яким до лікування додавали Канефрон Н. Так, вміст CD3+ зріс з 40,1 ± 0,6 % до 57,7±1,1 %, CD4+ — з 26,3 ± 0,3 % до 38,0 ± 0,6 %, CD8+ — з 13,7 ± 0,2 % до 19,8 ± 0,6 % (р < 0,01 для всіх показників). У даній групі показники були вірогідно кращі, ніж у групі стандартного лікування (CD3+ — з 40,9 ± 0,8 % до 47,2 ± 0,9 %, CD4+ — з 27,1 ± 0,5 % до 31,5 ± 0,7 %, р < 0,01, і CD8+ — з 15,0 ± 0,4 % до 15,8 ± 0,4 %, р > 0,05) (табл. 5).
Отже, динаміка клітинної ланки імунітету демонструє перевагу комплексного лікування із включенням Канефрону Н над стандартною антибактеріальною терапією.
Відносний вміст NK-клітин (CD16+) після проведеного лікування досягав показників здорових осіб в обох групах, проте більш істотну динаміку спостерігали в групі з додаванням Канефрону Н: рівень CD16+ зріс з 9,7 ± 0,2 % до 13,5 ± 0,2 %, р < 0,01, на той час як у групі стандартного лікування — з 8,9 ± 0,3 % до 10,5 ± 0,3 %, р < 0,01.
Протягом лікування було відмічено вірогідне зниження активності гуморальної ланки імунітету в обох досліджуваних групах. Рівень ЦІК більш істотно знижувався в групі комбінованого лікування (з 226,3 ± 12,9 ум.од. до 89,7 ± 7,3 ум.од. відповідно, р < 0,01) порівняно з групою стандартної терапії (з 220,8 ± 7,6 ум.од. до 141,5 ± 10,5 ум.од., р < 0,01) і максимально наблизився до норми.
Відносний вміст В-лімфоцитів також знижувався після лікування й вірогідно не відрізнявся від норми в групі комбінованого (з 10,2 ± 0,4 % до 9,1 ± 0,3 %, р < 0,05) і стандартного лікування (з 10,6 ± 0,2 % до 9,5 ± 0,2 %, р < 0,01). Концентрація Ig А, М, G знижувалась після лікування сильніше (р < 0,05) в групі комбінованого лікування (з 2,51 ± 0,15 г/л до 1,70 ± 0,05 г/л; з 2,64 ± 0,07 г/л до 1,74 ± 0,09 г/л і з 12,90 ± 0,42 г/л до 10,06 ± 0,24 г/л відповідно, р < 0,01) порівняно з групою терапії антибактеріальними препаратами (з 2,69 ± 0,08 г/л до 2,15 ± 0,10 г/л; з 2,52 ± 0,09 г/л до 2,08 ± 0,09 г/л і з 13,32 ± 0,25 г/л до 11,29 ± 0,27 г/л відповідно, р < 0,01). Відмічалось наближення концентрацій імуноглобулінів до показників групи здорових осіб, причому Ig A та Ig G значуще перевищували норму лише в групі стандартної терапії, а Ig M не досягав норми в усіх групах.
Вивчення показників прозапального цитокіну фактора некрозу пухлини альфа (ФНП-α) і протизапального цитокіну інтерлейкіну-10 (ІЛ-10) показало вірогідне збільшення рівня ФНП-α у 3,5 раза порівняно з групою здорових осіб (р < 0,01), а також рівня протизапального цитокіну ІЛ-10, який був підвищеним у понад 7 разів порівняно з конт–ролем (р < 0,01). Це розцінювалося як компенсаторна відповідь на збільшення рівня прозапальних цитокінів. У процесі лікування в обох групах мала місце позитивна динаміка рівнів цитокінів, проте більш вираженою вона була в групі комбінованого лікування з включенням Канефрону Н. Так, рівень ФНП-α у цій групі хворих вірогідно знижувався після лікування й практично досягав нормативних значень (р > 0,05). Також мало місце вірогідне зниження рівня ІЛ-10 (р < 0,01). У групі традиційної терапії мала місце вірогідна позитивна динаміка рівнів цитокінів під впливом лікування, проте вона була менш вираженою, ніж у групі комбінованої терапії (р < 0,01), а також зберігалася статистично вірогідна відмінність даних показників із контролем (р < 0,05).
Важливі результати були отримані при порівнянні результатів застосування Канефрону Н з лише антибактеріальним лікуванням відносно рецидивів ПН. Було відмічено, що включення Канефрону Н до схеми лікування сприяло зменшенню рецидивування протягом року спостереження (р < 0,05). Так, лише в 1 (2,9 %) хворого в групі Канефрону Н протягом 12 місяців мав місце рецидив хвороби, на той час як у групі традиційної терапії в 11 (32,4 %) пацієнтів повторно реєструвався рецидив ПН (р < 0,01) (рис. 4).
Висновки
1. Комбіноване лікування антибактеріальними препаратами і Канефроном Н більш ефективно зменшує клінічну симптоматику пієлонефриту у хворих із незначно й помірно зниженою функцією нирок порівняно з монотерапією антибактеріальними препаратами.
2. Включення Канефрону Н до схеми лікування з антибіотиком сприяє більш значущому зниженню рецидивування інфекції сечових шляхів як фактора прогресування ураження нирок у хворих із незначно й помірно зниженою функцією нирок.
3. Комбінована терапія з використанням Канефрону Н не впливає на ШКФ і функціональний стан печінки у хворих із незначно й помірно зниженою функцією нирок і може безпечно й успішно використовуватися в лікуванні даної категорії хворих.
4. Комбіноване лікування антибактеріальними препаратами і Канефроном Н більш ефективно знижує інтенсивність процесів перекисного окиснення ліпідів і нормалізує систему антиоксидантного захисту порівняно з монотерапією антибактеріальними препаратами.
5. Включення Канефрону Н до схеми лікування з антибіотиком сприяє більш вираженому позитивному впливу на показники імунного статусу у хворих із незначно й помірно зниженою функцією нирок порівняно із монотерапією антибактеріальними препаратами.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Guidelines on Urological Infection / M. Grabe, Т.Е. Bjerklund-Johansen, H. Botto [et al.] // European Association of Uro–logy, 2014. — www.uroweb.org.
2. Wagenlehner F.M. An update on uncomplicated urinary tract infections in women / F.M. Wagenlehner, M.E. Florian, W. Weidner, K.G. Naber // Current Opinion in Urology. — 2009. — Vol. 19, Issue 4. — P. 368-374.
3. Wagenlehner F.M., Naber K.G. Treatment of bacterial urinary tractinfections: presence and future // Eur. Urol. — 2006. — Vol. 2. — P. 235-244.
4. Аляев Ю.Г. Роль определения функционального состояния нижних мочевыводящих путей в выборе лечебной тактики у пациентов с хроническим циститом и хроническим необструктивным пиелонефритом / Ю.Г. Аляев, П.В. Глыбочко, З.К. Гаджиева // Урология. — 2011. — № 6. — С. 4-8.
5. Foxman B. Epidemiology of urinary tract infection: incidence, morbidity, and economic costs / B. Foxman // Am. J. Med. — 2002. — Vol. 13. — P. 113.
6. Scholes D. Risk factors for recurrent urinary tract infection in young women / D. Scholes, T.M. Hooton, P.L. Roberts, A.E. Stapleton [et al.] // J. Infeet. Dis. — 2000. — Vol. 182(4). — P. 1177-82.
7. Gilbart J. Recurrent Uncomplicated Urinary Tract Infections — The place of Immuno-Prophylaxis. Summary of presentations given by Professors Kurt Naber, Claude Schulman and Si lvano Sozzani at a satellite symposium at the European Associaion of Urology / Gilbart J. — Vienna, 20th March 2011. — www.touchbriefings.com
8. Horvath D.J. New paradigms of urinary tract infections: Implications for patient management / Dennis J. Horvath, Shareef M. Dabdoub, Birong Li, Brian A. VanderBrink and Sheryl S. Justice // Indian J. Urol. — 2012. — 28(2). — P. 154-158.
9. Gould I.M. Antibiotic resistance: the perfect storm / I.M. Gould // Int. J. Antimicrob. Agents. — 2009. — Vol. 34, Suppl. 3. — P. 52-55.
10. Колесник М.О. Рецидивуюча інфекція сечової системи у жінок: етіологічна структура та сучасна концепція патогенезу (огляд власних досліджень) / М.О. Колесник, Н.М. Степанова, В.Є. Дріянська, А.В. Руденко // Журнал НАМНУ. — 2013. — № 2. — С. 194-204.
11. Колесник Н.А. Концептуальная модель рецидивирующих инфекций мочевой системы / Н.А. Колесник, Г.Н. Дранник, В.Э. Дриянская, А.В. Руденко [и др.] // Укр. журнал нефрол. та діалізу. — 2011. — № 2. — С. 5-17.
12. Синякова Л.А. Рецидивирующие инфекции нижних мочевых путей: сложности упрощенной диагностики / Л.А. Синякова // Урология сегодня. — 2013. — № 1. — С. 18-22.
13. Kunin C.M. Urinary Tract infections: detection, prevention and management / C.M. Kunin. — Philadelphia; Williams&Wilkins, 1997. — 22 р.
14. Колесник М.О. Етіозалежні особливості стану імунітету у хворих на хронічний пієлонефрит / М.О. Колесник, В.Є. Дріянськая, Г.М. Драннік, А.В. Руденко [та ін.] // Укр. журнал нефрол. та діалізу. — 2010. — № 1. —
С. 3-15.
15. Колесник М.О. Етіологічний спектр інфекцій сечової системи / М. Колесник, Н. Степанова, А. Руденко, В. Кругліков // Український журнал нефрології та діалізу. — 2007. — № 3(15). — С. 16-29.
16. Колесник М.О. Патогенез пієлонефриту: що ми знаємо і що ні / М.О. Колесник, Н.М. Степанова, В.Є. Дріянська, А.В. Руденко [та ін.] // Укр. журнал нефрол. та діалізу. — 2011. — № 3. — С. 34-46.
17. Дудар І.О., Лобода О.М., Крот В.Ф. та ін. 12-місячне порівняльне дослідження застосування препарату Канефрон Н у лікуванні хворих із інфекцією сечової системи // Здоровье мужчины. — 2009. — № 3(30). — С. 85-90.
18. Биргер М.О. Справочник по микробиологическим и вирусологическим методам исследования. — М.: Медицина, 1982. — 523 с.
19. Стальная И.Д. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты / И.Д. Стальная, Т.Г. Гаришвили // Современные методы в биохимии. — М.: Медицина, 1977. — С. 66-67.
20. Арутюнян А.В., Дубинина Е.Е. Зыбина Н.Н. Методы оценки свободнорадикального окисления и антиоксидантной системы организма: Метод. рекомендации / Под ред. В.Х. Хавинсона. — СПб.: ИКФ «Фолиант», 2000. —
104 с.
21. Королюк М.А., Иванова Л.И., Майорова И.Г., Токарева В.Е. Метод определения активности каталазы // Лаб. дело. — 1988. — № 1. — С. 16-19.
22. Chelikani P., Fita I., Loewen P.C. Diversity of structures and properties among catalases // Cell. Mol. Life Sci. — 2004. — 61(2). — С. 192-208. PMID 14745498. doi:10.1007/s00018-003-3206-5.
23. Габриэлян Н.И. Скрининговый метод определения средних молекул в биологических жидкостях: методич. рекомендации / Н.И. Габриэлян. — М., 1985. — С. 47-54.
24. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA / О.Ю. Реброва. — М.: Медиасфера, 2003. — 312 с.
25. Скляр Т.В. Состав микрофлоры и чувствительность к антибиотикам бактерий урогенитального тракта женщин / Т.В. Скляр, А.В. Крысенко, Е.А. Сирокваша, А.И. Винников // Мікробіол. журн. — 2007. — Т. 69, № 3. — С. 50-57.
26. Kodner C.M. Recurrent Urinary Tract Infections in Wo–men: Diagnosis and Management / Charles M. Kodner, Emily K. Thomas Gupton // Am. Fam. Physician. — 2010. — Vol. 15. — № 82(6). — Р. 638-643.
27. Daniele Minardi. Urinary tract infections in women: etio–logy and treatment options / Daniele Minardi, Gianluca d’Anzeo, Daniele Cantoro et al. // Int. J. Gen. Med. — 2011. — Vol. 4. — P. 333-343.
28. Smyth M. Urinary tract infections: role of the clinical microbiology laboratory / M. Smyth, J. E. Moore, C. E. Goldsmith // Urol. Nurs. — 2006. — Vol. 26. — P. 198-203.
/41-2.jpg)

/38-1.jpg)
/39-1.jpg)
/40-2.jpg)
/40-1.jpg)
/41-1.jpg)