Резюме
Актуальність. Прееклампсія є частим ускладненням вагітності. Дані літератури та результати власних досліджень свідчать про виникнення морфофункціональних змін у нирках, сечоводах і сечовому міхурі плодів і новонароджених, які розвивалися в умовах материнської прееклампсії, зокрема відзначено розвиток у даних органах склеротичних процесів, морфогенез яких на сьогодні залишається невідомим. Мета дослідження: пошук ознак епітеліально-мезенхімальної трансформації в нирках, сечоводах і сечовому міхурі плодів і новонароджених, які розвивалися в умовах материнської прееклампсії, і оцінка її ролі в розвитку склеротичних змін в даних органах. Матеріали та методи. Матеріалом дослідження була тканина нирок, сечоводів і сечового міхура доношених плодів і новонароджених. Весь матеріал був розділений на наступні групи: I — плоди та новонароджені від матерів із фізіологічною вагітністю; II — плоди та новонароджені від матерів, вагітність яких ускладнилася прееклампсією легкого ступеня тяжкості; III — плоди та новонароджені від матерів, вагітність яких ускладнилася прееклампсією середнього ступеня тяжкості; IV — плоди та новонароджені від матерів, вагітність яких ускладнилася тяжкою прееклампсією. Проводилося імуногістохімічне дослідження з моноклональними антитілами до віментину, гладеньком’язового актину, десміну, цитокератинів 18 та 19. Результати. Комплексний аналіз проведених імуногістохімічних реакцій з моноклональними антитілами до віментину, гладеньком’язового актину, десміну, цитокератинів 18 та 19 дозволив виявити в нирках, сечоводах і сечовому міхурі доношених плодів і новонароджених, які розвивалися в умовах материнської прееклампсії різного ступеня тяжкості, ознаки епітеліально-мезенхімальної трансформації, які наростали зі збільшенням віку дітей, ступеня тяжкості прееклампсії у матері та характеризувалися підвищенням експресії віментину, гладеньком’язового актину, десміну і зниженням експресії цитокератинів 18 та 19. Висновки. У нирках, сечоводах і сечовому міхурі плодів і новонароджених від матерів, вагітність яких ускладнилася прееклампсією різного ступеня тяжкості, розвиток склеротичних змін обумовлений процесом епітеліально-мезенхімальної трансформації, який становиться більш вираженим від плода до новонародженого і зі збільшенням ступеня тяжкості материнської прееклампсії. У патогенезі епітеліально-мезенхімальної трансформації в нирках, сечоводах і сечовому міхурі плодів і новонароджених, які розвивалися в умовах материнської прееклампсії, імовірна роль хронічної внутрішньоутробної гіпоксії та активізації макрофагальної системи в даних органах.
Актуальность. Преэклампсия является частым осложнением беременности. Данные литературы и результаты собственных исследований свидетельствуют о возникновении морфофункциональных изменений в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии, в частности отмечено развитие в данных органах склеротических процессов, морфогенез которых на сегодняшний день остается неизвестным. Цель исследования: поиск признаков эпителиально-мезенхимальной трансформации в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии, и оценка ее роли в развитии склеротических изменений в данных органах. Материалы и методы. Материалом исследования послужила ткань почек, мочеточников и мочевого пузыря доношенных плодов и новорожденных. Весь материал был разделен на следующие группы: I — плоды и новорожденные от матерей с физиологической беременностью; II — плоды и новорожденные от матерей, беременность которых осложнилась преэклампсией легкой степени тяжести; III — плоды и новорожденные от матерей, беременность которых осложнилась преэклампсией средней степени тяжести; IV — плоды и новорожденные от матерей, беременность которых осложнилась тяжелой преэклампсией. Проводилось иммуногистохимическое исследование с моноклональными антителами к виментину, гладкомышечному актину, десмину, цитокератинам 18 и 19. Результаты. Комплексный анализ проведенных иммуногистохимических реакций с моноклональными антителами к виментину, гладкомышечному актину, десмину, цитокератинам 18 и 19 позволил выявить в почках, мочеточниках и мочевом пузыре доношенных плодов и новорожденных, развивавшихся в условиях материнской преэклампсии различной степени тяжести, признаки эпителиально-мезенхимальной трансформации, которые нарастали с увеличением возраста детей, утяжелением преэклампсии у матери и характеризовались повышением экспрессии виментина, гладкомышечного актина, десмина и снижением экспрессии цитокератинов 18 и 19. Выводы. В почках, мочеточниках и мочевом пузыре плодов и новорожденных от матерей, беременность которых осложнилась преэклампсией различной степени тяжести, развитие склеротических изменений обусловлено процессом эпителиально-мезенхимальной трансформации, который становится более выраженным от плода к новорожденному и с утяжелением материнской преэклампсии. В патогенезе эпителиально-мезенхимальной трансформации в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии, вероятна роль хронической внутриутробной гипоксии и активизации макрофагальной системы в данных органах.
Background. Preeclampsia is a frequent complication of pregnancy. The literature data and the results of our own studies indicate the development of morphofunctional changes in the kidneys, ureters and bladder of fetuses and newborns that developed under maternal preeclampsia, in particular, sclerotic processes in these organs, morphogenesis of which is currently unknown. The purpose of the study was to search for the signs of epithelial-mesenchymal transition in the kidneys, ureters and bladder of fetuses and newborns, which developed under the conditions of maternal preeclampsia, and to evaluate its role in the development of sclerotic changes in these organs. Materials and methods. Study materials were the tissues of the kidneys, ureters and bladder of full-term fetuses and newborns. All materials were divided into the following groups: I — fetuses and newborns from mothers with physiological pregnancy; II — fetuses and newborns from mothers, whose pregnancy was complicated by mild preeclampsia; III — fetuses and newborns from mothers, whose pregnancy was complicated by moderate preeclampsia; IV — fetuses and newborns from mothers, whose pregnancy was complicated by severe preeclampsia. An immunohistochemical study was performed with monoclonal antibodies to vimentin, smooth muscle actin, desmin, cytokeratins 18 and 19. Results. A comprehensive analysis of the immunohistochemical reactions with monoclonal antibodies to vimentin, smooth muscle actin, desmin, cytokeratins 18 and 19 allowed to reveal in the kidneys, ureters and bladder of fetuses and newborns developed under the conditions of maternal preeclampsia of varying severity the signs of epithelial-mesenchymal transition, which increased with the increasing age of the child, aggravation of maternal preeclampsia. Epithelial-mesenchymal transition was characterized by increased expression of vimentin, smooth muscle actin, desmin and decreased expression of cytokeratins 18 and 19. Conclusions. In the kidneys, ureters and bladder of fetuses and newborns from mothers, whose pregnancy was complicated by preeclampsia of varying severity, the sclerotic changes are caused by the process of epithelial-mesenchymal transition, which becomes more significant from fetus to newborn and with the increasing severity of maternal preeclampsia. Chronic intrauterine hypoxia and activation of the macrophage system in these organs may influence the pathogenesis of epithelial-mesenchymal transition in the kidneys, ureters and bladder of fetuses and newborns developing under maternal preeclampsia.
Введение
Преэклампсия занимает особое место среди актуальных вопросов современной медицины и определяется как специфическое для второй половины беременности осложнение, которое диагностируется при возникновении de novo артериальной гипертензии (артериальное давление (АД) > 140/90 мм рт.ст.) и протеинурии (свыше 0,3 г/сут) после 20 недель беременности [1].
В настоящее время преэклампсия рассматривается как мультифакторное осложнение беременности в связи с существованием более 40 теорий, объясняющих механизм развития данного состояния [2, 3].
В мире в структуре материнской заболеваемости и смертности на протяжении последних десяти лет преэклампсия занимает третье место после кровотечений и сепсиса [4–6]. Частота преэклампсии, по данным различных ученых, составляет от 7 до 23 % и не имеет тенденции к снижению [2]. Каждый год в мире, согласно данным Всемирной организации здравоохранения, около 70 000 случаев материнской заболеваемости и смертности обу–словлены преэклампсией [7]. В последнее время наблюдается увеличение доли малосимптомных и атипических форм течения данного осложнения беременности [2].
Преэклампсия не только увеличивает риск неблагоприятного исхода беременности для матери, но и ведет к нарушению роста и развития плода, рождению недоношенных детей, формированию перинатальных поражений гипоксического характера различных систем ребенка, негативно влияет на состояние здоровья детей в последующие годы жизни [8]. До 18 % случаев антенатальной гибели плода обусловлено гипертензивными осложнениями беременности. Риск смерти новорожденного почти в 5 раз выше у женщин с преэклампсией, а если учитывать вместе с отслойкой плаценты, то он возрастает в 45 раз [9].
Несмотря на внедрение в акушерство и перинатологию высокотехнологичных методов исследования, средств профилактики и лечения пре–эклампсии, проблемы в этой области по-прежнему далеки от разрешения [8].
При развитии преэклампсии у беременной женщины почки являются одним из основных органов-мишеней, которые повреждаются в той или иной степени в 100 % случаев, поскольку через них фильтруется большое количество крови, что было показано в ходе значительного количества исследований, проведенных отечественными [6, 10] и зарубежными учеными [11, 12]. Некоторые ученые отмечают, что у женщин, которые перенесли преэклампсию, в дальнейшем формируются беременность-ассоциированные заболевания, среди которых на первом месте находится патология почек [9]. В литературе отсутствуют данные о морфофункциональных особенностях мочеточников и мочевого пузыря у женщин, беременность которых осложнилась преэклампсией.
Давно известен факт о высокой вероятности повреждения одноименных органов матери и ее потомства. Данные литературы [13, 14] и результаты собственных исследований [15] свидетельствуют о возникновении морфофункциональных изменений в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии, в частности отмечено развитие в данных органах склеротических процессов, морфогенез которых на сегодняшний день остается неизвестным.
Ряд исследований доказывают роль эпителиально-мезенхимальной трансформации в развитии склероза во многих органах у взрослого человека, в том числе и в органах мочевыделительной системы, в условиях патологии [16, 17].
С учетом вышеизложенного целью настоящего исследования явился поиск признаков эпителиально-мезенхимальной трансформации в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии, и оценка ее роли в развитии склеротических изменений в вышеуказанных органах.
Материалы и методы
Материалом исследования послужила ткань почек, мочеточников и мочевого пузыря доношенных плодов и новорожденных от матерей с физиологической беременностью, а также от матерей, беременность которых осложнилась преэклампсией различной степени тяжести. Набор материала проводился во время вскрытий на базе Коммунального учреждения здравоохранения «Харьковский городской перинатальный центр».
В данном исследовании были сформированы следующие группы: I (группа сравнения) — плоды (n = 13) и новорожденные (n = 15) от матерей с физиологической беременностью; исследуемая группа II — плоды (n = 12) и новорожденные (n = 13) от матерей, беременность которых осложнилась преэклампсией легкой степени тяжести; исследуемая группа III — плоды (n = 13) и новорожденные (n = 14) от матерей, беременность которых осложнилась преэклампсией средней степени тяжести; исследуемая группа IV — плоды (n = 13) и новорожденные (n = 13) от матерей, беременность которых осложнилась тяжелой преэклампсией.
Иммуногистохимическое исследование проводилось в соответствии со стандартизированными протоколами с использованием моноклональных антител (МКА) к виментину (клон V9) (маркер мезенхимальных клеток), гладкомышечному актину (ГМА) (клон 1A4) и десмину (клон D33) (маркеры гладкомышечной ткани), цитокератинам 18 (клон CY-90) и 19 (клон A53-B/A2.26) (маркеры эпителиальных клеток). МКА к ГМА производства «DAKO» (Дания). МКА к виментину, десмину, цитокератинам 18 и 19, система детекции UltraVision Quanto HRP, хромоген ДАБ Quanto производства Thermo Fisher Scientific (США).
Изготовленные микропрепараты изучали на микроскопе Olympus ВХ-41 (Япония). Использовали полуколичественную шкалу для оценки степени выраженности иммуногистохимической реакции: «−» — отрицательная, «+» — слабая, «++» — умеренная, «+++» — выраженная.
Результаты и обсуждение
В группе I при оценке иммуногистохимической реакции с МКА к виментину были выявлены виментин-положительные клетки (коричневый цвет окраски) в почках, мочеточниках и мочевом пузыре плодов и новорожденных.
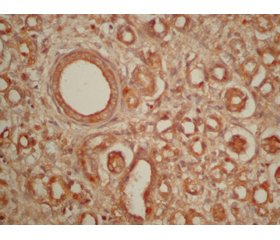
В почках плодов и новорожденных виментин-положительные клетки определялись в капсуле органа, где они располагались равномерно, в нефрогенной зоне и строме органа (рис. 1). В строме почек клетки фибробластического ряда, экспрессирующие виментин, характеризовались местами диффузным расположением, а местами определялось очаговое их скопление. Очаговые скопления виментин-положительных клеток отмечались преимущественно в строме мозгового слоя почек плодов и новорожденных. Кроме того, виментин экспрессировали эндотелиальные клетки сосудов стромы почек (рис. 1).
Виментин-положительные клетки также определялись в гломерулярном аппарате нефрона почек плодов и новорожденных (рис. 1). Так, виментин экспрессировали эпителиальные клетки внутреннего листка капсулы клубочков, некоторые мезангиальные клетки, эндотелиальные клетки капилляров клубочков. Интересно то, что в зрелых почечных тельцах по сравнению с незрелыми было выявлено увеличение количества клеток, экспрессирующих виментин.
В почках в вышеуказанных локализациях было отмечено возрастное увеличение количества виментин-положительных клеток, поэтому иммуногистохимическая реакция у плодов была расценена как слабая («+»), а у новорожденных — как умеренная («++»).
В мочеточниках и мочевом пузыре плодов и новорожденных группы I виментин экспрессировали эндотелиальные клетки сосудов, а также клетки фибробластического ряда, которые локализовались в собственной пластинке слизистой оболочки, подслизистой основе, строме мышечной оболочки и адвентициальной оболочке. В мочеточниках и мочевом пузыре была выявлена возрастная особенность, характеризующаяся увеличением количества виментин-положительных клеток с возрастом, поэтому иммуногистохимическая реакция с данным МКА была расценена у новорожденных как умеренная («++») и слабая («+») — у плодов.
В почках, мочеточниках и мочевом пузыре плодов и новорожденных групп II–IV экспрессия виментина отмечалась в тех же структурах, что и в группе I, характеризовалась однотипными возрастными изменениями, однако иммуногистохимическая реакция в данных группах была более выраженной и степень ее выраженности нарастала с утяжелением материнской пре–эклампсии. По сравнению с группой I в группах II–IV иммуногистохимическая реакция у плодов была расценена как умеренная («++»), а у новорожденных — как выраженная («+++»). При сравнении групп II–IV между собой в группе II иммуногистохимическая реакция была расценена как слабая («+»), в группе III — как умеренная («++»), в группе IV — как выраженная («+++»). Также с утяжелением материнской преэклампсии появлялась и нарастала экспрессия виментина некоторыми эпителиальными клетками наружного листка капсулы клубочков, тубулярного отдела нефронов, а также немногочисленными эпителиальными клетками, входящими в состав эпителиального пласта слизистых оболочек мочеточников и мочевого пузыря.
При постановке иммуногистохимической реакции с ГМА была выявлена экспрессия данного МКА в почках, мочеточниках и мочевом пузыре плодов и новорожденных групп I–IV.
В группе I в почках ГМА равномерно экспрессировали миофибробласты, расположенные в капсуле и строме данного органа, гладкомышечные клетки сосудов стромы, мезангиальные клетки гладкомышечного типа. Миофибробласты, экспрессирующие ГМА, располагались местами диффузно, а местами образовывали скопления, которые преимущественно определялись в мозговом слое почек плодов и новорожденных. В корковом слое почек миофибробласты располагались преимущественно в нефрогенной зоне. В почках у плодов иммуногистохимическая реакция с ГМА была расценена как слабая («+»), а у новорожденных — как умеренная («++»), что было обусловлено возрастным увеличением количества гладкомышечных клеток сосудов стромы, мезангиальных клеток гладкомышечного типа, однако количество миофибробластов в строме уменьшалось.
В мочеточниках и мочевом пузыре плодов и новорожденных группы I ГМА равномерно экспрессировали миофибробласты, расположенные в собственной пластинке слизистой оболочки, подслизистой основе, гладкомышечные клетки сосудов и мышечного слоя. У новорожденных иммуногистохимическая реакция была оценена как умеренная («++»), а у плодов — как слабая («+»), что также было обусловлено возрастным увеличением количества гладкомышечных клеток сосудов и мышечного слоя на фоне уменьшения количества миофибробластов.
В группах II–IV были выявлены определенные особенности экспрессии ГМА в почках, мочеточниках и мочевом пузыре плодов и новорожденных. В почках ГМА экспрессировали в клубочке немногочисленные эпителиальные клетки наружного листка капсулы Боумена, мезангиальные клетки гладкомышечного типа, гладкомышечные клетки сосудов стромы, а также расположенные в строме органа миофибробласты (рис. 2). Миофибробласты располагались как диффузно, так и очагово, образовывая скопления клеток, причем очаговое расположение данных клеток было одинаково выраженным в корковом и мозговом слоях почек. В группе III и особенно в группе IV в тубулярном аппарате нефронов появлялись эпителиальные клетки, экспрессирующие ГМА. С возрастом количество клеток, экспрессирующих ГМА, увеличивалось. По сравнению с группой I в группах II–IV иммуногистохимическая реакция была расценена у плодов как умеренная («++»), а у новорожденных — как выраженная («+++»). При анализе степени выраженности иммуногистохимической реакции среди групп II–IV в группе II она была расценена как слабая («+»), в группе III — как умеренная («++»), в группе IV — как выраженная («+++»).
/47-1.jpg)
В мочеточниках и мочевом пузыре плодов и новорожденных ГМА экспрессировали некоторые эпителиальные клетки, входящие в состав эпителиального пласта слизистых оболочек, миофибробласты, расположенные в собственной пластинке слизистой оболочки, подслизистой основе, гладкомышечные клетки сосудов и мышечного слоя (рис. 3). С возрастом количество клеток, экспрессирующих ГМА, как и в почках, увеличивалось. Иммуногистохимическая реакция в данных органах в группах II–IV была более выраженной по сравнению с группой I, поэтому у новорожденных она была расценена как выраженная («+++»), а у плодов — как умеренная («++»). При сравнении выраженности данной реакции среди групп II–IV в группе II она была расценена как слабая («+»), в группе III — как умеренная («++»), в группе IV — как выраженная («+++»).
Интересно то, что в мышечном слое данных органов была выявлена гетерогенность экспрессии ГМА гладкомышечными клетками (рис. 4). Так, были выявлены гладкомышечные клетки, которые местами хорошо экспрессировали вышеуказанное МКА, а местами — умеренно либо слабо. Выявленная гетерогенность экспрессии ГМА в мышечном слое мочеточников и мочевого пузыря плодов и новорожденных обусловлена развитием в данном слое дистрофических, ишемических и некротических изменений, что было отмечено нами в ранее проведенных исследованиях [18, 19].
/47-2.jpg)
В почках (рис. 5), мочеточниках и мочевом пузыре плодов и новорожденных групп I–IV при анализе иммуногистохимической реакции с МКА к десмину было отмечено, что данное МКА, во-первых, экспрессируется в тех же структурах, что и ГМА; во-вторых, характеризуется схожими с ГМА изменениями степени выраженности иммуногистохимической реакции с возрастом, в группах II–IV по сравнению с группой I, а также с увеличением степени тяжести материнской преэклампсии; в-третьих, в группах II–IV начинает экспрессироваться в местах, где ГМА не определяется (в почках в эпителии канальцев и наружного листка капсулы клубочков, в мочеточниках и мочевом пузыре в эпителиальных клетках, входящих в состав эпителиального пласта слизистых оболочек).
Выявленная нами экспрессия десмина в почках, мочеточниках и мочевом пузыре плодов и новорожденных групп II–IV в местах, где ГМА не определяется, обусловлена тем, что десмин является эволюционно более ранним гладкомышечным маркером по сравнению с ГМА [16].
Известно, что эпителиальные клетки различных отделов канальцевой системы нефрона экспрессируют разные молекулярные формы цитокератина, поэтому в данном исследовании мы использовали цитокератин 18 и 19. Анализируя иммуногистохимические реакции с цитокератинами в почках, мочеточниках и мочевом пузыре плодов и новорожденных групп I–IV, было отмечено, что цитокератин 19 в почках экспрессируется эпителиальными клетками дистальных канальцев, петель Генле и собирательных трубочек (рис. 6), а в мочеточниках и мочевом пузыре — переходным эпителием слизистых оболочек. Цитокератин 18 экспрессируется в почках эпителиальными клетками проксимальных и дистальных канальцев, нисходящих и восходящих тонких канальцев, собирательных трубочек, а в мочеточниках и мочевом пузыре — переходным эпителием слизистых оболочек.
/48-1.jpg)
В группе I было выявлено возрастное увеличение степени выраженности иммуногистохимической реакции с цитокератином 18 и 19, поэтому у плодов она была расценена как умеренная («++»), а у новорожденных — как выраженная («+++»). В группах II–IV также было выявлено возрастное увеличение степени выраженности иммуногистохимической реакции с цитокератином 18 и 19, однако по сравнению с группой I данная реакция была менее выраженной, поэтому у новорожденных она была расценена как умеренная («++»), а у плодов — как слабая («+»). Анализируя степень выраженности данной реакции в группах II–IV, было отмечено местами умеренное, а местами — выраженное ее снижение с утяжелением материнской преэклампсии, поэтому в группе II она была расценена как выраженная («+++»), в группе III — как умеренная («++»), в группе IV — как слабая («+») (рис. 6). Интересно то, что в почках плодов и новорожденных групп II–IV снижение экспрессии цитокератинов 18 и 19 определялось не только в эпителии канальцев с дистрофическими и некротическими изменениями, но и в местах неповрежденного эпителия.
Комплексный анализ проведенных иммуногистохимических реакций с МКА к виментину, ГМА, десмину, цитокератинам 18 и 19 позволил выявить в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии различной степени тяжести, признаки эпителиально-мезенхимальной трансформации, под которой понимают процесс утраты клетками эпителиального фенотипа и приобретение мезенхимального фенотипа [20].
В настоящее время ключевыми эффекторными клетками в развитии склероза в любом органе признаны миофибробласты [21], продуцирующие ряд ключевых компонентов внеклеточного матрикса, к которым относятся коллагены I, III, V, VII типов. Доказана возможность продукции миофибробластами также компонентов базальной мембраны — коллагена IV типа и ламинина. Кроме того, данная линия клеток продуцирует широкий спектр сульфатированных протеогликанов матрикса и базальной мембраны (в частности, декорин, перлекан и нидоген), влияющих на пролиферативные и миграционные способности клеток соединительной ткани и эпителия. Важным продуктом секреции миофибробластов являются фибронектин и тенасцин С. Помимо компонентов внеклеточного матрикса, миофибробласты продуцируют также множество металлопротеиназ и их тканевых ингибиторов, играющих существенную роль в ремоделировании матрикса, регуляции миграционной активности клеток [19, 22].
В нашем исследовании в органах мочевыделительной системы плодов и новорожденных от матерей, беременность которых осложнилась преэклампсией различной степени тяжести, было отмечено увеличение количества миофибробластов с нарастанием материнской преэклампсии, что происходило как из резидентных фибробластов, так и в результате эпителиально-мезенхимальной трансформации.
В ходе проведенного исследования было установлено, что эпителиально-мезенхимальная трансформация в почках, мочеточниках и мочевом пузыре плодов и новорожденных становилась более выраженной с утяжелением материнской преэклампсии, и это в результате приводило к развитию и нарастанию склеротических изменений в вышеуказанных органах, что было отмечено в проведенных нами ранее исследованиях [15].
Основными инициирующими факторами, запускающими программу эпителиально-мезенхимальной трансформации, являются факторы роста и цитокины, кислородный стресс и активные формы кислорода, гипоксия, механический стресс, компоненты внеклеточного матрикса, в том числе образующиеся при его деградации продукты конечного гликозилирования, микробные патогены [20].
В проведенном исследовании индуцирующим фактором, запускающим процесс эпителиально-мезенхимальной трансформации в органах мочевыделительной системы плодов и новорожденных, с нашей точки зрения, является хроническая внутриутробная гипоксия, которая возникает в связи с развитием хронической плацентарной недостаточности у женщин, беременность которых осложняется преэклампсией [23]. Гипоксия, как известно, может вызывать эпителиально-мезенхимальную трансформацию посредством индукции Snail, но Snail не специфичен для гипоксии, и другие основные гены, задействованные в данном процессе, каждый отдельно, могут быть индуцированы гипоксией [24].
Трансформирующий фактор роста β (TGF-β) — наиболее сильный индуктор эпителиально-мезенхимальной трансформации. Источником TGF-β являются, как известно, преимущественно моноциты и макрофаги, содержащие его постоянно, но секретирующие только при активации [25]. Учитывая, что в проведенных нами ранее исследованиях было установлено, что преэклампсия легкой степени тяжести, средней степени тяжести, а также тяжелая преэклампсия приводят к чрезмерной активации макрофагальной системы, Т-клеточного и В-клеточного иммунитета в почках, мочеточниках и мочевом пузыре плодов и новорожденных, что проявляется увеличением абсолютного количества СD 3, СD 20, СD 68 клеток [26], возможно, в данных органах процесс развития эпителиально-мезенхимальной трансформации обусловлен не только за счет действия гипоксического фактора, но и активизации макрофагальной системы, в результате чего продуцируется TGF-β. В модели фиброза почек, воспроизводимой на мышах, было установлено, что TGF-β является мощным индуктором Snail, транскрипционного фактора, который, в свою очередь, запускает эпителиально-мезенхимальную трансформацию [27].
Выводы
1. В почках, мочеточниках и мочевом пузыре плодов и новорожденных от матерей, беременность которых осложнилась преэклампсией различной степени тяжести, развитие склеротических изменений обусловлено процессом эпителиально-мезенхимальной трансформации, который становится более выраженным от плода к новорожденному и с утяжелением материнской преэклампсии.
2. В патогенезе эпителиально-мезенхимальной трансформации в почках, мочеточниках и мочевом пузыре плодов и новорожденных, развивавшихся в условиях материнской преэклампсии, вероятна роль хронической внутриутробной гипоксии и активизации макрофагальной системы в данных органах.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Рецензенты: проф. Дядык Е.А., проф. Шерстюк С.А.
Список литературы
1. Веропотвелян П.Н. Современные подходы к диагностике преэклампсии / П.Н. Веропотвелян, Н.П. Веропотвелян, Е.П. Смородская // Здоровье женщины. — 2013. — № 8(84). — С. 79-84.
2. Цхай В.Б. Современные теории патогенеза пре–эклампсии. Проблема функциональных нарушений гепатобилиарной системы у беременных / В.Б. Цхай, Н.М. Яметова, М.Я. Домрачева // Акушерство, гинекология и репродукция. — 2017. — Т. 11, № 1. — С. 49-55.
3. Advances in the pathophysiology of pre-eclampsia and related podocyte injury / I.M. Craici, S.J. Wagner, T.L. Weissgerber et al. // Kidney International. — 2014. — № 86(2). —
P. 275-285.
4. Ghulmiyyah L. Maternal mortality from preeclampsia / L. Ghulmiyyah, B. Sibai // Seminars in Perinatology. — 2012. — № 36(1). — P. 56-59.
5. Global cause of maternal death: a WHO systematic analysis / L. Say, D. Chou, A. Gemmill et al. // The Lancet Global Health. — 2014. — Vol. 2, № 6. — P. 323-333.
6. Веропотвелян П.Н. Современный взгляд практического врача на патогенез поражения почек при преэклампсии / П.Н. Веропотвелян, И.С. Цехмистренко, Н.П. Веропотвелян // Здоровье женщины. — 2016. — № 5(111). —
С. 67-72.
7. Potential risk factor of pre-eclampsia among healthy Chinese women: a retrospective case control study / Y. Yi, Y. Jing, Z. Gang et al. // Biomedical Research (India). — 2017. — Vol. 28, Issue 3. — P. 1183-1188.
8. Перфилова В.Н. Последствия гестоза (преэклампсии) / В.Н. Перфилова, Л.И. Михайлова, И.Н. Тюренков // Российский вестник перинатологии и педиатрии. — 2014. — № 2. — С. 13-18.
9. Коньков Д.Г. Прееклампсія та еклампсія: у фокусі — інфузійна терапія / Д.Г. Коньков, Н.В. Титаренко, І.Л. Кукуруза // Здоров’я України. — 2016. — Березень (тематичний номер). — С. 46-47.
10. Патоморфологические особенности изменений в поч–ках при тяжелой преэклампсии / И.С. Сидорова, А.П. Милованов, Н.А. Никитина и др. / Российский вестник акушера-гинеколога. — 2014. — № 1. — С. 4-9.
11. Stillman I.E. The glomerular injury of preeclampsia / I.E. Stillman, S.A. Karumanchi // Journal of the American Society of Nephrology. — 2007. — № 18. — P. 2281-2284.
12. Munkhaugen J. New aspects of pre-eclampsia: lessons for the nephrologist / J. Munkhaugen, B.E. Vikse // Nephrology Dialysis Transplantation. — 2009. — № 24. — P. 2964-2967.
13. Функциональная морфология почек недоношенных новорожденных, родившихся у матерей с преэклампсией / Н.Ф. Панахова, С.Ш. Гасанов, А.А. Ахундова и др. // Российский вестник перинатологии и педиатрии. — 2014. — № 3. — С. 57-62.
14. Наумова О.В. Морфофункциональное состояние почек плодов от матерей с поздним гестозом, сахарным диабетом I типа и хроническим гломерулонефритом в условиях Харьковского региона: Автореф. дис... на соискание учен. степени канд. мед. наук: спец. 14.03.02 «Патологическая анатомия» / О.В. Наумова; Харьковский государственный медицинский университет. — Х., 1999. — 16 с.
15. Морфологическая характеристика соединительной ткани почек доношенных плодов и новорожденных от матерей, беременность которых осложнилась преэклампсией различной степени тяжести / И.В. Сорокина, М.С. Мирошниченко, Н.В. Капустник и др. // Wiadomości Lekarskie. — 2018. — Т. LXXI, № 3, cz. 1. — S. 579-587.
16. Моногарова Н.Е. Роль эпителиально-мезенхимальной трансформации в патогенезе идиопатического фиброзирующего альвеолита (обычной интерстициальной пневмонии) / Н.Е. Моногарова, И.В. Василенко // Патологія. — 2010. — Т. 7, № 1. — С. 80-83.
17. Епітеліально-мезенхімальне трансдиференціювання у розвитку інтерстиціального фіброзу при різних формах гломерулонефритів / О.О. Дядик, М.Д. Іванова, О.В. Хмара та ін. // Здобутки клінічної та експериментальної медицини: збірник матеріалів науково-практичної конференції. — Тернопіль, 2009. — С. 16.
18. Мирошниченко М.С. Патогистологические особенности сердца и органов мочевыделительной системы у плодов и новорожденных с задержкой внутриутробного развития / М.С. Мирошниченко // Український журнал нефрології та діалізу. — 2013. — Додаток № 1 до № 3(39). — С. 77-81.
19. Sorokina I.V. The features of smooth muscle actin expression in the kidneys, ureters and bladder of the newborns exposed to chronic intrauterine, acute postnatal and mixed hypoxia / I.V. Sorokina, M.S. Myroshnychenko, I.V. Korneyko // The new Armenian medical journal. — 2017. — Vol. 11, № 2. —
Р. 33-39.
20. Пасечник Д.Г. Роль эпителиально-мезенхимального перехода в генезе хронической болезни почек и почечно-клеточного рака (проблемы и перспективы) / Д.Г. Пасечник // Науковий вісник міжнародного гуманітарного університету. — 2014. — № 6. — С. 30-33.
21. Хоринок А.В. Роль нарушения клеточно-матриксных взаимодействий в патогенезе прогрессирования фиброза легких / А.В. Хоринок, Д.Г. Амарантов, П.В. Косарева / Журнал анатомии и гистопатологии. — 2016. — Т. 5, № 3. —
С. 84-89.
22. Баринов Э.Ф. Гастроинтестинальные миофибробласты — роль в регуляции физиологической активности и репарации желудочно-кишечного тракта / Э.Ф. Баринов, О.Н. Сулаева // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2010. — № 20(3). — С. 9-18.
23. Преэклампсия беременных: особенности патогенеза, тактики ведения / И.И. Иванов, М.В. Черипко, Н.В. Косолапова и др. // Таврический медико-биологический вестник. — 2012. — Т. 15, № 2, ч. 2(58). —
С. 273-286.
24. Галишон П. Эпителиально-мезенхимальная трансформация как биомаркер почечного фиброза: готовы ли мы применить теоретические знания на практике? / П. Галишон, А. Гертиг // Нефрология. — 2013. — № 17(4). —
С. 9-16.
25. Особенности биологии трансформирующего ростового фактора β и иммунопатология / А.В. Москалев, А.С. Рудой, А.В. Апчел и др. // Вестник Российской военно-медицинской академии. — 2016. — № 2(54). — С. 206-216.
26. The morphological picture of local immune responses in the kidneys, ureters and bladder of the foetuses and newborns, who developed in conditions of maternal preeclampsia / I. Sorokina, M. Myroshnychenko, S. Sherstiuk et al. // Gergian medical news. — 2018. — № 2(275). — P. 123-132.
27. Современные представления о роли эпителиально-мезенхимального перехода в прогрессировании хронической болезни почек / В.Е. Потапов, Е.А. Синельник, М.А. Акименко и др. // Кубанский научный медицинский вестник. — 2016. — № 6(61). — С. 104-109.

/47-1.jpg)
/47-2.jpg)
/48-1.jpg)