Резюме
Нами проведено дослідження клінічної та лабораторної ефективності, а також оцінка впливу на якість життя інтермітуючої терапії препаратом золотарника звичайного Цисто-аурин у 96 хворих на часто рецидивуючу інфекцію сечовивідних шляхів (ІСШ). Після отримання інформованої згоди хворі були розділені на три статистично однорідні групи. Протягом лікування пацієнтки всіх груп використовували стратегію поведінкової терапії та посткоїтальної профілактики. Пацієнтки групи А додатково отримували Цисто-аурин по 1 табл. 4 рази на день курсами по 15 днів кожного місяця протягом 6 місяців, групи В — той же препарат по 2 табл. 2 рази на день такими ж курсами, пацієнтки групи С (порівняння) спеціальної терапії не отримували. Упродовж дослідження отримані об’єктивні дані, що свідчать про вірогідне зниження числа рецидивів ІСШ на 92,3 і 73,3 % протягом 6 місяців лікування, залежно від кратності прийому препарату. Аналіз впливу досліджуваного препарату на лабораторні прояви часто рецидивуючої інфекції сечової системи показав позитивний ефект інтермітуючого режиму терапії щодо піурії, редукцію прозапальної активності та статистично вірогідне зменшення проявів запалення в сечовій системі. Ефективність редукції лейкоцитурії у хворих, які приймали препарат, становила 73,4 і 44,6 %, тобто лейкоцитурія була в 3,7 і 1,8 раза нижче вихідних значень. У той же час серед хворих групи С статистично значущої динаміки виявлено не було. Дискретна і кількісна оцінка впливу досліджуваного препарату на бактеріурію показала клінічно значущий і статистично вірогідний бактеріостатичний ефект Цисто-аурину як в процесі лікування препаратом (на 41,0 і 27,6 % відповідно), так і в проспективному 6-місячному періоді спостереження після його прийому (на 30,3 і 18,0 % відповідно), що є важливим підтвердженням впливу препарату на персистенцію мікробів у сечовій системі. Структуризація антибактеріального ефекту щодо клінічно значущих уропатогенів підтвердила редукцію штамів E.сoli на 61,1 і 31,9 %, Klebsiella pneumoniae — на 33,1 і 17,1 %, P.mirabilis — на 19,1 і 12, 9 %, P.aeruginosa — на 21,1 і 14,1 %, Candida spp. — на 19,4 і 14,5 % відповідно. Оцінка впливу досліджуваного препарату на симптоматику рекурентного хронічного циститу (шкала UTISA) показала вірогідне зниження ключових клінічних симптомокомплексів рецидивної ІСШ: полакіурії (на 48,3 % в обох групах), імперативних позивів (59,8 і 30,1 %), болю й печіння (42,6 і 30,2 %), неповного випорожнення сечового міхура (53,8 і 30,9 %), а також інтегрального показника клінічних проявів патології (24,7 і 39,2 % відповідно). Динаміка показників якості життя, що пов’язана із здоров’ям (шкала SF-36), на тлі прийому препарату продемонструвала статистично значущу індукцію ключових доменів якості життя хворих на часто рецидивуючу ІСШ: психічного здоров’я (33,4 % проти 32,5 %) і кумулятивного показника загальної якості життя (19,6 % проти 14,6 % відповідно).
Нами проведено исследование клинической и лабораторной эффективности, а также оценка влияния на качество жизни интермиттирующей терапии препаратом золотарника обыкновенного Цисто-аурин у 96 больных с часто рецидивирующей инфекцией мочевыводящих путей (ИМП). Больные были разделены на три статистически однородные группы, в ходе лечения пациентки всех групп использовали стратегию поведенческой терапии и посткоитальной профилактики. Пациентки группы А дополнительно получали Цисто-аурин по 1 табл. 4 раза в день курсами по 15 дней каждого месяца в течение 6 месяцев, группы В — тот же препарат по 2 табл. 2 раза в день такими же курсами, пациентки группы С (сравнения) специальной терапии не получали. В ходе исследования получены данные, свидетельствующие о достоверном снижении числа рецидивов ИМП на 92,3 и 73,3 % в течение 6 месяцев лечения, в зависимости от кратности приема препарата. Анализ влияния исследуемого препарата на лабораторные проявления часто рецидивирующей ИМП показал позитивный эффект интермиттирующего режима терапии в отношении пиурии, редукцию провоспалительной активности и статистически достоверное уменьшение проявлений воспаления в мочевой системе. Редукция лейкоцитурии у больных 2 групп, принимающих препарат, составила через 6 мес. 73,4 и 44,6 %, т.е. лейкоцитурия была в 3,7 и 1,8 раза ниже исходных значений. Среди больных группы С статистически значимой динамики выявлено не было. Оценка влияния препарата на бактериурию показала клинически значимый и статистически достоверный бактериостатический эффект Цисто-аурина, выраженный как в процессе лечения препаратом (на 41,0 и 27,6 % соответственно), так и в проспективном 6-месячном периоде наблюдения после его приема (на 30,3 и 18,0 % соответственно), что является важным подтверждением влияния препарата на персистенцию микробного начала в мочевой системе. Антибактериальный эффект в отношении клинически значимых уропатогенов подтвердила редукция штаммов E.сoli на 61,1 и 31,9 %, Klebsiella pneumoniaе — на 33,1 и 17,1 %, P.mirabilis — на 19,1 и 12,9 %, P.aeruginosa — на 21,1 и 14,1 %, Candida spp. — на 19,4 и 14,5 % соответственно. Симптоматика рекуррентного хронического цистита (шкала UTISA) показала достоверное уменьшение выраженности ключевых клинических симптомокомплексов: поллакиурии (на 48,3 % в обеих группах терапии), императивных позывов (59,8 и 30,1 %), боли и жжения (42,6 и 30,2 %), неполного опорожнения мочевого пузыря (53,8 и 30,9 %), а также интегрального показателя клинических проявлений патологии (24,7 и 39,2 % соответственно). Динамика показателей качества жизни, связанного со здоровьем, SF-36, на фоне приема препарата продемонстрировала статистически значимую индукцию ключевых доменов больных часто рецидивирующими ИМП: психического здоровья (33,4 % против 32,5 %) и кумулятивного показателя общего качества жизни (19,6 % против 14,6 % соответственно).
We conducted a study of clinical and laboratory efficacy, as well as evaluated the effect on the quality of life of intermittent therapy with Cysto-aurin drug in 96 patients with recurrent urinary tract infection (UTI). After receiving an informed consent, the patients were divided into three statistically homogeneous groups. During the treatment, in all groups we used the strategy of behavioral therapy and postcoital prevention. Patients of group A additionally received Cysto-aurin 1 tablet qid by courses of 15 days in raw each month for 6 months, group B — the same drug for 2 tablets bid for 15 days in raw each month for 6 months, group C (comparison group) did not receive any special therapy. During the study, the data were obtained indicating a reliable decrease in the number of UTI relapses in groups A and B by 92.3 and 73.3 % within 6 months of treatment, depending on the frequency of drug administration. Analysis of the influence of the study drug on laboratory manifestations of recurrent UTI showed a positive effect of the intermittent treatment regimen on pyuria, a reduction in pro-inflammatory activity, and a statistically significant decrease of inflammation in the urinary system. Leukocyturia reduction in patients taking the drug was 73.4 and 44.6 %, i.e. 3.7 and 1.8 times lower than baseline, respectively. There was no statistically significant dynamics during the treatment among the patients of group C. A discrete and quantitative assessment of the impact of study drug on bacteriuria showed a clinically and statistically significant bacteriostatic effect of Cysto-aurin, both during the drug treatment in groups A and B (reduction by 41.0 and 27.6 %, respectively) and the prospective 6-month follow-up (by 30.3 and 18.0 %, respectively), which is an important confirmation of the effect of the drug on the microbial persistence in the urinary system. While structuring the antibacterial effect against clinically significant uropathogens, it was confirmed the reduction of E.coli strains by 61.1 and 31.9 %, Klebsiella pneumoniae — by 33.1 and 17.1 %, P.mirabilis — by 19.1 and 12.9 %, P.aeruginosa — by 21.1 and 14.1 %, Candida spp. — by 19.4 and 14.5 %, respectively. Evaluation of the effect of the study drug on the severity of recurrent chronic cystitis symptoms (UTI Symptoms Assessment) showed a significant decrease in the severity of key clinical symptomatic complexes of recurrent UTI: frequency (by 48.3 % in both groups), urgency (59.8 and 30.1 %), pain and burning (42.6 and 30.2 %), incomplete emptying of the bladder (53.8 and 30.9 %), as well as the integral indicator of clinical manifestations of pathology (24.7 and 39.2 %, respectively). The dynamics of health-related quality of life indicators (Short Form-36 score) when taking the study drug demonstrated a statistically significant induction of key quality-of-life domains for patients with recurrent UTI: mental health (33.4 vs. 32.5 %) and cumulative overall quality of life (19.6 against 14.6 %, respectively).
Введение
Инфекции мочевыводящих путей (ИМП) — воспалительные процессы инфекционной природы в различных отделах мочевыделительной системы. ИМП относятся к наиболее социально значимым и финансово затратным инфекционным заболеваниям человека. В структуре инфекционной заболеваемости они занимают второе место, уступая лишь респираторным инфекциям [1]. Доля ИМП среди внутрибольничных инфекций составляет более 40 %. Эти заболевания лидируют по формированию резистентных форм микроорганизмов вследствие антибактериальной терапии. Распространенность ИМП, склонность к частому рецидивированию, рост резистентности возбудителей ИМП к действию антибиотиков определяют тот факт, что более 15 % всех амбулаторно назначаемых в США антибиотиков выписываются по поводу ИМП. Известно, что 45–72 % от общего числа женщин как минимум один раз в жизни сталкиваются с эпизодом острого цистита, при этом часто рецидивирующие ИМП (3 и более эпизода за год) наблюдаются у 20–27 % этих пациенток [4, 5]. Часто рецидивирующие ИМП крайне негативно влияют на качество жизни больных, вызывая значительное снижение самооценки, дезадаптацию и социальную изоляцию. Ведение пациенток с этой патологией зачастую требует привлечения специалистов-психологов, психиатров и невропатологов.
Особенности клиники, динамики течения и уникальный патогенез этой патологии определяют неоднозначность подходов к лечению часто рецидивирующей ИМП. Уникальными особенностями этой патологии являются присутствие «тихих» микробных резервуаров инвазивных штаммов уропатогенной E.сoli в субэпителиальном слое мочевого пузыря, колонизация бактериями подлежащих слоев уротелия, образование биопленок и высокоустойчивых клеток-персистеров, формирование внутриклеточных бактериальных сообществ в клетках организма-носителя и интраэпителиальная бактериальная аккумуляция латентных форм резистентных уропатогенов [6–10].
Антибактериальная терапия и антибиотикопрофилактика — ядро современной стратегии лечения часто рецидивирующих ИМП, а арсенал, доступность и эффективность антибиотиков и уроантисептиков — ключевое средство ее осуществления [5, 9–11]. Между тем ежегодный прирост резистентности уропатогенов и формирование их полирезистентных штаммов на фоне стагнации разработок новых антибактериальных субстанций за последние десятилетия, негативные проявления антибиотикотерапии в виде иммуносупрессии, грибковой инфекции, кишечного и генитального дисбиоза и дисбактериоза свидетельствуют о целесообразности и эффективности разработки альтернативных подходов к лечению часто рецидивирующих ИМП без использования антибиотикотерапии [10–12]. Необходимость усовершенствования терапевтических подходов отражена в действующих рекомендациях профессиональных урологических ассоциаций. Перспективным и многообещающим средством реализации этой цели является применение традиционных средств лечения ИМП, в частности фитотерапевтических препаратов на основе экстрактов лекарственных растений, таких как золотарник обыкновенный. Среди прочих средств он выделяется широким спектром терапевтических эффектов, в первую очередь известной антибактериальной и противовоспалительной активностью в отношении уропатогенов.
Золотарник обыкновенный (Solidago virgaurea) — многолетнее растение, произрастающее в Европе, Азии, Северной Африке и Северной Америке [13]. Активные компоненты растения практически полностью находятся в его листьях и являются водорастворимыми. Полученная фракционированием экстракта растения в колонне Sephadex G-100 активная фракция имеет молекулярную массу ~40,000 [14]. Среди активных веществ — органические и фенолкарболовые кислоты, сапонины и флавоноиды, в т.ч. рутин, кверцетин, кверцитрин, астрагалин, изокверцитрин, кемпферол, изорамнетин, нарциссин, альфа-токоферола хинон, трансфитол, 2-метоксибензил-2,6-диметоксибензоат, определяющие основной диапазон фармакологических эффектов золотарника [13–17].
Solidago virgaurea — традиционное средство лечения инфекционно-воспалительной патологии мочевой системы, применяемое в качестве фитотерапевтической альтернативы при инфекциях мочевых путей в странах Европы на протяжении более 500 лет [15]. Популярности золотарник достиг в Средние века благодаря своим анальгетическим свойствам, способности ускорять заживление ран и устранять воспаление мочевого пузыря. Фармакопейное применение растения вне урологических показаний в настоящее время является ограниченным, в то время как его использование при патологии мочеполовой системы рекомендовано рядом профессиональных ассоциаций и комиссий в качестве диуретического, противовоспалительного и спазмолитического средства [15, 16]. На сегодняшний день изучены антибактериальные, спазмолитические, десенсибилизирующие, мочегонные и антинеопластические эффекты растения, опубликованы результаты мультицентровых исследований и обзоров применения Solidago virgaurea при различных патологиях [13–15].
Достоверно не известно, какой из компонентов растения ответствен за противовоспалительные свойства золотарника. Ряд экспертов полагают, что это результат действия лейокарпозида, фенольного гликозида листьев и стеблей растения [18–20]. Результаты экспериментального исследования экстракта растения на животной модели, проведенного учеными Каирского университета, показали противовоспалительную активность, сопоставимую с диклофенаком натрия [19, 20, 29–31]. Работами последних лет показано ингибирование провоспалительного энзима — лейкоцитарной эластазы под действием экстрактов золотарника, а также потенцирование синтеза и выброса в кровяное русло глюкокортикоидов, модулирующих реакции воспаления [21, 31]. Экстракты Solidago virgaurea тормозят связывание брадикинина с брадикининовыми рецепторами, что является отражением анальгезирующей активности золотарника [23–25, 33]. Экспериментально показано, что обезболивающее действие лейокарпозида, по-видимому основного анальгезирующего компонента экстракта, в животной модели сопоставимо с активностью аминофеназона (амидопирина) [33]. Кроме того, экстракты растения in vitro тормозят активность ксантиноксидазы, липоксигеназы, диафоразы и других систем, отвечающих за перекисное окисление липидов, проявляя тем самым антиоксидантную активность [26–28]. Изучена и спазмолитическая активность экстракта золотарника. Так, в экспериментах на гладкой мускулатуре кишечника морских свинок эффект составил 14,7 % от активности папаверина. In vitro определена способность золотарника расслаблять гладкую мускулатуру мочевого пузыря крыс и людей, связанная с неконкурентной блокадой М2- и М3-холинорецепторов [29–31].
Антибактериальные свойства Solidago virgaurea изучены значительным количеством исследователей начиная с 1952 г. В работах A. Bratner [35], а также B. Thiem et al. [36] выявлена активность экстракта растения в отношении грамположительных и грам–отрицательных микроорганизмов, включая наиболее популяционно распространенных возбудителей ИМП семейства Enterobacteriacea и клинически значимые штаммы Proteus mirabilis и Pseudomonas aeruginosa. Кроме того, выявлена слабая активность в отношении грибов рода Candida, в том числе биопленок, связанных с персистенцией этого инфекционного агента [19–25]. В исследованиях E. Strehl et al. [37] показана способность экстракта растения к ингибированию дигидрофолатредуктазы — энзима, определяющего деление бактериальных клеток, а также указано на возможность прямого повреждения бактериальных клеточных стенок и потенцирование их лизиса [15, 22]. В зависимости от степени бактериальной колонизации, вирулентности возбудителя, активности иммунной системы хозяина и дозировки экстракты Solidago virgaurea проявляют бактериостатический или бактерицидный эффект, однако точный механизм действия остается невыясненным [18–21].
Особенность акваретической активности растения состоит в увеличении диуреза без потенцирования выделения с мочой ионов натрия, хлора, калия и бикарбоната, что позволяет длительно принимать экстракт с мочегонной целью без риска электролитных нарушений. Выраженность мочегонного эффекта золотарника в исследовании Dietmar Schakau [38] была продемонстрирована увеличением объема отделяемой мочи на 27 % по сравнению с плацебо. Акваретический эффект наряду с антибактериальной и противовоспалительной активностью экстракта растения во многом определяет уроселективный характер его действия [34].
Противорецидивные свойства золотарника для профилактики рекуррентных ИМП детально изучены в исследованиях Emanuela Frumenzio et al. [39]. В ходе исследования пациентки с частыми рецидивами ИМП (n = 164) были разделены на две группы. Группе А (n = 57) был назначен профилактический прием антибиотика (фосфомицина 1 саше 1 раз в неделю на протяжении 3 месяцев). Женщинам группы В (n = 107) назначена комбинированная терапия: дополнительно к антибиотику назначали фитопрепарат, основным компонентом которого был золотарник обыкновенный (на протяжении 3 месяцев). По истечении 3 месяцев наблюдения частота рецидивов инфекций мочевыводящих путей достоверно не различалась между группами: 11,21 % в группе комбинированной терапии и 10,52 % в группе изолированной антибиотикопрофилактики (р = 0,854). Однако спустя 12 месяцев после окончания профилактической терапии картина значительно изменилась: женщины группы В, принимавшие золотарник, в 2,5 раза реже сталкивались с рецидивами ИМП, в отличие от участниц группы А, получавших антибиотик в качестве монотерапии (р < 0,0001). Исследователи подчеркнули, что в долгосрочной перспективе прием золотарника характеризовался значительным уменьшением количества эпизодов ИМП, а также увеличением времени до развития рецидива, что значительно улучшило качество жизни пациенток.
Благодаря особенно высокой активности в отношении органов мочеполовой системы Solidago virgaurea в форме экстракта уже более 20 лет используется при создании коммерчески доступных медицинских препаратов, действие которых преимущественно направлено на ИМП и МКБ [13, 14]. Единственный стандартизированный препарат золотарника в дозировке 300 мг –(ЦИСТО-АУРИН) представлен в Украине немецкой компанией Esparma GmbH, Aristo group.
Целью нашего исследования стало повышение эффективности лечения и улучшение качества жизни больных часто рецидивирующими инфекциями мочевыводящей системы посредством интермиттирующего приема препарата Цисто-аурин (Solidago virgaurea).
Материалы и методы
Для реализации цели на базе урологической клиники Одесского национального медицинского университета, городской клинической больницы № 10 г. Одессы и медицинского центра «Новые медицинские технологии» нами проведено открытое проспективное контролируемое исследование эффективности и переносимости оригинального препарата золотарника обыкновенного Цисто-аурин, представляющего собой сухой экстракт травы золотарника, в 1 таблетке которого содержится 300 мг стандартизированного экстракта Solidago virgaurea.
В исследование были включены 96 пациенток с хроническим рецидивирующим циститом (средний возраст 41,9 года). Критерием включения послужили характерные клинические проявления, наличие трех и более эпизодов обострения цистита на протяжении года (EAU Guidelines, 2017), отсутствие серьезной сопутствующей патологии, показатель ECOG ≤ 1 (полная дееспособность). Критериями исключения были выраженная сердечная или почечная недостаточность, сахарный и несахарный диабет, анамнез неврологической патологии: болезнь Паркинсона, рассеянный склероз, spina bifida и пр., беременность и лактация, а также количество остаточной мочи более 100 мл. В период обострения заболевания больные предъявляли жалобы на учащенное, болезненное мочеиспускание малыми порциями, императивные позывы, тупые боли над лоном вне акта мочеиспускания, выделение мутной мочи. Болевая терминальная макрогематурия наблюдалась у 27 больных. На этапе включения в исследование все больные имели лабораторные проявления бактериурии различной выраженности по данным культурального исследования.
В ходе исследования после получения информированного согласия больные были разделены на три статистически однородные по возрасту и спектру основных клинических проявлений группы: две основные клинические — группу А (n = 32) и группу В (n = 34), а также группу сравнения С (n = 30) (табл. 1). Согласно действующему руководству по инфекции в урологии (EAU Guidelines on urological infections, 2017), в ходе лечения пациентки всех групп использовали стратегию поведенческой терапии (не передерживать мочеиспускание, соблюдать тщательную гигиену, ограничить употребление острой и экстрактивной пищи) и посткоитальной профилактики (раннее мочеиспускание и гигиенические процедуры после коитуса). В силу выраженных антибактериальных свойств препарата Цисто-аурин антибиотик не применялся. Пациентки двух клинических групп, А и В, прошли дополнительный курс лечения — интермиттирующий прием препарата Цисто-аурин: пациентки группы А получали Цисто-аурин по 1 табл. 4 раза в день курсами по 15 дней каждого месяца в течение 6 месяцев. Больные группы В — тот же препарат по 2 табл. 2 раза в день курсами по 15 дней каждого месяца в течение 6 месяцев. Пациентки группы С (группы сравнения) никакой специальной терапии не получали. Проспективный период наблюдения составил 6 месяцев после окончания приема исследуемого препарата.
/58-1.jpg)
Обследование и лечение проводили в амбулаторных условиях. Для инициальной диагностики использовали следующие методы: сбор анамнеза, оценка симптомов, заполнение дневника моче–испусканий перед каждым визитом в клинику, физикальное исследование с осмотром наружных половых органов, общие анализы крови и мочи, ультразвуковое исследование мочевого пузыря, почек и гениталий, биохимическое исследование крови (глюкоза, мочевина, креатинин, функциональные пробы печени), а также заполнение стандартизированных шкал оценки качества жизни, связанного со здоровьем, SF-36 и шкал оценки симптомов заболевания Urinary Tract Infection Symptom Assessment (UTISA). Бактериологическое исследование средней порции пузырной мочи проводилось каждые три месяца и включало посев биоматериала на искусственные питательные среды, выделение чистой культуры возбудителя и ее количественную оценку в КОЕ/мл, изучение чувствительности микроорганизмов к антибактериальным препаратам.
Оценка эффективности лечения проводилась на протяжении года, с контрольными визитами через 15 дней, 3, 6, 9 и 12 месяцев от начала исследования. Критериями эффективности лечения послужили частота рецидивных эпизодов цистита в проспективный период наблюдения, оценка качества жизни, связанного со здоровьем, по SF-36 в динамике, оценка влияния лечения на выраженность симптомов UTISA с детализацией динамики частоты, характера и эффективности мочеиспусканий, а также динамика лабораторных показателей пиурии и бактериурии.
Результаты и обсуждение
В ходе исследования получены результаты лечения пациенток клинических групп А и В, а также больных группы сравнения С. Пациентки, получающие исследуемый препарат, в целом удовлетворительно переносили назначенное лечение. Клинически значимых негативных проявлений терапии, которые бы повлекли за собой отмену либо коррекцию лечения, выявлено не было. В целом общий опрос пациенток до и после курса лечения показал, что позитивный клинический эффект назначенного лечения отмечен у 86,7 % больных группы А, у 80 % больных группы В и только у 20 % больных группы сравнения С. Помимо субъективной удовлетворенности результатами лечения, получены статистически достоверные и клинически значимые результаты позитивной динамики лабораторных показателей пиурии и бактериурии, частоты и характера мочеиспусканий, частоты и длительности рецидивов ИМП и динамики качества жизни по ключевым параметрам на фоне интермиттирующего (15 дней каждого месяца) приема препарата Цисто-аурин. Весьма интересно, что, несмотря на отсутствие различия календарной длительности лечения, состава и суточной дозы применяемого препарата, больные в целом отмечали достоверно более высокий лабораторный и клинический эффект при увеличении кратности его приема. Таким образом, среди пациенток группы А по большинству оценочных критериев объективной, лабораторной и клинической эффективности получены подтверждения более высокой результативности лечения как в течение приема препарата, так и в 6-месячный проспективный период наблюдения по сравнению с больными группы В.
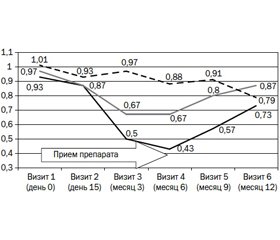
При оценке объективных показателей результатов лечения одним из ключевых маркеров стало наличие рецидивных эпизодов ИМП у исследуемых больных. Эффективность приема препарата была достоверно выше среди больных группы А, где снижение количества рецидивов цистита в течение первых 3 месяцев лечения составило 69,2 %, а в течение 6 месяцев — 92,3 %, несколько меньшая динамика отмечена у больных группы В — 60 и 73,3 % соответственно (рис. 1). Аналогичные показатели группы сравнения С составили 21,4 и 7,1 % соответственно. По окончании лечения в проспективный 6-месячный период наблюдения выявлена некоторая регрессия достигнутых показателей, при этом суммарная эффективность на протяжении периода наблюдения составила в клинических группах А и В 61,5 и 40,0 %, а в группе контроля С — 21,4 %. Анализ динамики среднего числа рецидивов в обеих клинических группах выявил статистически достоверные изменения по отношению к исходным данным как на протяжении лечения, так и в проспективный период. В группе А было зафиксировано 4 рецидива ИМП в первые 3 месяца и всего 1 рецидив в период с 3-го по 6-й месяц лечения, в то время как в группе сравнения С количество рецидивов составило 11 и 13 эпизодов соответственно.
Абсолютное большинство включенных в исследование больных с часто рецидивирующими ИМП не имели высоких показателей пиурии на момент начала исследования. Учитывая широкую волатильность лабораторных данных лейкоцитурии в общем анализе мочи, мы категоризировали результаты исследований средней порции мочи в группы условной нормы (0–5 нейтрофилов в поле зрения), низкой и высокой пиурии (6–10 и 11–30 нейтрофилов соответственно). Обработка данных лейкоцитурии в процессе лечения у пациенток клинических групп показала достоверное снижение данного показателя уже через 14 дней приема препарата (рис. 2): на 33,9 и 27,5 %, с дальнейшей градиентной регрессией в ходе лечения на 73,4 и 44,6 %, т.е. в 3,7 и 1,8 раза ниже исходных значений соответственно. Интересно, что и при отмене препарата в проспективный период наблюдения лейкоцитурия сохранялась ниже базовых показателей на 49,2 и 34,2 %. В то же время среди больных группы сравнения статистически значимой динамики как во время лечения, так и впоследствии выявлено не было.
/59-1.jpg)
Оценка количественных данных и структуры бактериурии у исследуемых больных — важнейшее объективное мерило как статического профиля клинической когорты пациенток, так и эффективности лечебных инициатив в динамике. В отличие от больных с острым циститом, которым в значительной мере присуща склонность к моноинфекции и превалирование бактерий семейства Enterobacteriaceae, исследуемые пациентки с часто рецидивирующей ИМП имеют в целом существенно больший полиморфизм выявленных уропатогенов с частым сочетанием двух и более в культуральных исследованиях, а также значимо меньший процент выявляемых культур E.сoli, прирост штаммов Klebsiella spp., Proteus spp., а также Candida spp. (табл. 1). При анализе динамики титра микроорганизмов в моче в процессе исследования отмечено достоверное снижение показателя степени бактериурии на протяжении лечения у больных обеих основных групп — на 41,0 и 27,6 % соответственно, а на протяжении всего 12-месячного периода наблюдений — на 30,3 и 18,0 % соответственно (рис. 3). В то же время динамика бактериурии в группе сравнения клинически значимых отклонений не продемонстрировала.
Динамика приема исследуемого препарата характеризовалась статистически достоверным, клинически значимым и стойким снижением полиморфизма уропатогенов по отношению к базовым показателям, что более ярко проявилось у больных группы А (рис. 4) — на 60,4 %, до 0,87 патогена в течение 6 месяцев с дальнейшей регрессией показателя по окончании проспективного периода наблюдения до 1,33 патогена (ΔM = 39,5 %). Аналогичные показатели группы В составили 1,13 (ΔM = 33,5 %) через 6 месяцев и 1,1 (ΔM = 35,3 %) через 12 месяцев после начала лечения. Соответствующая динамика показателей группы сравнения статистически достоверных изменений не выявила.
/60-1.jpg)
Детальный анализ динамики отдельных уропатогенов по принципу «эрадикация/титр ≤ 103» показал статистически достоверную редукцию клинически значимых микроорганизмов под действием исследуемого препарата среди больных клинических групп А и В в отношении E.сoli на 61,1 и 31,9 %, Klebsiella pneumoniaе — на 33,1 и 17,1 %, P.mirabilis — на 19,1 и 12,9 %, P.aeruginosa — на 21,1 и 14,1 %, Candida spp. — на 19,4 и 14,5 % соответственно.
Клиническую эффективность лечения, помимо прямого опроса и сбора жалоб, мы оценивали валидизированным инструментом объективизации клинических данных больных — опросником UTISA, с помощью которого вели детальный учет динамики частоты и характера микций, дизурии, урогенитальной боли и дискомфорта. В основном изменения клинических симптомов находились в корреляционной зависимости относительно лабораторной динамики пиурии и бактериурии. Характеризуя полученные данные, следует отметить равную эффективность снижения частоты мочеиспусканий в результате лечения среди больных обеих клинических групп А и В — 48,3 % в течение 6 месяцев (рис. 5), в то время как в последующем периоде наблюдения суммарная эффективность лечения была статистически выше среди больных группы А (ΔM = 40,8 и 29,4 % соответственно). Интересно, что показатель поллакиурии среди больных группы С также продемонстрировал достоверную динамику снижения, но эта динамика оставалась существенно ниже, чем в клинических группах А и В, — 23,2 % за 6 месяцев и 19,2 % за 12 месяцев.
В то же время динамика снижения частоты императивных позывов к мочеиспусканию (ургентности) на протяжении лечения была существенно более высокой среди пациенток группы А по сравнению с группой В (ΔM = 59,8 и 30,1 % соответственно). Подобная тенденция сохранялась и до конца проспективного периода наблюдения за больными (ΔM = 34,2 и 12,0 % соответственно). Соответствующий показатель группы сравнения С значимых изменений по сравнению с исходными данными не продемонстрировал (рис. 6).
Аналогичную динамику продемонстрировал показатель боли/жжения при мочеиспускании UTISA (рис. 7), где разница средних данных в клинических группах А и В составила 42,6 и 30,2 % в течение 6 месяцев и 36,2 и 11,3 % в течение 12 месяцев исследования при отсутствии значимой динамики в группе сравнения С.
Другой важный клинический критерий — показатель неполного опорожнения мочевого пузыря — характеризовался клинически значимым и статистически достоверным эффектом среди больных групп А и В исключительно на протяжении последних 3 месяцев приема препарата (ΔM = 53,8 и 30,9 % соответственно), тогда как в период проспективного наблюдения его данные достоверно не отличались от исходного показателя группы и данных группы сравнения (рис. 8).
/61-1.jpg)
Интегральный показатель выраженности симптомов UTISA, характеризующий, помимо выше–указанных жалоб, проявления урогенитальной боли, продемонстрировал существенный приоритет эффективности лечения, получаемого пациентками группы А (ΔM = 24,7 % против 39,2 % в группе В и 6,5 % в группе сравнения С), по окончании активной фазы исследования. В то же время аналогичные показатели в течение 6-месячного проспективного периода наблюдения были существенно ниже (15,0, 12,1 и 8,7 % соответственно). Динамика результатов группы сравнения на протяжении всего исследования статистически значимой не была.
Аналогичные результаты получены нами при оценке динамики влияния клинических симптомов на качество жизни больных по UTISA на протяжении исследования: обе клинические группы продемонстрировали позитивный эффект приема исследуемого препарата на качество жизни пациентов с достоверно более высокими результатами среди больных группы А: динамика показателя в течение периода приема препарата составила 54,6 и 34,2 % соответственно, а на протяжении периода наблюдения — 34,0 и 16,8 % соответственно (рис. 9).
Детализация влияния симптомов заболевания и характера его течения под воздействием назначенной терапии исследуемым препаратом на отдельные аспекты качества жизни, связанного со здоровьем, проводилась на основании изучения динамики суммарного балла опросника MOS SF-36, показателей физического и психического здоровья и динамики отдельных доменов этого инструмента с анализом их статистических изменений в каждой группе в процессе лечения. Также с помощью этого опросника осуществлялся анализ влияния заболевания на различные аспекты состояния здоровья больных каждой когорты, само–оценку, социальную адаптацию, взаимоотношения с близкими.
Достоверная лабораторная и клиническая эффективность лечения исследуемым препаратом нашла непосредственное отражение в домене общего здоровья SF-36. Позитивное воздействие интермиттирующего приема Цисто-аурина на больных основных клинических групп проявилось в устранении ключевых нарушений общего состояния здоровья в процессе лечения на протяжении 6 месяцев в группах А и В на 111,3 и 71 % соответственно (рис. 10), а по окончании периода наблюдения — на 24,4 и 38,7 % от базовых значений. Соответствующие изменения в группе сравнения С статистически достоверными не были.
Данные домена энергичности SF-36 у больных основных клинических групп также продемонстрировали сходную картину — повышение показателя жизненной активности через 6 месяцев приема препарата в группах А и В на 37,1 и 32,1 % соответственно, а по окончании периода наблюдения — на 11,3 и 13,3 % по отношению к базовым данным пациентов. Достоверных различий между показателями домена в динамике среди пациентов группы сравнения С выявлено не было.
/62-1.jpg)
Присущие больным часто рецидивирующей ИМП снижение социальной активности и социальная дезадаптация под бременем длительного течения заболевания в процессе лечения исследуемым препаратом подверглись существенному улучшению. Так, показатели домена социальной активности SF-36 на протяжении исследования характеризовались существенными позитивными изменениями с преимущественным эффектом в группе В: оптимизация социальных функций и увеличение активности в течение 6 месяцев составили 39,6 и 50,7 % в группах А и В соответственно, а в течение 12 месяцев — 8,1 и 29,3 % соответственно.
Статистически достоверные изменения домена физического здоровья SF-36 выявлены в динамике лечения только среди пациенток группы А по окончании шести месяцев приема препарата (ΔM = 19 %, р = 0,04). В то же время динамика домена среди пациенток группы В и группы сравнения С статистически значимых изменений по отношению к базовым данным не показала.
В домене ментального здоровья, отражающем совокупность характеристик социальной адаптации, жизненных сил, компенсаторных возможностей и копинг-поведения пациенток (снижение качества жизни и компенсаторные изменения личности, которые позволяют женщине с рецидивирующим циститом адаптироваться к социуму: туалетная картография, постоянное ограничение приема жидкости, ношение темной одежды и т.д.), существенные преимущества отмечены в результатах лечения больных группы А — динамика в течение 6 месяцев составила 33,4 % против 32,5 % в группе В, в течение 12 месяцев — 9 и 17,1 % соответственно.
Суммарный балл опросника SF-36 — кумулятивная мера качества жизни, связанного со здоровьем, и чувствительный инструмент динамики лечебных инициатив показал достоверные преимущества –режима приема препарата у больных группы А, где эффективность лечения была достоверно выше как по сравнению с группой сравнения С, так и в сравнении с показателями группы В (в течение 6 месяцев, ΔM = 19,6 % против 14,6 %, р ≤ 0,05). В то же время динамика домена в течение периода наблюдения не была достоверной в обеих группах (ΔM = 5,9 и 6,8 % соответственно).
Полные данные всех результатов исследования представлены в табл. 2.
Выводы
1. Часто рецидивирующие ИМП — источник драматических нарушений всех сфер социальной, трудовой, семейной и сексуальной жизни женщин наиболее трудоспособного, социально активного и репродуктивно значимого возраста, приводящих к социальной дезадаптации, адаптивному копинг-поведению, ограничениям в повседневной активности, социальных и личных контактах и ведущих к социальной изоляции, а иногда и инвалидизации пациентки.
2. Цисто-аурин — эффективное и безопасное средство лечения больных с часто рецидивирующей ИМП, позволяющее при интермиттирующем приеме (15 дней каждого месяца) существенно сократить частоту рецидивов патологии, объективно уменьшить количественные и качественные проявления бактериурии и пиурии. Прием препарата сопровождается объективным уменьшением частоты мочеиспусканий и ургентных позывов, снижением боли и дискомфорта, ассоциированных с патологией. Результатом приема препарата является улучшение социальной адаптации, взаимоотношений с близкими, самооценки больных, возврат пациента в привычное социальное окружение и ритм повседневной активности, общее улучшение качества жизни, связанного со здоровьем.
3. На наш взгляд, интермиттирующая терапия препаратом Solidago virgaurea 300 мг Цисто-аурин — действенная и безопасная альтернатива пролонгированной антибиотикопрофилактике с отсутствием модуляции популяционной антибиотикорезистентности, индукции фунгинальной активности и дисбиотических проявлений при долговременном приеме, позволяющая в перспективе решить принципиальную научную и практическую задачу лечения социально значимой группы больных с часто рецидивирующей ИМП.
4. Статистическая оценка результатов применения Цисто-аурина, полученная в результате его длительного приема у больных целевых групп, определила клиническую и лабораторную эффективность, сопоставимую с долговременной антибиотикопрофилактикой препаратами группы нитрофуранов. Для дальнейшей сравнительной оценки целесо–образно продолжить исследование эффективности препарата золотарника 300 мг в сопоставлении с препаратом-компаратором из группы традиционной продолжительной антибактериальной профилактики рецидивных ИМП — фосфомицином.
Конфликт интересов. Не заявлен.
Список литературы
1. Flores-Mireles Ana L. et al. Urinary Tract Infections: Epidemiology, Mechanisms of Infection and Treatment Options // Nature reviews. Microbiology. — 2015. — 269-284.
2. Schappert S.M., Rechtsteiner E.A. Ambulatory medical care utilization estimates for 2007 // Vital Health Stat. — 2011. — 13. — 1-38.
3. Griebling T.L. Urologic diseases in America project: trends in resource use for urinary tract infections in women // J. Urol. — 2005. — 173. — 1281-1287.
4. Grabe M., Bartoletti R., Bjerklund-Johansen T.E. et al. European Association of Urology: Guidelines on Urological Infections. 2015.
5. Dason S., Dason J.T., Kapoor A. Guidelines for the diagnosis and management of recurrent urinary tract infection in wo–men // Can. Urol. Assoc. J. — 2011. — 5. — 316-322.
6. Grimes C.L., Lukacz E.S. Urinary tract infections // Female Pelvic. Med. Reconstr. Surg. — 2011. — 17. — 272-278.
7. Matthew Glover, Cristiano G. Moreira, Vanessa Sperandio, Philippe Zimmern. Recurrent urinary tract infections in healthy and nonpregnant women // Urological Science. — 2014. — 25, 1. — 1-8.
8. Van der Starre W.E., Van Nieuwkoop C., Paltansing S., van't Wout J.W., Groeneveld G.H., Becker M.J. et al. Risk factors for fluoroquinolone-resistant Escherichia coli in adults with community-onset febrile urinary tract infection // J. Antimicrob. Chemother. — 2011. — 66. — 650-656.
9. Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden // Infect. Dis. Clin. North Am. — 2014. — 28. — 1-13.
10. Ejrnæs K. Bacterial characteristics of importance for recurrent urinary tract infections caused by Escherichia coli // Dan. Med. Bull. — 2011. — 58. — B4187.
11. Dwyer P.L., O'Reilly M. Recurrent urinary tract infection in the female // Curr. Opin. Obstet. Gynecol. — 2002. — 14. — 537-543.
12. Foxman B., Barlow R., D'Arcy H., Gillespie B., Sobel J.D. Urinary tract infection: self-reported incidence and associated costs // Ann. Epidemiol. — 2000. — 10. — 509-515.
13. European Goldenrod // Herbal Medicines. — 4th edition. — 2013. — 928 p.
14. Assessment report on Solidago virgaurea L. herba // European Medicines Agency. — 2008.
15. Melzig M.F. Goldenrod a classical exponent in the urological phytotherapy // Wien Med. Wochenschr. — 2004. — 154 (21–22). — 523-7.
16. Kołodziej B., Kowalski K., Kędzia B. Antibacterial and antimutagenic activity of extracts aboveground parts of three Solidago species: Solidago virgaurea L., Solidago canadensis L. and Solidago gigantea Ait // Journal of Medicinal Plants Research. — 2011. — 5, 31. — 6770-6779.
17. Laurençon L., Sarrazin E., Chevalier M., Prêcheur I., Herbette G., Fernandez X. Triterpenoid saponins from the aerial parts of Solidago virgaurea alpestris with inhibiting activity of Candida albicans yeast-hyphal conversion // Phytochemistry. — 2013. — 86. — 103-111.
18. Courtney M. Starks, Russell B. Williams, Matt G. Goe–ring, Mark O’Neil-Johnson, Vanessa L. Norman, Jin-Feng Hu, Eliane Garo, Grayson W. Hough, Stephanie M. Rice, Gary R. Eldridge. Antibacterial clerodane diterpenes from Goldenrod (Solidago virgaurea) // Phytochemistry. — 2010. — 71, 1. — 104-109.
19. Deng Y., Zhao Y., Padilla-Zakour O., Yang G. Polyphenols, antioxidant and antimicrobial activities of leaf and bark extracts of Solidago canadensis L // Industrial Crops and Pro–ducts. — 2015. — 74. — 803-809.
20. Brantner A. The antimicrobial activity of Solidago-containing phytourologica // Drogen-report. — 1999. — 12. — 27-28.
21. Thiem B., Goślińska O. Antimicrobial activity of Solidago virgaurea L. from in vitro cultures // Fitoterapia. — 2002. — 73, 6. — 514-516.
22. Strehl E., Schneider W., Elstner E.F. Inhibition of dihydrofolate reductase activity by alcoholic extracts from Fraxinus excelsior, Populus tremula and Solidago virgaurea // Arzneimittelforschung. — 1995. — 45, 2. — 172-173.
23. Kalemba D. Constituents and biological activity of the essential oils of some Solidago and Artemisia species // Scientific Papers Technical University of Lodz. — 2000. — 857. — 1-118.
24. Pepeljnjak S., Kustrak D., Vukusic I. Investigation of the antimycotic activity of Solidago virgaurea and Solidago gigantea extracts // Pharm. Pharmacol. Lett. — 1998. — 8. — 85-86.
25. Triterpenoid saponins from the aerial parts of Solidago virgaurea alpestris with inhibiting activity of Candida albicans yeasthyphal conversion / Laurençon L., Sarrazin E., Chevalier M. et al. // Phytochemistry. — 2013. — 86. — 103-111.
26. Echtes Goldenrutenkraut als entzündungshemmende Droge / Melzig M.F., Löser B., Bader G., Papsdorf G. // Z. Phytother. — 2000. — 21. — 67-70.
27. Meyer B., Schneider W., Elstner E.F. Antioxidative properties of alcoholic extracts from Fraxinus excelsior, Populus tremula and Solidago virgaurea // Arzneimittelforschung. — 1995. — 45, 2. — 174-176.
28. Immunomodulatory and antitumoral effects of triterpenoid saponins / Plohmann B., Bader G.T., Hiller K., Franz G. // Pharmazie. — 1997. — 12. — 953-957.
29. Immunmodulatorische und antitumorale Aktivität von Triterpensaponinen aus Solidago virgaurea L / Plohmann B., Franz G., Bader G., Hiller K. // Drogenreport. — 1999. — 12. — 29-30.
30. Immunobiological activity of a new benzyl benzoate from the aerial part sof Solidago virgaurea var. gigantea / Choi S.Z., Choi S.U., Bae S.Y. et al. // Arch. Pharm. Res. — 2005. — 28. — 49-54.
31. Westendorf J., Vahlensieck W. Spasmolytische und kontraktile Einflüsse eines pflanzlichen Kombinations-präparates auf die glatte Muskulatur des isolierten Meerschweinchendarms // Arzneim Forsch/Drug Res. — 1981. — 31. — 40-43.
32. Metzner J., Hirschelmann R., Hiller K. Antiphlogistische und analgetische Wirkungen von Leiocarposid, einem phenolischen Bisglucosid aus Solidago virgaurea L. // Pharmazie. — 1984. — 39. — 869-870.
33. Ethnomedicinally selected plants as sources of potential analgesic compounds: indication of in vitro biological activity in receptor binding assays / Sampson J.H., Phillipson J.D., Bo–wery N.G. et al. // Phytother. Res. — 2000. — 14, 1. — 24-9.
34. Melzig M.F. New aspects for understanding the mechanism of the aquaretic effects of birch leaves and goldenrod // Zeitschrift fur Phytotherapie. — 2000. — 21, 4. — 193-196.
35. Brantner A. The antimicrobial activity of Solidago-containing phytourologica // Drogen-report. — 1999. — 12. — 27-28.
36. Thiem B., Goślińska O. Antimicrobial activity of Solidago virgaurea L. from in vitro cultures // Fitoterapia. — 2002. — 73, 6. — 514-516.
37. Strehl E., Schneider W., Elstner E.F. Inhibition of dihydrofolate reductase activity by alcoholic extracts from Fraxinus excelsior, Populus tremula and Solidago virgaurea // Arzneimittelforschung. — 1995. — 45, 2. — 172-173.
38. Schakau D. Solidago Steiner® Tabletten. Solidago Stei–ner® Lösung und Harntee Steiner® // Portfolio-Schulung. — Januar, 2014.
39. Frumenzio E. at al. Role of phytotherapy associated with antibiotic prophylaxis in female patients with recurrent urinary tract infections // Archivio Italiano di Urologia e Andrologia. — 2013. — 85, 4.

/58-1.jpg)
/59-1.jpg)
/60-1.jpg)
/61-1.jpg)
/62-1.jpg)
/63-1.jpg)