Резюме
Актуальність. Відкриті проксимальні ушкодження променевого нерва найчастіше також виникають внаслідок ортопедичної травми. Повторний остеосинтез плечової кістки, поєднаний із ушкодженням променевого нерва, призводить до відстрочення реконструкції нерва, супроводжується значними технічними труднощами і, відповідно, призводить до погіршення результатів відновлення. Мета дослідження: оцінити ефективність реконструкції променевого нерва методом автонейропластики, визначити вплив переміщення кукс на розміри дефекту в умовах одночасного повторного синтезу плечової кістки. Матеріали та методи. Проведено ретроспективне дослідження результатів поєднаного нейрохірургічного та ортопедичного лікування 16 пацієнтів віком в середньому 34,5 року. Середній термін від моменту одержання поєднаної нервово-кісткової травми становив 4,8 місяця. 16 пацієнтам був проведений повторний синтез неконсолідованого перелому плечової кістки із використанням авторської техніки малоконтактного багатоплощинного остесинтезу за П.І. Білінським у середній термін від первинного остеосинтезу 3,9 місяця. У 16 пацієнтів ушкодження променевого нерва супроводжувалось наявністю критичного дефекту між куксами (більше 10 см), а його реконструкція полягала в виконанні пластики автологічними трансплантатами на медіальній поверхні плеча із використанням мікрохірургічної техніки. Клініко-неврологічне, електрофізіологічне та рентгенологічне обстеження проводилось на 3, 9, 12 та 15-му місяці. Середній follow-up період становив 1 рік 8 місяців. Результати. Середні терміни відновлення функції дорівнювали 13–15 місяцям. Відновлення усього комплексу розгиначів кисті, пальців, розгинання та відведення 1-го пальця досягнуто у 8 з 16 пацієнтів (50 %). У жодного пацієнта після повторного синтезу плечової кістки не спостерігали відсутності консолідації перелому. В 11 пацієнтів у середньому терміні 11,4 місяця після повторного синтезу плечової кістки було проведено видалення системи для МОС. Висновки. Переміщення кукс променевого нерва на внутрішню поверхню плеча дозволило зменшити розміри дефекту променевого нерва в середньому на 2,75 см, у 4 випадках — зменшити розміри дефекту до субкритичних (менше 7 см); відновлення функції усього комплексу м’язів задньої поверхні передпліччя досягнуто лише у близько 50 % хворих. Враховуючи відсутність чіткого прогнозу та мозаїчність відновлення м’язів задньої поверхні передпліччя, вважаємо перспективним впровадження в клінічну практику методики дистальної реіннервації променевого нерва.
Актуальность. Открытые проксимальные повреждения лучевого нерва чаще всего возникают вследствие ортопедической травмы. Повторный остеосинтез плечевой кости, сочетанный с повреждением лучевого нерва, приводит к существенной отсрочке реконструкции нерва, сопровождается техническими трудностями, соответственно, приводит к ухудшению результатов восстановления. Цель исследования: оценить эффективность реконструкции лучевого нерва методом аутонейропластики, определить влияние перемещения культей на размеры дефекта в условиях одномоментного повторного синтеза плечевой кости. Материалы и методы. Проведено ретроспективное исследование сочетанного нейрохирургического и ортопедического лечения 16 пациентов, средний возраст — 34,5 года. Средний срок от момента получения сочетанной нервно-костной травмы составил 4,8 месяца. 16 пациентам был проведен повторный синтез неконсолидированного перелома плечевой кости с использованием авторской техники малоконтактного многоплоскостного остеосинтеза по П.И. Билинскому, средний срок от момента первичного остеосинтеза — 3,9 месяца. У 16 пациентов повреждение лучевого нерва сопровождалось наличием критического дефекта между культями (более 10 см), а реконструкция заключалась в выполнении пластики аутологическими трансплантатами на медиальной поверхности плеча с использованием микрохирургической техники. Клинико-неврологическое, электрофизиологическое и рентгенологическое обследование проводилось на 3, 9, 12 и 15-м месяце. Средний follow-up период составил 1 год 8 месяцев. Результаты. Средние сроки восстановления функции составили 13–15 месяцев. Восстановление всего комплекса разгибателей кисти, пальцев, отведения и разгибания 1-го пальца достигнуто у 8 из 16 пациентов (50 %). Ни у одного пациента после проведения повторного синтеза плечевой кости не наблюдалось отсутствия консолидации перелома. У 11 пациентов в средний срок 11,4 месяца после повторного синтеза плечевой кости было проведено удаление системы МОС. Выводы. Перемещение культей лучевого нерва на внутреннюю поверхность плеча позволило уменьшить размеры дефекта в среднем на 2,75 см, в 4 случаях — уменьшить размеры дефекта до субкритических (менее 7 см); восстановление всего комплекса мышц задней поверхности предплечья достигнуто лишь в 50 % случаев. Принимая во внимание отсутствие четкого прогноза и мозаичность восстановления мышц задней поверхности предплечья, считаем перспективным внедрение в клиническую практику методики дистальной реиннервации лучевого нерва.
Background. Proximal injuries of the radial nerve are most commonly associated with orthopedic trauma. Secondary synthesis of the humerus combined with the radial nerve injury leads to postponement of the nerve reconstruction, and is associated with major technical difficulties, thereafter, impacts the recovery outcomes. The purpose of the study was to evaluate the efficacy of the radial nerve reconstruction via grafting technique, to define the influence of the stump transfer maneuver on the gap length at secondary humeral synthesis. Materials and methods. This study presents a retrospective analysis of the consecutive series of 16 patients with proximal radial nerve injury over a 4-year period (2013–2016). Twelve men and four women were enrolled into the study. The mean age of enrolled patients was 34.5 years (range 19–54). The mean time from occurrence of injury to primary humeral osteosynthesis was 4.8 months. Sixteen patients received secondary humeral synthesis due to absence of fracture consolidation with Bilinskyy synthesis device within mean term of 3.9 months after primary humeral synthesis. Sixteen patients underwent autologous nerve grafting in order to reconstruct radial nerve continuity. Mean gap length between proximal and distal stumps of radial nerve was the critical one in all patients (10 cm or higher). All sixteen cases of proximal radial nerve injury required transfer of both stumps onto the medial aspect of the shoulder in order to shorten the gap between the stumps. All grafts were sutured under microscopic magnification (5–8 times) with 8/0 — 10/0 nonabsorbable monofilament suture in a tension-free manner with 180 degrees extended forearm. All patients received standard therapy in post-operative period, which included antibiotics and painkillers. No early or delayed complications associated with surgery were observed. The mean follow-up period was 1 year 8 months. The follow-up period included clinical neurological examination with evaluation of muscle strength with Medical Research Council Grading System (MRCS), ENMG in 3, 9, 12 and 15 months after surgery followed by “on-demand” examination. Results. Mild to moderate strength in wrist extensors was detected on the 10th month among younger patients (under 21 years). Mean term of wrist extensors recovery was 13 months. First signs of finger extensors reinnervation did not differ among younger patients versus older ones; mean term of finger extensors recovery was 14.5 months. The recovery of thumb extensors and abductors in the majority of patients initiated simultaneously with finger extensors, wherein their strength reached their maximum on the 15th month and showed no tendency to improve with time. Summarizing the outcomes of radial nerve reconstruction via grafting technique we conclude that the recovery of the entire complex of thumb, fingers and wrist extensors was achieved only in 8 out of 16 cases (50 %). Better recovery of more proximal radial extensors (100 % of cases) was still accompanied by the lack of consistency within the outcomes, wherein 68.75 % showed recovery of both radial wrist extensors. The more distally the extensors were situated, the more dramatically grew the inconsistency of recovery: 87.5 % showed sufficient recovery of thumb extension, 62.5 % showed sufficient recovery of all finger extensors, and only 50 % showed recovery of thumb abduction. All 6 patients (37.5 %) with incomplete recovery of finger extensors required tenodesis of the finger extensors to provide simultaneous extension in MCP joints in later terms. In much later terms another 7 patients (43.75 %) with complete but ineffective recovery of thumb abductors of the dominant hand and no reliable improvement with time required PL transfer to restore proper thumb abduction. In some patients the recovered functions of proximal and distal extensors were accompanied by simultaneous activation of thumb and wrist extensors with complete loss of movement independency most probably due to the phenomenon of heterotopic reinnervation. They required injection of botulinum toxin either into thumb or wrist extensors during the reeducation process in order to turn temporary the “parasite” movements off. Two patients with entirely recovered complex of wrist and finger extensors suffered from neuropathic pain and required long-term intake of painkillers. No patient showed poor or no consolidation of the humeral fracture after secondary synthesis. Eleven patients underwent removal of the secondary osteosynthesis device in much later terms (mean 11.4 months). Conclusions. Radial nerve stump transfer maneuver helped us to decrease the gap up to (mean) 2.75 cm, and in 4 cases decreased the gap to subcritical (under 7 cm); the recovery of the entire complex of thumb, fingers and wrist extensors was achieved only in 8 out of 16 cases (50 %); considering the unpredictability of recovery of the proximal radial nerve after injuries, lack of the consistency within the recovery outcomes we find it necessary to implement into daily practice the innovative distal median-to-radial nerve transfer.
Вступ
Розвиток закритих ушкоджень променевого нерва (ПН) при проксимальних переломах плечової кістки пов’язаний із нефізіологічним надмірним раптовим рухом кінцівки, що в більшості випадків призводить до розтягнення нервової структури в короткий, обмежений частками секунд, момент часу — тракційного ушкодження нерва [1, 2]. Відкриті проксимальні ушкодження ПН також найчастіше виникають внаслідок ортопедичної травми, а порушення функції променевого нерва після первинного або повторного остеосинтезу плечової кістки (ПК) є одним із найпоширеніших та найсерйозніших ускладнень [3, 10]. Клінічні прояви проксимальних ушкоджень ПН проявляються частковою або повною втратою функції триголового м’яза плеча, а також втратою функції м’язів задньої поверхні передпліччя — розгиначів кисті, пальців тощо.
На сьогодні не існує єдиної узгодженої стратегії реконструкції променевого нерва при його проксимальних ушкодженнях — яка саме техніка дозволяє досягнути найкращих результатів в контексті відновлення функції розгиначів кисті, пальців тощо [4]. Деякі автори стверджують, що саме автонейропластика дозволяє досягнути задовільних функціональних результатів [5], хоча й не заперечують значну залежність результатів реконструкції від розмірів дефекту нерва та часу її виконання [6]. З іншого боку, транспозиція сухожилків на передпліччі не втрачає своєї актуальності та в більшості випадків залишається методом вибору при прогностично несприятливих проксимальних ушкодженнях ПН, залишаючись традиційним методом відновлення втрачених функцій, хоча деякі автори вказують на значну кількість незадовільних функціональних результатів після транспозиції сухожилків [6, 7]. Методика дистальної невротизації гілок променевого нерва при його проксимальних ушкодженнях набуває все більшого поширення, хоча й вона має свої технічні обмеження [3]. Протягом останніх років все більше обговорюються переваги дистальної невротизації над транспозицією сухожилків при проксимальних ушкодженнях ПН, а методика автонейропластики все більше втрачає свою актуальність [3].
Ціла низка факторів може призвести до відсутності консолідації плечової кістки, відповідно, до невідворотної необхідності проведення повторного остеосинтезу: занизька локальна щільність кісткової тканини, резидуальна варусна деформація, ішемія кістки в зоні остеосинтезу, вибір хибного методу чи апарату для синтезу перелому тощо [2]. В більшості випадків проведення повторних остеосинтезів ПК, що поєднані з проксимальними ушкодженнями ПН, призводить до значного відстрочення реконструкції власне ПН (на місяці). Досить часто проведений на більш ранніх етапах остеосинтез ПК та реконструкція ПН технічно ускладнюють проведення повторного синтезу. Переважно пошкодження ПН проходить при застосуванні контактних довгих пластин [9, 10]. Такі конструкції не виключають значну ймовірність вторинних і ятрогенних ушкоджень ПН (при первинно збереженій анатомічній цілісності) та ушкоджень ПН проксимальніше/дистальніше, власне зони реконструкції тощо. При використанні засобів для малоконтактного багатоплощинного остеосинтезу (МБО) такі ускладнення практично виключаються [9, 10].
Мета дослідження: оцінити ефективність реконструкції проксимальних ушкоджень ПН методом автонейропластики, визначити вплив переміщення кукс променевого нерва на розміри дефекту в умовах одночасного повторного синтезу ПК.
Матеріали та методи
Проведено ретроспективне дослідження результатів поєднаного нейрохірургічного та ортопедичного лікування 16 послідовних випадків ушкодження променевого нерва, асоційованого із неконсолідованими переломами променевої кістки, протягом 4-річного періоду (2013–2016 рр.) в пацієнтів, які проходили хірургічне лікування в ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України».
Критеріями включення в дослідження були: 1) клінічно та інструментально (дані ЕНМГ) підтверджене ушкодження променевого нерва проксимальніше с/3 плеча (5-й клас ушкодження за Sunderland [8]); 2) неконсолідований перелом плечової кістки в в/3-с/3 після остеосинтезу; 3) термін від асоційованої нервово-кісткової травми до вторинної реконструкції плечової кістки, первинної реконструкції променевого нерва не перевищував 9 місяців.
Характеристика пацієнтів, включених в дослідження. В дослідження включено 16 пацієнтів (12 чоловіків та 4 жінки) віком від 19 до 54 років (середній вік — 34,5 року) (табл. 1). Всі включені в дослідження пацієнти були обстежені на дохірургічному етапі за допомогою клініко-неврологічного, електронейроміографічного та рентгенологічного методів. Середній термін від моменту одержання поєднаної нервово-кісткової травми становив 4,8 місяця (табл. 1). Середній термін від моменту проведення первинного остеосинтезу плечової кістки до реконструктивного втручання становив 3,9 місяця.
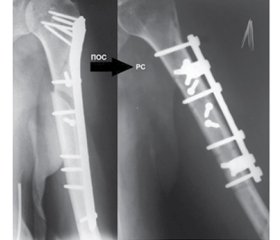
У 13 хворих первинний остеосинтез плечової кістки проводився із використанням пластин LCP (рис. 1а), у 3 хворих — із використанням блокуючого інтрамедулярного остеосинтезу (рис. 1б).
Характеристика проведених ортопедичних втручань. Усім 16 пацієнтам, включеним в дослідження, був проведений повторний синтез неконсолідованого перелому плечової кістки із використанням авторської техніки МБО за П.І. Білінським [9, 10]. Хірургічне втручання передбачало видалення раніше встановленого фіксатора для остеосинтезу, зачищення та репозиції уламків із усуненням ротаційного компонента та відновленням осі кінцівки (рис. 2а). В 12 випадках за наявності дефекту променевої кістки остеосинтез доповнювався одномоментною трансплантацією автологічної губчастої кісткової тканини із передньої поверхні в/3 великогомілкової кістки із забезпеченням повного виповнення наявного кісткового дефекту (рис. 2б).
/53-1.jpg)
Характеристика та особливості хірургічної реконструкції променевого нерва. В усіх 16 пацієнтів, включених у дослідження, ушкодження променевого нерва супроводжувалось наявністю дефекту між його куксами, розміри якого перевищували 10 см (критичний дефект). Вимірювання розмірів дефекту після освіження кукс променевого нерва проводилось зі збереженням нормального анатомічного шляху нерва, починаючи з медіальної поверхні в/3 плеча в trigonum subpectorale та послідовно в canalis spiralis, зовнішній поверхні в/3-с/3 плеча відповідно. В усіх 16 випадках передбачувана зона автопластики променевого нерва мала б щільно контактувати із фіксатором для МБО. Для уникнення контакту зони реконструкції нерва із ділянкою перелому променевої кістки і МБО фіксатором та зменшенням розмірів дефекту проводилось переміщення обох кукс (проксимальної та дистальної) променевого нерва на медіальну поверхню плеча: дистальна кукса проводилась під черевцем двоголового м’яза плеча та над черевцем плечового м’яза в косо-висхідному напрямку в н/3 плеча — stump transfer maneuver (STM). Після проведення STM розміри дефекту променевого нерва не перевищували 7 см (субкритичний дефект) у 4 випадках та перевищували 7 см (критичний дефект) у 12 випадках. STM дозволив зменшити розміри дефекту променевого нерва в середньому на 2,75 см (табл. 1).
В усіх 16 випадках реконструкція променевого нерва полягала в виконанні автологічної пластики. Як автологічні трансплантати використовували литковий нерв, медіальний шкірний нерв плеча, передпліччя, поверхневу гілку променевого нерва тощо. Адаптація кукс променевого нерва з автотрансплантатами проводилась під мікроскопічним збільшенням ×5–8 із використанням фасцикулярного шва атравматичним нерозсмоктуючим шовним матеріалом 8/0 за UPS. Обов’язковою умовою при виконанні автологічної пластики була відсутність натягу в проксимальній та дистальній зонах з’єднання з автотрансплантатами при розгинанні в ліктьовому суглобі під кутом 180°. Середня кількість автотрансплантатів, що була необхідна для перекриття усього поперечного зрізу проксимальної та дистальної кукс променевого нерва, дорівнювала трьом та залежала від розмірів дефекту: у міру їх зростання кількість автотрансплантатів зменшувалась (рис. 3).
/54-1.jpg)
Характеристика періоду спостереження за пацієнтами (follow-up періоду). Усі пацієнти отримували стандартну терапію в післяопераційному періоді, що включала антибактеріальні та знеболюючі препарати. Ми не спостерігали жодних ранніх чи відстрочених хірургічних ускладнень. Усім пацієнтам протягом трьох тижнів після повторного остеосинтезу плечової кістки проводилась жорстка іммобілізація верхньої кінцівки в фізіологічному положенні із дотриманням усіх стандартних вимог.
Середній follow-up період становив 1 рік 8 місяців. Клініко-неврологічне (із дослідженням сили м’язів за Medical Research Council Grading System (MRCS)), електрофізіологічне та рентгенологічне обстеження проводилось на 3, 9, 12 та 15-му місяці з подальшим обстеженням хворого при зверненні.
Мала кількість пацієнтів не дозволила провести будь-який значущий статистичний аналіз. Усі етапи дослідження проводились із дотриманням етичних стандартів ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», національного етичного комітету, Гельсінської декларації 1964 р. та подальших включень та доповнень; усі пацієнти, які були включені в дослідження, надали добровільну інформовану згоду на обробку вихідної та остаточної клінічної інформації.
Результати та обговорення
У пацієнтів молодшого віку (до 21 року) первинні ознаки реіннервації м’язів задньої поверхні передпліччя виникли вже на 6–7-й місяць після проведеного реконструктивного втручання. Напруження променевих розгиначів кисті (від незначного до задовільного) спостерігали на 10-й місяць у пацієнтів молодого віку (довгого променевого розгинача кисті — ECRL та короткого променевого розгинача кисті — ECRB відповідно). Середні терміни відновлення функції ECRL/ECRB дорівнювали 13 місяцям. Виникнення первинних ознак реіннервації загальних розгиначів 2–5-го пальців (EDC) не залежало від віку хворого, середні терміни відновлення функції EDC коливались в ме-жах 14–15 місяців. У більшості хворих відновлення функції довгого м’яза, що відводить 1-й палець (APL), та довгого розгинача 1-го пальця (EPL) розпочалось одночасно з відновленням EDC. М’язова сила відновлених APL та EPL досягла свого максимуму в середньому на 15-й місяць після проведеного реконструктивного втручання без жодної тенденції до збільшення із плином часу.
У чотирьох пацієнтів спостерігали відновлення функції лише ECRL (рис. 4). У вказаних вище чотирьох хворих функція лише ECRL була здатна забезпечити ефективне розгинання в променево-зап’ястковому суглобі та задовільну стабільність суглоба. У 2 пацієнтів, у яких розгинання в променево-зап’ястковому суглобі забезпечувалась виключно ECRL, спостерігалась надлишкова радіарна девіація кисті. В 11 пацієнтів спостерігалось задовільне відновлення функції обох променевих розгиначів кисті (рис. 4).
Одночасного розгинання 2–5-го пальців у п’ясно-фалангових суглобах досягнуто в 10 пацієнтів. У трьох пацієнтів спостерігали ослаблене розгинання вказівного пальця, ще в трьох — ослаблене розгинання 3–5-го пальців без ознак відновлення функції власного розгинача 5-го пальця.
У двох пацієнтів ми не спостерігали відновлення EPL, ще в трьох пацієнтів — APL. Підсумувавши результати реконструкції ПН методом автонейропластики, встановили: відновлення усього комплексу розгиначів кисті, пальців, розгинання та відведення 1-го пальця досягнуто у 8 з 16 пацієнтів (50 %). Незважаючи на відновлення у 100 % випадків більш проксимально розташованих променевих розгиначів кисті, якісний компонент відновлення не завжди був функціонально задовільним: лише в 68,75 % випадків спостерігали відновлення обох променевих розгиначів кисті. У 31,25 % випадків ми спостерігали відновлення лише довгого променевого розгинача кисті, причому в одному випадку усунення вираженої радіарної девіації кисті вимагало проведення переміщення сухожилка відновленого ECRL на нефункціонуючий ECRB (без втрати сили переміщеного м’яза) на більш пізніх етапах.
Чим дистальніше були розташовані м’язи задньої поверхні передпліччя, тим суттєвіше зменшувався якісний компонент відновлення: лише у 10 пацієнтів (62,5 %) ми спостерігали відновлення загальних розгиначів 2–5-го пальців, у 14 пацієнтів (87,5 %) — відновлення довгого м’яза, що розгинає 1-й палець, та у 8 пацієнтів (50 %) — відновлення довгого м’яза, що відводить 1-й палець. Шести пацієнтам (37,5 %) із неповним відновленням функції загальних розгиначів 2–5-го пальців були проведені тенодезуючі хірургічні втручання на більш пізніх етапах. Двом пацієнтам без відновлення функції довгого м’яза, що розгинає 1-й палець, та 8 пацієнтам без відновлення функції довгого м’яза, що відводить 1-й палець, були проведені коригуючі хірургічні втручання з переміщенням довгого м’яза, що напружує долонний апоневроз, на сухожилки відповідних м’язів.
На значно пізніших етапах семи пацієнтам (43,75 %) із задовільним відновленням сили (4–5б за MRCS) довгого м’яза, що відводить 1-й палець, проте незадовільною функцією відведення 1-го пальця було проведено коригуюче хірургічне втручання з переміщенням довгого м’яза, що напружує долонний апоневроз.
У п’яти пацієнтів (31,25 %) із 16 відновлені функції проксимальних та дистальних розгиначів супроводжувались одночасною активацією довгого м’яза, що розгинає 1-й палець, та розгиначів кисті (синкінетичні рухи) та, відповідно, повною втратою незалежної функції вказаних вище м’язів, що, найвірогідніше, пов’язано з феноменом гетеротопної реіннервації. У трьох пацієнтів синкінетичні рухи вимагали проведення ін’єкцій ботуліністичного токсину в черевце довгого м’яза, що розгинає палець, чи в черевця променевих розгиначів кисті для тимчасового виключення «паразитних» рухів та полегшення реабілітаційного процесу.
Два пацієнти з повним відновленням комплексу розгиначів кисті та пальців страждали від вираженого невропатичного больового синдрому, що вимагало тривалого прийому протибольових препаратів різних фармакологічних груп.
У всіх пацієнтів після повторного остеосинтезу неконсолідованого перелому плечової кістки з використанням фіксаторів для МБО П.І. Білінського ми спостерігали добру консолідацію перелому плечової кістки в передбачувані терміни.
В 11 пацієнтів у середніх термінах 11,4 місяця після повторного синтезу плечової кістки та задовільної консолідації перелому в умовах ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України» було проведено видалення системи для МОС. Жодних неврологічних ускладнень (порушення відновлених функцій променевого нерва) ми не спостерігали.
Висновки
Оцінка ступеня ушкодження, визначення необхідності та обсягу реконструкції променевого нерва на етапі первинного остеосинтезу переломів плечової кістки є обов’язковими. В усіх випадках повторного остеосинтезу неконсолідованих переломів плечової кістки, що поєднані з повним порушенням анатомічної цілісності променевого нерва, переміщення обох кукс та реконструкція променевого нерва на внутрішній поверхні плеча (відмежування від зони остеосинтезу) є обов’язковою умовою. Переміщення кукс променевого нерва на внутрішню поверхню плеча (stump transfer maneuver) дозволило зменшити розміри дефекту променевого нерва в середньому на 2,75 см, у 4 випадках — зменшити розміри дефекту до субкритичних (менше 7 см). Це значно полегшує проведення повторного остеосинтезу плечової кістки та, відповідно, унеможливлює ушкодження відновленого променевого нерва при видаленні фіксатора для МБО на більш пізніх етапах. Повноцінне відновлення функції усього комплексу м’язів задньої поверхні передпліччя після проведення реконструкції проксимальних ушкоджень променевого нерва методом автонейропластики досягнуто лише у близько половині випадків.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Coene L.N.J.E.M. Mechanisms of brachial plexus lesions // Clinical Neurology and Neurosurgery. — 1993. — 95. — Р. 24-29. doi: 10.1016/0303-8467(93)90030-k.
2. Pförringer D. Nerve Injury During Treatment of the Proximal Humerus Fracture // Fractures of the Proximal Hume-rus. — 2015. — Р. 219-223. doi: 10.1007/978-3-319-20300-3_27.
3. Ray W.Z., Mackinnon S.E. Clinical Outcomes Following Median to Radial Nerve Transfers // The Journal of Hand Surgery. — 2011. — 36(2). — Р. 201-208. doi: 10.1016/j.jhsa.2010.09.034.
4. Schutt D. Injury of the radial nerve in humeral shaft fractures // Ther. Umsch. — 1969. — 26(3). — Р. 133-6.
5. Filippova R.P., Lotsova E.I., Ruks V.R., Runde I.R., Kikane V.I. Results of treatment of humeral fractures complicated by injury of the radial nerve // Ortop. Travmatol. Protez. — 1978. — 8. — Р. 11-4.
6. Elton S., Rizzo M. Management of Radial Nerve Injury Associated with Humeral Shaft Fractures: An Evidence-Based Approach // Journal of Reconstructive Microsurgery. — 2008. — 24(08). — Р. 569-573. doi: 10.1055/s-0028-1090623
7. Holstein A., Lewis G.B. Fractures of the Humerus with Radial-Nerve Paralysis // The Journal of Bone & Joint Surgery. — 1963. — 45(7). — Р. 1382-1484. doi: 10.2106/00004623-196345070-00004.
8. Sunderland S. A classification of peripheral nerve injuries producing loss of function // Brain. — 1951. — 74(4). — Р. 491-516. doi: 10.1093/brain/74.4.491.
9. Білінський П.І. Теорія та практика малоконтактного многоплощинного остеосинтезу. — К.: Макрос, 2008. — 376 с.
10. Профілактика ушкоджень променевого нерва при хірургічному лікуванні переломів кісток передпліччя та плеча / В.І. Цимбалюк, І.Б. Третяк, П.І. Білінський, М.А. Сапон // Український нейрохірургічний журнал. — 2001. — № 3. — С. 38-43.

/53-2.jpg)
/52-1.jpg)
/53-1.jpg)
/54-1.jpg)
/55-1.jpg)