Вступ
Вогнепальне поранення, також відоме як балістична травма, — це форма фізичної травми, що виникає під впливом вражаючих факторів вогнепальної зброї або боєприпасів. Залежно від вражаючого фактора (снаряда) виділяються декілька різновидів вогнепальних ран, проте в нашому дослідженні ми мали справу лише з такими типами бойової травми, як кульові та осколкові поранення. Ці типи пошкоджень зазвичай характеризуються сильним забрудненням пилом, ґрунтом, одягом пацієнта й іншими сторонніми предметами; крім того, вони характеризуються формуванням значного ранового дефекту у зв’язку з необоротною втратою м’яких тканин і кісткових фрагментів. Ушкодження множинних анатомічних ділянок робить таких пацієнтів критичними, що вимагає термінової реанімації та інтенсивної терапії, тому ведеться пошук нових методів місцевого лікування ран, які включають застосування сучасних перев’язувальних матеріалів, лазерної терапії, ультразвукової кавітації тощо [1].
Переваги вакуум-асистованого закриття ран (VAC) при лікуванні вогнепальної травми були відзначені в багатьох попередніх дослідженнях [2, 3]. Про ефективність терапії ран негативним тиском можна судити лише по тому, що під час операції «Нескорена свобода» у березні 2003 року (Афганістан) близько 46 % ран лікувались за допомогою VAC, а у вересні 2003 року його використовували в більше ніж 90 % госпіталізованих із бойовими травмами [4]. Подальші технічні удосконалення зробили можливим використання цього методу під час повітряного транспортування, що дозволяє отримувати безперервну підтримку пораненим на всіх етапах медичної евакуації [5]. Ми також у попередніх дослідженнях описували свій досвід застосування негативного тиску в бойових вогнепальних ранах [6, 7]. Однак для цілісного розуміння комплексу патологічних змін, які відбуваються в організмі пацієнта із вогнепальними ранами, дуже важливо зіставити клінічні показники, що відбивають процеси запалення та регенерації на системному рівні, з даними локальних змін у рані. Вивчення такого взаємозв’язку, з одного боку, інтегрує уявлення тих процесів, що відбуваються на системному рівні, з іншого — дозволяє більш об’єктивно оцінювати зміни в рані на основі аналізу загальних клінічних даних.
Мета дослідження: провести комплексний аналіз ефективності вакуумної терапії рани, оцінюючи параметри раннього періоду загоєння ран, показники лейкоцитарної формули, рівня судинного ендотеліального фактора росту (VEGF) та цитограм із ранового вмісту у взаємозв’язку з відсотком гнійно-септичних ускладнень та готовності до закриття ран у хворих із вогнепальними (кульовими та осколковими) пораненнями, на основі отриманих результатів удосконалити тактику комплексного лікування хворих із тяжкими вогнепальними травмами.
Материали та методи
У роботі проведене клінічне, біохімічне, гематологічне та цитологічне дослідження в 34 хворих, госпіталізованих у Дніпропетровську обласну клінічну лікарню ім. І.І. Мечникова в ургентному порядку з відкритими ушкодженнями м’яких тканин, ускладненими компартмент-синдромом, великими некротичними ранами, відкритими переломами Gustilo — Anderson II, IIIA, IIIB.
18 пацієнтам застосовувався метод накладення пов’язки з негативним тиском (Vacuum Assisted Closure, VAC-терапія), описаний у наших попередніх публікаціях [6, 7]; 16 пацієнтам застосовувався класичний пов’язковий метод лікування відкритих вогнепальних пошкоджень кінцівок із використанням щоденних перев’язок із розчинами антисептиків та гіпертонічним розчином.
Клінічні методи. Оцінювався загальний стан рани за такими параметрами: набряк, гіперемія, поява грануляційної тканини, крайової епітелізації. Висновок про наявність набряку робився на підставі пальпації, при цьому оцінювалась лише наявність або відсутність ознаки; аналіз наявності гіперемії, грануляційної тканини та крайової епітелізації виконувався на підставі зовнішнього огляду рани.
Лабораторні методи. Лейкоцитарну формулу обчислювали до початку лікувальних заходів, а також через 3 і 7 діб у мазках крові. Далі проводили підрахунок інтегральних гематологічних індексів, включаючи модифікований лейкоцитарний індекс інтоксикації (ЛІІ) за методом В.К. Островського [8] як показник анекробіотичних процесів і рівня ендогенної інтоксикації; індекс співвідношення нейтрофілів і лімфоцитів (ІСНЛ = кількість нейтрофілів/кількість лімфоцитів) дозволяв судити про активність запалення.
Цитологічні методи. Цитологічну оцінку перебігу ранового процесу проводили за допомогою методу М.Ф. Камаєва [9]. Матеріал отримували за рахунок легкого зішкрібання поверхневого шару рани за допомогою шпателя з подальшим розподілом його тонким мазком на предметному склі та якісною й кількісною оцінкою клітинного складу.
Біохімічні методи. Біохімічне дослідження концентрації VEGF у сироватці крові було проведено за допомогою імуноферментного аналізу відповідно до стандартного протоколу виробника (ELISAKit, Quantikine, США). Використовували розведення матричного розчину фосфатним буфером або сироваткою (від 150 до 50 μl). Зразкам із невиявленим рівнем VEGF були призначені значення 9 пг/мл, тобто мінімальний рівень виявлення. Матеріал (сироватку крові пацієнта) забирали при надходженні хворого в стаціонар, через одну, дві, три та сім діб після початку ведення пацієнта.
Статистичні методи. Статистичний аналіз проводився за допомогою програмного забезпечення Microsoft Excel. Результати були виражені як середнє значення M ± m. Аналіз вірогідності розбіжностей між вибірками здійснювали з урахуванням парного t-критерію Стьюдента та непараметричного U-критерію Манна — Уїтні.
Результати та обговорення
Серед загальної тенденції клінічного перебігу локальних змін, що спостерігалися в ранах пацієнтів у досліджуваному періоді спостережень, ми відзначили зниження перифокального набряку, гіперемії, утворення грануляційної тканини та появу крайової епітелізації.
У групі з накладанням негативного тиску на 3-тю добу набряк м’яких тканин вірогідно купірувався в 17 пацієнтів (94,45 %; р < 0,05), гіперемія тканин — у 16 пацієнтів (88,89 %; р < 0,05). У групі з традиційним методом лікування на 3-тю добу набряк м’яких тканин вірогідно знижувався в 10 хворих (62,5 %; р < 0,05), гіперемія тканин — у 11 (68,75 %; р < 0,05). Разом із цим пацієнти, у яких застосовувався метод вакуум-терапії, відмічали значне покращання загального стану, зменшення больового синдрому, нормалізацію температури тіла, покращання сну та апетиту, тоді як у групі з пов’язковим методом лікування ці показники стабілізувалися лише на 7-му добу лікування.
У 5 хворих із накладанням негативного тиску формування грануляційної тканини розпочиналося на 3-тю добу, тоді як на 7-му добу в 16 поранених (88,89 %; р < 0,05) даної групи дослідження грануляційна тканина вже була сформована, а рана готова до проведення закриття одним із методів пластичної хірургії (накладання вторинних швів, автодермопластика). У той самий час пацієнти з використанням традиційного методу лікування демонстрували вірогідно повільнішу тенденцію формування грануляційної тканини: лише у 2 поранених у рановому ложі з’являлись ніжні грануляції на 3-тю добу (12,5 %) раннього періоду загоєння, на 7-му добу кількість хворих із наявністю грануляційної тканини в рановому ложі зростала до 68,75 % від загальної кількості в даній групі (11 пацієнтів).
Поява крайової епітелізації оцінювалась макроскопічно та підтверджувалась гістологічно в наших попередніх дослідженнях [10]. Отже, параметри швидкості крайової епітелізації як у хворих із традиційним методом лікування, так і в пацієнтів із використанням вакуум-асистованого закриття ран були порівнянними з параметрами швидкості утворення грануляційної тканини. У 8 хворих (44,4 %) із вакуум-терапією крайова епітелізація розпочиналася на 3-тю добу, а на 7-му добу відзначалася в 94,45 % поранених. Так само пацієнти з використанням пов’язкового методу демонстрували повільнішу тенденцію до крайової епітелізації: 2 поранених продемонстрували появу крайової епітелізації на 3-тю добу (12,5 %), тоді як на 7-му добу кількість хворих із наявністю крайової епітелізації збільшилась до 81,25 % від загальної кількості. Усі дані щодо клінічного перебігу локальних змін у ранах підсумовані в діаграмі (рис. 1). Слід зауважити, що в п’яти пацієнтів, яким був застосований метод традиційного лікування, спостерігався розвиток гнійно-септичних ускладнень (31,25 %), тоді як серед хворих, яким на рани накладався негативний тиск, утворення гнійного ексудату спостерігалося у 2 випадках (11,11 %; p < 0,05).
Вивчення гематологічних показників, що відбивають процеси ендогенної інтоксикації та імунологічної реактивності організму у хворих із вогнепальних травмами на момент надходження, продемонструвало динаміку змін, що можна порівняти з даними мікробіологічного дослідження, які були опубліковані раніше [11]. У всіх пацієнтів при надходженні відзначалося вірогідне збільшення абсолютного числа лейкоцитів крові та середній показник становив 23,5 ± 4,5 • 109/л, що у 2,6 раза більше порівняно з нормальними значеннями, відмічалося підвищення частки поліморфноядерних лейкоцитів (78,43 ± 4,67 %) із наявністю зсуву формули вліво і наявністю юних форм. ЛІІ становив у середньому 4,68, а ІСНЛ — 6,96. Іншими словами, у хворих із тяжкими вогнепальними ранами відзначалася значна інтоксикація (лейкоцитоз із тривалою стимуляцією білого ростка).
На 3-тю добу спостерігалося зниження показників інтоксикації та активності запалення у всіх пацієнтів, проте в групі з VAC-терапією відзначалася статистично вірогідна різниця досліджуваних показників порівняно з пацієнтами з традиційним веденням ран (р < 0,05). На тлі вакуумної терапії констатовані вірогідне зниження загального рівня лейкоцитів до 15,3 ± 2,4 • 109/л, зменшення ЛІІ до 2,53, ІСНЛ — до 3,12. У той же час дана динаміка у хворих із пов’язковим методом лікування не продемонструвала вірогідної різниці порівняно з початком лікування (лейкоцити — 20,7 ± 3,2 • 109/л, ЛІІ — 3,95, ІСНЛ — 5,86).
Після 7 діб лікування спостерігалося подальше зниження показників інтоксикації та активності запалення. Незважаючи на це, через 7 діб у хворих із застосованим пов’язковим методом більшість досліджуваних показників, як і раніше, перевищували значення норми (лейкоцити — 13,7 ± 1,2 • 109/л, ЛІІ — 1,95, ІСНЛ — 1,86). У пацієнтів, яким проводилася вакуум-терапія, на 7-му добу показники лейкоцитарної формули наблизилися до значень норми (лейкоцити — 9,7 ± 0,9 • 109/л, ЛІІ — 1,05, ІСНЛ — 1,6; рис. 2).
/67-1.jpg)
За даними цитологічного аналізу, на момент надходження увсіх хворих відмічався некротичний або дегенеративно-запальний тип цитограм із переважанням у мазку-відбитку нейтрофілів (96,78 %). Загалом відзначена позитивна динаміка перебігу ранового процесу у всіх хворих, однак вона була більш виражена в пацієнтів із використанням вакуумної терапії щодо тих, в яких застосований традиційний метод лікування. Так, на 3-тю добу ведення рани в пацієнтів із застосуванням вакуумної терапії кількість нейтрофілів зменшувалася та становила 72,15 ± 2,38 %, кількість макрофагів зростала до 10,95 ± 1,53 %, фібробластів — до 8,11 ± 0,93 %, лімфоцитів — до 7,79 ± 1,68 %. Зі свого боку, у цей же період у пацієнтів із пов’язковим методом лікування динаміка змін клітинного складу була менш вираженою: відсоток нейтрофілів зменшився до 84,24 ± 1,11 %, макрофагів — збільшився до 8,15 ± 0,13 %, фібробластів — до 2,18 ± 0,48 %, лімфоцитів — до 5,43 ± 0,92 %.
На 7-му добу в пацієнтів з обробкою рани негативним тиском кількість нейтрофілів знизилася до 52,49 ± 6,12 %, кількість макрофагів продовжувала зростати до 23,68 ± 5,74 %, фібробластів — до 12,97 ± 0,93 %, лімфоцитів — до 10,86 ± 2,66 %. Через тиждень у пацієнтів із пов’язковим методом лікування відсоток нейтрофілів також зменшувався порівняно з попереднім етапом, однак залишався вірогідно вищим, ніж у досліджуваній групі (63,55 ± 5,43 %). Проте відсоток макрофагів і лімфоцитів (21,8 ± 4,92 % і 11,42 ± 3,45 % відповідно) вірогідно не відрізнявся від аналогічних показників у хворих із застосуванням негативного тиску, хоча кількість фібробластів була вірогідно меншою (7,34 ± 2,52 %).
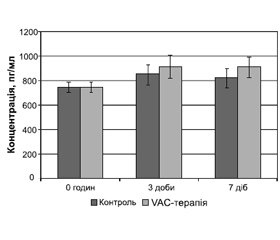
За даними імуноферментного аналізу, перед-операційний рівень концентрації VEGF крові усіх хворих значно перевищував відповідний діапазон нормальних значень (34–340 пг/мл). Вивчення цих змін на основі визначення індивідуальних тенденцій показало, що у всіх пацієнтів після 3-ї доби від початку лікування ран відбувалося істотне збільшення концентрації VEGF щодо передопераційного рівня. Через 3 доби після початку терапії таке збільшення було найвираженішим у хворих із застосуванням негативного тиску.Через 7 діб лікування рівень VEGF знижувався у всіх хворих, проте більш істотно в групі з традиційним веденням ран. І, нарешті, навіть після 7 діб лікування в усіх пацієнтів визначався підвищений рівень цього параметра порівняно зі станом перед початком лікування (рис. 3). Однак коливання показника у всіх хворих спостереження досягало статистичної значущості.
/68-1.jpg)
У нашому дослідженні було проаналізовано динаміку клінічних, біохімічних, гематологічних і цитологічних показників пацієнтів. Раніше вже повідомлялося, що вакуумна терапія посилює бактеріальний кліренс ран за рахунок збільшення кровопостачання, що покращує стійкість зараженої тканини до інфекції і поліпшує оксигенацію [11–13]. Було стверджено, що збільшення локальної оксигенації тканин зменшує зростання анаеробів і підсилює оксидативний стрес нейтрофілами, руйнуючи тим самим бактерії [14]. Це може відображати можливу модуляцію імунної системи і збільшення кровопостачання в рані, викликаного негативним тиском. Результати цього дослідження показали, що застосування VAC є оптимальним вибором раннього лікування ран порівняно з накладенням звичайних пов’язок із точки зору імунологічної реактивності. Вже на 3-тю добу лікування в 67,5 % хворих, які отримували вакуумну терапію, з’явилися клітини продуктивної фази запалення. На 7-му добу у 88,89 % із проведенням вакуум-терапії відмічено максимальне дозрівання грануляційної тканини, що дозволяє створити сприятливі умови для проведення закриття ран одним із методів пластичної хірургії. При порівнянні цих показників у пацієнтів із традиційним методом лікування на 3-тю добу не було виявлено істотного збільшення клітин проліферативної фази запалення, а на 7-му добу дозрівання повноцінної грануляційної тканини спостерігалось лише в 68,75 % випадків. Проаналізована динаміка концентрації VEGF у сироватці демонструє, що він є важливим фактором загоєння ран безпосередньо після травми. Індукований запальними клітинами та локальними умовами в рані VEGF потенційно послаблює тканинну гіпоксію та дефіцит нутрієнтів, сприяючи розвитку ранніх подій ангіогенезу, а також посилюючи функціонування ендотеліальних клітин [15–17]. Максимальна активність спостерігається протягом «вікна можливостей» приблизно від 3 до 7 діб після травми. Після формування грануляційної тканини ангіогенез припиняється і кількість кровоносних судин знижується, оскільки ендотеліальні клітини зазнають апоптозу. Це повністю корелює із цитологічними трансформаціями, а саме зі зміною запально-некротичного типу цитограм із ранового вмісту на регенеративний.
Таке прискорення регенераційних процесів у рані призводило до того, що середній період стабілізації рани (тобто утворення соковитих грануляцій, зникнення набряку) у хворих із накладанням негативного тиску становив 7,8 ± 1,2 ліжко-дня, що на 5,2 ± 0,8 ліжко-дня менше, ніж у пацієнтів із традиційним методом ведення ран. Рани 75,0 % пацієнтів із застосуванням VAC були готові до проведення хірургічного закриття вже на 8-му добу, тоді як рани пацієнтів із традиційною методикою ведення ран демонстрували подібну готовність лише в 50,0 % випадків.
Висновки
1. На підставі аналізу динаміки стану ранового ложа встановлено, що проведення вакуум-асистованого лікування вогнепальних поранень кінцівок вже на 3-тю добу знижує частку пацієнтів із запальним набряком на 31,95 % та гіперемією на 20,14 % порівняно з групою пацієнтів, яким проводилася загальноприйнята методика накладання пов’язок. Зі свого боку, після 7 діб проведення вакуум-асистованого лікування ран частка пацієнтів із наявністю зрілої грануляційної тканини та крайової епітелізації була відповідно на 20,14 та 13,2 % більшою за таку в пацієнтів із застосуванням традиційних повязок, що підтверджує доцільність застосування способу в другій фазі ранового процесу з 3-ї по 7-му добу.
2. Вакуум-терапія ран пришвидшує зміну дегенеративно-некротичного типу цитограм із ранового вмісту на регенераторний. На 3-тю добу лікування в 37,5 % хворих, які отримували вакуумну терапію, дегенеративно-некротичний тип цитограм змінюється на запальний тип, що є вірогідно швидшим, ніж при застосуванні звичайних марлевих пов’язок (18,3 % пацієнтів). На 7-му добу у 81,63 % хворих із накладанням негативного тиску і в 68,75 % зі звичайними марлевими пов’язками відмічено появу регенераторних типів цитограм (р < 0,05).
3. Визначено, що на тлі вакуумної терапії ран відмічається прискорення нормалізації показників лейкоцитограми порівняно з пацієнтами з пов’язковим методом лікування після 3 і 7 діб лікування в 1,3 та 1,35 раза (p < 0,05) відповідно, включаючи лейкоцитарний індекс інтоксикації, що зменшувався в пацієнтів із вакуум-асистованим лікуванням після 3-ї доби в 1,56 раза (p < 0,05) швидше, а після 7 діб — у 1,77 раза (p < 0,05), ніж у пацієнтів із пов’язковим методом лікування, внаслідок зменшення обсягу некробіотичних процесів, а також вірогідного зниження бактеріального навантаження рани.
4. Незважаючи на більш істотне зменшення некротичних процесів у ранах пацієнтів із VAC, сироваткова концентрація судинно-ендотеліального фактора росту в даних пацієнтів підтримується на високому рівні та істотно не відрізняється від пацієнтів із використанням традиційних пов’язок внаслідок стимуляції локальної гіпоксії та механічного подразнення ранового ложа негативним тиском.
5. Порівняльний аналіз характеру загоєння ран при травмах із використанням вакуумної терапії та марлевими пов’язками показав, що порівняно з традиційними методами вакуум-асистована терапія вогнепальних бойових ран дозволяє зменшити кількість ускладнень у короткостроковій перспективі (протягом 1 тижня) у 2,8 раза (p < 0,05), скоротити терміни підготовки ран до реконструктивних заходів у хворих у середньому на 5,2 ± 0,8 дня (p < 0,05). Таким чином, вакуум-асистована терапія знижує економічні витрати, скорочуючи термін перебування пацієнта в стаціонарі.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Taylor C., Jaffery S. Management of military wounds in modernera // Wounds. — 2009. — 5. — Р. 50-58.
2. Morykwas M.J., Simpson J., Punger K., Argenta A., Kremers L., Argenta J. Vacuum-assisted closure: state of basic research and physiologic foundation // Plast. Reconstr. Surg. — 2006. — 117. — Р. 121-126.
3. Geiger S., McCormick F., Chou R., Wangel A.G. Warwounds: lessons learned from Operation Iraqi Freedom // Plast. Reconstr. Surg. — 2008. — 122. — Р. 146-153.
4. Horrocks C. Blast injuries: biophysics, pathophysiology and management principles // J. R. Army Med. Corps. — 2001. — 147. — Р. 28-40.
5. Murray C.K., Hsu J.R., Solomkin J.S. et al. Prevention and management of infections associated with combat-related extremities injuries // J. Trauma. — 2008. — 64. — Р. 238-251.
6. Naumenko L.Y., Horehliad O.M., Mamet’ev A.A., Kostrica K.Y., Roleof V.A. Cin treatment of open severe polystructural damage of extremities // Trauma. — 2016. — 17(3). — Р. 25-26.
7. Naumenko L., Horehliad O., Mametyev A., Kostrytcya K., Domansky A. Healing of severe polystructural limb wounds using vacuum therapy // Orthopaedics, Traumatology and Prosthetics. — 2017. — 4. — doi: 10.15674/0030-59872017457-61.
8. Островский В.К., Свитич Ю.М., Вебер В.Р. Лейкоцитарный индекс интоксикации при острах гнойных и воспалительных заболеваниях легких // Вестн. хирургии. — 1983. — Т. 131, № 11. — С. 21-24.
9. Камаев М.Ф. Инфицированная рана и ее лечение. — М.: Медицина, 1970. — 159 с.
10. Морфологічні особливості репаративних процесів у ранах бойового характеру під впливом вакуум-асистованої терапії / О.Є. Лоскутов, О.М. Горегляд, О.О. Бондаренко, Н.С. Бондаренко // Morphologia. — 2018. — Т. 12, № 1. — С. 20-28.
11. Горегляд А.М. Изменение контаминированности ран под. действием локального применения негативного давления // Вестник Витебского государственного медицинского университета. — 2018. — Т. 17, № 2. — С. 63-69.
12. Scherer S.S., Pietramaggiori G., Mathews J.C., Prsa M.J., Huang S., Orgill D.P. The mechanism of action of vacuum-assisted closure device. Plast. Reconst. Surg. — 2008. — 122. — Р. 786-799.
13. Orgill D.P., Manders E.K., Sumpio B.E. et al. The mechanism of action of vacuum-assisted closure: moretolearn // Surgery. — 2009. — 146. — Р. 40-51
14. Huang C., Leavitt T., Bayer L.R., Orgill D.P. Effect of negative pressure wound therapy on wound healing // Curr. Probl. Surg. — 2014. — 51. — Р. 301-331.
15. McNulty A.K., Schmidt M., Feeley T., Kieswetter K. Effects of negative pressure wound therapy on fibroblast viability, chemotactic signaling, and proliferation in a provisional wound (fibrin) matrix // Wound Repair Regen. — 2007. — 15. — Р. 838-846.
16. Erba P., Ogawa R., Ackermann M. et al. Angiogenesis in wounds treated by microdeformational wound therapy // Ann. Surg. — 2011. — 253. — Р. 402-409.
17. Borgquist O., Ingemansson R., Malmsjo M. Individualizing the negative pressure wound therapy for optimal wound healing: a focused review of literature // Ostomy Wound Mana–ge. — 2011. — 57. — Р. 44-54.

/67-1.jpg)
/68-1.jpg)