За даними ВООЗ, туберкульоз залишається однією з 10 провідних причин смерті у світі і є однією з провідних причин смерті серед ВІЛ-інфікованих. При цьому понад 95 % випадків смерті від туберкульозу реєструються в країнах із низьким і середнім рівнем прибутку [1]. Кінцевої метою ВООЗ на сьогодні є викоренення туберкульозу у всьому світі [2]. Захворюваність на туберкульоз у світі знижується на 1,5 % на рік, але для глобального викоренення туберкульозу такі темпи замалі. Експертами визначено, що досягти цієї мети неможливо, якщо займатись лише активними випадками туберкульозу й ігнорувати випадки латентної туберкульозної інфекції (ЛТІ). Глобальний звіт ВООЗ із туберкульозу за 2016 рік визначає, що лікування ЛТІ є ключовим фактором профілактики нових випадків активного туберкульозу [1, 3].
За визначенням ВООЗ, ЛТІ — це стан стійкої імунної відповіді на антигени мікобактерій туберкульозу (МБТ), що потрапили в організм раніше, за відсутності клінічних проявів активної форми туберкульозу [4]. ЛТІ є одним з найбільш поширених інфекційних станів, що впливають на людство. За експертними оцінками, близько 1/3 населення світу інфіковано туберкульозом [5].
На даний час методи прямого вимірювання ступеня інфікування людського організму МБТ відсутні. У переважної більшості інфікованих осіб немає ознак або симптомів туберкульозу, але є ризик розвитку активної форми туберкульозу, що збільшується під впливом різноманітних чинників (табл. 1). Цей ризик можна знизити за допомогою профілактичного лікування [4, 6, 7].
/173-1.jpg)
Головним шляхом передачі туберкульозу є аерозольний: мікобактерії туберкульозу переносяться в ядрах повітряно-патогенних крапель, що утворюються при кашлі хворої на туберкульоз легень людини. Патогенні часточки залишаються в повітрі у вигляді аерозолю й можуть потрапити в організм здорової людини при вдиху [8]. Близько 90 % інфікованих пацієнтів можуть нормально реагувати на МБТ-інфекцію шляхом формування гранульоми, без виявлення клінічних симптомів активного туберкульозу, у стані, що називається ЛТІ. Проте в 5–10 % інфікованих пацієнтів із різними імунологічними станами МБТ починають неконтрольовано розмножуватись, а ЛТІ переходить в активний туберкульоз [3, 9]. У більшості таких осіб туберкульоз розвивається протягом перших п’яти років з моменту первинного інфікування [10, 11]. Передача туберкульозу в суспільстві відбувається в нескінченному повторюваному циклі контакту з хворим, інфікування й розвитку активного захворювання [4].
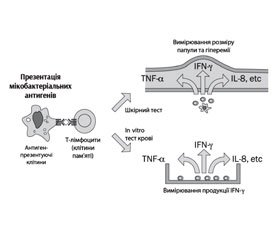
Діагностика латентної туберкульозної інфекції
На сьогодні у світі використовуються такі методи діагностики ЛТІ (рис. 1):
— туберкуліновий шкірний тест (ТШТ) — проба Манту;
— тести продукції гамма-інтерферону (IGRA — Interferon Gamma Release Assays): квантифероновий тест (КФТ; QuantiFERON TB Gold, QuantiFERON TB Gold In tube) та ELIAPOT/T-SPOT.TB.
IGRA-тести засновані на визначенні продукції гамма-інтерферону, що секретується СD4-лімфоцитами у відповідь на стимуляцію специфічними антигенами МБТ.
Але існуючі діагностичні тести на ЛТІ не можуть розрізнити стан після повністю вилікуваного туберкульозу, активного й латентного туберкульозу. Тому на додаток до позитивного тестування на ЛТІ необхідне виключення наявності активної туберкульозної інфекції в організмі [11].
ВООЗ рекомендує в країнах із високим та вищим від середнього рівнем доходів, у яких захворюваність не перевищує 100 випадків на 100 тис. населення, проводити систематичне тестування на ЛТІ у ВІЛ-інфікованих, дорослих і дітей, які мали контакт із хворими на легеневу форму туберкульозу, у пацієнтів, які починають лікування препаратами фактора некрозу пухлини, пацієнтів, які отримують гемодіаліз, готуються до трансплантації, а також у пацієнтів із силікозом. Для тестування на ЛТІ рекомендується проводити тести IGRA або ТШТ (проба Манту). Рекомендується розглянути можливість систематичного тестування на ЛТІ та лікування для осіб, які перебували в місцях позбавлення волі, працівників системи охорони здоров’я, іммігрантів із країн з високим тягарем туберкульозу, безхатченків та осіб, які вживають наркотичні препарати. При цьому ВООЗ не рекомендує проводити систематичне тестування для хворих на цукровий діабет, тих, хто не зловживає алкоголем, палінням, осіб із дефіцитом ваги (за умови, що ці особи не належать до вищеперерахованих категорій). Для діагностики ЛТІ рекомендується використовувати IGRA або ТШТ [4].
Для країн з обмеженими ресурсами й для інших країн із середнім рівнем прибутків рекомендовано проводити лікування ЛТІ ВІЛ-інфікованим і дітям у віці до 5 років, які тісно контактували з хворими на туберкульоз, за умови виключення активного захворювання на туберкульоз. ВООЗ не рекомендує замінювати туберкулінову шкірну пробу (проба Манту) аналізом IGRA у країнах із низьким півнем прибутків. Перед проведенням тестування на ЛТІ необхідно провести опитування пацієнта щодо скарг, характерних для туберкульозу, виконати оглядову рентгенограму органів грудної порожнини для виключення активних форм туберкульозу легень. При виявленні скарг, характерних для туберкульозу, та/або змін на рентгенограмі слід провести додаткові обстеження [4].
В Україні донедавна найчастіше використовувався лише ТШТ — проба Манту [12]. Проба Манту — це шкірний тест із 2 ТО туберкуліну, що визначає специфічну сенсибілізацію організму до МБТ. Чутливість до туберкуліну розвивається протягом 2–10 тижнів після зараження. Результат проби Манту оцінюється через 72 години.
Реакція вважається:
— негативною — при повній відсутності інфільтрату (папули) чи гіперемії або за наявності лише реакції на укол (0–1 мм);
— сумнівною — при інфільтраті розміром 2–4 мм або тільки гіперемії будь-якого розміру без інфільтрату;
— позитивною — за наявності інфільтрату діаметром 5 мм і більше [12].
Безперечною перевагою проби Манту є можливість діагностувати за її допомогою як латентну, так і активну туберкульозну інфекцію [10, 12]. Щорічне виконання проби Манту допомагає відстежити динаміку реакції у вакцинованих БЦЖ дітей, вчасно виявити первинне інфікування — віраж туберкулінової реакції і призначити лікування. Проба Манту є стандартом діагностики ЛТІ у дітей і дорослих у країнах із середнім та низьким рівнем доходу [4]. Перевагами цього тесту є дешевизна й доступність для населення. Але цей метод має багато недоліків: спостерігається високий відсоток хибнопозитивних і хибнонегативних результатів, позитивний результат виникає на вакцинні штами БЦЖ і нетуберкульозні мікобактерії, протипоказане проведення проби при гострих респіраторних вірусних інфекціях, шкірних захворюваннях, алергії, загостренні хронічних захворювань, вакцинації тощо. Хибнонегативні результати є наслідком недостатньої імунологічної відповіді через коінфікування ВІЛ, прийом цитотоксичних препаратів, імуносупресорів і при інших імунодефіцитних станах. Тяжкі форми туберкульозу легень, генералізований туберкульоз також можуть тимчасово знижувати інформативність проби. Хибнопозитивні результати можуть бути зумовлені сенсибілізуючим ефектом на імунну систему або вакцинації БЦЖ, або інфікування іншими мікобактеріями нетуберкульозного комплексу. Крім того, оцінювання результату тестування необхідно проводити в певні терміни — через 48–72 год. Якщо пацієнт не з’явився вчасно на прийом, то довіряти отриманим результатам не можна [12].
Не так давно в Україні з’явилась можливість призначати для діагностики ЛТІ квантифероновий тест. КФТ заснований на виявленні in vitro продукції гамма-інтерферону сенсибілізованими Т-лімфоцитами пацієнта, стимульованими in vitro специфічними протеїнами мікобактерій туберкульозу, що входять до комплексу Micobacterium tuberculosis, — ESAT-6 і –CFP-1. Ці антигени характерні для комплексу Micobacterium tuberculosis: M.tuberculosis, M.bovis, M.africanum, а також для нетуберкульозних мікобактерій: M.kansasii, M.szulgai і M.marinum [13]. Безсумнівною перевагою КФТ є те, що його виконання проводиться in vitro.
Для виконання квантиферонового тесту QuantiFERON-TB Gold Plus використовуються 4 пробірки для забору зразків цільної крові. Упродовж 16–24 годин кров у пробірках інкубується. Наступним етапом є виділення плазми й дослідження наявності в ній гамма-інтерферону методом ELISA.
Принцип аналізу:
— перша пробірка — NUL Tube: негативний конт–роль, що дозволяє регулювати фоновий шум;
— друга пробірка — TB1 ANTIGEN Tube: включає специфічні антигени Mycobacterium tuberculosis –ESAT-6/CFP-10 і пептиди для виявлення CD4-відповіді;
— третя пробірка — TB2 ANTIGEN Tube: включає специфічні антигени Mycobacterium tuberculosis ESAT-6/CFP-10 і пептиди для виявлення CD4- і CD8-відповіді;
— четверта пробірка — Mitogen Tube: позитивний контроль, дозволяє перевіряти функціональність імунної системи, а саме ідентифікувати людей з ослабленою імунною системою. Окрім того, ця пробірка може бути використана для контролю правильності поводження з пробірками.
Результати у пробірках вимірюються в МО/мл. Тест вважається негативним при нормальних значеннях у всіх пробірках. Позитивний результат фіксують у разі, якщо значення гамма-інтерферону в одній або обох пробірках з антигеном перевищує значення у нульовій пробірці. При цьому низький показник у пробірці з мітогеном (менше від 0,5 МО/мл) свідчить про сумнівний результат. Значення гамма-інтерферону в нульовій пробірці віднімається від значення гамма-інтерферону в пробірках з антигеном і пробірці з мітогеном [14].
Інтерпретація результатів QuantiFERON-TB Gold Plus під час скринінгу на ЛТІ (табл. 2):
— негативний КФТ: ЛТІ малоймовірна;
— позитивний КФТ: ЛТІ вельми вірогідна;
— невизначений результат КФТ означає, що імунна система пацієнта ослаблена. Подібний результат дуже інформативний і говорить про необхідність спеціального обстеження пацієнта. Невизначений результат може також бути наслідком неправильного поводження зі зразком, що повинен бути верифікований перед інтерпретацією результатів.
При інтерпретації результатів КФТ необхідно враховувати:
— КФТ не відповідає на питання, чи є позитивна відповідь результатом ЛТІ або активного туберкульозу;
— КФТ — це якісний тест, а це означає, що числове вираження в пробірках з антигенами ніяк не корелює зі ступенем ймовірності активного туберкульозу.
Для порівняння клінічної значимості КФТ і проби Манту доцільно вивчити їх чутливість, специфічність і діагностичну ефективність (табл. 3):
1. Чутливість — це відсоток тих, хто хворіє й кого дійсно виявлено за допомогою тесту. Стовідсоткова чутливість говорить про те, що методика ніколи не має хибнонегативних результатів.
2. Специфічність — параметр, що характеризує розпізнавальні можливості тест-системи щодо саме цього захворювання, яке вона «не плутає» з іншими. Стовідсоткова специфічність говорить про те, що методика ніколи не дає хибнопозитивний результат.
3. Діагностична ефективність — це параметр, що характеризує можливості даної тест-системи одночасно правильно визначати позитивні проби як позитивні, а негативні проби — як негативні.
Діагностична значимість різних тестів для виявлення латентної туберкульозної інфекції варіює в різних дослідженнях, але загалом КФТ демонструє майже стовідсоткову специфічність, що дає можливість виключити вірогідність хибнопозитивних результатів [8, 9, 11, 12].
Перевагами КФТ є висока специфічність, відсутність протипоказань до його проведення, відсутність побічних реакцій, відсутність впливу людського фактора на інтерпретацію результатів. За допомогою КФТ можна диференціювати інфекційну й поствакцинальну алергію. Алергічні стани й захворювання не впливають на результати КФТ.
До недоліків можна віднести нестовідсоткову чутливість і, внаслідок цього, можливість хибнонегативних результатів, високу собівартість дослідження й необхідність дотримання умов забору крові: забір крові проводять тільки рано-вранці натще (або не раніше ніж через 8 годин після останнього прийому їжі).
Суперечливими залишаються питання можливості використання й вірогідності результатів КФТ в особливих клінічних ситуаціях.
Квантифероновий тест для скринінгу на ЛТІ
У 2017 році опубліковані результати іспанського дослідження, у якому оцінювалась користь QuantiFERON-TB Gold іn Tube для скринінгу на ЛТІ в дорослих, які були вакциновані вакциною БЦЖ. Було порівняно 2 стратегії скринінгу контактних із хворими на туберкульоз: 1) використання тільки ТШТ — проби Манту; 2) використання ТШТ і КФТ. У результаті було визначено, що додаткове використання КФТ зменшувало гіпердіагностику ЛТІ без збільшення ризику подальшого розвитку туберкульозу [15].
Використання тесту QuantiFERON-TB Gold іn Tube для скринінгу осіб, контактних із хворими на туберкульоз, і його прогностичне значення щодо ризику розвитку активного туберкульозу вивчалось у дослідженні 2015 року. У дослідженні взяли участь 625 людей, контактних із хворими на туберкульоз. Період спостереження в середньому становив 637 днів. 168 осіб мали позитивний результат КФТ і 457 мали негативний результат КФТ. Серед пацієнтів із позитивним КФТ упродовж періоду спостереження була виявлена активна форма туберкульозу в 10 осіб (6 %), а в групі з негативним КФТ захворіли на активну форму туберкульозу 2 пацієнти (0,4 %). Отже, контактні особи з позитивним результатом КФТ мають більший ризик захворювання на активний туберкульоз, ніж особи з негативним КФТ, що підтверджує ефективність цього тесту для відбору осіб для проведення профілактичного лікування [16].
Отже, КФТ має беззаперечні переваги при скринінгу на ЛТІ. Для країн із низьким і середнім рівнем доходів, у яких ВООЗ не рекомендує КФТ як рутинну методику скринінгу, КФТ може бути додатковим інструментом для зменшення гіпердіагностики ЛТІ в осіб із позитивним ТШТ.
Квантифероновий тест у діагностиці активних форм туберкульозу
Дискутабельне питання про хибнонегативні результати КФТ у хворих з активним туберкульозом легень (підтвердженим бактеріологічними методами) ставило під сумнів можливість використання КФТ у процесі проведення диференціальної діагностики змін у легенях. Але останніми роками проведено декілька досліджень, які вивчали фактори, що впливають на такі результати. Так, у 2013–2015 рр. американськими спеціалістами проводилось дослідження факторів, що впливають на негативні результати КФТ у хворих на туберкульоз легень. Використовуючи дані спостереження за хворими на туберкульоз легень у Техасі (США), автори виділили характеристики, що впливають на отримання негативного результату КФТ на момент діагностики туберкульозу. Серед 1527 хворих, яким на етапі діагностики туберкульозу виконувався КФТ, 87,7 % мали позитивний результат і 12,3 % мали негативний результат.
Із негативним результатом КФТ корелювали:
— похилий вік,
— коінфекція туберкульозу/ВІЛ,
— неіспаномовна біла раса.
Окрім того, було встановлено, що серед пацієнтів із негативними результатами КФТ були зафіксовані більш високі показники смертності [17].
Схожі результати були отримані й іншими авторами: вірогідність хибнонегативних результатів підвищувалась у хворих із тяжкими формами туберкульозу (наприклад, при міліарному туберкульозі) і при станах із вираженою лімфоцитопенією [18].
Квантифероновий тест у дітей
Досі залишається спірним питання використання КФТ у дітей молодшої вікової групи через побоювання щодо незрілої імунної відповіді в дітей. У дослідженні Т. Bielecka та ін., опублікованому у 2018 році, з’ясовувалось, чи є достатньою продукція гамма-інтерферону в дітей віком до 5 років для того, щоб розглядати КФТ як діагностичний тест при скринінгу на ЛТІ дітей віком від 0 до 17 років із підозрою на інфікування туберкульозом. Їм виконувалась проба Манту та КФТ. У мітогенних пробірках середній рівень гамма-інтерферону був вищим у дітей, старших від 5 років, але в пробірках TB ANTIGEN Tube показники були вищими в молодшій групі. Була визначена позитивна кореляція між рівнем гамма-інтерферону і віком у мітогенних пробірках і негативна кореляція в пробірках TB-антигену. У пацієнтів із ЛТІ кореляція виявилася ще більш сильною. Тому автори дійшли висновку, що найменші діти виділяють достатню кількість гамма-інтерферону у відповідь на туберкульозні антигени, тому КФТ може бути корисним інструментом для діагностики ЛТІ в цій віковій групі [19].
Подібні ж результати були отримані в ретроспективному аналізі результатів дослідження 517 дітей віком від 0 до 14 років, яким виконували скринінг на ЛТІ. Кількісна відповідь гамма-інтерферону на специфічні для Mycobacterium tuberculosis антигени істотно не відрізнялась у дітей з активним туберкульозом і ЛТІ, хоча медіанне значення були вищим у першій групі. У дітей віком до 5 років з активним туберкульозом отримували значно більш високі рівні гамма-інтерферону в пробірках TB ANTIGEN (у середньому 10 МО/мл), ніж у пацієнтів із ЛТІ (медіана 1,96 МО/мл). Реакція в пробірках TB ANTIGEN збільшувалася з віком [20].
У дослідженні, яке проводилось у дитячому медичному центрі іранської лікарні серед дітей і їхніх опікунів, визначено, що було менше позитивних результатів тесту IGRA, ніж позитивних результатів шкірного туберкулінового тесту (33 % проти 56 %) серед дітей. Серед дорослих (опікунів) шкірний туберкуліновий тест та IGRA були позитивними у 41 і 40 % відповідно. Результати дослідження показали, що тест IGRA має більш високу специфічність, ніж TШT, особливо в дітей, на той час як частота позитивних результатів при обох тестах у дорослих була однаковою. З огляду на хибнопозитивні результати TШT авторами вважається доцільним замінити TШT тестом IGRA у дітей [21].
Отже, використання КФТ можливе в усіх вікових групах дітей.
Квантифероновий тест у вагітних
Своєчасне виявлення як активного, так і латентного туберкульозу у вагітних дозволяє не тільки зменшити негативні наслідки для жінки, але й унеможливлює в подальшому зараження дитини. Найбільш актуальними питаннями є вирішення ситуацій тісного сімейного контакту із хворим на туберкульоз легень і відбір ВІЛ-інфікованих вагітних для проведення профілактичного лікування.
У великому дослідженні 829 ефіопських вагітних жінок (5,9 % ВІЛ-позитивних) були протестовані за допомогою КФТ. 287 жінок (33 %) мали позитивний результат КФТ (ВІЛ-позитивні — 16/49 (33 %), ВІЛ-негативні — 261/780 (33 %)). ВІЛ-позитивні жінки мали нижчий рівень абсолютного гамма-інтерферону порівняно з ВІЛ-негативними жінками. ВІЛ-інфіковані жінки з позитивним КФТ, які були протестовані на пізніх стадіях вагітності, продемонстрували нижчу здатність продукувати гамма-інтерферон, тому у ВІЛ-інфікованих вагітних жінок можна враховувати нижчий рівень для визначення позитивності КФТ [22].
У іншому дослідженні доведено, що частота невизначених результатів КФТ була вищою під час вагітності (16 %) порівняно з післяпологовим обстеженням (0 %) через меншу реакцію мітогену. Окрім того, за допомогою КФТ було виявлено у 2 рази більше жінок з ЛТІ порівняно з пробою Манту під час вагітності та після пологів. Реакція на мітоген під час вагітності порівняно з післяпологовим рівнем вказує на те, що ймовірні зміни, пов’язані з вагітністю, можуть впливати на ефективність тестування ЛТІ [23].
Загалом доведено, що вагітність без ВІЛ-інфікування не змінює суттєво результати КФТ, а отримання невизначеного результату є показанням для повторного обстеження пацієнтки.
Квантифероновий тест у ВІЛ-інфікованих
Використання безпечних та ефективних методик для діагностики ЛТІ у ВІЛ-інфікованих пацієнтів залишається одним з актуальних питань сучасної фтизіатрії. Дефіцит CD4-лімфоцитів і пов’язані з цим зміни у функціонуванні імунної системи ставлять під сумнів вірогідність результатів імунологічних методів скринінгу на туберкульоз. Згідно з існуючими даними, як у когортах ВІЛ-негативних, так і в когортах ВІЛ-позитивних пацієнтів ТШТ сприяють гіпердіагностиці ЛТІ. Застосування КФТ (або як самостійного методу, або в поєднанні із ТШТ) в обох когортах пацієнтів дозволяє зменшити гіпердіагностику ЛТІ [24–27]. При аналізі встановлено, що тести продукції гамма-інтерферону дозволяли вірогідно зменшити гіпер–діагностику у хворих, вакцинованих БЦЖ.
Вірогідність хибнонегативних результатів КФТ у ВІЛ-інфікованих пацієнтів підвищується при зменшенні рівня CD4-лімфоцитів у крові нижче від 200 кл/мл. Такі дані були отримані в іспанському дослідженні 2010 року після дослідження 150 ВІЛ-інфікованих пацієнтів за допомогою тестів T-SPOT.TB, КФТ і ТШТ. Серед пацієнтів із рівнем CD4-лімфоцитів менше від 200 кл/мл був отриманий лише 1 позитивний результат T-SPOT.TB, а КФТ та ТШТ були негативними в усіх пацієнтів. У пацієнтів із рівнем CD4-лімфоцитів понад 200 кл/мл частка позитивних результатів становила: T-SPOT.TB — 10,9 % (6/55), КФТ — 9,1 % (5/55) і ТШТ — 16,4 % (9/55).
Отже, при проведенні скринінгу на ЛТІ у ВІЛ-інфікованих пацієнтів із рівнем CD4-лімфоцитів понад 200 кл/мл можна застосовувати такі ж підходи до інтерпретації результатів, як і у ВІЛ-негативних пацієнтів. При нижчому рівні CD4-лімфоцитів у крові доцільно враховувати можливість хибнонегативних результатів [26].
Квантифероновий тест у хворих на цукровий діабет
Використання КФТ у рутинній практиці для проведення скринінгу на ЛТІ у хворих на цукровий діабет, у яких не було підтвердженого контакту з хворими на легеневий туберкульоз, не рекомендовано. Окрім того, існує думка, що цукровий діабет спотворює результати тестів, чутливість яких може залежати від умов імунної дисрегуляції. Саме з цієї причини захворювання на цукровий діабет може збільшити частоту невизначених результатів IGRA [28].
Для підтвердження або спростування цієї гіпотези групою вчених був проведений ретроспективний аналіз карток усіх пацієнтів, які пройшли тестування КФТ: 37,3 % мали позитивний результат КФТ, 7,8 % мали невизначений результат, 54,9 % мали негативний результат. Багатофакторний аналіз показав, що системне застосування кортикостероїдів, туберкульоз, лімфоцитопенія, низький рівень альбуміну й високий рівень С-реактивного білка в сироватці були значно пов’язані з невизначеними результатами КФТ. Після додаткового статистичного аналізу встановлено, що цукровий діабет не асоціювався з невизначеними результатами КФТ [29].
Отже, проведення КФТ під час скринінгу на ЛТІ необхідно здійснювати за показаннями з метою виявлення осіб, яким необхідно призначати профілактичне лікування, і виключення гіпердіагностики. КФТ є ефективним доповненням і/або альтернативою туберкуліновим тестам. Майже стовідсоткова специфічність і висока чутливість забезпечують високий рівень вірогідності отриманих результатів. Безсумнівною перевагою КФТ є виключення людського фактора при інтерпретації результатів.
Конфлікт інтересів. Не заявлений.
Список литературы
1. World Health Organization. Global tuberculosis report 2016 [Internet]. — Geneva: World Health Organization; 2016. [cited 2017 Jun 1]. — Available from: http://www.who.int/tb/publications/global_report/en/
2. World Health Organization. Global strategy and targets for tuberculosis prevention, care and control after 2015: World Health Organization; 2015. — http://www.who.int/tb/post2015_strategy/en/
3. Kim H.W., Kim J.S. Treatment of Latent Tuberculosis Infection and Its Clinical Efficacy // Tuberculosis and Respiratory Disea–ses. — 2018. — 81(1). — 6-12. doi:10.4046/trd.2017.0052. — https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5771748/#B2
4. World Health Organization. Guidelines on the management of latent tuberculosis infection [Internet] Geneva: World Health Organization; 2015. [cited 2017 Jun 1]. — Available from: http://www.who.int/tb/publications/latent-tuberculosis-infection/en/
5. Dye C., Scheele S., Dolin P., Pathania V., Raviglione M.C. Consensus statement. Global burden of tuberculosis: estimated incidence, prevalence, and mortality by country. WHO Global Surveillance and Monitoring Project // JAMA. — 1999. — 282(7). — 677-686.
6. Iannone F., Cantini F., Lapadula G. Diagnosis of latent tuberculosis and prevention of reactivation in rheumatic patients receiving biologic therapy: international recommendations // J. Rheumatol. Suppl. — 2014 May. — 91. — 41-6. doi:10.3899/jrheum.140101. Review. PubMed PMID: 24788999.
7. Menzies D., Adjobimey M., Ruslami R. et al. Four Months of Rifampin or Nine Months of Isoniazid for Latent Tuberculosis in Adults // N. Engl. J. Med. — 2018 Aug 2. — 379(5). — 440-453. doi:10.1056/NEJMoa1714283. PubMed PMID: 30067931
8. Ahmad S. Pathogenesis, immunology, and diagnosis of latent Mycobacterium tuberculosis infection // Clin. Dev. Immunol. — 2011. — 2011. — 814943. doi: 10.1155/2011/814943
9. Ahmad S. New approaches in the diagnosis and treatment of latent tuberculosis infection // Respir Res. — 2010. — 11. — 169.
10. Comstock G.W., Livesay V.T., Woolpert S.F. The prognosis of a positive tuberculin reaction in childhood and adolescence // Am. J. Epidemiol. — 1974. — 99. — 131-8.
11. Vernon A. Treatment of latent tuberculosis infection // Semin. Respir. Crit. Care Med. — 2013 Feb. — 34(1). — 67-86. doi: 10.1055/s-0032-1333544. Epub 2013 Mar 4. Review. PubMed PMID: 23460007.
12. Фещенко Ю.І., Черенько С.О. Латентна туберкульозна інфекція: перебіг, діагностика, лікування // Здоров’я України. — 2014, квітень. — С. 30-31.
13. Matulis G. et al. Detection of latent tuberculosis in immunosuppressed patients with autoimmune diseases: performance of a Mycobacterium tuberculosis antigen-specific interferon gamma assay // Ann. Rheum. Dis. — 2008 Jan. — 67(1). — 84-90. Epub 2007 Jul 20. doi: 10.1136/ard.2007.070789
14. Мельник А.А. Диагностика латентной туберкулезной инфекции с использованием квантиферонового теста Quantiferon®-TB Gold // Лабораторна діагностика. — 2018. — 1(80). — 6-18.
15. Muñoz L., Gonzalez L., Soldevila L., Dorca J., Alcaide F., Santin M. QuantiFERON®-TB Gold In-Tube for contact screening in BCG-vaccinated adults: A longitudinal cohort study // PLoS One. — 2017 Aug 30. — 12(8). — e0183258. doi: 10.1371/journal.pone.0183258.
16. Yoshiyama T., Harada N., Higuchi K., Saitou M., Kato S. Use of the QuantiFERON®-TB Gold in Tube test for screening TB contacts and predictive value for active TB // Infect. Dis. (Lond.). — 2015 Aug. — 47(8). — 542-9. doi: 10.3109/23744235.2015.1026935. Epub 2015 Apr 22.
17. Nguyen D.T., Teeter L.D., Graves J., Graviss E.A. Characteristics Associated with Negative Interferon-γ Release Assay Results in Culture-Confirmed Tuberculosis Patients, Texas, USA, 2013–2015 // Emerging Infectious Diseases. — 2018. — 24(3). — 534-540. doi:10.3201/eid2403.171633
18. Kim C.H., Lim J.K., Yoo S.S., Lee S.Y., Cha S.I., Park J.Y., Lee J. Diagnostic performance of the QuantiFERON-TB Gold In-Tube assay and factors associated with nonpositive results in patients with miliary tuberculosis // Clin. Infect. Dis. — 2014 Apr. — 58(7). — 986-9. doi: 10.1093/cid/ciu045.
19. Bielecka T., Komorowska-Piotrowska A., Krenke K., Feleszko W., Kulus M. Is secretion of IFN-gamma in response to Mycobacterium tuberculosis antigens in youngest children sufficient to play a role in TB diagnostics? // Pediatr. Pulmonol. — 2018 Feb. — 53(2). — 181-188. doi: 10.1002/ppul.23910. Epub 2017 Nov 14.
20. Lombardi G., Petrucci R., Corsini I., Bacchi Reggiani M.L., Visciotti F., Bernardi F., Landini M.P., Cazzato S., Dal Monte P. Quantitative Analysis of Gamma Interferon Release Assay Response in Children with Latent and Active Tuberculosis // J. Clin. Microbiol. — 2018 Jan 24. — 56(2). pii: e01360-17. doi: 10.1128/JCM.01360-17.
21. Pourakbari B., Yousefi K., Mahmoudi S., Sadeghi R.H., Mamishi S. Evaluation of the QuantiFERON®-TB Gold In-Tube assay and tuberculin skin test for the diagnosis of latent tuberculosis infection in an Iranian referral hospital // Infect. Disord. Drug Targets. — 2018 Feb 28. doi:10.2174/1871526518666180228164036.
22. König Walles J., Tesfaye F., Jansson M. et al. Performance of QuantiFERON-TB Gold Plus for detection of latent tuberculosis infection in pregnant women living in a tuberculosis- and HIV-ende–mic setting // PLoS One. — 2018 Apr 4. — 13(4). — e0193589. doi: 10.1371/journal.pone.0193589.
23. LaCourse S.M., Cranmer L.M., Matemo D. et al. Effect of Pregnancy on Interferon Gamma Release Assay and Tuberculin Skin Test Detection of Latent TB Infection Among HIV-Infected Women in a High Burden Setting // J. Acquir. Immune Defic. Syndr. — 2017 May 1. — 75(1). — 128-136. doi: 10.1097/QAI.0000000000001298
24. Stout J.E., Wu Y., Ho C.S., Pettit A.C., Feng P.J., Katz D.J., Ghosh S., Venkatappa T., Luo R.; Tuberculosis Epidemiologic Studies Consortium. Evaluating latent tuberculosis infection diagnostics using latent class analysis // Thorax. — 2018 Jul 7. pii:thoraxjnl-2018-211715. doi: 10.1136/thoraxjnl-2018-211715.
25. James P.M., Ganaie F.A., Kadahalli R.L. The performance of quantiferon-TB gold in-tube (QFT-IT) test compared to tuberculin skin test (TST) in detecting latent tuberculosis infection (LTBI) in the presence of HIV coinfection in a high TB-burden area with BCG-vaccinated population // J. Int. Assoc. Provid. AIDS Care. — 2014 Jan-Feb. — 13(1). — 47-55. doi: 10.1177/2325957412469687.
26. Latorre I., Martínez-Lacasa X., Font R. et al. IFN-γ response on T-cell based assays in HIV-infected patients for detection of tuberculosis infection // BMC Infect. Dis. — 2010 Dec 10. — 10. — 348. doi: 10.1186/1471-2334-10-348. PubMed PMID: 21143955; PubMed Central PMCID: PMC3016378.
27. Khawcharoenporn T., Apisarnthanarak A., Phetsuksiri B., Rudeeaneksin J., Srisungngam S., Mundy L.M. Tuberculin skin test and QuantiFERON-TB Gold In-tube Test for latent tuberculosis in Thai HIV-infected adults // Respirology. — 2015 Feb. — 20(2). — 340-7. doi: 10.1111/resp.12442.
28. Shin H.J., Kim T.O., Oh H.J. et al. Impact of diabetes mellitus on indeterminate results of the QuantiFERON TB Gold In-Tube test: A propensity score matching analysis // PLoS One. — 2017 Jul 21. — 12(7). — e0181887. doi: 10.1371/journal.pone.0181887
29. Lee S.J., Lee S.H., Kim Y.E. et al. Risk factors for latent tuberculosis infection in close contacts of active tuberculosis patients in South Korea: a prospective cohort study // BMC Infect. Dis. — 2014 Nov 18. — 14. — 566. doi: 10.1186/s12879-014-0566-4.

/173-1.jpg)
/174-1.jpg)
/175-1.jpg)