Нейрогенний сечовий міхур (НСМ) — це загальне поняття, що об’єднує велику групу розладів резервуарної чи евакуаторної функцій сечового міхура (СМ), що розвиваються внаслідок ураження нервової системи на різних рівнях [1–5]. Під цим терміном розуміють цілу низку розладів функції СМ — від ізольованої гіпотонії детрузора СМ до детрузорно-сфінктерної дисенергії [2, 3, 5]. НСМ може розвиватися внаслідок вроджених чи набутих патологій: вроджених вад розвитку, запальних захворювань, травм [2, 4–6]. Однією з найчастіших причин вроджених нейрогенних розладів СМ є дефекти нервової трубки, або spina bifida. У світі spina bifida зустрічається з частотою від 0,3 до 4,5 на 1000 новонароджених. У США ця патологія є найпоширенішим нехромосомним уродженим дефектом, що викликає тяжку патологію декількох органів і систем [2–4, 7, 8].
Спинномозкова грижа, або spina bifida, — це вроджена аномалія розвитку спинного мозку та хребта, що виникає внаслідок порушення злиття каудального відділу невральної трубки в період ембріогенезу. Унаслідок цього формується дефект однієї чи більше хребцевих арок з формуванням грижового мішка зі спинномозкових оболонок, залученням спинного мозку і нервових корінців за межами спинномозкового каналу. Вираженість клінічних симптомів залежить від величини дефекту та його локалізації. Найпоширенішою та одночасно найтяжчою формою є мієломенінгоцеле. Розлади сечовипускання при мієлодисплазіях виникають при ураженні спинного мозку на рівні сегментів L1–S3, де розміщені основні центри сечовипускання [2, 8–10]. Загалом механізм регуляції наповнення та спорожнення СМ є досить складним і включає центри сечовипускання в головному мозку (так званий мостовий центр), спинному мозку і периферичну нервову систему [2, 3, 10].
Унаслідок пошкодження іннервації детрузора СМ та його зовнішнього сфінктера виникає не тільки нетримання сечі, а й ураження верхніх і нижніх сечовидільних шляхів (СВШ). Порушення здатності зберігати і виділяти сечу зумовлює підвищення внутрішньоміхурового тиску, що з часом може пошкоджувати стінку сечового міхура, нирок і викликати ниркову недостатність [4, 5, 8, 10–12]. Міхурово-сечовідний рефлюкс (МСР) та рецидивуючий пієлонефрит є основними причинами ниркової недостатності в ранньому віці та протягом життя, тоді як ускладнення внаслідок перенесеної інфекції СВШ переважають на першому році життя. Тривала обструкція випускного отвору СМ особливо в поєднанні з МСР спричиняє ураження нирок [4, 13, 14]. Розвиток вторинних захворювань сечовидільної системи (рецидивуючий хронічний цистит, міхурово-сечовідний рефлюкс, уретерогідронефроз, хронічний пієлонефрит) із часом призводять до нефросклерозу, артеріальної гіпертензії та розвитку ниркової недостатності [1, 3, 13]. Хоча рівень виживання дітей, народжених із спинномозковою грижею, покращився, ниркова недостатність як віддалене ускладнення, як і раніше, широко зустрічається і залишається основною причиною смерті, часто до настання повноліття [3, 12, 13]. Зокрема, Little та ін. (1994) описали випадки пересадки нирок у дітей із spina bifida, що підтверджує важливість даної проблеми [15]. Частота пошкодження нирок у дітей із детрузорно-сфінктерною дисенергією досягає 100 % з відсутності адекватної терапії. За різними даними, майже в третини хворих із відкритою формою spina bifida урологічна патологія є причиною захворюваності та смерті [1, 3, 4]. При цьому фетальна хірургічна корекція спинномозкової грижі покращує рухову функцію і зменшує тяжкість гідроцефалії, проте ефект щодо функції СВШ не такий однозначний [5].
За нормальних умов детрузор, шийка та зовнішній сфінктер СМ працюють як єдина функціональна система для адекватного утримання та ефективного виведення сечі. Мимовільне сечовипускання характерне для немовлят та дітей раннього віку до досягнення 3–5 років, у яких цей процес контролює тільки автономна частина нервової системи, а далі, з віком, акт сечовипускання стає контрольованим [2–5]. У здорових осіб тиск наповнення СМ, що визначається різницею між наповненим і порожнім СМ, у нормі є меншим за 10–15 см вод.ст. Нормальний тиск, при якому відбувається спорожнення СМ, для чоловіків і жінок становить від 50 до 80 і від 40 до 65 см водн.ст. відповідно [4].
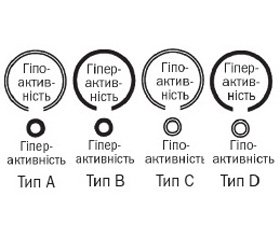
За даними уродинамічних досліджень, Мадерс–бахер описав чотири групи пацієнтів із НСМ [3, 4] (рис. 1):
— гіпоактивність детрузора з гіперактивністю сфінктера (тип А);
— гіперактивність детрузора з гіперактивністю сфінктера (тип В);
— гіпоактивність детрузора з гіпоактивністю сфінктера (тип С);
— гіперактивність детрузора з гіпоактивністю сфінктера (Тип D).
З усіх чотирьох типів тільки поєднання гіпофункції сфінктера та детрузора (тип С) вважається безпечним і таким, що не призводить до пошкодження СВШ. Хоча нетримання сечі, що має місце в даному випадку, може бути причиною збільшення частоти інфекцій СВШ. Європейська асоціація урологів рекомендує модифіковану функціональну класифікацію Мадерсбахера для оцінки функції нижніх СВШ та адекватного призначення терапії в кожному випадку [3, 4].
Детрузорно-сфінктерна дисенергія (ДСД) — скорочення детрузора одночасно з мимовільним скороченням уретри. При наявності ДСД сечовий міхур вважається «небезпечним», тобто таким, що вимагає початку активної терапії [2, 3].
Діагностика НСМ у дітей старшого віку повин–на починатися з вивчення щонайменше протягом 3 днів поспіль спеціального щоденника сечовипускань, або карти частоти/об’єму сечовипускань. Він має містити дані про час і об’єм виділеної або катетеризованої сечі. На основі цього щоденника можна встановити три основні параметри: частота сечовипускань за 24 год, максимальний виділений об’єм, що свідчить про анатомічну місткість СМ і функціональну ємкість, яка визначається середнім об’ємом виділеної чи катетеризованої сечі [3]. Ведення такого щоденника є надійним та неінвазивним методом діагностики. Даний щоденник повинен заповнюватися кожного разу перед плановим оглядом в уролога чи при погіршенні стану дитини. Для визначення нормальної місткості СМ залежно від віку використовують різні формули. Однією з поширених є формула Hjälmås: об’єм (мл) = 30 × [вік (у роках) + 1] [3].
Лабораторно-інструментальне обстеження дітей повинно включати загальний аналіз сечі, з бактеріологічним дослідженням при потребі, оцінку азотовидільної функції нирок (уміст креатиніну та сечовини), УЗД нирок і сечового міхура. При потребі використання екскреторної урографії, КТ тощо. Обсяг обстежень залежить від кожного конкретного випадку [2, 3, 10].
Діагноз нейрогенного сечового міхура та визначення його дисфункціонального типу встановлюють за допомогою уродинамічних досліджень. Саме з їх допомогою можна підтвердити порушення функції СМ та сфінктерів уретри, у той час як інші тести використовуються для оцінки типу та тяжкості ускладнень, викликаних ней–рогенною дисфункцією сечової системи [3, 4]. У дітей, привчених до туалету, проведення нейроурологічної оцінки має починатися з урофлоуметрії, що вимірює швидкість сечовипускання. Для оцінки ефективності сечовипускання визначається кількість залишкової сечі в міхурі після сечовипускання (у нормі не більше 5 мл) за даними ультразвукового дослідження. При необхідності рекомендуються більш складні уродинамічні тести, такі як цистометрія, та інші [2, 3 ,10]. Рівень внутрішньоміхурового тиску є важливим показником стану СМ.
Сечовий міхур вважається «небезпечним», коли внутрішньоміхуровий тиск становить більше ніж 40 см вод.ст. або виявлено сфінктерно-детрузорну дисенергію.
Уперше уродинамічне дослідження має проводитися не раніше 2–3-го місяця життя. Це пов’язано з тим, що після закриття спини статус тазового дна може змінитися від паралізованого до гіперактивного протягом перших 2–3 місяців життя [3, 16]. Також чим менша дитина, тим вищий ризик того, що механічні фактори (обструкція вихідного отвору сечового міхура катетером, що використовується для дослідження) можуть призводити до помилкових результатів (підвищений тиск витікання) [4]. З віком контрольні уродинамічні дослідження проводяться у зв’язку з можливістю вторинного неврологічного погіршення внаслідок розвитку синдрому фіксованого спинного мозку (тетеринг-синдром), особливо в перші 6 років життя [3, 16]. При цьому в майже третини осіб урологічні розлади є першими симптомами розвитку цього синдрому [5].
Альтернативним неінвазивним методом діагностики в майбутньому може бути еластографія сечового міхура. У даний час проводяться клінічні випробування щодо її ефективності [5].
Терапія НСМ є складним і комплексним процесом. Виділяють три основні цілі лікування НСМ у дітей із spina bifida:
— оптимізація спорожнення сечового міхура;
— профілактика ураження верхніх та нижніх СВШ;
— досягнення утримання сечі та покращення якості життя [3–5, 10].
Загалом вони змінюються з віком. Стартова терапія новонародженого зосереджена насамперед на збереженні функції нирок. У шкільному віці, окрім збереження нирок, важливого значення набувають утримання сечі та випорожнень. Для цієї категорії пацієнтів залишатися сухими має важливе соціально-психологічне значення, що значною мірою відображає якість життя. Для підлітків і дорослих важливою метою стає незалежність та сексуальна функція. Перехід до дорослого життя є надзвичайно складним для таких хворих. Однією з причин є зміна дитячого уролога та медичної сестри на спеціалістів, які працюють з дорослими [3–5, 8].
Усі методи терапії можна поділити на консервативні та хірургічні. Перевага надається консервативному лікуванню. Дві найважливіші форми консервативного лікування НСМ у дитини зі spina bifida — це чиста періодична катетеризація (ЧПК) та фармакотерапія функціональних розладів, підтверджених уродинамічними дослідженнями [3–5, 7, 8, 10, 11].
Чиста періодична катетеризація чи самокатетеризація (ЧПСК) в поєднанні з антихолінергічними препаратами (оксибутинін) є стандартом терапії для дітей із НСМ із гіперактивністю детрузора та з детрузорно-сфінктерною дисенергією або без неї [4, 5, 16]. Проведення ЧПК є доступним і ефективним методом для країн, що розвиваються [3, 4, 7, 18]. Препаратом вибору при гіперактивності детрузора є оксибутинін. Він може вводитися перорально, а при наявності побічних ефектів перевага надається внутрішньоміхуровому введенню, і лише після цього вирішується питання хірургічного втручання [3, 4, 7, 10].
Вперше періодична катетеризація була представлена в 1970-х роках Джеком Лапідешем. Цей метод є простим і ефективним способом досягнення всіх цілей лікування, згаданих вище [11]. Регулярне проведення ЧПК від періоду новонародженості має низку переваг: достатнє спорожнення сечового міхура, при якому немає затримки залишкової сечі, а отже, і відсутній ризик інфікування; мінімізація МСР шляхом зменшення тиску в СМ; із віком це також один з основних механізмів для утримання дитини «сухою» [3, 4, 10, 13]. Після широкого практичного впровадження ЧПК було досягнуто довготривалий успіх у профілактиці МСР та гідронефрозу, зменшилися частота проведення аугментації СМ та післяопераційна смертність внаслідок ниркової недостатності [5, 10]. За даними багатьох дослідників, використання різних матеріалів чи технік для ЧПК не впливає на ефективність та безпеку, доки застосовуються такі основні принципи: належне навчання та тренування, чисте та атравматичне введення, а також належне дотримання цих правил пацієнтом на довготривалій основі [4].
Важливим є те, що інтермітуюча катетеризація проводиться з певною частотою щодня батьками чи опікуном, а з віком дитина повинна навчитися проводити її самостійно (ЧПСК). У багатьох краї–нах ЧПК успішно проводиться батьками новонароджених та дітей грудного віку, і ця процедура стає частиною їх повсякденного життя. Деякі дослідники надають перевагу початку ЧПК починаючи з періоду новонародженості, аргументуючи це тим, що після досягнення 3-річного віку ЧПК буде необхідна для більшості дітей, щоб забезпечити утримання сечі, та можливі труднощі, котрі виникнуть при початку терапії в цьому віці. Так, ранній початок ЧПК покращує сімейний комплайєнс та здатність батьків допомагати дитині в боротьбі зі своїм захворюванням та з самою процедурою [3, 4, 13].
Самостійного проведення ЧПК можна успішно навчити хлопчиків та дівчаток, які мотивовані і піддаються навчанню, в основному у віці до 6 років. Бажано, щоб дитина оволоділа навиком самокатетеризації до початку навчання в школі, для того щоб він/вона могли проводити ЧПК самостійно під час занять. Необхідна частота катетеризації залежить від кількох факторів: споживання рідини, місткості сечового міхура, тиску наповнення/спорожнення сечового міхура. Практично рекомендується проводити катетеризацію шість разів на день дітям раннього віку і п’ять разів на добу дітям шкільного віку. Хоча повідомляється про випадки розвитку інфекції СВШ унаслідок катетеризації, проте загалом вважається, що цей ризик є низьким за умови досягнення повного спорожнення СМ. Крім того, за даними різних досліджень, навіть повторне використання матеріалів (катетерів) не пов’язане зі збільшенням частоти інфекцій сечових шляхів і широко використовується в країнах Африки [4, 10, 18]. Повторне використання катетера, що очищується після кожного використання, допускається протягом одного тижня в країнах із низьким прибутком [10]. Виникнення симптоматичних інфекції переважно спричинене непов–ним спорожненням СМ і потребує оптимізації техніки проведення ЧПК. Необхідними умовами для профілактики стриктур уретри та несправжнього пасажу у хлопчиків є застосування катетерів із лубрикантами та уникнення насильницьких маніпуляцій під час введення катетера. В ідеальних умовах для кожної катетеризації повинен використовуватися новий одноразовий катетер як для хлопчиків, так і для дівчаток.
Загалом усім пацієнтам, які знаходяться на ЧПК, проводиться хіміопрофілактика уросептиками в низьких дозах, переважно триметопримом 2 мг/кг на добу. При загостренні інфекції використовують антибіотикотерапію. Багато центрів зупиняють профілактику після 1-річного віку, приблизно в 50 % хворих зростання частоти інфікування СВШ відсутнє [3]. Згідно з протоколом Міжнародної федерації spina bifida та гідроцефалії для країн, що розвиваються (2005), тривалість хіміопрофілактики ко-тримоксазолом (20 ± 4 мг/кг/добу за сульфаметоксазолом та триметопримом відповідно) має становити 2 місяці [19]. На даний час проводяться дослідження для порівняння частоти інфекцій СВШ у дітей на ЧПК із хіміопрофілактикою та без неї [3].
Нейрогенна дисфункція кишечника із запорами й нетриманням випорожнень може перешкоджати успішному проведенню ЧПК. Накопичені фекалії механічно заважають наповненню СМ, збільшують його подразливість. Нетримання випорожнень збільшує ризик забруднення СМ та розвиток інфекцій СВШ. Тому ефективна терапія розладів кишечника є важливою для профілактики ураження нирок. Також з урахуванням високої поширеності латексної алергії у популяції spina bifida повинні використовуватися лише безлатексні матеріали [2, 4].
Терапія НСМ залежить від його дисфункціонального типу. Найлегшим для лікування вважається тип А (гіпофункція детрузора + гіперфункція сфінктера). Цей тип НСМ потребує раннього лікування через затримку сечі, високий тиск наповнення і безперервне протікання. В цьому випадку ефективною є ЧПК. Її проведення робить сечовий міхур «безпечним», знижує частоту інфекцій СВШ, і не менш важливим є те, що дитина залишається сухою. Повне спорожнення сечового міхура є вкрай важливим для уникнення його інфікування внаслідок утримання залишкової сечі.
Дисфункціональний тип В (гіперактивність детрузора + гіперактивність сфінктера) характеризується високим тиском наповнення та спорожнення СМ, що є надзвичайно небезпечним від народження внаслідок ДСД. У даному випадку застосування оксибутиніну дозволяє фармакологічно корегувати гіперактивний детрузор до неактивного резервуара (ситуація, аналогічна типу А), що спорожнюється за допомогою ЧПК.
При типі С (гіпоактивність детрузора + гіпоактивність сфінктера) ЧПК знижує ступінь нетримання сечі та дозволяє зменшити частоту інфекцій СВШ. Із віком при цьому типі НСМ для досягнення утримування сечі діти потребують хірургічної корекції функції зовнішнього сфінктера. Важливим застереженням тут є те, що нестабільність детрузора може з’явитися лише після хірургічного втручання та покращення функції вихідного отвору СМ. При відсутності вчасної діагностики та терапії (рекомендується оксибутинін) оперативне втручання може перетворити «вологий, але безпечний» СМ у «сухий, але небезпечний».
При останньому дисфункціональному типі D (гіперактивність детрузора + гіпоактивність сфінктера) спостерігається нетримання сечі через нестабільність детрузора. Поступово цей тип стає небезпечним у зв’язку з розвитком вторинних змін стінки СМ, а саме гіпертрофії детрузора та втрати адаптації СМ. Таким чином, лікування полягає у проведенні ЧПК у поєднанні з оксибутиніном і в пізнішому віці хірургічної реконструкції СМ [3, 4, 7].
Після призначення відповідної терапії необхідним є подальший нагляд, а при необхідності корекція ведення пацієнта (частота проведення ЧПК, дозування та спосіб введення ліків). Ефективність лікування можна оцінити, використовуючи клінічні параметри (включаючи частоту та об’ємні карти ЧПК), аналіз сечі, ультразвукове дослідження нирок та сечового міхура, рентгенівську цистографію, цистометрію та інші уродинамічні дослідження. Усі діти з spina bifida мають оглядатися після народження, далі в 3, 6 місяців, 1 рік і далі щорічно. У дітей старше 3 років, у яких на фоні ЧПК не досягнуто утримання сечі, рекомендують розпочати прийом оксибутиніну [19].
Початок терапії. Терміни і порядок медичних втручань, а також оптимальний протокол моніторингу залишаються суперечливими. Загалом виділяють два основних підходи — очікувальний та активний. Частина фахівців виступають за спостереження, інші вважають, що профілактичне проведення ЧПК та антихолінергічна терапія можуть запобігти розвитку ускладнень [5, 8, 10, 20].
Терапія очікування. Очікувальний підхід є більш консервативним. Прихильники цього варіанта терапії припускають, що < 10 % дітей із вродженим НСМ можуть самостійно контролювати сечовий міхура без необхідності ЧПК. Пацієнтам періодично проводять клінічний огляд та УЗД для контролю розвитку ураження СВШ. Уродинамічні дослідження та ЧПК із фармакотерапією (антихолінергічні препарати) чи без неї використовують тільки при клінічному погіршенні або розвитку гідронефрозу. При необхідності ЧПК розпочинають у період привчання до туалету [3, 8]. Прибічники цього підходу стверджують, що активна терапія повинна починатися з появою ознак та симптомів захворювання. Вони вважають, що зміни верхніх сечовидільних шляхів можуть бути оборотними і що цей підхід допомагає уникати сімейного стресу, пов’язаного з активною терапією [8, 20]. Зокрема, за різними даними, у 69–92 % пацієнтів із міхурово-сечовідним рефлюксом або гідронефрозом без рефлюксу зміни були оборотними після початку ЧПК з фармакотерапією або без неї [8]. Оскільки прихильники очікувального підходу вважають, що первинною метою терапії є уникнення ушкодження нирок, то лише результати сканування нирок можуть визначити ефективність терапії. Одним із досліджень на користь цього підходу є дослідження, проведене Woo та ін. Автори визначили, що початок ЧПК при народженні не зменшує швидкість виникнення фіброзу кіркової речовини за результатами сканування нирок [8, 21].
Активний підхід. Даний метод є найбільш популярним. Визначення активного підходу істотно відрізняється в літературі. Найчастіше активний підхід полягає в ранньому й регулярному уродинамічному тестуванні. В ідеалі ЧПК з фармакотерапією або без неї розпочинається до розвитку патологічних змін у верхніх СВШ і сечовому міхурі [3, 4, 8]. Таким чином, задовго до того, як утримання сечі стає проблемою, починаючи з першого року життя, терапія спрямована на постійне підтримання низького тиску в сечовому міхурі та повне і безпечне його спорожнення. У новонароджених дітей зі spina bifida функція і структура органів СВШ не порушені, тому вважається, що підтримка низького внутрішньоміхурового тиску має визначальне значення для профілактики ураження сечового міхура і нирок [3, 10].
До групи пацієнтів із високим ризиком, яким рекомендовано негайно розпочати активну терапію, відносять тих, у кого тиск у сечовому міхурі становить більше ніж 40 см вод.ст. або виявлено сфінктерно-детрузорну дисенергію.
Ранній початок ЧПК краще переноситься, зменшує необхідність хірургічної реконструкції СМ та має критичне значення для тривалості і якості життя [3, 4, 7, 8, 10]. Також, за деякими дослідженнями, прийом антихолінергічних препаратів зменшує проліферацію гладком’язових клітин СМ і таким чином запобігає стійким органічним змінам [8, 22]. Проте ці дані є недостатньо обґрунтованими, оскільки антихолінергічні препарати не впливають на основну причину, а неврологічна гіперактивність детрузора негайно повертається після припинення тривалого прийому оксибутиніну [23].
За даними Едельштайн та ін., при активному підході ризик виникнення ускладнень з боку верхніх СВШ та потреба в хірургічному лікуванні знижувалися, а погіршення стану з часом було лише в 3 із 20 осіб. Тоді як в групі очікування у 80 % виникали зміни СВШ, 14 % потребували реконструктивної хірургії і 5 % почали активно проводити ЧПК [8].
Згідно з даними P. Dik та ін. (2006), ранній початок ЧПК та/чи антихолінергічних препаратів допомагає максимально зберегти функцію нирок. Зокрема, при спостереженні протягом 13 років 144 дітей із spina bifida у 48 % спостерігався гіперактивний сфінктер, у 19 % — міхурово-сечовідний рефлюкс і в 4 % виявлено фіброз нирок. У жодного пацієнта не було останньої стадії ниркової недостатності. Усі пацієнти зі spina bifida aperta почали ЧПК й антихолінергічну терапію незабаром після народження. П’ять із шести пацієнтів із фіброзом нирок почали проведення ЧПК та антихолінергічну терапію (оксибутинін) через кілька місяців після народження. Шістдесят три із 82 дітей зі spina bifida були «сухими» на момент шкільного віку (із 6 років), ще 37 пацієнтів не потребували хірургічної корекції [13].
Інше дослідження, що свідчить на користь активного підходу, проведене Kurzrock і Polse [24]. Ними встановлено, що селективні уродинамічні дослідження можуть допомогти ідентифікувати пацієнтів з високим ризиком розвитку ураження нирок. У хворих, яким проводилися уродинамічні дослідження, але ЧПК починалася тільки при нетриманні сечі, рецидивуючих інфекціях, неповному спорожненні СМ або змінах верхніх СВШ, у 8 % випадків сформувався фіброз нирок.
Висновки
Застосування ЧПК та антихолінергічної терапії є ефективним засобом для збереження функції нирок та утримання дитини сухою в більше як у 90 % випадків НСМ. Рання діагностика та лікування задовго до того, як утримання сечі стає проблемою в дітей 1–3 років життя, може запобігти як пошкодженню нирок, так і вторинним змінам стінки верхніх і нижніх СВШ, тим самим покращити довгостроковий прогноз. У країнах із низьким рівнем доходів допускається повторне використання одного і того ж катетера протягом тижня. Порівняно з оральним прийомом внутрішньоміхурове введення оксибутиніну має більш потужний та триваліший ефект пригнічення детрузора, кращу переносимість, йому повинна надаватися перевага, перш ніж дитині буде проведена реконструктивна хірургія. Основними цілями урологічної терапії повинні бути забезпечення нормального росту нирок і сечового міхура згідно з віком, збереження безпечного тиску в СМ (менше 30 мм вод.ст.), утримання дитини сухою та покращення якості життя [4, 5, 10].
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Зоркин С.Н. Нейрогенный мочевой пузырь у детей. Возможности фармакотерапии / С.Н. Зоркин, Т.Н. Гусарова, С.А. Борисова // Лечащий врач. — 2009. — № 1. — С. 42-44.
2. Наконечний А.Й. Нейрогенні розлади функцій сечового міхура / А.Й. Наконечний, Д.Д. Іванов, Р.А. Наконечний // Новости медицины и фармации. — 2010. — № 8 (321).
3. Kroll P. Pharmacotherapy for Pediatric Neurogenic Bladder / P. Kroll // Pediatric Drugs. — 2017. — Vol. 19, № 5. — P. 463-478. doi: 10.1007/s40272-017-0249-x.
4. Verpoorten C. The neurogenic bladder: medical treatment / C. Verpoorten, G.M. Buyse // Pediatric Nephrology. — 2008. — № 23. — Р. 717-725. DOI: 10.1007/s00467-007-0691-z.
5. Sturm R.M. The management of the pediatric neurogenic bladder / R.M. Sturm, E.Y. Cheng // Current bladder dysfunction reports. — 2016. — № 11. — P. 225-233. doi: 10.1007/s11884-016-0371-6.
6. Медикаментозная и немедикаментозная терапия последствий взрывно-осколочного ранения позвоночника у ребенка с ушибом спинного мозга и нарушением функции тазовых органов / С.К. Евтушенко, С.П. Дубина, О.С. Евтушенко, Н.В. Яновская // Современная педиатрия. — 2015. — № 6 (70). — С. 40-42. DOI: 10.15574/SP.2015.70.40.
7. Treatment of the neurogenic bladder in spina bifida / Tom P.V.M. de Jong, R. Chrza, A.J. Klijn, P. Dik // Pediatric Nephro–logy. — 2008. — № 23. — P. 889-896. DOI: 10.1007/s00467-008-0780-7.
8. Snow-Lisy D.C. Update on urological management of spina bifida from prenatal diagnosis to adulthood / D.C. Snow-Lisy, E.B. Yerkes, E.Y. Cheng // The Journal of Urology. — 2015. — Vol. 194, № 2. — P. 288-296. DOI: 10.1016/j.juro.2015.03.107.
9. Дубина С.П. Диагностика и терапия энуреза у детей (научный обзор и личные наблюдения) / С.П. Дубина, О.С. Евтушенко, С.К. Евтушенко // Міжнародний неврологічний журнал. — 2013. — № 6 (60). — С. 114-120.
10. Maison P.O.M. The management of paediatric neurogenic bladder: an approach in a resource-poor setting / P.O.M. Maison, J. Lazarus // Paediatrics and International Child Health. — 2017. — Vol. 37, № 4. — P. 280-285. DOI: 10.1080/20469047.2017.1351745.
11. Clean, intermittent self-catheterization in the treatment of urinary tract disease / J. Lapides, A.C. Diokno, S.J. Silber, B.S. Lowe // The Journal of Urology. — 2017. — Vol. 197, № 2. — P. 122-124. DOI: https://doi.org/10.1016/j.juro.2016.10.097.
12. Kancherla V. Population-based study to determine morta–lity in spina bifida: New York State congenital malformations registry, 1983 to 2006 / V. Kancherla, C.M. Druschel, G.P. Oakley // Clinical and Molecular Teratology. — 2014. — Vol. 100, № 8. — P. 563-575. doi: 10.1002/bdra.23259.
13. Early start to therapy preserves kidney function in spina bifida patients / P. Dik, A.J. Klijn, J.D. van Gool, C.C. de Jong-de Vos van Steenwijk, T.P. de Jong // European Urology. — 2006. — Vol. 49, № 5. — P. 908-913. DOI: 10.1016/j.eururo.2005.12.056.
14. Gordon I. Vesico-ureteric reflux, urinary-tract infection, and renal damage in children / I. Gordon // The Lancet. — 1995. — Vol. 346, № 8973. — P. 489-490.
15. Renal transplantation in patients with spina bifida / D.M. Little, M.J. Gleeson, D.P. Hickey, M.G. Donovan, D.M. Murphy // The Urology. — 1994. — № 44. — P. 319-321.
16. International children’s continence society’s recommendations for initial diagnostic evaluation and follow-up in congenital neuropathic bladder and bowel dysfunction in children / S.B. Bauer, P.F. Austin, Y.F. Rawashdeh, T.P. de Jong, I. Franco, C. Siggard et al. // Neurourology and Urodynamics. — 2012. — № 31. — P. 610-614. DOI: 10.1002/nau.v31.5.
17. Frimberger D. The current management of the neurogenic bladder in children with spina bifida / D. Frimberger, E. Cheng, B.P. Kropp // Pediatric Clinics of North America. — 2012. — Vol. 59, № 4. — Р. 757-767. doi: 10.1016/j.pcl.2012.05.006. Epub 2012 Jun 22.
18. Schlager T.A. Effects of single-use sterile catheter for each void on the frequency of bacteriuria in children with neurogenic bladder on intermittent catheterization or bladder emptying / T.A. Schlager, M. Clark, S. Anderson // Pediatrics. — 2001. — Vol. 108, № 4. — P. 71-74. DOI: 10.1542/peds.108.4.e71.
19. Protocol for the management of neurogenic bladder for children in developing countries [Internet] / C. Verpoorten, M. Oneko, L. MacGowan, B.C. Warf // Available from: https://www.ifglobal.org/images/neurogenic-bladder-protocol.pdf.
20. Predictors of parenting stress in mothers of children with spina bifida / Y. Kanaheswari, N.N. Razak, V. Chandran, L.C. Ong // Spinal Cord. — 2011. — Vol. 49, № 3. — P. 376-380. doi: 10.1038/sc.2010.125.
21. Early clean intermittent catheterization may not prevent dimercaptosuccinic acid renal scan abnormalities in children with spinal dysraphism / J. Woo, K. Palazzi, J. Dwek, G. Kaplan, G. Chiang // Journal of Pediatric Urology. — 2014. — № 10. — P. 274-277. doi: 10.1016/j.jpurol.2013.09.001.
22. Oxybutynin chloride inhibits proliferation and suppresses gene expression in bladder smooth muscle cells / J.M. Park, S.B. Bauer, M.R. Freeman, C.A. Peters // The Journal of Urology. — 1999. — Vol. 162, № 3. — P. 1110-1114. DOI: 10.1097/00005392-199909000-00048.
23. Detrusor overactivity in spina bifida: how long does it need to be treated? / E. Ab, P. Dik, A.J. Klijn, J.D. van Gool, T.P. de Jong // Neurourology and Urodynamics. — 2004. — № 23 (7). — P. 685-688. DOI: 10.1002/nau.20044.
24. Kurzrock E.A. Renal deterioration in myelodysplastic children: urodynamic evaluation and clinical correlates / E.A. Kurzrock, S. Polse // The Journal of Urology. — 1998. — № 159. — С. 1657-1661. DOI: 10.1097/00005392-199805000-00084.

/92-1.jpg)