Введение
Марганец (Mn) и цинк (Zn) являются важнейшими элементами как макро-, так и микроорганизмов, а металлопротеины, содержащие Mn или Zn, участвуют в многочисленных физиологических процессах — от фотосинтеза и защиты клеток от деструктивного действия факторов оксидативного стресса до репликации ДНК [11, 12, 44, 45]. Поэтому изменение в уровне обеспечения патогенных бактерий данными микроэлементами может существенным образом предопределять течение инфекционного процесса.
Марганец
Бактериальные патогены используют ионы марганца как протектор, который предохраняет микроорганизм от радикальных соединений, которые генерируются макроорганизмом при инфекционном процессе [4], и от внеклеточного протеина — кальпротектина [14]. Соединения с двухвалентным марганцем (Mn2+) хорошо растворимы в воде, но соединения с более окисленными формами магния Mn3+, Mn4+ представляют собой нерастворимые соли. Многочисленные микроорганизмы катализируют ферментативное окисление Mn2+ до Mn3+, снижая неблагоприятное действие радикальных соединений и предупреждая поражение клеточных структур [21].
Обмен марганца у бактерий
Сенсинг и импорт ионов двухвалентного Mn патогены осуществляют при помощи молекул транспортеров: грамотрицательные бактерии импортируют марганец H+-зависимым транспортером (manganese transporter, H+-dependent — MntH/natural resistance-associated macrophage protein 1 — Nramp1) и АТФ-связывающими кассетными транспортерами (ATP-binding cassette — ABC) MntABC, SitABCD. Причем механизм транспорта марганца через наружную мембрану грамотрицательных бактерий до настоящего времени остается неизвестным. Грамположительные бактерии импортируют марганец транспортерами MntH или MntABC (рис. 1) [22, 32].
Транспортеры MntH являются представителями Mn2+-чувствительного субсемейства репрессора дифтерийного токсина (Mn2+-sensing subset of the diphtheria toxin Repressor — DtxR), идентифицированы у нескольких грамположительных бактерий как металлофоры. Димер MntR высокоселективно связывается с четырьмя ионами Mn2+ (MntR2: Mn4) на A и C сайтах каждого протомера, что способствует повышению активности связывания с ДНК. Протеины семейства MntH кроме Mn2+ переносят ионы и других металлов: Fe2+, Co2+ и Ni2+ [11, 21, 45]. Также сидерофоры транспортируют ионы марганца, но в отличие от металлопротеинов, специфично связывающих марганец, они переносят трехвалентные ионы марганца. Установлено, что пиовердин PVDMnB1 бактерий штамма Pseudomonas putida, обладающий всеми качествами сидерофора, отличается тем, что его уровень аффинитета к ионам Mn3+ почти в 1000 раз выше, чем к ионам Fe3+ [33]. Также пиовердины других бактерий и ризоферрин обладают большим аффинитетом к ионам Mn3+, чем к Fe3+ [34].
Избыток марганца
Установлено, что увеличение содержания марганца в диете может привести к летальному течению инфекции, вызванной бактериями Staphylococcus aureus. В частности, высокий уровень содержания Mn в диете у мышей, инфицированных бактериями Staphylococcus aureus, приводит к развитию летального бактериального эндокардита [22]. Уменьшение доступности ионов марганца, вероятно, может привести к снижению жизнеспособности патогенных бактерий.
Цинк
Цинк содержится примерно в 5–6 % бактериальных протеинов и используется в качестве кофактора многочисленных ферментов [9]. Острое воспаление индуцирует перераспределение Zn: большая часть ионов Zn транслоцируется из сыворотки крови в ткань печени, где участвует в продукции острофазовых белков. Снижение уровня концентрации Zn в сыворотке крови препятствует развитию системного инфекционного процесса [14]. Дефицит Zn приводит к нарушению многих биохимических процессов бактерии, а избыточный уровень концентрации Zn оказывает токсическое действие на патогенные бактерии [30].
Обмен цинка у бактерий
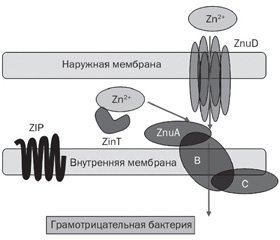
Большинство бактерий для обеспечения цинком использует транспортную систему ZnuABC. Высокоаффинные АВС-Zn-транспортеры состоят из периплазматического или внеклеточного солютабного протеина (субъединицы А, протеина связывания с солютабными веществами (solute-binding protein — SBP); трансмембранной пермеазы (субъединицы В) и цитоплазматической АТФазы (субъединицы C). Бактериальный Zn-специфический АВС-транспортер кодируется ZnuABC. Грам–отрицательные бактерии обладают особыми цинк-связывающими белковыми образованиями наружной мембраны — ZnuD, которые напоминают порины и участвуют в поглощении Zn2+ (рис. 2) [9–11, 15, 31]. Вспомогательным элементом транспортера ZnuABC у некоторых грамотрицательных бактерий, например Salmonella enterica, является протеин ZinT. Система поглощения цинка ZnuABC используется при очень низком содержании ионов цинка. В менее экстремальных условиях, когда концентрация Zn в окружающей среде достаточно высокая, поглощение Zn обеспечивается низкоаффинными транспортерами, например протеинами семейства ZIP (ZRT, IRT-подобного белка — ZRT, IRT-like protein) [44].
/100-1.jpg)
Лимитирование доступности марганца и цинка для бактериальных агентов
Макроорганизм во время инфекционного процесса ограничивает доступность марганца для бактериальных патогенов при помощи Mn2+-связывающего гетеродимера S100A8/S100A9 — кальпротектина [14]. Кальпротектин представляет собой нейтрофильный протеин, который может хелатировать Mn2+, Zn2+, конкурируя с бактериальными патогенами за данные элементы, и способствовать разрешению заболевания. Кальпротектин высвобождается в очень высоких концентрациях во время образования нейтрофильных внеклеточных ловушек [1, 13]. Кальпротектин ингибирует рост бактерий Staphylococcus aureus за счет секвестрации цинка [23, 28]. Ahmed Achouiti и соавт. [1] показали, что у нокаутных мышей mrp14–/–, не способных продуцировать кальпротектин, наблюдается более высокая бактериальная нагрузка и снижение уровня выживаемости при инфекции, вызванной бактериями Klebsiella pneumoniae. У данных мышей отмечается уменьшение активности образования нейтрофильных внеклеточных ловушек и фагоцитоза бактерий Klebsiella pneumoniae. Применение экзогенного рекомбинантного гетеродимера предотвращает рост колоний бактерий Klebsiella pneumoniae. Однако кальпротектин может и способствовать развитию инфекции, в частности, пневмонии, вызванной бактериями Streptococcus pneumoniae, Staphylococcus aureus, Pseudomonas aeruginosa [2, 43]. Присутствие кальпротектина способствует совместной колонизации бактериями Staphylococcus aureus, Pseudomonas aeruginosa ткани легкого мышей [43].
Препараты цинка
Эффективность применения препаратов цинка была широко изучена при различных инфекционных заболеваниях. Согласно результатам нескольких исследований, применение препаратов цинка внутрь способствует сокращению продолжительности тяжелой пневмонии у детей (табл. 1) [15, 37].
Известно, что ионы Zn связываются с некоторыми антибиотиками, в том числе с различными β-лактамными антибиотиками, аминогликозидами, макролидами, ванкомицином, фторхинолонами и другими. Связывание Zn с большинством антибиотиков усиливает их активность, исключение составляют пенициллин и тетрациклин (табл. 2) [35].
Препараты нанокомпозитов
Исследования последних лет показали, что наночастицы металлов, в том числе марганца и цинка, представляют собой потенциальные антибактериальные лекарственные средства, которые могут действовать и на антибиотикорезистентные бактерии, используя различные механизмы влияния (табл. 3) [3, 18, 42].
Установлено, что нанокомпозиты диоксида марганца (MnO2) и триоксида марганца (Mn2O3), легированные серебром, обладают выраженным антибактериальным действием на грамположительные (Staphylococcus aureus ATCC 6538, Streptococcus epidermis ATCC 12228, Bacillus subtilis ATCC 6633) и грамотрицательные бактерии (Klebsiella pneumoniae ATCC 1003, Escherichia coli ATCC 8739, Salmonella abony NCTC 6017). Причем нанокомпозиты MnO2 вызывают более выраженный антибактериальный эффект, чем наночастицы Mn2O3 [25].
Из соединений цинка в нанотехнологиях преимущественно используют оксид цинка (ZnO), который характеризуется высокой степенью биосовместимости. Установлено, что наночастицы ZnO обладают антимикробным действием против грамположительных и грамотрицательных бактерий. Нанокомпозиты ZnO также проявляют избирательную токсичность по отношению к нормальным (нейронам, эпителиоцитам) и раковым клеткам. Основными механизмами антибактериального действия наночастиц ZnO являются индукция АКМ и высвобождение Zn2+. Ионы Zn2+, высвобождаемые из наночастиц ZnO, повреждают клеточную мембрану и взаимодействуют с внутриклеточными компонентами, что приводит к подавлению активности метаболических путей бактерий [20, 24, 27].
В качестве одного из препаратов сферы фитонанотерапии Priyabrata Thatoi и соавт. [41] синтезировали при помощи зеленого синтеза наночастицы ZnO в сочетании с экстрактами мангровых растений Sonneratia apetala и Heritiera fomes, продемонстрировавшие высокую антибактериальную и противовоспалительную активность.
Выводы
Марганец и цинк играют определенную роль в инфекционном процессе: изменение концентрации этих ионов может модифицировать течение заболевания. Так, избыток марганца в диете может стать фактором, который отягощает течение заболевания. Применение препаратов цинка предотвращает развитие и способствует более легкому течению острых инфекционных респираторных заболеваний. Разработка новых нанокомпозитов марганца, цинка и нанофитопрепаратов может стать одним из эффективных способов лечения инфекционных заболеваний респираторного тракта, вызванных антибиотикорезистентными бактериальными штаммами.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Achouiti A. Myeloid-related protein-14 contributes to protective immunity in gram-negative pneumonia derived sepsis / A. Achouiti, T. Vogl, C.F. Urban et al. // PLoS Pathog. — 2012. — № 8(10). — Р. e1002987. — doi: 10.1371/journal.ppat.1002987.
2. Achouiti A. Myeloid-related protein-8/14 facilitates bacterial growth during pneumococcal pneumonia / A. Achouiti, T. Vogl, H. Endeman et al. // Thorax. — 2014 Nov. — № 69(11). — Р. 1034-42. — doi: 10.1136/thoraxjnl-2014-205668.
3. AlMatar M. The Role of Nanoparticles in the Inhibition of Multidrug-resistant Bacteria and Biofilms / M. AlMatar, E.A. Makky, I. Var, F. Koksal // Curr. Drug. Deliv. — 2017 Dec 7. — doi: 10.2174/1567201815666171207163504.
4. Barnese K. Biologically relevant mechanism for catalytic superoxide removal by simple manganese compounds / K. Barnese, E.B. Gralla, J.S. Valentine, D.E. Cabelli // Proc. Natl. Acad. Sci. USA. — 2012 May 1. — № 109(18). — Р. 6892-7. — doi: 10.1073/pnas.1203051109.
5. Bayroodi E., Jalal R. Modulation of antibiotic resistance in Pseudomonas aeruginosa by ZnO nanoparticles // Iran J. Micro–biol. — 2016 Apr. — № 8(2). — Р. 85-92. — PMID: 27307973.
6. Bhandari N. Effect of routine zinc supplementation on pneumonia in children aged 6 months to 3 years: randomised controlled trial in an urban slum / N. Bhandari, R. Bahl, S. Taneja et al. // BMJ. — 2002 Jun 8. — № 324(7350). — 1358. — PMID: 12052800.
7. Bhande R.M. Enhanced synergism of antibiotics with zinc oxide nanoparticles against extended spectrum β-lactamase producers implicated in urinary tract infections / R.M. Bhande, C.N. Khobragade, R.S. Mane et al. // J. Nanopart. Res. — 2013. — № 15. — Р. 1413-1426. — doi: 10.1007/s11051-012-1413-4.
8. Bobat R. Safety and efficacy of zinc supplementation for children with HIV-1 infection in South Africa: a randomised double-blind placebo-controlled trial / R. Bobat, H. Coovadia, C. Stephen et al. // Lancet. — 2005 Nov 26. — № 366(9500). — Р. 1862-7. — DOI: 10.1016/S0140-6736(05)67756-2.
9. Brooks W.A. Effect of weekly zinc supplements on incidence of pneumonia and diarrhoea in children younger than 2 years in an urban, low-income population in Bangladesh: randomised controlled trial / W.A. Brooks, M. Santosham, A. Naheed et al. // Lancet. — 2005 Sep 17–23. — № 366(9490). — Р. 999-1004. — doi: 10.1016/S0140-6736(05)67109-7.
10. Capdevila D.A., Wang J., Giedroc D.P. Bacterial Strategies to Maintain Zinc Metallostasis at the Host-Pathogen Interface // J. Biol. Chem. — 2016 Sep 30. — № 291(40). — Р. 20858-20868.
11. Chandrangsu P., Rensing C., Helmann J.D. Metal homeostasis and resistance in bacteria // Nat. Rev. Microbiol. — 2017 Jun. — № 15(6). — Р. 338-350. — doi: 10.1038/nrmicro.2017.15.
12. Chen Z. Molecular Insights into Hydrogen Peroxide-sensing Mechanism of the Metalloregulator MntR in Controlling Bacterial Resistance to Oxidative Stresses / Z. Chen, X. Wang, F. Yang et al. // J. Biol. Chem. — 2017 Mar 31. — № 292(13). — Р. 5519-5531. — doi: 10.1074/jbc.M116.764126.
13. Corbin B.D. Metal chelation and inhibition of bacterial growth in tissue abscesses / B.D. Corbin, E.H. Seeley, A. Raab et al. // Scien–ce. — 2008 Feb 15. — № 319(5865). — Р. 962-5. — doi: 10.1126/science.1152449.
14. Damo S.M. Molecular basis for manganese sequestration by calprotectin and roles in the innate immune response to invading bacterial pathogens / S.M. Damo, T.E. Kehl-Fie, N. Sugitani et al. // Proc. Natl. Acad. Sci. USA. — 2013 Mar 5. — № 110(10). — Р. 3841-6. — doi: 10.1073/pnas.1220341110.
15. Dao D.T. Assessment of Micronutrient Status in Critically Ill Children: Challenges and Opportunities / D.T. Dao, L. Anez-Bustillos, B.S. Cho et al. // Nutrients. — 2017 Oct 28. — № 9(11). — Р. E1185. — doi: 10.3390/nu9111185.
16. Elkhatib W., Noreddin A. In Vitro Antibiofilm Efficacies of Different Antibiotic Combinations with Zinc Sulfate against Pseudomonas aeruginosa Recovered from Hospitalized Patients with Urinary Tract Infection // Antibiotics (Basel). — 2014 Feb 17. — № 3(1). — Р. 64-84. — doi: 10.3390/antibiotics3010064.
17. Ghasemi F., Jalal R. Antimicrobial action of zinc oxide nanoparticles in combination with ciprofloxacin and ceftazidime against multidrug-resistant Acinetobacter baumannii // J. Glob. Antimicrob. Resist. — 2016 Sep. — № 6. — Р. 118-122. — doi: 10.1016/j.jgar.2016.04.007.
18. Hemeg H.A. Nanomaterials for alternative antibacterial the–rapy // Int. J. Nanomedicine. — 2017 Nov 10. — № 12. — Р. 8211-8225. — doi: 10.2147/IJN.S132163.
19. Isaei E. Novel Combinations of Synthesized ZnO NPs and Ceftazidime: Evaluation of their Activity against Standards and New Clinically Isolated Pseudomonas aeruginosa / E. Isaei, S. Mansouri, F. Mohammadi et al. // Avicenna J. Med. Biotechnol. — 2016 Oct-Dec. — № 8(4). — Р. 169-174. — PMID: 27920884.
20. Janaki A.C., Sailatha E., Gunasekaran S. Synthesis, cha–racteristics and antimicrobial activity of ZnO nanoparticles // Spectrochim. Acta A Mol. Biomol. Spectrosc. — 2015 Jun 5. — № 144. — Р. 17-22. — doi: 10.1016/j.saa.2015.02.041.
21. Johnstone T.C., Nolan E.M. Beyond iron: non-classical biological functions of bacterial siderophores // Dalton Trans. — 2015 Apr 14. — № 44(14). — Р. 6320-39. — doi: 10.1039/c4dt03559c.
22. Juttukonda L.J. Dietary Manganese Promotes Staphylococcal Infection of the Heart / L.J. Juttukonda, E.T.M. Berends, J.P. Zackular et al. // Cell Host Microbe. — 2017 Oct 11. — № 22(4). — Р. 531-542. — doi: 10.1016/j.chom.2017.08.009.
23. Karyadi E. A double-blind, placebo-controlled study of vitamin A and zinc supplementation in persons with tuberculosis in Indonesia: effects on clinical response and nutritional status / E. Karyadi, C.E. West, W. Schultink et al. // Am. J. Clin. Nutr. — 2002 Apr. — № 75(4). — Р. 720-7. — PMID: 11916759.
24. Król A. Zinc oxide nanoparticles: Synthesis, antiseptic acti–vity and toxicity mechanism / A. Król, P. Pomastowski, K. Rafińska et al. // Adv. Colloid Interface Sci. — 2017 Nov. — № 249. — Р. 37-52. — doi: 10.1016/j.cis.2017.07.033.
25. Kunkalekar R.K. Silver-doped manganese dioxide and trioxide nanoparticles inhibit both gram positive and gram negative pathogenic bacteria / R.K. Kunkalekar, M.S. Prabhu, M.M. Naik, A.V. Salker // Colloids Surf. B Biointerfaces. — 2014 Jan 1. — № 113. — Р. 429-34. — doi: 10.1016/j.colsurfb.2013.09.036.
26. Lassi Z.S., Moin A., Bhutta Z.A. Zinc supplementation for the prevention of pneumonia in children aged 2 months to 59 months // Cochrane Database Syst. Rev. — 2016 Dec 4. — № 12. — CD005978. — doi: 10.1002/14651858.CD005978.pub3.
27. Madhumitha G., Elango G., Roopan S.M. Biotechnological aspects of ZnO nanoparticles: overview on synthesis and its applications // Appl. Microbiol. Biotechnol. — 2016 Jan. — № 100(2). — Р. 571-81. — doi: 10.1007/s00253-015-7108-x.
28. Mahalanabis D. Randomized, double-blind, placebo-controlled clinical trial of the efficacy of treatment with zinc or vitamin A in infants and young children with severe acute lower respiratory infection / D. Mahalanabis, M. Lahiri, D. Paul. et al. // Am. J. Clin. Nutr. — 2004 Mar. — № 79(3). — Р. 430-6. — PMID: 14985218.
29. Malik A. Zinc supplementation for prevention of acute respiratory infections in infants: a randomized controlled trial / A. Malik, D.K. Taneja, N. Devasenapathy, K. Rajeshwari // Indian Pediatr. — 2014 Oct. — № 51(10). — Р. 780-4. — PMID: 25362008.
30. Martinez-Estevez N.S., Alvarez-Guevara A.N., Rodriguez-Martinez C.E. Effects of zinc supplementation in the prevention of respiratory tract infections and diarrheal disease in Colombian children: A 12-month randomised controlled trial // Allergol. Immunopathol. (Madr.). — 2016 Jul-Aug. — № 44(4). — Р. 368-75. — doi: 10.1016/j.aller.2015.12.006.
31. McDevitt C.A. A molecular mechanism for bacterial susceptibility to zinc / C.A. McDevitt, A.D. Ogunniyi, E. Valkov et al. // PLoS Pathog. — 2011 Nov. — № 7(11). — Р. e1002357. — doi: 10.1371/journal.ppat.1002357.
32. Merchant A.T., Spatafora G.A. A role for the DtxR fami–ly of metalloregulators in gram-positive pathogenesis // Mol. Oral. Microbiol. — 2014 Feb. — № 29(1). — Р. 1-10. — doi: 10.1111/omi.12039.
33. Palmer L.D., Skaar E.P. Transition Metals and Virulence in Bacteria // Annu Rev. Genet. — 2016 Nov 23. — № 50. — Р. 67-91. — doi: 10.1146/annurev-genet-120215-035146.
34. Parker D.L. Pyoverdine synthesis by the Mn(II)-oxidizing bacterium Pseudomonas putida GB-1 / D.L. Parker, S.W. Lee, K. Geszvain et al. // Front Microbiol. — 2014 May 7. — № 5. — 202. — doi: 10.3389/fmicb.2014.00202.
35. Poole K. At the Nexus of Antibiotics and Metals: The Impact of Cu and Zn on Antibiotic Activity and Resistance // Trends Microbiol. — 2017 Oct. — № 25(10). — Р. 820-832. — doi: 10.1016/j.tim.2017.04.010.
36. Rudramurthy G.R. Nanoparticles: Alternatives Against Drug-Resistant Pathogenic Microbes / G.R. Rudramurthy, M.K. Swamy, U.R. Sinniah, A. Ghasemzadeh // Molecules. — 2016 Jun 27. — № 21(7). — Р. E836. — doi: 10.3390/molecules21070836.
37. Sakulchit T., Goldman R.D. Zinc supplementation for pediatric pneumonia // Can. Fam. Physician. — 2017 Oct. — № 63(10). — Р. 763-765. — PMID: 29025801.
38. Sazawal S. Zinc supplementation reduces the incidence of acute lower respiratory infections in infants and preschool children: a double-blind, controlled trial / S. Sazawal, R.E. Black, S. Jalla et al. // Pediatrics. — 1998 Jul. — № 102(1 Pt. 1). — Р. 1-5. — PMID: 9651405.
39. Shah U.H. The efficacy of zinc supplementation in young children with acute lower respiratory infections: a randomized double-blind controlled trial / U.H. Shah, A.K. Abu-Shaheen, M.A. Malik et al. // Clin. Nutr. — 2013 Apr. — № 32(2). — Р. 193-9. — doi: 10.1016/j.clnu.2012.08.018.
40. Thati V. Nanostructured zinc oxide enhances the activity of antibiotics against Staphylococcus aureus / V. Thati, A.S. Roy, Prasad Ambika et al. // J. Biosci. Technol. — 2010. — № 1. — Р. 64-69.
41. Thatoi P. Photo-mediated green synthesis of silver and zinc oxide nanoparticles using aqueous extracts of two mangrove plant species, Heritiera fomes and Sonneratia apetala and investigation of their biomedical applications / P. Thatoi, R.G. Kerry, S. Gouda et al. // J. Photochem. Photobiol. B. — 2016 Oct. — № 163. — Р. 311-8. — doi: 10.1016/j.jphotobiol.2016.07.029.
42. Vimbela G.V. Antibacterial properties and toxicity from metallic nanomaterials / G.V. Vimbela, S.M. Ngo, C. Fraze et al. // Int. J. Nanomedicine. — 2017 May 24. — № 12. — Р. 3941-3965. — doi: 10.2147/IJN.S134526.
43. Wakeman C.A. The innate immune protein calprotectin promotes Pseudomonas aeruginosa and Staphylococcus aureus interaction / C.A. Wakeman, J.L. Moore, M.J. Noto et al. // Nat. Commun. — 2016 Jun 15. — № 7. — 11951. — doi: 10.1038/ncomms11951.
44. Wątły J., Potocki S., Rowińska-Żyrek M. Zinc Homeostasis at the Bacteria/Host Interface-From Coordination Chemistry to Nutritional Immunity // Chemistry. — 2016 Nov 2. — № 22(45). — Р. 15992-16010. — doi: 10.1002/chem.201602376.
45. Zogzas C.E., Mukhopadhyay S. Inherited Disorders of Manganese Metabolism // Adv. Neurobiol. — 2017. — № 18. — Р. 35-49. — doi: 10.1007/978-3-319-60189-2_3.

/100-1.jpg)
/101-1.jpg)
/102-1.jpg)