Введение
Существует мнение, что эпилептические приступы относятся к редким и даже атипичным проявлениям рассеянного склероза (РС) [1]. Вероятно, вышеупомянутое представление о нехарактерности эпилепсии для РС явилось основной причиной того, что данная проблема в течение длительного периода не привлекала пристального внимания исследователей и большинство ее аспектов изучены недостаточно [2].
Эпидемиология
Существующие данные о частоте эпилепсии при рассеянном склерозе весьма противоречивы. Впервые судороги при рассеянном склерозе были описаны в середине XIX века. Вильгельм Леубе описал пациента с одним эпизодом ночного затруднения дыхания и потерей сознания в 1871 году и наличием двусторонних демиелинизирующих очагов в базальных ганглиях [3].
Проанализировав 32 исследования, с 1935 по 2012 годы, Ruth Ann Marrie [4] и соавторы сообщили о том, что распространенность эпилепсии составляет от 0,65 до 5,97 % у взрослых после дебюта рассеянного склероза. У детей после дебюта рассеянного склероза частота эпилепсии составляла 5,98 %.
С одной стороны, ряд авторов указывают, что частота эпилепсии при РС составляет менее 1 %, то есть значимо не отличается от таковой в общей популяции [5]. С другой стороны, существует достаточно много исследований, в которых отмечена существенно более высокая частота эпилепсии при РС — до 7,5–8,6 % [6, 7] и даже до 14,5 % [8]. По данным метаанализа популяционных исследований, частота судорожных расстройств при РС составила 3,09 % [9]. В целом совокупность существующих данных позволяет определить более высокий риск эпилепсии при РС, превышающий популяционный в 3–6 раз [10, 11]. Также вызывают интерес сообщения о возможном повышении частоты эпилепсии при РС в последние десятилетия. В частности, в Норвегии частота эпилепсии среди пациентов с РС составила 7,4 % в 2003 г. по сравнению с 2,9 % в 1963 г., и за 40 лет риск развития эпилепсии при РС по сравнению с общей популяцией возрос в 4 раза, что, по мнению авторов, отражает увеличение выживаемости больных с РС [12].
Атипичные формы рассеянного склероза
Помимо классического варианта течения РС, выделяют редкие злокачественные атипичные формы заболевания: диффузный периаксиальный энцефалит Шильдера (миелинокластический диффузный склероз), концентрический склероз Балло (периаксиальная концентрическая лейкоэнцефалопатия), болезнь Марбурга (тяжелый острый монофазный энцефаломиелит) и псевдотуморозную форму РС, характеризующуюся собственными нейровизуализационными, клиническими и патоморфологическими признаками, отличными от классического варианта РС и другой патологии ЦНС [13]. При вышеперечисленных формах рассеянного склероза эпилепсия встречается чаще.
Распространенность псевдотуморозной формы составляет 1–2 на 1000 случаев РС. Клиническая картина заболевания полностью зависит от локализации и размеров очага. В большинстве своем очаг располагается супратенториально в полушариях головного мозга, причем чаще в лобной и теменной долях. Патологический процесс нередко захватывает серое вещество — кору и подкорковые ядра. Поэтому в клинической картине заболевания могут встречаться нетипичные симптомы: расстройство высших мозговых функций и эпилептические приступы. Псевдотуморозная форма РС характеризуется развитием острой очаговой демиелинизации, проявляющейся формированием на МРТ крупного очага повышенного МР-сигнала с перифокальным отеком. Появление псевдотуморозного очага демиелинизации возможно как в дебюте РС (в форме одиночного образования), так и на фоне текущего заболевания (с клиническими проявлениями или субклинического) при наличии в головном мозге других очагов демиелинизации, характерных для РС и расположенных в белом веществе обоих полушарий. Отличительной чертой этого очага является его размер — как известно, для классического РС характерно образование очагов преимущественно от 3 до 16 мм в диаметре (максимум 30 мм). При псевдотуморозном течении РС очаг превышает в своих размерах 20 мм (до 120 мм) [14].
В отличие от классической формы рассеянного склероза основу патогенеза варианта Балло, вероятно, составляют другие процессы, которые обусловливают формирование патогномоничной для концентрического склероза кольцевой демиелинизации. Некоторые исследователи пришли к выводу о ведущей роли гипоксических механизмов, хотя их генез пока остается неизвестным. Морфологически участки демиелинизации при склерозе Балло представляют собой кольцевидное чередование зон демиелинизации и церебральной ткани с сохраненным или восстановленным благодаря ремиелинизации миелином. Микроскопически определяется глубокая дегенерация олигодендроцитов, приводящая к их апоптозу. Для концентрического склероза Балло характерна особая МРТ-картина очагов, отличающаяся специфичной слоистой структурой, которую сравнивают с годичными кольцами на спиле дерева; участки демиелинизации имеют гиперинтенсивный сигнал на Т2-ВИ, а прослойки частично сохранной ткани изоинтенсивны белому веществу головного мозга. Важным моментом являются незначительная выраженность масс-эффекта при достаточно большом объеме поражения и особенности локализации очагов, присущие демиелинизации [15].
Патогенез эпилепсии при рассеянном склерозе
Особый интерес у пациентов с РС представляет природа эпилептических приступов, появление которых традиционно ассоциируется с корковым эпилептогенным очагом. При РС в нейродегенеративный процесс включается не только белое вещество мозга, в котором преобладают процессы демиелинизации, но и серое вещество мозга, где выражено нейрональное поражение [16].
Одна из последних классификаций демиелинизирующих очагов в сером веществе (по Bö L.) разделяет смешанные очаги, пересекающие границу серого и белого вещества (очаги I типа), и очаги, расположенные в толще серого вещества коры (очаги II–IV типа). К очагам II типа относятся мелкие внутрикорковые очаги; очаги III типа (самые распространенные) — более крупные, начинаются непосредственно под мягкой мозговой оболочкой и простираются вглубь серого вещества, не достигая субкортикального белого вещества (субпиальные очаги); а очаги IV типа поражают всю толщу серого вещества коры, от субпиальной области до субкортикального белого вещества [17]. Корковая демиелинизация протекает с поражением аксонов, дендритов и нейронов. Степень повреждения нейронов в очагах первого типа в сером веществе в 3–4 раза ниже, чем в белом. Так как корковые очаги плохо визуализируются при МРТ, их чаще всего выявляют на аутопсийном и биопсийном материале [18, 19].
Причинно-следственные связи между эпилепсией и РС дискутабельны. Эпилепсия может быть следствием РС. Согласно этой точке зрения, предполагаемый анатомический субстрат судорог — области воспаления, отека, демиелинизации церебральной коры и околокортикального белого вещества [20].
В таких случаях фокусом эпиактивности становится очаг демиелинизации и/или отека, что на клеточном уровне может отражать, например, аномальную экспрессию ионных каналов, задержку или блокирование потенциала действия с гиперсинхронизацией кластеров нейронов и др. В качестве альтернативного механизма предполагается активация латентного фокуса эпилептической активности вследствие сопутствующих хроническому воспалительному процессу метаболических нарушений и изменений церебрального микроокружения (например, ирритация нейронов и их повышенная возбудимость вследствие деполяризации из-за повышения проницаемости клеточной мембраны антителами, цитокинами и другими иммунными факторами) [21].
Возникновение эпилептических приступов связывают как с поражением коры головного мозга, так и с лабильностью церебральных регуляторных механизмов, сопровождающих обострения РС. При этом возникающие пароксизмальные эпизоды могут быть проявлением как острых симптоматических приступов (ОСП), связанных с текущим иммунным повреждением, так и симптоматической эпилепсии [22]. Как известно, возникновение ОСП находится в тесной временной и нейробиологической связи с острым структурным повреждением головного мозга и не соответствует основной дефиниции эпилепсии о неспровоцированном характере приступов (ILAE Commission on Epidemiology; Subcommission on Definitions of Acute Symptomatic Seizures, 2010).
По наблюдениям Ю.А. Беловой и соавт. [23], более половины случаев возникновения судорог у больных РС связаны с обострениями заболевания, что соответствует дефиниции ОСП. После купирования обострения РС приступы могут не повторяться. Однако отмечено, что у 50 % от общего числа больных РС, перенесших судорожные приступы, симптоматическая эпилепсия развивается как самостоятельное заболевание и протекает активно независимо от наличия обострений РС. У 60 % пациентов эпилептические приступы сопровождаются вторичной генерализацией, у трети пациентов регистрируются эпизоды серийного и статусного течения [24].
Клиническая характеристика
Первично- и вторично-генерализованные приступы составляют 2/3 от всех приступов, что сходно с показателями в общей популяции. Однако среди парциальных приступов простые парциальные встречаются в два раза чаще, чем сложнопарциальные, а в общей популяции — наоборот. Также у больных рассеянным склерозом может быть эпилептический статус, который является причиной смерти. В ряде сообщений о случаях заболевания описаны больные РС с необычными формами эпилепсии, такими как дисфазный эпилептический статус и музыкальная эпилепсия [3].
Самый частый тип приступов — вторично-генерализованные, нередко наблюдают простые или сложные парциальные [25, 26]. Часть авторов отмечают, что эпилептические приступы наиболее часто развиваются при ремиттирующем течении рассеянного склероза. Так, по данным C. Lebrun [27], эпилептические приступы при РС начинаются в возрасте 25–40 лет, обычно через 4–7 лет после постановки диагноза РС, а количество приступов обычно коррелирует с частотой обострений и по мере прогрессирования заболевания снижается. Другие исследователи, напротив, отмечают ассоциацию эпилептических приступов с прогрессирующим течением. По данным P. Striano (2003), эпилепсия при РС начиналась при прогрессирующем течении, обычно через много лет от начала РС, что отличало ее от ассоциированных с обострениями острых симптоматических судорог [28].
Начиная с Bronisch в 1948 году (Bronisch & Rауch, 1948) патанатомические исследования сообщили о связи демиелинизирующего заболевания и коры больших полушарий и обнаружили подкорковые или корковые поражения у больных с генерализованным (Bronisch & Rауch, 1948) и парциальным (Quandt, 1957) эпилептическим статусом, а также у пациентов с первично- (Kufs & Braunmühl, 1951) или вторично-генерализованными (Drake & Macrae, 1961) приступами [29].
Truyen и его коллеги провели исследование с участием 13 пациентов и обнаружили значительно большее количество корковых и подкорковых очагов у больных с приступами, в то время как тотальное поражение не отличалось между двумя группами [30].
Sokic и коллеги пытались соотнести расположение очагов на МРТ с симптомами во время приступа у 20 пациентов с корковым/подкорковым поражением или очаговой атрофией коры головного мозга и обнаружили связь в 10 случаях (Sokic и соавт., 2001).
Müller (1949) отмечает в своей диссертации, что прогноз эпилепсии у больных рассеянным склерозом лучше, чем при изолированной эпилепсии, и только 7 пациентам из 13 требовалось назначение специфической противоэпилептической терапии.
Два современных эпидемиологических исследования, в которых изучался прогноз судорог при рассеянном склерозе, приходят к противоположным выводам. Kinnunen & Wikström (1986) отмечают, что приступы спонтанно исчезали у 10 из 21 (48 %) больного с эпилепсией в популяции, охватывающей 599 пациентов с рассеянным склерозом. Engelsen и Gronning отмечают наличие эпилептического статуса у 4 из 17 (24 %) больных с эпилепсией в популяции, охватывающей 423 пациента с рассеянным склерозом, и это их главная причина подозревать, что прогноз судорожного синдрома при рассеянном склерозе может быть хуже, чем сообщалось ранее [31].
Приступы наблюдаются при рецидивирующе-ремиттирующем течении рассеянного склероза, так же как и при первично- и вторично-прогрессирующем.
Существуют данные о том, что эпилептические приступы при РС чаще развиваются у мужчин [32], хотя в большинстве популяционных исследований соотношение мужчин и женщин не отличалось от ожидаемого при РС [33].
В некоторых исследованиях треть приступов приходилась на рецидив РС, иногда говорилось о статусе фокальных приступов, обычно с моторным компонентом. Эти острые симптоматические судороги обычно прекращались при ремиссии и не требовали длительного лечения. На МРТ было видно острое воспаление, согласующееся с локализацией судорог или ЭЭГ-паттернами [34].
Самый частый вид приступов — короткие тонические спазмы, у 4 % пациентов с РС они происходили по нескольку раз в день, кластерами, и далее прекращались спонтанно через несколько недель или месяцев. Другими проявлениями были транзиторные соматосенсорные феномены, временная атаксия или афазия, связанные с эфаптической передачей между демиелинизированными нервами, которые обычно прекращались после низких доз мембраностабилизирующих препаратов, таких как карбамазепин, которые наиболее эффективны при фокальных приступах [35].
Эпилептический статус при РС характеризуется рефрактерностью к традиционной терапии ПЭП, и происходит улучшение течения при лечении обострения РС. Приступы часто встречаются при обострении РС и могут быть единственным симптомом обострения. Оценка ЭЭГ имеет прогностическое значение для приступов. Для лечения необходимо использовать комбинацию ПЭП, в том числе нового поколения [36].
Учитывая редкость судорог при рассеянном склерозе, трудно исследовать, являются ли судороги фактором риска для более быстрого наступления инвалидности или более быстрого вступления во вторичную прогрессирующую фазу. Такие исследования в настоящее время отсутствуют.
Нейрофизиологические и нейровизуализационные исследования
Большинство авторов отмечают сравнительно невысокую значимость рутинной ЭЭГ. Так, по данным P.A. Nyquist (2001), эпилептиформная активность отмечена только в трети случаев (односторонние или двусторонние спайки — в 20,9 %, генерализованный пик-волновой разряд или мультифокальные эпилептиформные нарушения — у 14,0 %), в остальных случаях на ЭЭГ обнаруживались неспецифичные изменения (диффузное или локальное замедление — в 44,2 %) либо ЭЭГ была нормальной (25,6 %) [37]. Близкие данные приводят и другие исследователи: частота обнаружения эпилептиформной активности обычно составляет от 12,5 до 50 % [38, 39].
Какие-либо специфические изменения, характерные для пациентов с РС и эпилептическими приступами, на МРТ-исследовании, как правило, отсутствуют. Существуют данные об относительно более высокой очаговой нагрузке, особенно в лобной и/или височной доле или в области ствола, а также о большей выраженности атрофических изменений у пациентов с РС и эпилепсией [40]. У пациентов с эпилепсией отмечается более выраженное поражение коры и частота обнаружения и количество чистых интракортикальных очагов (90 % и 7) оказались существенно выше, чем у больных без эпилепсии (48 % и 1,5), а их объем — в 6 раз выше. Помимо более высокой нагрузки кортикальными очагами и их большего количества, у пациентов с РС и эпилепсией также обнаруживают более выраженную атрофию коры головного мозга, а также большую скорость ее прогрессирования. В этом контексте случаи РС с эпилепсией можно рассматривать как одно из потенциальных фенотипических проявлений кортикальной формы РС, характеризующейся преимущественным и выраженным поражением серого вещества при относительно невысокой очаговой нагрузке в белом веществе [8].
По данным Ф.А. Хабирова и соавт. от 2015 г., у относительно небольшой части пациентов (8 человек, 19 %) эпилептические приступы возникали до появления более типичных симптомов РС и в дальнейшем какой-либо определенной связи с течением РС не отмечалось. В этой группе вполне возможно случайное сочетание РС и эпилепсии иной этиологии. У 12 пациентов (28,6 %) эпилептические приступы возникали во время первого или очередного обострения, а в дальнейшем прослеживалась кластеризация приступов при обострениях, хотя у 3 больных приступы явно возникали и вне обострений (у оставшихся приступы можно интерпретировать как острые симптоматические судороги). Возникновение через длительное время после начала РС (часто при переходе во вторично-прогрессирующее течение) отмечено у 22 пациентов (52,4 %). Явная ассоциация приступов с обострениями у этих пациентов не прослеживалась. Что касается феноменологии эпилептических приступов, то доминировали парциальные и вторично-генерализованные (33,3 и 71,2 %). Из необычных паттернов можно отметить 1 случай фенотипа epilepsia partialis continua и 3 случая эпилептического кортикального миоклонуса (в сочетании с генерализованными тонико-клоническими приступами). Последние случаи, возможно, не были этиологически связаны с РС, а отражали случайное сочетание с идиопатическими миоклоническими эпилепсиями. Эпилептиформная активность при рутинной ЭЭГ была обнаружена у 22 пациентов: у 18 (42,8 %) она была региональной, у 4 (9,5 %) — генерализованной. Клинико-ЭЭГ-МРТ-корреляция (то есть соответствие паттерна приступа локализации эпилептиформной активности на ЭЭГ и структурных изменений на рутинной МРТ) наблюдалась существенно реже — только у 10 пациентов (23,8 %). Эффективность терапии антиэпилептическими препаратами была относительно невысокой. Клинически удовлетворительный контроль приступов был достигнут у 34 пациентов (81 %), в том числе у 22 (51 %) — с помощью монотерапии (использовались вальпроевая кислота, карбамазепин, топирамат), у 12 (29 %) была необходима политерапия [2].
Лечение и прогноз
Существуют сведения о том, что у пациентов с РС некоторые антиэпилептические препараты переносятся плохо и чаще вызывают побочные эффекты [3]. Кроме того, установлено, что ряд препаратов, широко применяемых для лечения РС, может провоцировать эпилептические приступы. К ним относятся, в частности, интерфероны бета, которые в настоящее время являются препаратами первой линии патогенетической терапии, производные аминопиридина, баклофен (в том числе при интратекальном введении) [25, 41].
Относительно прогноза эпилепсии при РС сообщалось о вполне удовлетворительных результатах лечения с достижением полной ремиссии [37], а также об отсутствии какой-либо корреляции между наличием эпилептических приступов и тяжестью течения РС [26]. Тем не менее большое число исследований свидетельствует как о частой резистентности эпилепсии при РС к терапии [33], так и об ассоциации с неблагоприятным прогнозом РС. Так, эпилептические приступы часто ассоциируются с нарушением когнитивных функций [42], более высокой частотой обострений, быстрым нарастанием EDSS (шкала степени инвалидизации у больных РС), ранней утратой способности к передвижению и летальным исходом [8, 43].
Нам представилось целесообразным описать собственные клинические наблюдения пациентов с сочетанной патологией: рассеянным склерозом и симптоматической эпилепсией.
Клинические наблюдения
Авторами наблюдались 2 пациента: мужчина в возрасте 28 лет и 36-летняя на момент написания статьи женщина.
У первого пациента, 28 лет, дебют рассеянного склероза состоялся в 11 лет. С 15 лет стали отмечаться эпилептические приступы одного типа: вторично-генерализованные тонико-клонические длительностью 2–3 минуты, аур или других предчувствий приступов пациент не отмечал. Приступы сопровождались мочеиспусканием, в постприступном периоде наблюдалось оглушение, спутанность в течение 20 минут. После приступа в течение 2–3 дней отмечалось усугубление неврологических симптомов рассеянного склероза — нарушение ходьбы из-за слабости, дискоординации. Приступы происходили исключительно в состоянии бодрствования.
У второй пациентки, 36 лет, с 27 лет наблюдались первые проявления РС в виде преходящего тетрапареза, однако диагноз РС был верифицирован лишь в 31 год. Дебют эпилептических приступов возник в возрасте 21 года, после родов, до появления первых симптомов РС. Наблюдались несколько типов приступов: сложнопарциальные, по типу замираний, без автоматизмов, длительностью до 1 минуты, вторично-генерализованные с тонико-клоническими судорогами длительностью до 4 минут и тонические длительностью до 2 минут. Дебют приступов — с 21 года, после родов. Перед приступами отмечала ауру в виде тревоги, ожидания худшего длительностью до нескольких минут. Приступы проходили исключительно в состоянии бодрствования. Вторично-генерализованные приступы сопровождались мочеиспусканием, в постприступном периоде отмечалось оглушение. После приступов не отмечалось усугубления неврологических симптомов рассеянного склероза.
Частота приступов в двух клинических случаях варьировала. У первого пациента частота приступов в начале заболевания составляла 1–2 раза в год. После подбора противоэпилептической терапии (вальпроаты 1000 мг/сутки) — 1 раз в два года, только на фоне пропуска приема препарата. Последний приступ наблюдался в 2015 году. У второй пациентки приступы, начинающиеся с простого парциального в виде ощущения надвигающейся тревоги с последующим переходом в сложнопарциальный по типу замираний, протекали сериями по 2–3 в день с частотой серий от 1 до 4 раз в неделю. В последний год частота серий уменьшилась до 1 раза в 2 недели. Вторично-генерализованные тонико-клонические и тонические приступы протекали с частотой 1 раз в 3–4 месяца. Данная частота сохраняется по настоящее время; несмотря на проводимую терапию, полностью купировать приступы не удалось, но их серийность ушла.
У первого пациента приступы появились через 4 года после верифицированного рассеянного склероза в возрасте 11 лет. Во втором клиническом случае — за 6 лет до выполнения МРТ и установления диагноза рассеянного склероза.
Неврологические расстройства неэпилептического генеза наблюдались у обоих пациентов, были представлены головокружением, шаткостью походки, нарушением речи по типу «каши во рту», неловкостью в руках, слабостью в конечностях, снижением памяти, затруднением мочеиспускания. Во втором клиническом случае наблюдался энкопрез.
МРТ-исследование пациентам проводилось несколько раз. Первому пациенту — до развития первых эпилептических приступов.
В возрасте 15 лет в белом веществе с обеих сторон, перивентрикулярно и субкортикально, определяются множественные очаговые включения (гиперинтенсивные по Т2 и гипоинтенсивные по Т1) с отчетливыми округлыми ровными контурами, различные по размеру (3–5–10 мм). Отмечаются также участки с измененной интенсивностью сигнала больших размеров (35 × 40 мм) и неправильно очерченными контурами без зон перифокального отека. После введения контрастного вещества отмечается периферическое накопление в единичных очагах.
/82-1.jpg)
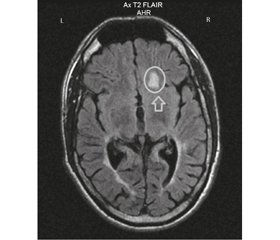
После развития первого эпилептического приступа при повторном МРТ-исследовании в возрасте 15 лет и на момент исследования отмечалось формирование свежих очагов в субкортикальных отделах правой лобной, правой затылочной и левой теменной долей (рис. 1).
Во втором клиническом случае первая МРТ была выполнена в возрасте 31 года, после появления неврологических симптомов РС в виде преломления зрения, шаткости походки и через 10 лет после начала эпилептического синдрома. На МРТ в структуре белого вещества преимущественно перивентрикулярно определяются участки повышенной интенсивности на Т2 и FLAIR размером до 5 мм. Очаговых изменений в стволе мозга и мозжечке не выявлено. Заключение: очаговые изменения головного мозга, вероятно, демиелинизирующего генеза. В возрасте 34 лет была проведена повторная МРТ, где в динамике определяются множественные мелкие очаги демиелинизации овальной формы сливного характера у задних рогов обоих боковых желудочков. Заключение: картина демиелинизирующего заболевания супратенториальной локализации.
Для анализа биоэлектрической активности головного мозга в обоих случаях использовалась дневная рутинная ЭЭГ длительностью 15 минут с функциональными нагрузками (открывание-закрывание глаз, фотостимуляция, гипервентиляция). В первом случае были выявлены только диффузные изменения без специфической эпилептиформной активности (рис. 2).
Во втором случае определялся очаг эпилептиформной активности в левых височных отведениях.
Специфическая патогенетическая терапия рассеянного склероза проводилась только у первого пациента (глатирамера ацетат). У второй пациентки препараты, изменяющие течение рассеянного склероза, не были назначены в связи с частыми эпилептическими приступами.
Оба пациента получали противоэпилептическую терапию, кратную двум приемам в день. В первом клиническом случае противоэпилептическую терапию начали после первого эпилептического приступа. В этом случае наблюдалась стойкая медикаментозная ремиссия продолжительностью 2 года 10 месяцев. Во втором случае на фоне противоэпилептической терапии частота сложнопарциальных приступов снизилась до 1 раза в 2 недели, вторично-генерализованных — до 1 раза в 3–4 месяца. В обоих случаях использовались вальпроаты (в дозировке 1000–1200 мг/сутки).
Обсуждение
В обоих клинических случаях не было отмечено первично-генерализованных судорожных приступов, несмотря на данные в литературном обзоре. Нам представляется, что упоминание в литературе первично-генерализованных приступов при рассеянном склерозе с эпилептическим синдромом носит ошибочный характер.
Эпилептический синдром при рассеянном склерозе носит исключительно симптоматический характер и, как любая симптоматическая эпилепсия, не может быть первично-генерализованным согласно классификации 1981 г.
Классификация эпилептических приступов Международной противоэпилептической лиги (1981 г.)
I. Парциальные (фокальные, локальные) при-ступы.
А. Простые парциальные приступы (без нарушения сознания).
1. Моторные приступы:
а) фокальные моторные без марша;
б) фокальные моторные с маршем (джексоновские);
в) адверсивные;
г) постуральные;
д) фонаторные (вокализация или остановка речи).
2. Соматосенсорные приступы, или приступы со специальными сенсорными симптомами (простые галлюцинации, например вспышки пламени, звон):
а) соматосенсорные;
б) зрительные;
в) слуховые;
г) обонятельные;
д) вкусовые;
е) с головокружением.
3. Приступы с вегетативно-висцеральными проявлениями (сопровождаются эпигастральными проявлениями, потливостью, покраснением лица, сужением и расширением зрачков).
4. Приступы с нарушением психических функций (изменения высшей нервной деятельности); редко бывают без нарушения сознания, чаще проявляются как сложные парциальные приступы:
а) дисфазические;
б) дисмнестические (например, ощущение уже виденного);
в) с нарушением мышления (например, мечтательные состояния, нарушение чувства времени);
г) аффективные (страх, злоба и др.);
д) иллюзорные (например, макропсия);
е) сложные галлюцинаторные (например, музыка, сцены).
Б. Сложные парциальные приступы (с нарушением сознания, могут иногда начинаться с простой симптоматики).
1. Простой парциальный приступ с последующим нарушением сознания:
а) начинается с простого парциального приступа (А1–А4) с последующим нарушением сознания;
б) с автоматизмами.
2. Начинается с нарушения сознания:
а) только с нарушением сознания;
б) с двигательными автоматизмами.
В. Парциальные приступы с вторичной генерализацией (могут быть генерализованными тонико-клоническими, тоническими, клоническими).
1. Простые парциальные приступы (А), переходящие в генерализованные.
2. Сложные парциальные приступы (Б), переходящие в генерализованные.
3. Простые парциальные приступы, переходящие в сложные, а затем в генерализованные.
II. Генерализованные приступы (судорожные и бессудорожные).
А. Абсансы.
1. Типичные абсансы:
а) только с нарушением сознания;
б) со слабо выраженным клоническим компонентом;
в) с атоническим компонентом;
г) с тоническим компонентом;
д) с автоматизмами;
е) с вегетативным компонентом.
2. Атипичные абсансы:
а) изменения тонуса более выражены, чем при типичных абсансах;
б) начало и/или прекращение приступов происходит не внезапно, а постепенно.
Б. Миоклонические приступы (единичные или множественные миоклонические судороги).
В. Клонические приступы.
Г. Тонические приступы.
Д. Тонико-клонические приступы.
Е. Атонические (атаксические) приступы.
III. Неклассифицированные эпилептические приступы (приступы, которые нельзя включить ни в одну из вышеописанных групп из-за отсутствия необходимой информации, а также некоторые неонатальные приступы, например ритмические движения глаз, жевательные, плавательные движения).
В первом случае удалось связать появление новых очагов на МРТ с эпилептическим приступом однократно. Данный случай может подтверждать описанную в литературном обзоре иммунную теорию патогенеза эпилепсии при рассеянном склерозе.
Выводы
Поскольку ЭЭГ-исследование является малоинформативным методом в эпилептологии, в настоящее время используется длительное видео-ЭЭГ-мониторирование, которое является стандартом диагностики патологической биоэлектрической активности. На наш взгляд, это объясняет то, что при проведении рутинных ЭЭГ специфическая эпилептиформная активность регистрировалась не во всех клинических случаях, что совпадает с данными литературного обзора.
Учитывая это, нам представляется целесообразным изучение эпилептического процесса при рассеянном склерозе с использованием видео-ЭЭГ-мониторинга.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Хабиров Ф.А. Клиническая картина, диагностика и лечение рассеянного склероза: руководство для врачей / Ф.А. Хабиров, А.Н. Бойко, Ф.И. Девликамова [и соавт.]; под ред. Ф.А. Хабирова, А.Н. Бойко. — Казань: Медицина, 2010. — 88 с.
2. Хабиров Ф.А., Хайбуллин Т.И., Гранатов Е.В., Аверьянова Л.А., Бабичева Н.Н., Шакирзянова С.Р. Эпилепсия при рассеянном склерозе (обзор литературы и собственные данные) // Практическая медицина. — 2015. — № 5. — С. 119-124.
3. Marcus Koch, Maarten Uyttenboogaart, Susan Polman, Jacques De Keyser. Seizures in multiple sclerosis // Journal Epilepsia. — 6 June 2008. — Vol. 49. — P. 948-953. DOI: 10.1111/j.1528-1167.2008.01565.x.
4. Ruth Ann Marrie, Nadia Reider, Jeffrey Cohen et al. A systematic review of the incidence and prevalence of sleep disorders and seizure disorders in multiple sclerosis // Multiple Sclerosis Journal. — 2015. — Vol. 21(3). — Р. 342-349. DOI: 10.1177/ 1352458514564486.
5. Buttner T., Hornig C.R., Dorndorf W. Multiple sclerosis and epilepsy. An analysis of 14 case histories // Nervenarzt. — 1989. — Vol. 60(5). — P. 262-267. PMID: 2500609.
6. Sokic D.V., Stojsavljevic N., Drulovic J. et al. Seizures in multiple sclerosis // Epilepsia. — 2001. — Vol. 42(1). — P. 72-79. PMID: 11207788.
7. Cheng M.Y., Wai Y.Y., Ro L.S. Wu T. Seizures and multiple sclerosis in Chinese patients: a clinical and magnetic resonance ima–ging study // Epilepsy Res. — 2012. — Vol. 101(1–2). — P. 166-173. PMID: 22503593 DOI: 10.1016/j.eplepsyres.2012.03.018.
8. Nicholas R., Magliozzi R., Campbell G., Mahad D., Reynolds R. Temporal lobe cortical pathology and inhibitory GABA interneuron cell loss are associated with seizures in multiple sclerosis // Mult. Scler. — 2016 Jan. — 22(1). — Р. 25-35. PMID: 25921040. PMCID: PMC4702245. DOI: 10.1177/1352458515579445.
9. Marrie R.A., Cohen J., Stuve O. et al. A systematic review of the incidence and prevalence of comorbidity in multiple sclerosis: Overview // Multiple Sclerosis Journal. — 2015. — Vol. 21, № 3. — Р. 263-281. PMID: 25623244. PMCID: PMC4361468. DOI: 10.1177/1352458514564491.
10. Olafsson E., Benedikz J., Hauser W.A. Risk of epilepsy in patients with multiple sclerosis: a population-based study in Iceland // Epilepsia. — 1999. — Vol. 40(6). — P. 745-747. PMID: 10368072.
11. Poser C.M., Brinar V.V. Epilepsy and multiple sclerosis // Epilepsy Behav. — 2003. — Vol. 4(1). — P. 6-12. PMID: 12609222.
12. Lund C., Nakken K.O., Edland A. Celius EG Multiple sclerosis and seizures: incidence and prevalence over 40 years // Acta Neurol. Scand. — 2014. — Vol. 130(6). — P. 368-373. PMID: 25209977. DOI: 10.1111/ane.12276.
13. Брюхов В.В., Куликова С.Н., Кротенкова И.А. и др. МРТ в диагностике рассеянного склероза // Медицинская визуализация. — 2014. — 2. — С. 10-21.
14. Гурьянова О.Е., Гулевская Т.С., Моргунов В.А., Завалишин И.А. Псевдотуморозный вариант течения рассеянного склероза и острой очаговой демиелинизации. Клинический разбор Научного центра неврологии РАМН // Нервные болезни. — 2012. — 3. — С. 45-9.
15. Caracciolo J.T., Murtagh R.D., Rojiani A.M., Murtagh F.R. Pathognomonic MR imaging findings in Balo concentric sclerosis // Am. J. Neuroradiol. — 2001. — 22(2). — Р. 292-3. PMID: 11156771.
16. Chard D., Miller D. Grey matter pathology in clinically early multiple sclerosis: evidence from magnetic resonance imaging // J. Neurol. Sci. — 2009. — 282(1-2). — Р. 5-11. PMID: 19201002. DOI: 10.1016/j.jns.2009.01.012.
17. Geurts J.J., Stys P.K., Minagar A., Amor S., Zivadinov R. Gray matter pathology in chronic MS: modern views on an early observation // J. Neurol. Sci. — 2009. — 282(1–2). — Р. 12-20. PMID: 19249061. DOI: 10.1016/j.jns.2009.01.018.
18. Давыдовская М.Ф., Бойко А.Н., Гусев Е.И. Патология серого вещества головного мозга при рассеянном склерозе // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2010. — 110(2). — Р. 78-83.
19. Feinstein A., Roy P., Lobaugh N., Feinstein K., O’Connor P., Black S. et al. Structural brain abnormalities in multiple sclerosis patients with major depression // Neurology. — 2004. — 62(4). — Р. 586-90. PMID: 14981175.
20. Allen A.N., Seminog O.O., Goldacre M.J. Association between multiple sclerosis and epilepsy: large population-based recordlin-kage studies // BMC Neurol. — 2013. — Vol. 13. — P. 189. PMID: 24304488. PMCID: PMC4235201. DOI: 10.1186/1471-2377-13-189.
21. Sponsler J.L., Kendrick-Adey A.C. Seizures as a manifestation of multiple sclerosis // Epileptic Disord. — 2011. — Vol. 13(4). — P. 401-410. PMID: 22258045. DOI: 10.1684/epd.2011.0468.
22. Липатова Л.В., Рудакова И.Г., Сивакова Н.А., Капустина Т.В. Остро возникшие эпилептические припадки и симптоматический эпилептический статус // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2015. — 115(4). — С. 24-9.
23. Белова Ю.А., Якушина Т.И., Рудакова И.Г. Псевдотуморозная форма рассеянного склероза с симптоматическими судорожными приступами (клиническое наблюдение) // Русский журнал детской неврологии. — 2015. — № 4. — С. 55-60.
24. Белова Ю.А., Якушина Т.И., Рудакова И.Г., Котов С.В. Эпилепсия у больных рассеянным склерозом. Особенности диагностики и терапии // Неврология, нейропсихиатрия, психосоматика. — 2014. — Спецвыпуск 1. — С. 41-6.
25. Spatt J., Chaix R., Mamoli B. Epileptic and non-epileptic seizures in multiple sclerosis // J. Neurol. — 2001. — Vol. 248(1). — P. 2-9. PMID: 11266015.
26. Kinnunen E., Wikstrom J. Prevalence and prognosis of epilepsy in patients with multiple sclerosis // Epilepsia. — 1986. — Vol. 27(6). — P. 729-733. PMID: 3780609.
27. Lebrun C., Bensa C., Debouverie M. et al. Unexpected multiple sclerosis: follow-up of 30 patients with magnetic resonance imaging and clinical conversion profile // J. Neurol. Neurosurg. Psychiatry. — 2008 Feb. — 79(2). — Р. 195-8. PMID: 18202208. DOI: 10.1136/jnnp.2006.108274.
28. Striano P., Orefice G., Brescia Morra V. et al. Epileptic seizures in multiple sclerosis: clinical and EEG correlations // Neurol. Sci. — 2003. — Vol. 24(5). — P. 322-328. PMID: 14716527. DOI: 10.1007/s10072-003-0183-2.
29. Drake W.E., Macrae D. Epilepsy in multiple sclerosis // Neurology. — 1961. — 11. — Р. 810-816. PMID: 13724258.
30. Truyen L., Barkhof F., Frequin S.T., Polman C.H., Tobi H., Hommes O.R., Valk J. Magnetic resonance imaging of epilepsy in multiple sclerosis: a case control study. Implications for treatment trials with 4-aminopyridine // Mult. Scler. — 1996. — 1. — Р. 213-217. PMID: 9345437.
31. Engelsen B.A., Gronning M. Epileptic seizures in patients with multiple sclerosis. Is the prognosis of epilepsy underestimated? //Seizure. — 1997 Oct. — 6(5). — Р. 377-82. PMID: 9663801.
32. Calabrese M., Grossi P., Favaretto A. et al. Cortical patho–logy in multiple sclerosis patients with epilepsy: a 3 year longitudinal study // J. Neurol. Neurosurg. Psychiatry. — 2012. — Vol. 83(1). — P. 49-54. PMID: 21890577. DOI: 10.1136/jnnp-2011-300414.
33. Catenoix H., Marignier R., Ritleng C. et al. Multiple sclerosis and epileptic seizures // Mult. Scler. — 2011. — Vol. 17(1). — P. 96-102. PMID: 20861180. DOI: 10.1177/1352458510382246.
34. Thompson A.J., Kermode A.G., Moseley I.F., MacManus D.G., McDonald W.I. Seizures due to multiple sclerosis: seven patients with MRI correlations // J. Neurol. Neurosurg. Psychiatry. — 1993 Dec. — 56(12). — Р. 1317-20. PMID: 8270935. PMCID: PMC1015382.
35. Calabrese M., de Stefano N., Atzori M. et al. Extensive cortical inflammation is associated with epilepsy in multiply sclerosis // J. Neurol. — 2008 Apr. — 255(4). — Р. 581-6. PMID: 18227989. DOI: 10.1007/s00415-008-0752-7.
36. Atmaca M.M., Gurses C. Status Epilepticus and Multiple Sclerosis: A Case Presentation and Literature Review // Clin. EEG Neurosci. — 2017 Jan 1. — PMID: 29161897. DOI: 10.1177/1550059417693732.
37. Nyquist P.A., Cascino G.D., Rodriguez M. Seizures in patients with multiple sclerosis seen at Mayo Clinic, Rochester, Minn, 1990–1998 // Mayo Clin. Proc. — 2001. — Vol. 76(10). — P. 983-986. PMID: 11605699. DOI: 10.4065/76.10.983.
38. Ghezzi A., Montanini R., Basso P.F., Zaffaroni M., Massimo E., Cazzullo C.L. Epilepsy in multiple sclerosis // Eur. Neurol. — 1990. — Vol. 30(4). — P. 218-223. PMID: 2209677. DOI: 10.1159/000117350.
39. Shaygannejad V., Ashtari F., Zare M., Ghasemi M., Norouzi R., Maghzi H. Seizure characteristics in multiple sclerosis patients // J. Res. Med. Sci. — 2013. — Vol. 18(Suppl 1). — P. S74-77. PMID: 23961293. PMCID: PMC3743327.
40. Papathanasiou E.S., Pantzaris M., Myrianthopoulou P., Kkolou E., Papacostas S.S. Brainstem lesions may be important in the development of epilepsy in multiple sclerosis patients: an evoked potential study // Clin. Neurophysiol. — 2010. — Vol. 121(12). — P. 2104-2110. PMID: 20542465. DOI: 10.1016/j.clinph.2010.05.017.
41. Schuele S.U., Kellinghaus C., Shook S.J., Boulis N., Bethoux F.A., Loddenkemper T. Incidence of seizures in patients with multiple sclerosis treated with intrathecal baclofen // Neurology. — 2005. — Vol. 64(6). — P. 1086-1087. PMID: 15781838. DOI: 10.1212/01.WNL.0000154639.35941.21
42. Eriksson M., Ben-Menachem E., Andersen O. Epileptic seizures, cranial neuralgias and paroxysmal symptoms in remitting and progressive multiple sclerosis // Mult. Scler. — 2002. — Vol. 8(6). — P. 495-499. PMID: 12474990. DOI: 10.1191/1352458502ms812oa.
43. Durmus H., Kurtuncu M., Tuzun E. et al. Comparative clinical cha-racteristics of early and adult-onset multiple sclerosis patients with seizures // Acta Neurol. Belg. — 2013. — Vol. 113(4). — P. 421-426. PMID: 23696071. DOI: 10.1007/s13760-013-0210-x.
/82-1.jpg) После развития первого эпилептического приступа при повторном МРТ-исследовании в возрасте 15 лет и на момент исследования отмечалось формирование свежих очагов в субкортикальных отделах правой лобной, правой затылочной и левой теменной долей (рис. 1).
После развития первого эпилептического приступа при повторном МРТ-исследовании в возрасте 15 лет и на момент исследования отмечалось формирование свежих очагов в субкортикальных отделах правой лобной, правой затылочной и левой теменной долей (рис. 1).