Введение
Боль в нижней части спины (БНС) — одна из наиболее актуальных мультидисциплинарных проблем медицины. В большинстве случаев БНС возникает на фоне дегенеративно-дистрофических заболеваний позвоночника, которые обнаруживаются у 90–95 % взрослого населения [1–3]. Тем не менее БНС не всегда коррелирует с патологией структур позвоночника, выявляемой при нейровизуализации [4–6].
На сегодняшний день нет единого универсального эффективного метода или препарата, который однозначно доказал бы свою эффективность в терапии БНС, причем это касается как острых, так и хронических, а также рецидивирующих болей в спине [3, 7, 8]. Поэтому необходим поиск новых возможностей для лечения. Одним из таких направлений является применение хондропротекторов, которое обусловлено тем, что одним из периферических факторов патогенеза, предопределяющих тенденцию к хронизации и рецидивированию боли в спине, является разрушение хрящевой ткани, вовлекающее как межпозвоночные диски, так и межпозвоночные суставы [9]. Это приводит к стойким биомеханическим нарушениям, способствующим постоянному возобновлению болевого синдрома, и, в свою очередь, провоцирует дальнейшее прогрессирование патологического процесса в структурах позвоночника [10, 11]. В связи с этим применение хондропротекторов в комплексном лечении БНС выглядит логичным. Кроме того, интерес к этой группе препаратов как к потенциальным анальгетикам обусловлен их противовоспалительными свойствами и безопасностью применения. Хорошо изучена эффективность этих средств в лечении патологии суставов [12–15], тогда как в лечении хронической боли в спине они используются значительно реже [16–18]. В ряде работ показано, что такие компоненты хондропротекторных препаратов, как глюкозамин и хондроитин, в больших дозах обладают определенными противовоспалительными эффектами и уменьшают боль [19–24]. Мы также имеем позитивный клинический опыт применения хондропротекторов при лечении мышечно-скелетных и вертеброгенных болевых синдромов [10, 11, 25, 26].
Использование хондропротекторов стимулирует продукцию основных компонентов хряща (прежде всего протеогликанов) в хондроцитах и тем самым способствует замедлению дегенерации хрящевой ткани с восстановлением ее структуры [27–30]. Кроме того, опыт применения различных хондропротекторов при дегенеративных поражениях суставов конечностей показал, что хондропротекторы способствуют более быстрому купированию болевого синдрома, предупреждению повторных обострений, восстановлению подвижности пораженных суставов и даже, возможно, увеличению толщины суставного хряща [31–33].
Еще одно доказательство необходимости применения хондропротекторов — это наличие воспалительных механизмов в инициации хронических болевых синдромов, являющихся реакцией на повреждение тканей и сопровождающихся нейрогенным воспалением в результате высвобождения сенсибилизирующих воспалительных веществ (простагландинов, брадикинина), которые снижают болевые пороги ноцицепторов воспаленной ткани, тем самым увеличивая нейрональную болевую активность [28, 29, 34]. Усиление прогрессирования дегенеративно-дистрофических процессов в межпозвоночных дисках и дугоотростчатых (фасеточных) суставах также сопровождается повышением уровня провоспалительных цитокинов.
С учетом вышеизложенного для лечения БНС наряду с нестероидными противовоспалительными препаратами (НПВП) и миорелаксантами (Практические рекомендации Американской коллегии врачей, 2017) для повышения эффективности терапии, несмотря на все контраверсии, необходимы препараты, патогенетическое действие которых опосредуется как улучшением состояния межпозвоночных дисков, фасеточных суставов, так и уменьшением выраженности воспалительных процессов в этих структурах.
Поэтому в комплексном лечении БНС представляется целесообразным использование лекарственных средств, называемых препаратами замедленного действия (SYSADOA — symptomatic slow acting drugs for osteoarthritis), обладающих симптоматическим и возможным структурно-модифицирующим действием.
Наше внимание привлек препарат Артрида®, состоящий из натриевой соли хондроитина сульфата А и С (средняя молекулярная масса 11 000 дальтон). Хондроитина сульфат — основной компонент протеогликанов, составляющих вместе с коллагеновыми волокнами хрящевой матрикс. Обладает хондропротекторными свойствами; подавляет активность ферментов, вызывающих деградацию суставного хряща; стимулирует выработку хондроцитами протеогликанов; усиливает метаболические процессы в хряще и субхондральной кости; оказывает влияние на фосфорно-кальциевый обмен в хрящевой ткани, стимулирует ее регенерацию, участвует в построении основного вещества костной и хрящевой ткани. Артрида® оказывает противовоспалительный и анальгезирующий эффект благодаря снижению выброса в синовиальную жидкость медиаторов воспаления и болевых факторов через синовиоциты и макрофаги синовиальной оболочки, а также вследствие угнетения секреции лейкотриена В и простагландина Е. Препарат стимулирует регенерацию хрящевой ткани, оказывает хондропротекторное действие, заменяя хондроитина сульфат суставного хряща. Угнетает активность энзимов, способствующих деградации хряща: ингибирует металлопротеиназы, а именно лейкоцитарную эластазу. Снижает активность гиалуронидазы, частично блокирует выброс свободных кислородных радикалов, способствует блокированию хемотаксиса, антигенных детерминант.
Артрида® замедляет резорбцию костной ткани и уменьшает потери кальция, ускоряет процессы восстановления костной ткани.
В настоящем исследовании нам представлялось интересным отследить анальгетический эффект препарата Артрида®, а также определить его влияние на восстановление двигательной активности у пациентов с болью в нижней части спины.
Цель исследования: оценка динамики болевого синдрома и функциональной активности пациента с болью в нижней части спины на фоне применения препарата Артрида®.
Материалы и методы
Под нашим наблюдением находилось 57 пациентов в возрасте от 40 до 60 лет с болью в нижней части спины. Все пациенты имели актуальный болевой синдром длительностью от 3 до 7 дней и в анамнезе от 1 до 7 эпизодов острой дорсалгии на протяжении от 1 года до 6 лет. Таким образом, болевой синдром носил хронический рецидивирующий характер с обострением в момент наблюдения, что требовало лечения острой –дорсалгии.
Для выполнения поставленной цели из исследуемых были сформированы две группы наблюдения, различающиеся по терапевтической тактике.
Первая группа (основная) состояла из 30 пациентов (12 женщин, 18 мужчин) в возрасте 41–57 лет (средний возраст — 49 лет). Вторая группа — сравнения — включала 27 больных соответствующего возраста и пола. Группы были сопоставимы по давности заболевания и выраженности болевого и вертебрального синдромов. Анализ показал, что у большинства пациентов в целом и по группам боль имеет умеренный и выраженный характер в покое и выраженный при движении.
Критериями включения в исследование были: наличие актуального болевого синдрома с локализацией в поясничной области позвоночника с интенсивностью по ВАШ более 30 мм, наличие эпизодов острой боли в анамнезе с давностью первого болевого эпизода не менее 3 месяцев (давность первого эпизода боли у наших пациентов составила от 1 до 6 лет), а также отсутствие в предыдущих схемах лечения кортикостероидных препаратов и хондропротекторов. Критериями исключения были: наличие воспалительных и объемных образований позвоночника, предшествующий прием хондропротекторов и глюкокортикоидов.
Больным проводилось клиническое неврологическое, общесоматическое (для исключения ишемической болезни сердца, изменений в крови воспалительного характера) обследование. Для оценки структурных изменений пациентам проводилась нейровизуализация с помощью МРТ. Структурные дегенеративно-дистрофические изменения в позвоночнике были представлены протрузиями межпозвоночных дисков на поясничном уровне в 1 позвоночном двигательном сегменте (ПДС) — у 9 пациентов, в 2 ПДС — у 7 пациентов, в 3 ПДС — у 5 пациентов, грыжами дисков в 1 ПДС — у 12 пациентов, в 2 ПДС — у 11 пациентов, сочетанием протрузий и грыжи — у 11 пациентов с величиной грыжевого выпячивания от 3 до 6 мм.
У пациентов обеих групп применялись комплексы немедикаментозной терапии (биомеханическая коррекция позвоночника, мануальная терапия, акупунктура, массаж, лечебная гимнастика в сочетании с НПВП и при необходимости с миорелаксантами). В основной группе дополнительно был назначен препарат Артрида® согласно инструкции в стандартной дозировке внутримышечно 25 инъекций.
Контроль эффективности терапии осуществлялся на основании анализа динамики неврологического статуса, выраженности болевого синдрома с использованием 100 мм визуально-аналоговой шкалы (умеренная — от 30 до 50 мм, сильная — 50–70 мм, очень сильная — 70–100 мм), а также категорий — спонтанная боль, боль при движении, степень ограничения функции исходно и на фоне терапии.
Функциональное состояние пациентов определялось по шкале WOMAK (Western Ontario and Universities Osteoartritis Index). Индекс WOMAC исследовался в трех категориях: боль, ограничение по–движности и затруднения в выполнении повседневной деятельности.
Кроме того, для оценки клинического эффекта использовалась шкала общего клинического впечатления, предусматривающая следующие градации: 1 балл — ухудшение; 0 баллов — отсутствие эффекта; 1 балл — незначительно выраженный эффект; 2 балла — умеренный эффект; 3 балла — значительный эффект.
Указанные шкалы позволяли оценить динамику болевого синдрома, ограничения повседневной активности и функциональной способности пациента, что являлось важным для выполнения поставленной нами цели. Динамическое наблюдение осуществлялось в следующие сроки: начало лечения, 10-й день терапии (для определения анальгетического эффекта), 30-й и 60-й дни терапии (для выяснения влияния препарата Артрида® на восстановление подвижности и повседневную деятельность пациента).
Результаты
Основными неврологическими синдромами у всех обследованных больных были болевой, мышечно-тонический и вертебральный, проявлявшийся в измененной биомеханике позвоночника, нарушении осанки, походки, подвижности позвоночника и т.п. Пациенты жаловались на боли в пояснично-крестцовой области, в области тазобедренного сустава, бедра, голени, усиливающиеся при определенных движениях, на состояние скованности, ограничение подвижности в позвоночнике, нарушение походки. Все пациенты имели измененный биомеханический паттерн, обусловленный мышечно-тоническим синдромом мышцы, выпрямляющей позвоночник, миофасциальным синдромом ишиокруральной мускулатуры, грушевидной мышцы, дисфункцией дугоотростчатых и крестцово-подвздошных суставов, что вызывало перегрузку некоторых отделов позвоночного столба, усиливало болевые проявления и способствовало, по-видимому, нарастанию дегенеративных процессов в позвоночнике.
В целом у пациентов обеих групп под влиянием терапии отмечалась положительная динамика в виде уменьшения болей и скованности движений, но выраженность болевого синдрома у пациентов основной группы оказывалась достоверно ниже на всех этапах анализа (10, 30, 60-й день), причем это касалось не только спонтанной боли, но и боли при движении, что характеризовало в том числе и подвижность, связанную с восстановлением двигательного паттерна (рис. 1, 2).
/39-1.jpg)
/40-1.jpg)
Как видно из представленных данных, присоединение препарата Артрида® к НПВП приводило к повышению эффективности терапии, выражавшемуся в усилении анальгетического эффекта и ускорении купирования болевого синдрома. Анализ состояния пациентов через 10 дней после начала лечения показал, что 90 % больных основной группы жаловались на незначительную спонтанную боль и отмечали более выраженное снижение боли при движении, чем пациенты группы сравнения, что позволило отменить им НПВП. Пациенты же группы сравнения имели умеренный болевой синдром, особенно при движении, что ограничивало их повседневную функциональную активность. Так, у пациентов основной группы наблюдалось уменьшение ограничения повседневной активности уже к десятому дню лечения. На 10-й день терапии повседневную активность из-за боли в спине ограничивали 12 (40 %) пациентов, на 30-й день лечения — 10 % больных, тогда как во второй группе — соответственно 55,5 и 28,5 %.
Анализ состояния пациентов через 60 дней после начала лечения показал, что все больные основной группы не были ограничены в повседневной активности и жаловались на незначительную боль, что позволило отменить им НПВП. Пациенты же группы сравнения имели болевой синдром, который они оценивали как незначительный, но все же ограничивающий повседневную активность.
Позитивная динамика болевого синдрома, скованности и двигательной активности была подтверждена при анализе показателей WOMAC (рис. 3).
Как видно на рис. 3, улучшение функционального состояния по WOMAC наблюдалось в обеих группах больных, однако более выраженное улучшение двигательной активности было достигнуто в основной группе.
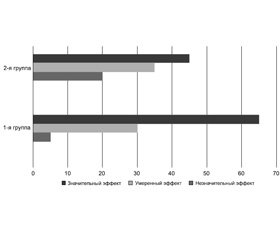
В целом эффективность терапии у пациентов обеих групп распределилась следующим образом (рис. 4).
Как видно из представленных данных, присоединение препарата Артрида® к НПВП приводило к повышению эффективности терапии, выражавшемуся в усилении анальгетического эффекта, и ускорению купирования болевого синдрома. Важным также представляется аспект воздействия препарата Артрида® на восстановление функциональной активности пациентов с болью в нижней части спины. Следует подчеркнуть, что эффективность хондропротекторов повышается благодаря рациональному применению двигательного режима и лечебной гимнастики.
Немаловажным является также переносимость препарата и его безопасность. Необходимо отметить, что все пациенты хорошо переносили лечение, побочных явлений, требующих отмены препарата, не было выявлено. Все пациенты закончили исследование в запланированном режиме.
Обсуждение
Курс лечения препаратом Артрида® № 25 привел к достоверному снижению интенсивности болевого синдрома в основной группе пациентов. Уменьшение боли отмечалось с 10-го дня инъекций, достигало максимума к завершению курса. В результате терапии отмечено достоверное улучшение двигательных функций пациентов, что является важным фактором профилактики рецидивов и хронизации боли.
Результаты нашего исследования показали, что у пациентов с хронической болью в нижней части спины Артрида® оказывает обезболивающее действие в довольно короткие сроки, по-видимому, за счет компонентов, обладающих противовоспалительными свойствами. Во многих работах подчеркивается, что хондропротективные препараты, содержащие глюкозамина сульфат, хондроитин и др., обладают противовоспалительными свойствами и могут уменьшать боль независимо от структурно-модифицирующего эффекта [4, 5, 8, 11, 12]. Одним из результатов проведенного исследования было достоверное уменьшение степени нарушения функциональных способностей пациента на фоне лечения, оцениваемых по шкале WOMAK. С нашей точки зрения, этот результат чрезвычайно важен, так как скорейшее возвращение пациента к повседневной двигательной активности является главным фактором профилактики рецидивов и препятствует хронизации боли [1–3]. Известно, что при хронической боли в спине длительный постельный режим, отказ от физических нагрузок ассоциированы с плохим прогнозом восстановления и уменьшения интенсивности боли. Важным при этом, с нашей точки зрения, является регулярное выполнение пациентами лечебной гимнастики. В нашей работе мы показали, что постепенное снижение интенсивности боли начиная с 10-го дня лечения препаратом Артрида® позволило пациентам исследуемой группы быстрее восстановить свои двигательные функциональные способности.
Выводы
Таким образом, применение препарата Артрида® показало свою эффективность в комплексной терапии болевого синдрома в нижней части спины. Причем на этапе актуального болевого синдрома сочетание препарата Артрида® и НПВП усиливало анальгетический эффект последних, что приводило к более ранней их отмене, сокращало сроки купирования болевого синдрома и, соответственно, усиливало общий клинический эффект. Это позволяло сокращать сроки и дозы приема НПВП, что важно для снижения лекарственной нагрузки. Кроме того, препарат Артрида® способствовал улучшению биомеханических показателей в силу хондропротекторной активности и способствовал улучшению функциональной способности пациентов.
Повышение эффективности комплексной терапии с включением препарата Артрида® связано, с одной стороны, с усилением и ускорением анальгетического эффекта, а с другой — с положительным влиянием препарата Артрида® на увеличение объема движений в позвоночнике и суставах и усиление повседневной активности, что сочеталось с ускорением улучшения биомеханического паттерна.
Конфликт интересов. Не заявлен.
Список литературы
1. Юмашев Г.С. Остеохондрозы позвоночника / Г.С. Юмашев, М.Е. Фурман. — 2-е изд. — М.: Медицина, 1984. — 384 с.
2. Вознесенская Т.Г. Боли в спине и конечностях / Т.Г. Вознесенская // Болевые синдромы в неврологической практике / Под ред. А.М. Вейна. — М.: Медпресс, 1999. — С. 217-83.
3. Подчуфарова Е.В. Хронические боли в спине: патогенез, диагностика, лечение / Е.В. Подчуфарова // РМЖ. — 2003. — 11 (25). — 32-7.
4. Поворознюк В.В. Боль в нижней части спины. Распространенность, причины, механизмы развития и особенности диагностики / В.В. Поворознюк // Боль. Суставы. Позвоночник. — 2011. — № 1 (01). — С. 7-14.
5. Данилов А.Б. Болевые синдромы / А.Б. Данилов // Неврология. Национальное руководство. — 2009. — С. 423-441.
6. Бадокин В.В. Значение воспаления в развитии и течении остеоартроза / В.В. Бадокин // Cons. Med. — 2009. — 11 (9). — 91-5.
7. Вейн А.М. Боль и обезболивание / А.М. Вейн, М.Я. Авруцкий. — М.: Медицина, 1997. — С. 3-164.
8. Мамчур В.Й. Фармнагляд лікарських засобів, що використовуються при патології опорно-рухового апарату / В.Й. Мамчур, В.І. Опришко, Д.С. Носівець // Biomedical and biosocial anthropology. — 2013. — № 21. — С. 219-221.
9. Левин О.С. Как предупредить хронизацию боли в спине: роль хондропротекторов / О.С. Левин // Consilium Medicum. — 2015. — № 17 (2). — С. 75-78.
10. Морозова О.Г. Эффективность применения хондропротекторов в лечении вертеброгенных дорсалгий / О.Г. Морозова, А.А. Ярошевский // Международный неврологический журнал. — 2011. — № 4. — С. 76-78.
11. Ярошевский А.А. Современные принципы диагностики и лечения вертеброгенных болевых синдромов / А.А. Ярошевский // Международный неврологический журнал. — 2013. — № 2 (56). — С. 43-45.
12. Гроппа Л.Г., Мынзату И., Карасава М. и др. Эффективность алфлутопа у больных деформирующим артрозом / Л.Г. Гроппа, И. Мынзату, М. Карасава и др. // Клин. ревматол. — 1995. — 3. — 20-28.
13. Henrotin Y. Intra-articular use of a medical device composed of hyaluronic acid and chondroitin sulfate (Structovial CS): effects on clinical, ultrasonographic and biological parameters / Y. Henrotin, J.P. Hauzeur, P. Bruel, T. Appelboom // BMC Res. Notes. — 2012. — Vol. 5. — Р. 407.
14. Schneider H. Symptom-modifying effect of chondroitin sulfate in knee osteoarthritis: a meta-analysis of randomized placebo-controlled trials performed with Structum® / Н. Schneider, Е. Maheu, М. Cucherat // The Open Rheumatology Journal. — 2012. — Vol. 6. — Р. 183-189.
15. Railhac J.J. Effect of 12 months treatment with chondroitin sulfate on cartilage volume in knee osteoarthritis patients: a randomized, double-blind, placebo-controlled pilot study using MRI / J.J. Railhac, M. Zaim, A.S. Saurel, J. Vial, B. Fournie // Clin. Rheumatol. — 2012. — Vol. 31, № 9. — Р. 1347-1357.
16. Гориславец В.А. Структурно-модифицирующая терапия неврологических проявлений остеохондроза позвоночника / В.А. Гориславец // Cons. Med. — 2010. — 12 (9). — 62-7.
17. Баранцевич Е.Р. Рациональная терапия дорсалгий / Е.Р. Баранцевич // Managepain. — 2017. — № 2. — С. 3-7.
18. Левин О.С. Хроническая боль в спине: возможности предупреждения и лечения / О.С. Левин // Терапия. — 2016. — № 5 (9). — С. 104-109.
19. Мамчур В.Й. Фармакологія хондропротекторів. Можливості медикаментозного захисту синовіальних суглобів і хрящової тканини / В.Й. Мамчур, Д.С. Носивець // Фармацевтичний кур’єр. — 2013. — № 5. — С. 22-27.
20. Walsh A.J. Glucosamine HCl alters production of inflammatory mediators by rat intervertebral disc cells in vitro / A.J. Walsh, C.W. O'Neill, J.C. Lotz // Spine J. — 2007. — 7 (5). — 601-8.
21. Носивец Д.С. Возможные механизмы анальгезии при фармакотерапии хондропротекторами / Д.С. Носивец // Мат-лы науч.-практ. конф. «Филатовские чтения — 2016». — Одесса, 2016. — С. 222.
22. Du Souich P. Immunomodulatory and anti-inflammatory effects of chondroitin sulphate / Р. Du Souich // European Musculoske–letal Review. — 2009. — 4 (2). — 8-10.
23. Носивец Д.С. Изменение болевого порога у крыс при экспериментальном остеоартрозе после введения хондроитина сульфата / Д.С. Носивец // Мат-лы V Национального съезда фармакологов Украины. — Запорожье, 2017. — С. 101.
24. Носивец Д.С. Системный обзор международных исследований по применению Алфлутопа в комплексной фармакотерапии болевого синдрома в области спины / В.И. Опрышко, Д.С. Носивец // Международный неврологический журнал. — 2018. — № 1 (95).
25. Ярошевский А.А. Скелетно-мышечная боль: пути повышения эффективности терапии / А.А. Ярошевский // Международный неврологический журнал. — 2014. — № 3 (65). — С. 102-108.
26. Ярошевский А.А. Анализ использования хондропротекторов в комплексной терапии вертеброгенной дорсалгии / А.А. Ярошевский // Международный неврологический журнал. — 2014. — № 1 (63). — С. 75-81.
27. Носивец Д.С. Морфометрическая оценка состояния суставов крыс при экспериментальном остеоартрозе на фоне введения хондроитина сульфата / Д.С. Носивец // Сучасні аспекти клінічної фармакології на тлі досягнень доказової медицини / Мат-лы ІХ Всеукраїнської наук.-практ. конф. з міжнародною участю, 16–17 листопада 2017 року. — Вінниця: Нілан-ЛТД, 2017. — С. 76-83.
28. Risbud M.V. Cytokines role in degeneration of intervertebral disks / M.V. Risbud, I.M. Shapiro // Nat. Rev. Rheumatol. — 2014. — 10 (1). — 44-56.
29. Le Maitre C.L. The role of interleukin-1 in the pathogenesis of human intervertebral disc degeneration / C.L. Le Maitre, A.J. Freemont, J.A. Hoyland // Arthritis Res. Ther. — 2007. — 9. — R77 [Pubmed: 17688691].
30. Chen L. Hyaluronic acid in combination with chondroitin sulfate and hyaluronic acid improved the degeneration of synovium and cartilage equally in rabbits with osteoarthritis / L. Chen, P.X. Ling, Y. Jin, T.M. Zhang // Drug Discov. Ther. — 2011. — Vol. 5, № 4. — Р. 190-194.
31. Шавловская О.А. Обзор зарубежной литературы по применению хондроитина сульфата / О.А. Шавловская // РМЖ. — 2012. — № 34. — С. 1678.
32. Майко О.Ю. Влияние курсового лечения с применением хондропротекторов и нестероидных противовоспалительных препаратов на качество жизни больных остеоартрозом / О.Ю. Майко, Г.Г. Багирова // Клиническая медицина. — 2009. — Т. 87, № 4. — С. 47-54.
33. Gilron I. Combination pharmacotherapy for management of chronic pain: from bench to bedside / I. Gilron, Т. Jensen, А. Dickenson // Lancet Neurol. — 2013. — 12. — 1084-1095.
34. Murata Y. Local application of interleikin-6 to the dorsal root ganglion induces tumor necrosis factor in the dorsal root ganglion and results in apoptosis of the dorsal root ganglion cells / Y. Murata et al. // Spine. — 2011. — 36. — 926-932 [Pubmed: 21192292].

/39-1.jpg)
/40-1.jpg)
/40-2.jpg)
/41-1.jpg)