Журнал «Почки» Том 7, №4, 2018
Вернуться к номеру
Сравнительная эффективность различных подходов к метафилактике часто рецидивирующих инфекций мочевой системы
Авторы: Шостак М.В., Костев Ф.И., Лукинюк Е.И.
Одесский национальный медицинский университет, г. Одесса, Украина
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Проведено порівняльне відкрите проспективне дослідження клініко-лабораторної ефективності та безпеки прийому препарату фосфоміцину трометамолу Еспа-фоцин і препарату золотарника звичайного Цисто-аурин виробництва Еsparma GmbH у 126 хворих на часто рецидивуючу інфекцію сечовивідних шляхів (РІСШ), рандомізованих у чотири статистично однорідні групи. У ході лікування пацієнтки всіх груп використовували стратегію поведінкової терапії та посткоїтальної профілактики. Пацієнтки групи А (n = 32) також приймали Цисто-аурин по 1 табл. 4 р. на день курсами по 15 днів кожного місяця протягом 6 міс., групи В (n = 34) — той же препарат по 2 табл. 2 р. на день курсами по 15 днів кожного місяця протягом 6 міс., групи D (n = 30) — Еспа-фоцин 3 г один раз у 10 днів протягом 6 міс., пацієнтки групи порівняння С (n = 30) спеціальної терапії не отримували. Ефективність лікування оцінювалася протягом 12 місяців від початку дослідження, з контрольними візитами через 15 днів, 3, 6, 9 і 12 місяців від рандомізації. У ході дослідження отримано пул об’єктивних даних, що свідчать про вірогідне зниження числа рецидивів РІСШ протягом 6 міс. лікування у хворих клінічних груп, а також протягом проспективного 6-місячного періоду. За даними шкали продуктивності, позитивний клінічний ефект відзначений у 83,3 % груп Цисто-аурину, у 93,3 % хворих групи Еспа-фоцину, а також у 20 % пацієнток групи порівняння. В активній фазі лікування протирецидивна ефективність була вірогідно вищою серед хворих групи D, де зниження кількості рецидивів протягом перших трьох місяців лікування становило 86,8 % і досягнутий показник (0,07 ± 0,09 рецидиву за 3 міс.) зберігався незмінним до закінчення прийому препарату. Відповідна динаміка в групах А і В була нижчою — 69,2 і 60 % протягом 3 міс. і 92,3 і 73,3 % протягом 6 міс.; у хворих групи порівняння аналогічні показники становили 21,4 і 7,1 % відповідно. Вірогідне зниження лейкоцитурії у пацієнток клінічних груп було досягнуто вже через 15 днів прийому препарату: на 57,9 % в групі D та на 33,9 і 27,5 % в групах А і В і протягом усього періоду лікування на 78,1, 73,4 і 44,6 %, тобто в 4,6, 3,7 і 1,8 раза нижче вихідних значень відповідно. У проспективний період спостереження у хворих груп А і В рівень лейкоцитурії зберігався вірогідно нижчим від базових показників — на 49,2 і 34,2 % (р < 0,01), тоді як серед пацієнток групи фосфоміцину практично повернувся до початкових показників. Динаміка бактеріурії та піурії в групі D характеризувалася істотно більшою швидкістю й амплітудою проявів пікової ефективності антибактеріальної активності, але більш швидкою реверсією клініко-лабораторних результатів порівняно з аналогічними показниками прийому Цисто-аурину. Амплітуда і швидкість усунення клінічних симптомів за UTISA серед пацієнток, які приймали Еспа-фоцин, була значно вищою, ніж у хворих, які використовували препарат золотарника (ΔM = 58,15 проти 41,2 %), однак з настільки ж прогресивною реверсією клінічних проявів РІСШ після відміни лікування. Більш повільна динаміка клінічної ефективності в групах А і В поєднувалася з настільки ж плавною інверсією сукупності симптомів патології. За амплітудою клінічної ефективності при РІСШ ефективність інтермітуючого прийому Цисто-аурину порівнянна з фосфоміцином. Швидкість наростання клінічного результату при терапії препаратом золотарника в 1,5 раза повільніша, сила проявів на 24,7 % нижча, тоді як стійкість дії після скасування прийому — в 1,45 раза більша порівняно з антибіотикотерапією. Збільшення кратності прийому Цисто-аурину забезпечує більш високий клінічний результат при незмінній тривалості ефекту. Порівняльна інтегральна ефективність різних режимів інтермітуючої терапії за ключовими показниками динаміки клінічних, лабораторних даних і якості життя дозволяє рекомендувати прийом препарату фосфоміцину Еспа-фоцин для лікування РІСШ, що супроводжуються агресивним перебігом, високою бактеріурією і лейкоцитурією, поєднанням різних уропатогенів у культуральному дослідженні. Інтермітуючий прийом Цисто-аурину має пріоритет при помірній бактеріурії, необхідності значної тривалості протирецидивного лікування, у хворих із вираженою індукцією фунгінальної активності при РІСШ, пов’язаними з персистенцією С.albicans, локальними і системними проявами дисбіозів.
Проведено сравнительное открытое проспективное исследование клинико-лабораторной эффективности и безопасности приема препарата фосфомицина трометамола Эспа-фоцин и препарата золотарника обыкновенного Цисто-аурин производства Еsparma GmbH у 126 больных часто рецидивирующей инфекцией мочевыводящих путей (РИМП), рандомизированных в четыре статистически однородные группы. В ходе лечения пациентки всех групп использовали стратегию поведенческой терапии и посткоитальной профилактики. Пациентки группы А (n = 32) также принимали Цисто-аурин по 1 табл. 4 р. в день курсами по 15 дней каждого месяца в течение 6 мес., группы В (n = 34) — тот же препарат по 2 табл. 2 р. в день курсами по 15 дней каждого месяца в течение 6 мес., группы D (n = 30) — Эспа-фоцин 3 г 1 раз в 10 дней в течение 6 мес., пациентки группы сравнения С (n = 30) специальной терапии не получали. Эффективность лечения оценивалась на протяжении 12 мес. от начала исследования, с контрольными визитами через 15 дней, 3, 6, 9 и 12 месяцев от рандомизации. В ходе исследования получен пул объективных данных, свидетельствующих о достоверном снижении числа рецидивов РИМП в течение 6 мес. лечения у больных клинических групп, а также на протяжении проспективного 6-месячного периода. По данным шкалы продуктивности, позитивный клинический эффект отмечен у 83,3 % больных из группы Цисто-аурина, у 93,3 % больных из группы Эспа-фоцина, а также у 20 % пациенток группы сравнения. В активной фазе лечения противорецидивная эффективность была достоверно выше среди больных группы D, где снижение количества рецидивов в течение первых трех месяцев лечения составило 86,8 % и достигнутый показатель (0,07 ± 0,09 рецидива за 3 мес.) сохранялся неизменным до окончания приема препарата. Соответствующая динамика в группах А и В была ниже — 69,2 и 60 % в течение 3 мес. и 92,3 и 73,3 % в течение 6 мес.; у пациенток из группы сравнения аналогичные показатели составили 21,4 и 7,1 % соответственно. Достоверное снижение лейкоцитурии у пациенток клинических групп было достигнуто уже через 15 дней приема препарата, на 57,9 % в группе D и на 33,9 и 27,5 % в группах А и В, и в течение всего периода лечения на 78,1, 73,4 и 44,6 %, т.е. в 4,6, 3,7 и 1,8 раза ниже исходных значений соответственно. В проспективный период наблюдения у больных групп А и В уровень лейкоцитурии сохранялся достоверно ниже базовых показателей — на 49,2 и 34,2 % (р < 0,01), в то время как среди пациенток группы фосфомицина практически возвратился к исходным показателям. Динамика бактериурии и пиурии в группе D характеризовалась существенно большей скоростью и амплитудой проявления пиковой эффективности антибактериальной активности, но более быстрой реверсией клинико-лабораторных результатов по сравнению с аналогичными показателями после приема Цисто-аурина. Амплитуда и скорость устранения клинических симптомов по UTISA среди пациентов, принимавших Эспа-фоцин, была значительно выше, чем у больных, использовавших препарат золотарника (ΔM = 58,15 против 41,2 %), однако со столь же прогрессивной реверсией клинических проявлений РИМП после отмены лечения. Более медленная динамика клинической эффективности в группах А и В сочеталась со столь же плавной инверсией совокупности симптомов патологии. По амплитуде клинической эффективности при РИМП эффективность интермиттирующего приема Цисто-аурина сопоставима с фосфомицином. Скорость нарастания клинического результата при терапии препаратом золотарника в 1,5 раза медленнее, сила проявлений на 24,7 % ниже, тогда как стойкость действия после отмены приема — в 1,45 раза больше по сравнению с антибиотикотерапией. Увеличение кратности приема Цисто-аурина обеспечивает более высокий клинический результат при неизменной длительности эффекта. Сравнительная интегральная эффективность различных режимов интермиттирующей терапии по ключевым показателям динамики клинических, лабораторных данных и качества жизни позволяет рекомендовать прием препарата фосфомицина Эспа-фоцин для лечения РИМП, сопровождающихся агрессивным течением, высокой бактериурией и лейкоцитурией, сочетанием различных уропатогенов в культуральном исследовании. Интермиттирующий прием Цисто-аурина имеет приоритет при умеренной бактериурии, необходимости значительной продолжительности противорецидивного лечения, у больных с выраженной индукцией фунгинальной активности и РИМП, связанными с персистенцией С.albicans, локальными и системными проявлениями дисбиозов.
An open-label comparative prospective study of the clinical and laboratory efficacy and safety of Espa-Focin (fosfomycin trometamol) and Cysto-Aurin (goldenrod preparation) manufactured by Еsparma GmbH was performed in 126 female patients with recurrent urinary tract infections (reUTI), who were randomized into four statistically homogeneous groups. During the treatment, patients of all groups used the strategy of behavioral therapy and post-coital prophylaxis. Patients of group A (n = 32) also received Cysto-Aurin 1 tablet qid, in courses of 15 days each month for 6 months, group B (n = 34) — the same drug 2 tablets bid in courses of 15 days each month for 6 months, groups D (n = 30) — Espa-Focin 3 g once every 10 days for 6 months, patients of the comparison group C (n = 30) did not received any special therapy. Treatment efficacy was evaluated within 12 months from the start of the study, with follow-up visits in 15 days, 3, 6, 9 and 12 months from randomization. During the study, a pool of objective data was obtained, indicating a significant decrease in the number of reUTI within 6 months of treatment in patients of clinical groups, as well as during a prospective 6-month period. According to the scale of productivity, a positive clinical effect was observed in 83.3 % of Cysto-Aurin patients, in 93.3 % of persons in Espa-Focin group, and also in 20 % of the comparison group. In the active phase of treatment, anti-relapse efficacy was significantly higher among patients of group D, where the reduction in the number of relapses during the first three months of treatment was 86.8 % and the achieved rate (0.07 ± 0.09 relapses for 3 months) remained unchanged until the end of the drug administration. The corresponding dynamics in groups A and B was lower — 69.2 and 60 % for 3 months and 92.3 and 73.3 % for 6 months; in patients of the comparison group, these figures were 21.4 and 7.1 %, respectively. A significant decrease in leukocyturia in patients of clinical groups was achieved after 15 days of taking the drug, by 57.9 % in group D and by 33.9 and 27.5 % in groups A and B, and during the entire period of treatment — by 78.1, 73.4 and 44.6 %, i.e. 4.6, 3.7 and 1.8 times lower than baseline values, respectively. In the prospective follow-up period, in patients of group A and B, the level of leukocyturia remained significantly lower than the baseline values — by 49.2 and 34.2 % (p < 0.01), while among patients of the fosfomycin group, it almost returned to baseline values. The dynamics of bacteriuria and pyuria in group D was characterized by a significantly higher rate and amplitude of manifestation of peak efficacy of antibacterial activity, but faster reversion of clinical and laboratory results, compared with similar indicators after Cysto-Aurin intake. The amplitude and rate of elimination of clinical symptoms on UTISA questionnaire among patients taking Espa-Focin was significantly higher than among patients using goldenrod (ΔM = 58.15 versus 41.2 %), however, with an equally progressive reversion of reUTI clinical manifestations after discontinuation of treatment. The slower dynamics of clinical efficacy in groups A and B was combined with the moderate inversion of symptoms of the pathology. According to the amplitude of clinical efficacy, in case of reUTI, the efficacy of intermittent administration of Cysto-Aurin is comparable with that of fosfomycin. The rate of increase of the clinical effectiveness during therapy with goldenrod is 1.5 times slower, the strength of manifestations is 24.7 % lower, whereas the duration of the action after discontinuation is 1.45 times higher compared to antibiotic therapy. An increase in the frequency of Cysto-Aurin administration (per day) provides a higher clinical result with a constant duration of the effect. Comparative integral efficiency of different modes of intermittent therapy, according to key indicators of clinical, laboratory data and quality of life, allows us recommending the administration of Espa-Focin for reUTI, which is accompanied by an aggressive course, high bacteriuria and leukocyturia, a combination of different uropathogens in culture. Intermittent administration of Cysto-Aurin has priority in case of moderate bacteriuria, the necessity for a prolonged duration of anti-relapse treatment in patients with significant induction of fungal activity and reUTI associated with the persistence of C.albicans, local and systemic manifestations of dysbiosis.
інфекції сечової системи; рекурентний цистит; часто рецидивуюча інфекція сечовивідних шляхів; цистит; фосфоміцин; золотарник; Solidago Virgaurea; профілактика циститу; метафілактика інфекцій сечовивідних шляхів; Цисто-аурин; Еспа-фоцин
инфекции мочевой системы; рекуррентный цистит; часто рецидивирующая инфекция мочевыводящих путей; цистит; фосфомицин; золотарник; Solidago Virgaurea; профилактика цистита; метафилактика инфекций мочевыводящих путей; Цисто-аурин; Эспа-фоцин
urinary tract infections; recurrent cystitis; recurrent urinary tract infections; cystitis; fosfomycin; goldenrod; solidago virgaurea; prevention of cystitis; metaphylaxis of urinary infections; Cysto-Aurin; Espa-Focin
Введение
Часто рецидивирующие инфекции мочевыводящих путей (РИМП) относятся к распространенной, финансово затратной и социально дезадаптирующей хронической патологии, преимущественно поражающей женщин как репродуктивного, так и постменопаузального возраста. Согласно действующему определению Европейской урологической ассоциации (EAU), к РИМП относятся неосложненные инфекции мочевыводящих путей (ИМП), имеющие 3 и более эпизода обострений за год или 2 и более эпизода за полгода [1–5]. Данная проблема стоит особняком среди патологий мочевой системы, характеризуясь особыми проявлениями клиники и динамики, уникальным патогенезом, связанным с бактериальной колонизацией подлежащих слоев уротелия, кумуляцией внутриклеточных сообществ уропатогенов в клетках организма-хозяина [6, 7], формированием «тихих» микробных резервуаров инвазивных штаммов E.coli в субэпителиальном слое стенки мочевого пузыря, ограничением активности полиморфноядерных нейтрофилов и редукцией звеньев гуморального и локального клеточного иммунитета. При этом происходит интраэпителиальное накопление латентных форм резистентных возбудителей, а также формирование биопленок и клеток-персистеров [8].
РИМП — причина значительного снижения качества жизни, связанного со здоровьем, и изменений личности пациента, обусловленных формированием адаптивного копинг-поведения, снижением самооценки, дезадаптацией и социальной изоляцией. Значительная распространенность патологии, отсутствие действенных стратегий профилактики и метафилактики РИМП, значительные экономические затраты и социальные аспекты, связанные с патологией, определяют приоритетность и высокую актуальность проблемы поиска адекватных средств терапии, профилактики и метафилактики заболевания [9].
Основные векторы действующей стратегии ведения больных РИМП — антибиотикотерапия и антибиотикопрофилактика, а ключевые звенья ее проведения — широта арсенала, доступность и эффективность антимикробных средств [2, 5, 6, 10]. Наиболее используемые средства продолжительной антибиотикопрофилактики в межрецидивном периоде у больных РИМП — фосфомицин и нитрофураны, а также низкие дозы цефалоспоринов и фторхинолонов. Известными негативными проявлениями подобной стратегии являются селекция полирезистентных штаммов уропатогенов, локальная и системная иммуносупрессия, проявления грибковой инфекции, кишечного и генитального дисбиоза и дисбактериоза [11–14]. Между тем драматический рост резистентности основных возбудителей РИМП по отношению к фторхинолонам и цефалоспоринам за последние десятилетия внес существенные ограничения в режим применения препаратов этих групп [14]. Cреди средств, обеспечивающих эффективную антибактериальную метафилактику РИМП, особое место занимает фосфомицин, который отличает эффективность при однодозовом приеме, стабильно низкий уровень приобретения бактериальной резистентности уропатогенов и угнетение формирования перекрестной резистентности к другим группам антибиотиков благодаря уникальным свойствам индукции формирования мутаций, снижающих вирулентность и устойчивость бактерий Enterobacteriaceae. Между тем действующие рекомендации урологических ассоциаций указывают на целесообразность поиска эффективных неантибактериальных средств метафилактики РИМП [1, 2]. Наряду с поведенческой терапией, приемом вакцин и лизатов уропатогенных штаммов Enterobacteriaceae перспективным представляется применение традиционных средств, в частности препаратов на основе золотарника обыкновенного (Solidago virgaurea) [16–19]. Показано, что экстракт золотарника обладает собственной бактерицидной и бактериостатической активностью в отношении ряда уропатогенов, в частности E.coli, Klebsiella pneumoniaе, Proteus mirabilis, Staphylococcus aureus, St.epidermidis, St.faecalis, а также тормозит рост грибов C.albicans, C.krusei, C.tropicalis и других. В то же время, несмотря на значительное количество публикаций о позитивных результатах приема экстракта золотарника в моноисследованиях [8, 9, 15–20, 23], его использование зачастую не может быть в полной мере сопоставимо с антибиотикопрофилактикой за счет различного дизайна исследований и отсутствия возможности интерполяции их результатов с компараторами [1, 11].
Клиническая оценка сравнительной эффективности и терапевтической эквивалентности продолжительной профилактики РИМП приемом антибактериальных и стандартизированных неантибактериальных средств среди статистически однородных групп в рамках одного исследования несет в себе возможность качественной оптимизации действующих подходов к ведению больных данной категории за счет как повышения эффективности, так и улучшения безопасности долговременной метафилактики с использованием данных лечебных средств.
Целью нашего исследования стало повышение эффективности и безопасности лечения, а также улучшение качества жизни больных часто рецидивирующими инфекциями мочевой системы посредством сравнительного исследования интермиттирующего приема препарата фосфомицина трометамола и стандартизированного препарата золотарника обыкновенного.
Материалы и методы
Для реализации цели мы на базе урологической клиники Одесского национального медицинского университета, городской клинической больницы № 10 г. Одессы, медицинского центра «Новые медицинские технологии» провели сравнительное открытое проспективное контролируемое исследование эффективности и переносимости двух препаратов производства немецкой фармацевтической компании esparma GmbH, а именно препарата фосфомицина трометамола ЭСПА-ФОЦИН и оригинального растительного монокомпонентного препарата ЦИСТО-АУРИН. Препарат Цисто-аурин представляет собой стандартизованный сухой экстракт золотарника обыкновенного (Solidago virgaurea), содержащий активное вещество в дозе 300 мг в одной таблетке. Препарат Эспа-фоцин представляет собой порошок для приема внутрь, одна доза которого содержит 3 г фосфомицина трометамола.
В исследование включены 126 пациенток с хроническим рекуррентным циститом (средний возраст 40,3 года). Критериями включения послужили характерные клинические проявления заболевания, наличие трех и более эпизодов обострения цистита на протяжении года (European Association of Urology Guidelines, 2017), отсутствие серьезной сопутствующей патологии, показатель ECOG ≤ 1. Критериями исключения из исследования являлись выраженная сердечная или почечная недостаточность, сахарный диабет и любая серьезная сопутствующая патология, беременность и лактация, а также количество остаточной мочи более 100 мл.
В период рецидива РИМП пациентки отмечали типичные жалобы на учащенные, болезненные микции малыми порциями, ургентные позывы на мочеиспускание, тупые надлобковые боли вне акта мочеиспускания, выделение мутной мочи. На этапе включения в исследование, по данным культурального анализа, больные имели лабораторные проявления бактериурии различной выраженности.
После получения информированного согласия больные были рандомизированы на четыре статистически однородные по возрасту и спектру основных клинических проявлений группы: три основные клинические — группа А (Цисто-аурин 1 табл. 4 р/д), n = 32, группа В (Цисто-аурин 2 табл. 2 р/д), n = 34, группа D (Эспа-фоцин 1 доза в 10 дней), n = 30, а также группу сравнения C, n = 30 (табл. 1). Обследование и лечение проводили в амбулаторных условиях.
Для инициальной диагностики использовали следующие методы: сбор анамнеза, оценка симптомов, заполнение дневника мочеиспусканий, физикальное исследование с осмотром наружных половых органов, общие анализы крови и мочи, ультразвуковое исследование мочевого пузыря, почек и гениталий, биохимическое исследование крови (глюкоза, мочевина, креатинин, функциональные пробы печени), а также заполнение стандартизированных шкал оценки качества жизни, связанного со здоровьем, SF-36 и шкалы оценки симптомов заболевания Urinary Tract Infection Symptom Assessment (UTISA) [21]. Бактериологическое исследование чистой средней порции пузырной мочи проводилось каждые три месяца и включало посев биоматериала на искусственные питательные среды, выделение чистой культуры возбудителя, ее количественную оценку в КОЕ/мл и изучение чувствительности уропатогенов к антибактериальным препаратам.
В ходе лечения пациентки всех групп использовали стратегию поведенческой терапии (не передерживать мочеиспускание, соблюдать тщательную гигиену, ограничение острой и экстрактивной пищи) и посткоитальной профилактики (раннее мочеиспускание и гигиенические процедуры после коитуса). Дополнительно пациентки группы А принимали Цисто-аурин по 1 табл. 4 раза в день курсами по 15 дней каждого месяца в течение 6 месяцев, больные группы В — тот же препарат по 2 табл. 2 раза в день курсами по 15 дней каждого месяца в течение 6 месяцев, пациентки группы D получали препарат Эспа-фоцин в дозировке 3 г один раз в 10 дней в течение 6 месяцев, пациентки группы сравнения С специальной терапии не получали. В случае рецидива РИМП пациентки групп А, В и C симптомно принимали препарат Эспа-фоцин в дозировке 3 г в 0,5 стакана воды однократно. Проспективный период наблюдения составил 6 месяцев после окончания приема исследуемых препаратов.
Оценка эффективности лечения проводилась на протяжении 12 месяцев от начала исследования, с контрольными визитами через 15 дней, 3, 6, 9 и 12 месяцев от рандомизации. Критериями эффективности лечения послужили частота рецидивных эпизодов цистита в проспективный период наблюдения, оценка качества жизни, связанного со здоровьем, по SF-36 в динамике, оценка влияния лечения на выраженность симптомов UTISA с детализацией динамики частоты, характера и эффективности мочеиспусканий, а также динамика лабораторных показателей пиурии и бактериурии.
Результаты и обсуждение
В ходе исследования получены результаты лечения пациенток клинических групп, а также больных группы сравнения. Пациентки, получающие исследуемые препараты на протяжении периода лечения, в целом удовлетворительно переносили назначенную терапию. Негативных проявлений лечения, которые бы повлекли за собой его отмену либо коррекцию приема препаратов, выявлено не было. По данным шкалы продуктивности лечения, в целом позитивный клинический эффект назначенной терапии отмечен у 83,3 % пациенток из групп Цисто-аурина (86,7 % в группе А и 80 % в группе В), у 93,3 % больных группы Эспа-фоцина, а также у 20 % пациенток группы сравнения.
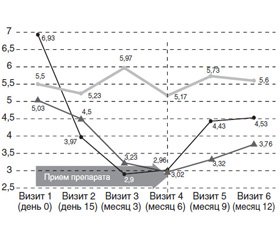
Важнейшим маркером среди объективных показателей результатов противорецидивного лечения пациенток с РИМП, отражающим кумулятивный эффект исследуемых режимов интермиттирующей терапии на течение заболевания, на наш взгляд, стала динамика рецидивных эпизодов. При статистической оценке динамики рецидивов ИМП, фиксируемых повизитно, за предшествующие визиту 3 месяца выявлены групповые закономерности, связанные с приемом исследуемых препаратов. В течение активной фазы лечения (6 месяцев приема препарата) противорецидивная эффективность была достоверно (p < 0,05) выше среди больных группы, принимавшей фосфомицин (Эспа-фоцин), где снижение количества рецидивов цистита в течение первых трех месяцев лечения составило 86,8 % и достигнутый показатель (0,07 ± 0,09 рецидива/3 мес) сохранялся неизменным до окончания приема препарата (рис. 1). Соответствующая динамика при приеме Цисто-аурина была несколько ниже — 69,2 и 60 % в течение 3 месяцев и 92,3 % (группа А) и 73,3 % (группа В) в течение 6 месяцев, в то время как у больных группы сравнения аналогичные показатели составили 21,4 и 7,1 % соответственно.
По окончании лечения в проспективный 6-месячный период наблюдения выявлена регрессия достигнутых показателей в группе D, принимающей антибиотик. Реверсия рецидивных эпизодов в группе D оказалась существенно быстрее соответствующей динамики группы Цисто-аурина — в 1,7 раза. Суммарная эффективность на протяжении всего периода исследования составила в группе Эспа-фоцина 30,2 %, в подгруппах Цисто-аурина 61,5 и 40,0 % соответственно, а в группе сравнения — 21,4 %. При этом статистически достоверной по отношению к исходным данным в течение всего исследования (12 мес.) являлась динамика лишь в группе А (р = 0,02).
Интересной находкой, отмеченной при анализе результатов лечения больных группы Цисто-аурина, стала достоверно более высокая лабораторная и клиническая эффективность препарата при увеличении кратности его приема. Так, среди пациенток группы А по сумме основных оценочных критериев объективной и клинико-лабораторной эффективности получены подтверждения более высокой результативности лечения как в период приема препарата, так и в 6-месячный проспективный период наблюдения по сравнению с больными группы В, принимавшими препарат в идентичной суточной дозе, но в иной кратности.
По ключевым оценочным критериям среди больных основных групп получены статистически достоверные и клинически значимые результаты количества и длительности рецидивов ИМП, частоты и характера мочеиспусканий, позитивной динамики лабораторных показателей пиурии и бактериурии, а также динамики качества жизни на фоне интермиттирующего приема исследуемых средств. Абсолютное большинство включенных в исследование больных с РИМП не имело высоких показателей пиурии на момент начала исследования. В связи с широкой волатильностью лабораторных результатов лейкоцитурии в общем анализе мочи нами категоризированы показатели исследований средней порции мочи в когорты условной нормы (0–5 нейтрофилов в поле зрения), низкой и высокой пиурии (6–10 и 11–30 нейтрофилов соответственно). В процессе лечения у пациенток всех клинических групп достигнуто достоверное снижение лейкоцитурии уже через 15 дней приема препарата (рис. 2): на 57,9 % в группе D и на 33,9 и 27,5 % в группах А и В и в течение всего периода лечения на 78,1, 73,4 и 44,6 %, т.е. в 4,6, 3,7 и 1,8 раза ниже исходных значений соответственно. Интересно, что при отмене препарата, в проспективный период наблюдения, у больных групп А и В уровень лейкоцитурии сохранялся достоверно ниже базовых показателей — на 49,2 % (р < 0,01) и 34,2 % (р < 0,01), в то время как у пациенток группы фосфомицина лейкоцитурия практически возвратилась к исходным показателям (р = 0,26). Среди больных группы сравнения статистически значимой динамики как во время лечения, так и после него выявлено не было.
В ходе исследования получены объективные данные количественных и структурных характеристик бактериурии у больных клинических групп.
Будучи ключевым признаком статистического профиля данной категории больных, бактериурия также является наиболее объективной характеристикой, отражающей эффективность лечебных инициатив по поводу РИМП в динамике.
На протяжении исследования отмечено достоверное снижение показателя степени бактериурии у больных основных групп — в период лечения на 49,9 % в группе D и на 41,0 и 27,6 % в группах А и В соответственно. Между тем на протяжении всего периода наблюдения общая динамика бактериурии (13,5, 30,3, 18,0 % соответственно) была статистически значимой только в подгруппах больных, принимавших препарат золотарника, тогда как в когорте, использовавшей Эспа-фоцин, после отмены препарата через 6 месяцев приема произошел достаточно быстрый регресс изменений к базовым показателям (рис. 3). В то же время скорость нарастания эффекта противомикробной активности у больных группы D была безусловно выше — подавляющее большинство пациенток на фоне лечения не имели значимой бактериурии (104 и выше) уже в первом контрольном исследовании, тогда как нарастание эффекта приема у больных групп А и В носило существенно более медленный характер. Динамика бактериурии в группе сравнения клинически значимых отклонений не выявила.
В отличие от больных с неосложненными ИМП, которым в значительной мере присуща склонность к моноинфекции с превалированием бактерии семейства Enterobacteriaceae, исследуемые пациентки имели в целом существенно больший полиморфизм выявленных уропатогенов с частым сочетанием двух и более в культуральных исследованиях, значимо меньший процент выявляемых культур E.coli и прирост штаммов Klebsiella spp., Proteus spp., а также Candida spp. (табл. 1). Корреляционный анализ симптомов и выявленной микрофлоры, проведенный на этапах включения в исследование, показал достоверно более выраженные клинические проявления рецидивов РИМП (амплитуда выраженности симптомов и степени беспокойства UTISA) в случаях, когда культуральное исследование мочи выявило присутствие Pseudomonas aeruginosa, Proteus mirabilis, Corynebacterium urealyticum, Candida spp. Детальный анализ динамики отдельных уропатогенов по принципу «эрадикация/титр ≤ 103» на фоне лечения показал статистически достоверную редукцию через 6 месяцев отдельных клинически значимых микроорганизмов у больных групп приема препарата: E.coli на 72,3 % в группе D и 43,6 % в группах А и В, Klebsiella pneumoniaе на 88,9 и 43,3 %, P.mirabilis на 76,9 и 43,6 %, Candida spp. на 43,5 и 53,3 % соответственно. Отмена препарата в проспективном периоде характеризовалась прогрессивным нарастанием титров Enterobacteriaceae, при этом среди больных группы D данный эффект был существенно более быстрым. Интересной находкой в когортах групп Цисто-аурина стали достоверно лучшие результаты бактериостатического эффекта в отношении Enterobacteriaceae у пациенток подгруппы А, где эффективность в отношении E.coli и Klebsiella pneumoniaе была на 25,2–33,4 % выше по отношению к аналогичным результатам в подгруппе В, в то же время подобных тенденций в отношении других уропатогенов отмечено не было.
С учетом важности выявления микробно-микробных и микробно-фунгинальных ассоциаций в моче, непосредственно влияющих на патогенез РИМП, одной из задач исследования было изучение динамики числа различных уропатогенов в моче пациенток. Так, на этапе включения в исследование только 35 % наших больных имели моноинфекцию мочевой системы с одним уропатогеном (преимущественно грамотрицательными бактериями семейства Enterobacteriacea), в то время как две трети пациенток имели различные паттерны микробных и микробно-грибковых ассоциаций, среднее число уропатогенов в моче пациенток составило 1,97.
Динамика полиморфизма уропатогенов на фоне лечения характеризовалась статистически достоверным, клинически значимым и стойким снижением по отношению к базовым показателям: среди больных группы D (рис. 4) на 70 % в течение 3 месяцев и сохранялась до конца периода лечения на том же уровне (0,6 ± 0,26, DM = 70,0 %), и имела регрессию при отмене препарата до 1,33 ± 0,30 (DM = 30,0 %). Динамика группы А составила 60,4 %, до 0,87 патогена в течение 6 месяцев с дальнейшей регрессией показателя по окончании проспективного периода наблюдения до 1,33 патогена (DM = 39,5 %). Аналогичные показатели группы В составили 1,13 (DM = 33,5 %) через 6 и 1,1 (DM = 35,3 %) через 12 месяцев после начала лечения. Динамика показателей группы сравнения за то же время статистически достоверных изменений не показала. Примечательно, что, несмотря на регресс полиморфизма уропатогенов при отмене лечения, итоговая эффективность в клинических группах была статистически достоверной по отношению к базовым данным: р = 0,003, р < 0,001, p = 0,04 соответственно. Это позволяет характеризовать исследуемые лечебные подходы как эффективно влияющие на устойчивость межвидовых ассоциаций и полиморфизм уропатогенов у больных с РИМП.
Помимо оценки лабораторной динамики, клиническую эффективность лечения мы оценивали валидизированным инструментом объективизации данных больных — опросником UTISA, с помощью которого вели детальный учет динамики частоты и характера микций, дизурии, урогенитальной боли и дискомфорта. При оценке динамики выраженности поллакиурии (UTISA frequency) в результате лечения у больных клинических групп обнаружено статистически достоверное снижение этого показателя во всех когортах на фоне приема препарата (р < 0,001, табл. 2), тогда как в дальнейшем, после окончания лечения, в группе больных D отмечена прогрессивная редукция достигнутых позитивных изменений. Интересно, что среди больных группы Цисто-аурина достигнутая индукция частоты микций характеризовалась значительной длительностью выраженности: по окончании проспективного периода наблюдения показатель по-прежнему достоверно отличался от базовых значений в обеих подгруппах.
Ургентные (императивные) позывы к мочеиспусканию по сравнению с дизурией и поллакиурией определяют существенно худшее качество жизни больной при РИМП. Известно, что патогенез данного симптома вовлекает качественно иные морфологические и функциональные звенья, а также структуры периферической нервной системы, чем иных проявлений патологии мочевой системы. Динамика императивных позывов на протяжении лечения охарактеризовалась статистически достоверными изменениями и была существенно более высокой среди пациенток группы D по сравнению с группами Цисто-аурина (DM = 62,7 и 44,9 % соответственно), тогда как соответствующий показатель группы сравнения значимых изменений по сравнению с исходными данными не продемонстрировал. Спустя 6 мес. после отмены исследуемого препарата лишь пациентки группы А имели достоверные улучшения по данному признаку относительно базовых показателей.
Одним из возможных объяснений существенных различий силы и длительности клинического эффекта одинаковой суточной дозы Цисто-аурина на проявления ургентности в зависимости от режима приема препарата (табл. 3), на наш взгляд, является фармакокинетика ингибирования цитокинов и простагландинов, более связанная со стабильностью концентрации модулирующего агента в плазме крови, чем с общей суточной дозой.
/25-1.jpg)
При анализе динамики боли и жжения у больных РИМП отмечена существенно более высокая эффективность антибиотикопрофилактики: результат приема Эспа-фоцина у больных группы D характеризовался быстрым, клинически значимым, стойким и статистически достоверным результатом уже через 15 дней от начала лечения. Эффект приема отличался стабильностью проявлений на протяжении всего курса лечения и оставался достоверно высоким на протяжении 6 месяцев после отмены лечения, согласно динамике шкалы оценки соответствующего признака UTISA (табл. 4). Соответствующие изменения у больных групп Цисто-аурина, несмотря на некоторую позитивную тенденцию средних данных в обеих подгруппах, статистически достоверными не были. Также отсутствовала динамика показателя в группе сравнения.
Показатель чувства неполного опорожнения мочевого пузыря UTISA у больных с необструктивным мочеиспусканием, часто отражающий вовлечение в патологический процесс подлежащих слоев уротелия и рефлексогенного аппарата треугольника Льето, имел клиническую значимость со статистически достоверным эффектом среди больных всех клинических групп. Достоверная эффективность устранения симптома отмечена после 15 дней лечения в группе D, а также начиная с 3 месяцев приема — в когортах Цисто-аурина, тогда как в период проспективного наблюдения его показатели среди больных, получавших Эспа-фоцин и в когорте А, сохранялись достоверно более высокими по отношению к базовым данным, а в подгруппе В достоверно не отличались от исходного уровня и данных группы сравнения (табл. 5).
Показатель общей выраженности симптомов UTISA, являющийся субъективной оценкой выраженности симптомов заболевания при повизитном статистическом анализе данных, охарактеризовал основные тенденции устранения клинических проявлений патологии на фоне приема исследуемых средств с позиции восприятия этих симптомов пациентом. Интермиттирующий прием препарата Эспа-фоцин сопровождает быстрый и выраженный клинический результат с максимальной эффективностью через 3 месяца от начала лечения и достаточно быстрой реверсией симптомов при отмене приема антибиотика практически до исходных значений показателя. Динамика соответствующих показателей группы Цисто-аурина имела существенно меньшую амплитуду, скорость нарастания клинического эффекта, но и характеризовалась достоверно более продолжительным клиническим результатом после отмены приема препарата (рис. 5).
Весьма наглядным является интегральный показатель совокупной силы репортируемых симптомов по UTISA, представляющий собой сумму оценок отдельных клинических показателей РИМП по UTISA — поллакиурии, ургентности, дизурии, чувства неполного опорожнения, а также проявлений урогенитальной боли надлобковой, поясничной локализации и гематурии. На наш взгляд, интегральный показатель в совокупности отражает динамику клинических проявлений существенно более объективно, чем балл общей выраженности симптомов, и в структуре патологии дает важную информацию о вкладе каждого проявления в текущий клинический портрет пациентки (рис. 6). Анализ этого показателя демонстрирует, что амплитуда и скорость устранения клинических симптомов среди пациенток, принимавших Эспа-фоцин, была значительно выше, чем у больных, использовавших препарат золотарника (DM = 58,15 против 41,2 %). В то же время эта когорта пациенток отмечала столь же прогрессивную реверсию клинических проявлений РИМП после отмены лечения. Пик амплитуды показателя в первой группе пришелся на 3, во второй — на 6 месяцев интермиттирующего приема. Примечательно, что среди пациенток, использовавших Цисто-аурин, значительно более медленная динамика клинической эффективности сочеталась со столь же плавной инверсией совокупности симптомов патологии. Динамика результатов группы сравнения на протяжении всего исследования статистически значимой не была.
Сходные результаты получены нами при оценке динамики влияния клинических симптомов на качество жизни больных по шкале UTISA на протяжении исследования: все клинические группы больных продемонстрировали позитивный эффект приема исследуемого препарата на качество жизни, связанное со здоровьем, с достоверно более высокими результатами у больных группы D: динамика показателя в период приема препарата составила 61,0 и 44,9 % соответственно, а в период наблюдения — 36,1 и 27,3 % от исходных данных соответственно (рис. 7). Интересно, что пик амплитуды данного показателя в обеих группах пришелся на 6 месяцев после начала лечения.
Помимо оценки клинической динамики заболевания, ключевое место исследования эффективности лечебных инициатив по поводу РИМП занимает, безусловно, анализ качества жизни больных с данной патологией, так как именно качество жизни, связанное со здоровьем, при рекуррентной хронической патологии представляет собой наивысшую, конечную цель любых терапевтических векторов и лечебных средств. Анализ воздействия интермиттирующего приема исследуемых препаратов на отдельные аспекты качества жизни, связанного со здоровьем, проводился на основании изучения динамики отдельных доменов и суммарного балла опросника MOS SF-36 с учетом статистических изменений показателей в клинических группах в процессе лечения и в проспективный период наблюдения. Детальным учетом отдельных характеристик SF-36 осуществляли анализ воздействия заболевания на различные аспекты здоровья больных каждой когорты, степень ограничения самооценки, социальных контактов и адаптации, взаимоотношений с близкими.
Характеризуя статистические изменения отдельных доменов SF-36 при РИМП, следует отметить преимущественное влияние патологии на домены психического здоровья — боль, энергичность, жизненную силу, общее здоровье, социальное функционирование, ментальное здоровье.
При оценке динамики домена боли SF-36 статистически достоверные изменения отмечены исключительно в группе D, принимавшей Эспа-фоцин, где соответствующий эффект проявлялся как на фоне приема препарата, так и по его окончании (табл. 6), в то время как аналогичный показатель в группах Цисто-аурина и сравнения значимой динамикой не обладал.
Достоверная лабораторная и клиническая эффективность лечения исследуемыми препаратами нашла непосредственное отражение в динамике домена общего здоровья SF-36. Достоверный и стойкий позитивный эффект интермиттирующего лечения у больных основных клинических групп демонстрирует сопоставимую эффективность устранения ключевых нарушений общего состояния здоровья в процессе лечения при использовании каждой из исследуемых методик метафилактики РИМП как на протяжении 6 месяцев приема, так и по окончании периода наблюдения (табл. 7). Соответствующие изменения группы сравнения статистически достоверными не были.
Драматическое снижение социальной активности, контактов и социальная дезадаптация больных, обусловленные длительным течением изучаемой патологии, в процессе лечения в клинических группах подверглись существенной динамике. Данные домена социальной активности SF-36 на протяжении исследования характеризовались существенными позитивными изменениями с гораздо более выраженным и стойким клиническим эффектом в группе D: оптимизация социальных функций и увеличение активности в течение 6 и 12 месяцев составили 43 и 33,3 % соответственно (табл. 8). Аналогичные показатели в подгруппах Цисто-аурина также проявляли себя достоверной динамикой, но со значимо меньшей относительной амплитудой изменений.
Кумулятивный показатель психического статуса SF-36, отражающий совокупность нарушений ментальных и эмоциональных функций, социальной адаптации, жизненных сил, компенсаторных возможностей и копинг-поведения пациенток, при динамическом анализе характеризовал обе принципиальные лечебные стратегии как достоверно эффективные (рис. 8). Амплитуда средних показателей и суммарный клинический эффект, определяемый как площадь под кривой, были существенно выше у группы Эспа-фоцина, скорость изменений (как нарастания, так и падения) признака также была выше у больных группы D. По завершении проспективного наблюдения изменения показателя оставались статистически достоверными во всех группах пациенток, кроме группы сравнения.
Суммарный балл опросника SF-36 — чувствительный инструмент динамики лечебных инициатив и кумулятивная мера качества жизни, связанного со здоровьем, показал достоверные преимущества режима приема препарата у больных группы Эспа-фоцина (рис. 9), где эффективность лечения была достоверно выше по сравнению как с результатами, полученными в группе С, так и с показателями группы Цисто-аурина (в течение 6 месяцев приема препарата, DM = 22,3 против 17,1 %, р ≤ 0,05). Позитивный эффект исследуемых режимов лечения после окончания лечебной фазы, несмотря на существенное снижение выраженности, сохранялся в течение всего 6-месячного периода наблюдения статистически достоверным по отношению к исходным данным, но без значимости межгрупповых различий (DM = 12,5 против 6,3 %, р = 0,08).
Полные данные всех результатов исследования представлены в табл. 9.
Выводы
1. Рекуррентная патология мочевой системы и РИМП, вовлекая все сферы жизни индивидуума, характеризуются глубокими нарушениями ключевых доменов социальной, трудовой, семейной и сексуальной жизни женщин фертильного возраста, приводят к существенному ограничению повседневной активности, социальных и личных контактов, к дезадаптации и социальной изоляции пациентки.
2. Эффективная продолжительная метафилактика РИМП возможна с использованием традиционных неантибактериальных средств, в частности препарата золотарника обыкновенного Цисто-аурин, который в интермиттирующем режиме (15 дней каждого месяца) позволяет достоверно снизить частоту рецидивов, проявления бактериурии и пиурии, уменьшить поллакиурию и ургентность, боль и дискомфорт, обусловленные патологией, а также улучшить качество жизни, связанное со здоровьем.
3. Эффективность интермиттирующего приема Цисто-аурина при рекуррентных ИМП по амплитуде клинической эффективности сопоставима с приемом препарата фосфомицина трометамола Эспа-фоцин. Скорость нарастания клинического результата при терапии препаратом золотарника в 1,5 раза медленнее, сила проявлений на 24,7 % ниже, тогда как стойкость действия после отмены приема — в 1,45 раза больше в сравнении с антибиотикотерапией. Увеличение кратности приема Цисто-аурина обеспечивает более высокий клинический результат при неизменной длительности эффекта.
4. Лабораторные проявления устранения бактериурии и пиурии при приеме Эспа-фоцина характеризуются существенно большей скоростью проявления пиковой эффективности курсового лечения и амплитудой антибактериальной активности, но в то же время — более быстрой реверсией клинико-лабораторных результатов по сравнению с аналогичными показателями Цисто-аурина.
5. Сравнительная суммарная эффективность различных режимов интермиттирующей терапии РИМП по ключевым показателям динамики клинических, лабораторных данных и влиянию на качество жизни больных позволяет рекомендовать прием препарата фосфомицина Эспа-фоцин для лечения РИМП, сопровождающихся агрессивным течением, высокой бактериурией и лейкоцитурией, сочетанием различных уропатогенов в культуральном исследовании, а также значительным влиянием на качество жизни больной.
6. Продолжительный интермиттирующий прием препарата золотарника Цисто-аурин имеет существенный приоритет при РИМП с умеренной бактериурей, необходимостью значительной продолжительности противорецидивного лечения, у больных с выраженной индукцией фунгинальной активности и РИМП, связанными с персистенцией С.albicans, локальными и системными проявлениями дисбиозов.
7. Выявленные новые закономерности динамики лабораторной активности и клинической эффективности различных режимов интермиттирующего лечения больных РИМП определяют целесообразность в дальнейшем изучения сочетанного приема препаратов золотарника и фосфомицина для оценки возможности потенцирования взаимных эффектов и оптимизации функциональных и клинико-лабораторных результатов продолжительной метафилактики рецидивирующих инфекций мочевыводящих путей.
Конфликт интересов. Не заявлен.
Список литературы
1. Grabe M., Bartoletti R., Bjerklund-Johansen T.E. et al. European Association of Urology: Guidelines on Urological Infections, 2015.
2. Dason S., Dason J.T., Kapoor A. Guidelines for the diagnosis and management of recurrent urinary tract infection in women // Can. Urol. Assoc. J. — 2011. — 5. — Р. 316-322.
3. Grimes C.L., Lukacz E.S. Urinary tract infections // Female Pelvic. Med. Reconstr. Surg. — 2011. — 17. — Р. 272-278.
4. Matthew G., Cristiano G. Moreira, Sperandio Vanessa, Zimmern Philippe. Recurrent urinary tract infections in healthy and nonpregnant women // Urological Science. — 2014. — Vol. 25, Is. 1. — P. 1-8.
5. Ejrnæs K. Bacterial characteristics of importance for recurrent urinary tract infections caused by Escherichia coli // Dan. Med. Bull. — 2011. — 58. — Р. B4187.
6. Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden // Infect. Dis. Clin. North Am. — 2014. — 28. — Р. 1-13.
7. Foxman B., Barlow R., D'Arcy H., Gillespie B., Sobel J.D. Urinary tract infection: self-reported incidence and associated costs // Ann. Epidemiol. — 2000. — 10. — Р. 509-515.
8. European Goldenrod // Herbal Medicines. — 4th edition. — 2013. — 928 p.
9. Melzig M.F. Goldenrod-a classical exponent in the urological phytotherapy // Wien Med. Wochenschr. — 2004. — 154 (21–22). — Р. 523-7.
10. Dwyer P.L., O'Reilly M. Recurrent urinary tract infection in the female // Curr. Opin. Obstet. Gynecol.. — 2002. — 14. — Р. 537-543.
11. Flores-Mireles, Ana L. et al. Urinary Tract Infections: Epidemiology, Mechanisms of Infection and Treatment Options // Nature reviews. Microbiology. — 2015. — 13 (5). — Р. 269-284. PMC. Web. 9 Jan. 2018.
12. Schappert S.M., Rechtsteiner E.A. Ambulatory medical care utilization estimates for 2007 // Vital. Health Stat. — 2011. — 13. — Р. 1-38.
13. Griebling T.L. Urologic diseases in America project: trends in resource use for urinary tract infections in women // J. Urol. — 2005. — 173. — Р. 1281-1287.
14. Van der Starre W.E., van Nieuwkoop C., Paltansing S., van't Wout J.W., Groeneveld G.H., Becker M.J. et al. Risk factors for fluoroquinolone-resistant Escherichia coli in adults with community-onset febrile urinary tract infection // J. Antimicrob. Chemother. — 2011. — 66. — Р. 650-656.
15. Assessment report on Soidago virgaurea L. herba // European Medicines Agency. — 2008.
16. Kołodziej B., Kowalski K., Kędzia B. Antibacterial and antimutagenic activity of extracts aboveground parts of three Solidago species: Solidago virgaurea L., Solidago canadensis L. and Solidago gigantea Ait // Journal of Medicinal Plants Research. — 2011. — Vol. 5, № 31. — P. 6770-6779.
17. Laurençon L., Sarrazin E., Chevalier M., Prêcheur I., Herbette G., Fernandez X. Triterpenoid saponins from the aerial parts of Solidago virgaurea alpestris with inhibiting activity of Candida albicans yeast-hyphal conversion // Phytochemistry. — 2013. — Vol. 86. — Р. 103-111.
18. Courtney M. Starks, Russell B. Williams, Matt G. Goering, Mark O’Neil-Johnson, Vanessa L. Norman, Jin-Feng Hu, Eliane Garo, Grayson W. Hough, Stephanie M. Rice, Gary R. Eldridge. Antibacterial clerodane diterpenes from Goldenrod (Solidago virgaurea) // Phytochemistry. — 2010. — Vol. 71, Is. 1. — Р. 104-109.
19. Brantner A. The antimicrobial activity of Solidago-containing phytourologica // Drogen-report. — 1999. — V. 12. — P. 27-28.
20. Echtes Goldenrutenkraut als entzündungshemmende Droge / Melzig M.F., Löser B., Bader G., Papsdorf G. // Z. Phytother. — 2000. — Vol. 21. — P. 67-70.
21. Clayson D., Wild D., Doll H., Keating K., Gondek K. Validation of a patient-administered questionnaire to measure the severity and bothersomeness of lower urinary tract symptoms in uncomplicated urinary tract infection (UTI): the UTI Symptom Assessment questionnaire // BJU Int. — 2005. — 96 (3). — Р. 350-9.
22. Sardar A., Basireddy S.R., Navaz A. et al. Comparative evaluation of fosfomycin activity with other antimicrobial agents against E.coli isolates from urinary tract infections // J. Clin. Diagn. Res. — 2017. — 11 (2). — DC26-DC29.
23. Шостак М.В., Костев Ф.И., Лукинюк Е.И. Эффективное лечение и профилактика часто рецидивирующих инфекций мочевых путей действием препарата золотарника обыкновенного (Solidago virgaurea) Цисто-аурин // Почки. — 2018. — № 3.

/22-2.jpg)
/22-1.jpg)
/23-1.jpg)
/24-1.jpg)
/26-1.jpg)
/27-1.jpg)
/27-2.jpg)
/28-1.jpg)
/28-2.jpg)
/29-2.jpg)
/29-1.jpg)
/31-2.jpg)
/30-1.jpg)
/31-1.jpg)