Основой прогресса в современной клинической практике является решение проблемы сочетания эффективности и безопасности медикаментозной терапии. Огромное количество новых препаратов и лекарственных форм, создание лекарственных средств новых поколений значительно затрудняют выбор адекватного инструмента лечения конкретной патологии у конкретного больного. Своевременная и адекватная коррекция нейромедиаторных и нейрометаболических нарушений, играющих важную роль в генезисе психосоматической патологии, различных форм астенического синдрома, возрастных нарушений нейрогуморальной регуляции, позволяет добиться существенного не только психоневрологического, но и соматического клинического эффекта [1].
Сегодня единственной группой фармакологических средств с направленным комплексным нейрометаболическим, нейромедиаторным и в ряде случаев вазотропным действием являются ноотропы. Это лекарственные средства, обладающие уникальностью клинико-фармакологических эффектов, широким спектром клинического применения и достаточным уровнем безопасности. Ноотропы наряду с седативными средствами являются наиболее назначаемыми препаратами нейро- и психотропного действия, по праву заслужившими название «лекарства XXI века» [2]. В основе действия ноотропов лежат два принципиальных эффекта — влияние на интеллектуально-мнестические функции и нейропротекторный за счет реализации многостороннего (мембраностабилизирующего, антиоксидантного, нейропластического, антигипоксического) нейротропного действия [3, 4]. Идеология создания и применения ноотропов направлена прежде всего на регуляцию естественных метаболических процессов в центральной нервной системе, их нормализацию в условиях воздействия того или иного патогенного фактора, а также при старении, когда возрастные изменения деятельности мозга создают основу для последующего развития определенного заболевания [1, 5, 6].
Как правило, в клинической практике ноотропные средства назначаются в составе комплексной терапии. При этом нередки случаи одновременного назначения одному больному до 5–10 и более препаратов различных групп с разным механизмом действия. Это приводит к развитию целого ряда нежелательных последствий:
— перекрещиванию путей биотрансформации различных препаратов в организме, приводящему к существенному усилению или ослаблению их действия, росту числа побочных эффектов и неконтролируемости клинического ответа;
— вероятности потенцирования известных побочных эффектов отдельных средств и усилению их токсического действия, прежде всего на желудочно-кишечный тракт, печень, почки и головной мозг;
— возможности возникновения новых побочных эффектов, в ряде случаев существенно осложняющих течение основного заболевания;
— сложности подбора адекватного дозового режима и его соблюдения, что приводит к ухудшению комплайенса или даже к отказу от лечения;
— значительному удорожанию процесса лечения, особенно при долговременной терапии, наиболее частой в неврологической практике [1, 7, 8].
Оптимизация фармакотерапии неврологических и психосоматических заболеваний привела к созданию комбинированных лекарственных средств, содержащих два и более компонента с различным механизмом действия, по-разному влияющих на патогенез и клинические проявления конкретных форм патологии. Общие принципы разработки фиксированных комбинаций в неврологии включают следующее:
— комбинации нерациональны, если длительность действия их ингредиентов существенно различается;
— включение вещества, уменьшающего побочные реакции другого, оправданно, если они несерьезны или редки;
— вещества с узким терапевтическим индексом не должны включаться в комбинации;
— высокий уровень доказательности для каждого из компонентов;
— высокий уровень доказательности для комбинации [9, 10].
Особенно популярными в последние годы стали комбинированные препараты, способствующие нормализации центральных регуляторных механизмов развития соматической патологии, улучшающие мозговой метаболизм и гемодинамику, стабилизирующие корково-подкорковые взаимоотношения, нарушение которых лежит в основе многих форм неврологической и психосоматической патологии. Основными преимуществами таких препаратов являются:
— возможность применения доказанных стандартных эффективных сочетаний биологически активных веществ в рамках одной лекарственной формы;
— сокращение вынужденной полипрагмазии при сохранении или повышении эффективности лечения;
— улучшение комплайенса;
— повышение экономической доступности лечения [11, 12].
С учетом изложенного несомненный интерес представляет комбинированный нейротропный препарат Олатропил (АО «Олайнфарм», Латвия), который, в отличие от других комбинированных ноотропных средств, представляет собой сочетание в одной лекарственной форме двух «истинных» ноотропов — аминалона (125 мг) и пирацетама (250 мг), т.е. является первым «истинно ноотропным» комбинированным препаратом. Подобная комбинация дает возможность одномоментной реализации комплекса многосторонних и разнообразных эффектов в отношении центральной нервной системы, свойственных как пирацетаму, так и аминалону, однако достигаемых за счет принципиально различных механизмов действия данных средств [11–13].
Основной механизм действия пирацетама связан с изменением метаболических, биоэнергетических процессов в нервной клетке, повышением скорости оборота информационных макромолекул и активацией синтеза белка. Наилучшие показатели эффективности лечения достигаются при назначении пирацетама в дозе 4,8 г/сут в течение 3 месяцев [14, 15]. Существенным недостатком терапии пирацетамом является наличие побочных эффектов: возбуждения, головной боли, бессонницы, раздражительности, беспокойства, развития судорожного синдрома, у пожилых больных — провокации приступа стенокардии. Все это существенно снижает комплайентность пациентов и в ряде случаев требует дополнительной медикаментозной поддержки [14].
Гамма-аминомасляная кислота (ГАМК) — важнейшее биогенное вещество, которое содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге: под влиянием ГАМК активируются энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение [16].
Сочетание пирацетама с ГАМК позволяет снизить риск развития побочных эффектов пирацетама и оптимизировать ноотропную терапию каждым из препаратов в отдельности [17].
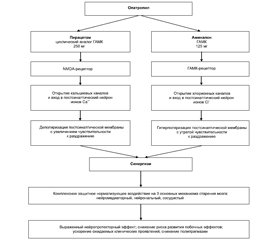
Механизм действия Олатропила демонстрирует выраженный синергизм монокомпонентов препарата (рис. 1).
Подобное сочетание позволяет уменьшить в 2 раза терапевтические дозировки каждого из действующих веществ, что, в свою очередь, приводит к снижению частоты возникновения и выраженности возможных побочных эффектов, нивелированию возбуждающего действия пирацетама и обеспечению более высокой безопасности и эффективности.
Фармакологический потенциал Олатропила более весомый, чем у обычных ноотропов, благодаря наличию поливалентной фармакодинамики, а именно собственно ноотропного, антиастенического, анксиолитического, вегето- и сосудостабилизирующего эффектов [18].
Основные преимущества Олатропила следующие:
— комплексное действие на три основных механизма старения мозга (нейромедиаторный, нейрональный и сосудистый) обеспечивает нормализацию когнитивных функций;
— уменьшенные в 2 раза терапевтические дозы снижают риск развития возможных побочных эффектов пирацетама (возбудимости, раздражительности, беспокойства, нарушений сна, приступов стенокардии у пожилых);
— более быстрый и значимый клинический эффект по сравнению с использованием пирацетама и аминалона в стандартных дозировках в качестве монотерапии;
— расширение терапевтического спектра действия и показаний к применению;
— уменьшение полипрагмазии при повышении эффективности лечения;
— улучшение комплайентности.
Важный элемент фармакодинамики препарата Олатропил — появление взаимодополняющих фармакологических эффектов его монокомпонентов (пирацетама и ГАМК), которые являются различными, далеко выходящими за рамки их собственного но-отропного потенциала. Это связано с возникновением нового фармакодинамического феномена в виде синергического потенцирования положительных ноотропных возможностей пирацетама и ГАМК при сочетанном введении с одновременным нивелированием неблагоприятных проявлений токсикодинамики пирацетама. Так, в данной фиксированной комбинации под воздействием ГАМК сглаживается возбуждающий эффект пирацетама. Это реализуется путем взаимодействия со специфическими ГАМК-рецепторами в различных регионах мозга, вследствие чего происходит открытие хлорионных каналов и вход в постсинаптический нейрон ионов Cl–, что приводит к гиперполяризации постсинаптической мембраны с утратой чувствительности к раздражению. При этом достигается благоприятное влияние на нейродинамику, мозговое кровообращение, сочетание успокаивающего и мягкого психостимулирующего действия, что имеет своим результатом положительный эффект в отношении когнитивных и неврологических функций, церебральной гемодинамики, возможности достижения анксиолитического эффекта [18].
Представленный спектр фармакодинамических свойств не только и не столько определяет терапевтическую эффективность препарата, но и является доказательством его эффективности и переносимости при проведении многочисленных клинических исследований.
В частности, в ходе сравнительного клинического изучения Олатропила и пирацетама было показано, что Олатропил ускорял темп сенсомоторных реакций и повышал концентрацию внимания на 14 %, улучшал вербальное обучение на 20 %, улучшал кратковременную память на 47 % [19].
Рядом исследований подтвержден выраженный вегетостабилизирующий эффект Олатропила: уменьшение проявления вегетативной дисфункции в 2 раза; снижение выраженности соматоформных симптомов на 17 % [20]. Выраженный антиастенический и анксиолитический эффекты препарата Олатропил подтверждены позитивной динамикой симптомов на фоне проведенного лечения: улучшение самочувствия на 38 %; настроения — на 28 %; снижение уровня тревожности на 24 %; уменьшение депрессивной симптоматики на 56 %; повышение физической работоспособности на 37 % и активности — на 57 % [13].
Олатропил является препаратом выбора для профилактики и лечения когнитивных нарушений при цереброваскулярной патологии, которая в Украине остается наиболее актуальной и социально значимой в структуре неврологической патологии. В свою очередь, среди цереброваскулярных заболеваний первое место занимают не инсульты и транзиторные ишемические атаки, а хронические нарушения мозгового кровообращения (ХНМК) (около 90 %) [21, 22]. Для адекватной терапии хронической церебральной ишемии, возникшей на фоне артериальной гипертензии, и профилактики прогрессирования заболевания логичным является, с одной стороны, коррекция артериального давления, а с другой — воздействие на мозговой кровоток и облигатные синдромы гипертонической дисциркуляторной энцефалопатии, а именно когнитивные и эмоционально-вегетативные [23, 24].
Выбор Олатропила при хронической церебральной ишемии, возникшей на фоне артериальной гипертензии, основывается на следующих положениях:
1. Ноотропы являются оптимальной группой препаратов для лечения неврологических проявлений цереброваскулярной патологии. Их уникальность основана на сочетанном воздействии на различные звенья функционально-метаболических процессов в центральной нервной системе и вместе с тем на регулируемые этими процессами психосоматические и психоэмоциональные взаимоотношения.
2. Олатропил представляет собой сочетание в одной лекарственной форме двух «истинных» ноотропов — пирацетама и аминалона и является первым «истинно ноотропным» комбинированным препаратом [7, 12, 25].
В исследовании, проведенном в клинике Института геронтологии с участием 30 пациентов с артериальной гипертензией (АГ) в возрасте 42–70 лет (средний возраст — 58,5 года), добавление Олатропила к базовой терапии больных с АГ привело не только к уменьшению выраженности тревожно-депрессивных расстройств, но и к уменьшению проявлений вегетативной дисфункции. В результате двухмесячной терапии Олатропилом уменьшилось количество больных с тревожно-депрессивными расстройствами. Так, субклиническая тревога была диагностирована у 12 пациентов, клинически значимая — у 2. Субклиническая депрессия регистрировалась после 2-месячной терапии у 13 пациентов; при этом они отметили существенное уменьшение явлений астенизации, увеличение физической и умственной работоспособности. Прием Олатропила сопровождался улучшением качества сна: 13 пациентов отметили значительное уменьшение дневной сон-ливости, отсутствие ночных пробуждений и быстрое засыпание [25].
В одноцентровом рандомизированном контролируемом исследовании, проведенном в НМУ им. А.А. Богомольца (МЦ «Превентклиника», г. Киев), была дана оценка эффективности Олатропила в комплексном лечении пациентов с хроническими цереброваскулярными заболеваниями высокого и очень высокого сердечно-сосудистого риска (СРР). В исследование был включен 61 пациент с диагнозом «гипертоническая болезнь II–III степени», которые имели факторы риска сердечно-сосудистых заболеваний, получали стандартную антигипертензивную терапию и были разделены на группы. Группа сравнения (20 пациентов) получала пирацетам в дозе 0,4 г 3 раза в сутки. Подгруппа А (умеренного ССР) — 20 пациентов в возрасте 40–60 лет — получала комбинированный препарат Олатропил в дозе 1 капсула 3 раза в сутки. Подгруппа Б (высокого ССР) — 21 пациент старше 60 лет — получала Олатропил в дозе 1 капсула 3 раза в сутки. Показано, что добавление к антигипертензивной терапии церебропротектора Олатропила позволяет в течение 2 месяцев достоверно улучшить качество жизни у пациентов с АГ II и III степени, особенно у лиц старше 60 лет, что способствует их длительной социальной активности [26].
Как свидетельствуют результаты исследований И.В. Дамулина и соавт. [27], перспективным и оправданным является применение Олатропила у больных с дисциркуляторной энцефалопатией I (ДЭ I) и II (ДЭ ІІ) стадии, в патогенезе которой важнейшую роль играют нейрометаболические нарушения. Хроническая ишемическая гипоксия приводит к нарушениям энергетического потенциала нейронов, снижению биосинтеза макроэргических соединений (АТФ, АДФ), сдвигам в структурно-функциональном состоянии нейрональных мембран и развитию оксидативного стресса. В результате развиваются дистрофия и дегенерация нейронов, нарушения нейромедиаторного баланса и прогрессирующие изменения в неврологической и психической сферах. К отмеченным изменениям добавляются нарушения нейрогенной регуляции системной и церебральной гемодинамики. Немаловажным в этом отношении является процесс старения нервной, дыхательной и сердечно-сосудистой систем в целом, что приводит к усилению явлений гипоксии мозга. Сама же по себе гипоксия лежит в основе дальнейшего повреждения механизмов ауторегуляции мозгового кровообращения.
Особенно важно отметить значимость возникающего при хронической церебральной ишемии нейромедиаторного дисбаланса — ослабления активности прежде всего ГАМК- и холинергических систем на всех уровнях структурно-функциональной организации: биосинтеза и высвобождения медиатора, его связывания с рецепторными структурами, а также рецепторно-эффекторных реакций. Результатом сочетанных нейромедиаторных, нейрометаболических и сосудистых нарушений при ДЭ (атеросклеротического, артериосклеротического генеза и вследствие патологии магистральных сосудов мозга и шеи) является ведущий симптомокомплекс на ранних стадиях заболевания, включающий когнитивные расстройства и микроорганическую симптоматику. При прогрессировании заболевания возникают двигательные расстройства, резкое ослабление памяти, появляются преходящие церебральные сосудистые кризы, т.е. симптомы, существенно ограничивающие трудоспособность и социальную адаптацию. В дальнейшем возможно развитие экстрапирамидного синдрома, различных грубых очаговых поражений, приводящих к инвалидизации больных, а также сосудистой деменции. Таким образом, прогрессирование ДЭ проявляется не только нарастанием выраженности того или иного синдрома, но и комплексностью развития нескольких синдромов, в первую очередь когнитивных и двигательных расстройств [28].
Авторами установлено, что применение Олатропила в терапии дисциркуляторной энцефалопатии способствует улучшению нейродинамических, регуляторных и мнестических функций у пациентов. Важным представляется и то, что сочетанное применение ГАМК и пирацетама в уменьшенных дозировках позволяет добиться более значимого клинического эффекта по сравнению с использованием пирацетама в стандартных дозировках в качестве монотерапии. Препарат хорошо переносится, не вызывая значительных нежелательных побочных эффектов, что особенно важно при использовании Олатропила в гериатрической практике.
Изучение клинической эффективности и безопасности применения Олатропила для лечения когнитивных нарушений у 60 лиц, которые пострадали вследствие аварии на Чернобыльской АЭС, показало, что Олатропил и аминалон положительно влияют на когнитивные функции: улучшают вербальное обучение и память, а также являются эффективными для коррекции соматоформных и тревожных нарушений на фоне органического поражения головного мозга. Принципиальным отличием Олатропила от аминалона является ускорение темпа сенсомоторных реакций, повышение концентрации и стойкости внимания, оптимизация умственной трудоспособности. Олатропил обусловливает больший ноотропный (вербальный тест Рея, таблицы Шульте), вегетостабилизирующий (GHQ-28A) и анксиолитический (GHQ-28B) эффект, а также выраженное активирующее влияние на биоэлектрическую активность головного мозга [29].
Профессором Л.Н. Юрьевой представлена 3-этапная терапевтическая программа, включающая фармакологические, психотерапевтические и психообразовательные стратегии ведения пациентов с посттравматическими стрессовыми расстройствами (участники боевых действий в Афганистане, беженцы, переселенцы и участники АТО и т.п.). В программе обосновывается необходимость назначения ноотропов для коррекции когнитивных нарушений, а также описываются преимущества назначения комбинированных нейротропных препаратов, в частности Олатропила [30].
Таким образом, пирацетам и ГАМК обладают различными, взаимодополняющими клинико-фармакологическими эффектами, далеко выходящими за рамки собственно ноотропного действия. С учетом механизмов воздействия Олатропил призван одновременно влиять как на когнитивные, так и на вегетативно-эмоциональные расстройства. Препарат оказался эффективным инструментом терапии различных форм цереброваскулярной патологии, улучшая когнитивные функции, психическую активность, психоэмоциональный статус, вегетативные функции, благоприятно влияя на качество жизни пациентов.
С учетом изложенного показаниями к применению Олатропила являются:
— цереброваскулярная патология (острые нарушения мозгового кровообращения — инсульт в реабилитационном периоде, все виды хронической недостаточности мозгового кровообращения);
— неврозы с явлениями астенического синдрома (неврастения, психастения);
— психоорганические синдромы различной этиологии, преимущественно связанные с хронической сосудисто-мозговой недостаточностью;
— комплексная терапия старческих деменций (включая болезнь Альцгеймера);
— психосоматическая патология (нейроциркуляторная дистония, гипертоническая болезнь с выраженными астено-невротическими проявлениями);
— комплексная реабилитация больных после инфаркта миокарда, нейротравм, нейроинфекций и нейроинтоксикаций;
— в психиатрии препарат применяется с целью уменьшения дозы антидепрессантов и коррекции побочных эффектов нейролептиков и транквилизаторов;
— в качестве профилактического средства при возрастных нарушениях высшей нервной деятельности и в качестве стресс-протектора при состояниях хронического стресса, сопровождающихся нарушениями когнитивной и психоэмоциональной сферы («синдром менеджера» и др.) [11].
За счет синергизма действия компонентов Олатропила возможно уменьшение стандартных дозировок пирацетама и аминалона, применяемых в рамках монотерапии, что способствует повышению уровня безопасности фиксированной комбинации и упрощает ее применение в условиях комплексной терапии различных форм неврологических заболеваний, позволяя оптимизировать ноотропную терапию.
Конфликт интересов. Не заявлен.
Список литературы
1. Бурчинский С.Г. Проблема безопасности ноотропной фармакотерапии в неврологической практике / С.Г. Бурчинский, О.Ю. Гончар, К.В. Райченко // Междунар. невролог. журнал. — 2017. — № 7 (93). — С. 56-60.
2. Elgood A.L. Use of nootropic drugs in general practice: metaanalysis // J. Clin. Pract. Pharm. — 2012. — Vol. 9. — P. 114-123.
3. Schatzberg A.F., Nemeroff C.B. Textbook of Psychopharmaco-logy. — Washington: Amer. Psychiat. Ass., 2007. — 824 p.
4. Евтушенко И.С. Ноотропы и нейропротекторы в современной клинической нейрофармакологии / И.С. Евтушенко // Междунар. невролог. журнал. — 2013. — № 3 (57). — С. 20-27.
5. Бурчинский С.Г. Клинико-фармакологические критерии оценки безопасности ноотропных средств / С.Г. Бурчинский // Междунар. невролог. журнал. — 2015. — № 3 (73). — С. 77-84.
6. Церебропротекція: роль і місце ноотропів / В.Й. Мамчур, В.І. Жилюк, К.О. Кравченко, С.М. Дронов // Новости медицины и фармации. — 2008. — № 12. — С. 12-15.
7. Бурчинский С.Г. Ноотропы: классификация, механизмы действия, сравнительная характеристика фармакологических свойств. — К., 2004. — 21 с.
8. Остроумова О.Д. Лекарственное взаимодействие: существуют ли «идеальные» лекарственные препараты для использования в условиях полипрагмазии? / О.Д. Остроумова, А.М. Ватутина, А.А. Зыкова // Рус. мед. журн. — 2003. — Т. 11, № 21. — С. 11-21.
9. Giurgea C. The nootropic approach to the pharmacology of the integrative activity of the brain / C. Giurgea // Cond. Reflex. — 2003. — № 8 (2). — Р. 108-115.
10. Polypharmacy and medicines optimisation. Making it safe and sound / M. Duerden, T. Avery, R. Payne. — London: The King’s Fund, 2013. — 56 p.
11. Бурчинский С.Г. Новые подходы к созданию комбинированных ноотропных средств: ожидания неврологов и клиническая практика / С.Г. Бурчинский // Медицинские новости. — 2010. — № 11. — С. 51-56.
12. Бурчинський С.Г. Олатропіл — новий комбінований ноотропний препарат / С.Г. Бурчинський // Медичні перспективи. — 2006. — Т. 11, № 4. — С. 53-56.
13. Ярош О.К. Клініко-експериментальна оцінка церебропротективної дії Олатропілу / О.К. Ярош, О.Т. Дудко, Л.О. Громов // Клін. фармація. — 2005. — № 1. — С. 12-17.
14. Компендиум 2014 — лекарственные препараты / Под ред. В.Н. Коваленко. — К.: Морион, 2014. — 2448 с.
15. Malykh A.G. Piracetam and piracetam-like drugs. From Basic Science to Novel Clinical applications to CNS Disorders / A.G. Ma-lykh, M.R. Sadaie // Drugs. — 2010. — Vol. 70 (3). — Р. 287-312.
16. Клінічна фармакологія: підручник / О.Я. Бабак, О.М. Біловол, Н.П. Безугла та ін.; за ред. О.Я. Бабака, О.М. Біловола, І.С. Чекмана. — 2-ге вид., перероб. та доп. — К.: Медицина, 2010. — 776 с.
17. Фармакология церебропротекторов в виде фиксированных комбинаций / В.И. Мамчур, В.И. Жилюк, С.Н. Дронов [и др.] // Психофармакология и биологическая наркология. — 2007. — Т. 7, спецвыпуск, часть 2 // Мат-лы III съезда фармакологов России «Фармакология — практическому здравоохранению», 23–27 сентября 2007 г. — СПб., 2007. — С. 2-1847.
18. Зупанец И.А. Фармакодинамические аспекты нейрогеропротекторного синергизма препарата Олатропил / И.А. Зупанец, С.К. Шебеко, И.А. Отришко // Український вісник психоневрології. — 2016. — Т. 24, вип. 2 (87). — С. 113-116.
19. Логановский К.Н. Эффективность и переносимость Олатропила в лечении органического поражения головного мозга // К.Н. Логановский, Н.Ю. Чупровская, Е.Ю. Антипчук [и др.] // Журнал практического врача. — 2007. — № 2. — С. 46-53.
20. Статинова Е.А. Комбинированная ноотропная терапия в лечении умеренных когнитивных расстройств / Е.А. Статинова, С.А. Селезнева // Український вісник психоневрології. — 2008. — Т. 16, вип. 3 (56). — С. 21-23.
21. Міщенко Т.С. Сучасна діагностика і лікування у неврології та психіатрії / За ред. Т.С. Міщенко, В.С. Підкоритова. — К.: Доктор-Медіа, 2008. — 624 с.
22. Кадыков А.С. Хронические сосудистые заболевания головного мозга (дисциркуляторная энцефалопатия) / А.С. Кадыков, Л.С. Манвелов, Н.В. Шахпаронова. — М.: ГЭОТАР-Медиа, 2006. — 224 с.
23. Приходько В.Ю. Коррекция психосоматических расстройств в практике терапевта / В.Ю. Приходько, Н.А. Масленникова, Л.А. Редько // Новости мед. и фарм. — 2008. — № 4. — С. 18-20.
24. Морозова О.Г. Влияние Олатропила на когнитивные, вегетативные и психоэмоциональные показатели у лиц с хронической церебральной ишемией на фоне артериальной гипертензии / О.Г. Морозова, А.А. Ярошевский, Я.В. Липинская // Междунар. невролог. журнал. — 2015. — № 3 (73). — С. 61-67.
25. Приходько В.Ю. Коррекция симптомов хронической ишемии мозга у больных с артериальной гипертензией комбинированным ноотропным препаратом Олатропил / В.Ю. Приходько, И.Р. Микропуло, Е.А. Кононенко // Семейная медицина. — 2016. — № 1 (63). — С. 96-100.
26. Барна О.М. Оцінка ефективності та безпеки препарату Олатропіл у комплексному лікуванні хронічних цереброваскулярних захворювань у пацієнтів високого і дуже високого серцево-судинного ризику / О.М. Барна, Я.В. Корост, О.О. Аліфер, В.О. Малєєва, Ю.І. Романюк // Ліки України. — 2018. — № 1 (217). — С. 61-66.
27. Дамулин И.В. Использование Олатропила при дисциркуляторной энцефалопатии / И.В. Дамулин, Н.Н. Коберская, И.Ю. Савушкина // The Journal of Neuroscience of B.M. Mankovsky’. — 2014. — Т. 2, № 2. — С. 37-39.
28. Бурчинский С.Г. ГАМКергические средства в фармакотерапии хронической церебральной ишемии / С.Г. Бурчинский // Междунар. невролог. журнал. — 2015. — № 1 (71). — С. 101-105.
29. Антипчук Е.Ю. Олатропил в лечении когнитивных нарушений у пострадавших вследствие Чернобыльской катастрофы / Е.Ю. Антипчук, К.Н. Логановский, Н.Ю. Чупровская [и др.] // Укр. неврол. журн. — 2007. — № 4. — С. 75-81.
30. Юрьева Л.Н. Особенности ведения пациентов с посттравматическим стрессовым расстройством в практике семейного врача / Л.Н. Юрьева // Семейная медицина. — 2015. — № 5 (61). — С. 69-72.
/77.jpg)

/78.jpg)