Введение
Нарушение функции щитовидной железы, как гипертиреоз, так и гипотиреоз, может приводить к нарушению мозговых функций [1, 2]. Развитие энцефалопатии возможно также у пациентов с аутоиммунным тиреоидитом, в том числе при тиреоидите Хашимото, получившем название энцефалопатии Хашимото (ЭХ), что необязательно зависит от состояния функции щитовидной железы. При этом есть предположение, что ЭХ является идиопатической энцефалопатией у пациентов с тиреоидитом Хашимото, которая отличается от обычной гипотиреоидной энцефалопатии. Тиреоидит Хашимото чаще сопровож-дается гипотиреозом, однако у больных с ЭХ описаны различные состояния функции щитовидной железы. Так, субклинический гипотиреоидизм — в 35 %, эутиреоидизм — в 30 %, явный гипотиреоидизм — в 20 % и реже гипертиреоидизм — в 7 % случаев [3].
Первое сообщение об ЭХ было опубликовано в 1966 году Brain в журнале Lancet [4], где был описан мужчина 49 лет с тиреоидитом Хашимото и нейро-психиатрическими симптомами. В 1991 году описано несколько пациентов, у которых симптомы энцефалопатии были ассоциированы с высокими титрами антитиреоидных антител, а также наблюдался хороший результат после терапии кортикостероидами [5]. Р. Shaw назвал такую энцефалопатию энцефалопатией Хашимото и подтвердил, что важными диагностическими критериями являются нейропсихиатрические симптомы, наличие антитиреоидных антител и хороший ответ на терапию стероидными гормонами.
ЭХ — достаточно редкое состояние. Описана распространенность 2,1 на 100 тыс. [6]. Развивается преимущественно у женщин, соотношение мужчины/женщины составляет примерно 1 : 5, средний возраст начала — 45–55 лет, однако описаны случаи развития в возрасте до 18 лет. Большинство пациентов с ЭХ страдают аутоиммунным тиреоидитом Хашимото [7].
ЭХ характеризуется высокими титрами антител к тиреопероксидазе (ТПО) и тиреоглобулину и очень вариабельной клинической манифестацией, которая может включать эпилептические припадки, расстройства сознания, когнитивные нарушения, инсультоподобные эпизоды, тремор, миоклонии, другие насильственные движения, галлюцинации, психозы. Это приводит к тому, что правильный диагноз зачастую устанавливается с опозданием. Среди нейропсихиатрических симптомов описаны эпилептические припадки и расстройство сознания — в 51 %, когнитивные нарушения и снижение памяти — в 48 %, миоклонии — в 32 %, галлюцинации и психотические синдромы — в 26 %, инсультоподобные эпизоды — в 21 %, тремор и непроизвольные движения — в 12 %, речевые нарушения — в 8 %, атаксия — в 6 % случаев [8]. В настоящее время сложились диагностические критерии, с помощью которых ЭХ может быть диагностирована. К ним относятся: 1) отсутствие других заболеваний, таких как инфекции, инсульт, метаболические расстройства и другие причины, приводящие к развитию острой или подострой энцефалопатии; 2) изменения тиреоидных гормонов или эутиреоидизм; 3) наличие связи с аутоиммунным заболеванием щитовидной железы; 4) положительный ответ на терапию кортикостероидами [9].
Хотя клинические симптомы ЭХ вариабельны и неспецифичны, описаны два типа клинического течения: рецидивирующе-ремиттирующий, который, вероятно, связан с развитием васкулита и сопровождается инсультоподобными эпизодами, и диффузно прогрессирующий тип, который отличается скрытым началом, прогрессирующим течением с периодическими флуктуациями и манифестацией с психиатрических симптомов и деменции. При обоих типах течения могут наблюдаться тремор, миоклонии, эпилептические припадки, сопор или кома [3].
Патогенез ЭХ пока окончательно не ясен, однако несомненна роль аутоиммунного фактора. ЭХ сопровождается подъемом циркулирующих антител к тиреоидным антигенам, особенно к ТПО, и антитиреоглобулиновых антител, однако их уровень не коррелирует с клиническим состоянием больных и воздействием кортикостероидов. Тем не менее наличие анти-ТПО антител является важным серологическим маркером (выявляются у 95 % пациентов). Антитела к тиреоглобулину менее специфичны (выявляются у 60–70 %) [10, 11]. В экспериментальных исследованиях показано, что антитела к ТПО связываются с астроцитами мозжечка и имеют прямое отношение к патогенезу развития церебральных симптомов ЭХ, могут выступать маркером аутоиммунного поражения центральной нервной системы. В литературе также описано повышение титров антител к альфа-энолазе, что может быть дополнительным диагностическим критерием [12, 13].
Нейровизуализационное обследование головного мозга и электроэнцефалография (ЭЭГ) выявляют различные изменения, однако они не специфичны и помогают только исключить другие заболевания. Так, на ЭЭГ часто отмечается генерализованная медленноволновая активность, могут быть эпилептиформные феномены или фотопароксизмальная реакция [14]. При магнитно-резонансной томографии (МРТ) головного мозга выявляются фокальные субкортикальные или диффузные изменения белого вещества, церебральная атрофия [15]. При аутопсии больных с ЭХ описаны лимфоцитарный васкулит венул и артериол, лимфоцитарная инфильтрация вен ствола головного мозга, диффузная периваскулярная лимфоцитарная инфильтрация, диффузный глиоз, вовлекающий в большей степени серое вещество [16, 17]. Манифестация заболевания с эпилептического статуса, психозов, когнитивных расстройств зачастую приводит к тому, что пациенты изначально получают другой диагноз [18]. А.Б. Гусовой и А.А. Кашинским описана пациентка 42 лет, наблюдавшаяся в психиатрической клинике в течение 2 лет с диагнозом «слабоумие вследствие энцефалопатии смешанного генеза», затем скончавшаяся с диагнозом «болезнь Пика», а также у эндокринологов по поводу диффузного токсического зоба с рецидивирующим тиреотоксикозом и высокими титрами (более чем в 3 раза превышающими норму) к ТПО [19]. S. Horikoshi описана пациентка 52 лет, поступившая в психиатрическую клинику с острым психозом, делирием, зрительными и слуховыми галлюцинациями, у которой были обнаружены высокие титры к тиреоглобулину и высокий уровень гомованилиновой кислоты [20]. J.-S. Chang, T.-C. Chang описаны три случая ЭХ, которые дебютировали с острого психоза, зрительных и слуховых галлюцинаций, делирия, тремора, с признаками аутоиммунного тиреоидита, разным состоянием функции щитовидной железы — гипер-, гипо- и эутиреоидизмом и драматическим улучшением после пульс-терапии метилпреднизолоном [21].
Лечение ЭХ делится на три категории. Первая заключается в использовании иммуномодулирующих средств, препаратами первой линии являются кортикостероиды — внутривенные инфузии 1000 мг метилпреднизолона в течение 3–5 дней. При плохом ответе на кортикостероиды возможно назначение азатиоприна, метотрексата, циклофосфамида, внутривенного иммуноглобулина или плазмафереза. Вторая категория — назначение тироксина или антитиреоидных средств, третья — лечение осложнений (антиэпилептические препараты при наличии эпиприпадков, маннитол при отеке мозга и др.) [3, 22].
Мы представляем собственное клиническое наблюдение пациентки, соответствующей всем критериям ЭХ.
Клиническое наблюдение
Пациентка Г., 1958 года рождения, ранее считалась здоровой. Первый приступ потери сознания с судорогами развился в феврале 2017 г., за медицинской помощью не обращалась. 09.06.2017 после длительного перелета развился эпилептический припадок с потерей сознания, генерализованными тонико-клоническими судорогами, потерей мочи. Доставлена в ГКБ № 7 г. Харькова. Уровень сознания — кома I ст., шкала комы Глазго — 8 баллов. Артериальное давление (АД) 130/80 мм рт.ст., частота сердечных сокращений (ЧСС) — 86 ударов в 1 минуту. В неврологическом статусе зрачковые и корнеальные рефлексы сохранены, лицо симметричное, мышечный тонус низкий, сухожильные рефлексы несколько выше справа, на болевые раздражения разгибательная двигательная реакция. Клинические и биохимические анализы крови в пределах нормальных показателей. На МРТ головного мозга единичные мелкие очаги в белом веществе, вероятно, сосудистого характера. Ультразвуковая допплерография (УЗДГ) магистральных сосудов без признаков стенозирования, замедление кровотока по яремным венам. ЭЭГ: диффузная низкоамплитудная активность. Электрокардиография: гипертрофия левого желудочка, нарушение процессов реполяризации. УЗДГ щитовидной железы: выраженный диффузный загрудинный зоб Хашимото (аутоиммунный тиреоидит) с псевдоузлом правой доли щитовидной железы. Состояние пациентки быстро стабилизировалось. Выписана на 5-й день в ясном сознании, очаговая неврологическая симптоматика не определяется. Диагноз «дисциркуляторная и дисметаболическая (тиреоидная) энцефалопатия. Состояние после эпиприпадка». Рекомендована консультация эндокринолога.
18.11.2017 вновь развился генерализованный эпиприпадок с резкой потерей сознания, генерализованными тонико-клоническими судорогами. Доставлена в реанимационное отделение ГКБ № 7 г. Харькова в тяжелом состоянии, уровень сознания — глубокое оглушение. Очаговая неврологическая симптоматика не определяется. На МРТ головного мозга единичные мелкие очаги в белом веществе, вероятно, сосудистого характера. ЭЭГ: фокус патологической активности в правой височно-теменной области. Клинический анализ крови в норме. В биохимических анализах выявлено повышение уровня холестерина до 7,69 ммоль/л, повышение уровня С-реактивного белка +++. В течение 3 суток сохранялась спутанность сознания. Дезориентация в месте, времени, неузнавание знакомых людей, снижение речевой продукции, автоматизированные движения в руках в виде постоянного перебирания постели, растирания собственного тела. Получала лечение: раствор Рингера, реосорбилакт, магнезия, эноксапарин, актовегин, карбамазепин. Состояние постепенно стабилизировалось, выписана в ясном сознании, без очаговой неврологической симптоматики, с рекомендацией наблюдения у эндокринолога, приема финлепсина 400 мг/сут.
20.04.2018 состояние пациентки резко ухудшается, развивается потеря сознания, в ургентном порядке доставлена в реанимационное отделение ГКБ № 7 в коме. АД 100/60 мм рт.ст., ЧСС — 68 ударов в 1 минуту, температура тела нормальная. Клинические и биохимические анализы крови в пределах нормы, электролиты и микроэлементы в норме. Определяется повышение тиреотропного гормона (ТТГ) до 12,27 мкМЕ/мл (норма — 0,27–4,4), уровень трийодтиронина (Т3) и тироксина (Т4) в пределах нормы. Тесты на боррелиоз, токсоплазмоз, бруцеллез отрицательные. Раковый эмбриональный антиген отрицательный. Анализ ликвора: цитоз — 5 × 106, белок — 0,91 г/л. В ликворе методом полимеразной цепной реакции выявлено ДНК цитомегаловируса. МРТ головного мозга без динамики. Проведено лечение: реосорбилакт, р-р Рингера, эноксапарин, магнезия, ацикловир, лефлоцин, инфулган, солу-медрол. Повторное обследование крови и ликвора на ДНК вирусов группы герпеса дало отрицательные результаты. Состояние в течение нескольких суток улучшилось, сознание восстановилось, но сохраняется полная дезориентация во времени, месте. В неврологическом статусе: со стороны черепно-мозговых нервов без патологии. Активные движения в конечностях в полном объеме, мышечный тонус низкий, тремор при выполнении координаторных проб, больше справа, выраженная атаксия походки. Чувствительные нарушения не определяются. С этого времени сознание пациентки не возвращается к нормальному, сохраняется полная дезориентация, амнезия всех предшествующих событий, периодически наблюдаются зрительные и слуховые галлюцинации, состояния психического возбуждения, миоклонические подергивания в теле. Неоднократно поступала в неврологический стационар в связи с эпиприпадками, расстройствами сознания, где лечилась по поводу энцефалита неясной этиологии.
Для дальнейшего лечения пациентка поступила 16.07.2018 в ЛДЦ «Лоритом». В неврологическом статусе: сознание сохранено, однако продуктивный контакт отсутствует, на вопросы правильные ответы не дает, произносит невнятные фразы, сложные команды не выполняет, дезориентирована в месте и времени, родственников не узнает. Менингеальных знаков нет. Периодически наблюдаются зрительные и слуховые галлюцинации, приступы агрессии, отсутствие сна. Зрачки симметричны, зрачковые реакции сохранены. Движения глазных яблок не нарушены. Асимметрия носогубных складок. Речь несколько гипофонична, дизартрична. Парезов в конечностях нет. Сухожильные рефлексы живые. Чувствительные расстройства не определяются. В руках постурально-кинетический тремор, атаксия при стоянии и ходьбе. Миоклонии в туловище и конечностях.
Клинические и биохимические анализы крови без существенных отклонений от нормы. Анализ крови на вирусы группы герпеса (иммуноферментный анализ) отрицательные. При исследовании гормонов щитовидной железы уровень ТТГ умеренно повышен — 5,6 мкМЕ/мл (норма — 0,4–3,6), Т4 (свободный) — 16,78 пмоль/мл (норма — 9,0–21,03), Т3 (связанный) — 2,78 пмоль/мл (норма — 3,34–5,14); повышены титры антител к тиреоглобулину > 4000 МЕ/мл (норма — до 115) и ТПО — 98,48 МЕ/мл (норма — до 63).
УЗДГ щитовидной железы: щитовидная железа расположена типично, увеличена, суммарный объем 26,2 мл. Структура неоднородная, ложноузловая, гиперэхогенная тяжистость. В левой доле изоэхогенный узел с анэхогенными участками, гипоэхогенным ободком размерами 24 × 24 мм. Общая эхогенность ткани железы местами повышена. Общая васкуляризация ткани железы не повышена. Заключение: смешанный зоб 2-й степени.
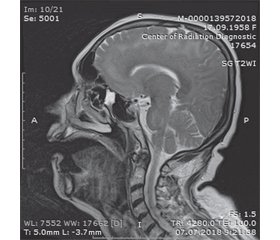
На серии повторных МРТ с июня 2017 по июнь 2018 года очаговых и объемных изменений головного мозга не выявлялось. Но 07.07.2018 выявлено диффузное повышение МР-сигнала от белого вещества головного мозга и варолиева моста преимущественно в лобных долях и перивентрикулярно. Желудочки мозга и субарахноидальные пространства не расширены. После введения контрастного вещества усиление МР-сигнала не визуализируется. Заключение: МР-картина диффузной лейкоэнцефалопатии головного мозга, вероятно, как проявление энцефалопатии на фоне сниженного иммунитета с признаками умеренного отека мозга (рис. 1).
Консультация эндокринолога: аутоиммунный тиреоидит. Многоузловой зоб 2-й ст. Гипотиреоз, тяжелая форма. Энцефалопатия Хашимото.
Проведена терапия: метилпреднизолон 1000 мг внутривенно капельно в течение 5 дней, затем пероральный преднизолон 64 мг, L-тироксин 100 мкг, альфа-биселен, реосорбилакт, альфа-липоевая кислота, омез, верошпирон, депакин хроно, труксал.
На фоне проводимой терапии состояние несколько стабилизировалось, стала лучше ориентироваться в месте и собственной личности, узнавать родственников, уменьшился атактический синдром, миоклонии, стала самостоятельно ходить, эпилептические припадки не повторяются.
Диагноз при выписке: энцефалопатия Хашимото (аутоиммунное заболевание головного мозга). Аутоиммунный тиреоидит, узловая форма. Гипотиреоз, стадия медикаментозной субкомпенсации. Гипертоническая болезнь II ст. Хронический холецистопанкреатит.
Обсуждение
Представленное клиническое наблюдение пациентки соответствует диагностическим критериям ЭХ: у больной на фоне аутоиммунного тиреоидита
Хашимото развилась энцефалопатия, сопровождающаяся эпиприпадками, тремором, непроизвольными движениями, амнезией, галлюцинаторным синдромом. Исключены другие заболевания, такие как инфекции, инсульт, другие метаболические расстройства. Выявлено аутоиммунное заболевание щитовидной железы с выраженным гипотиреозом и высокими титрами антител к тиреоглобулину и ТПО. На ЭЭГ типичные изменения в виде диффузной медленноволновой активности. Изменения на МРТ головного мозга в виде лейкоэнцефалопатии появились только через год после первых проявлений болезни. Ответ на терапию кортикостероидами положительный, течение рецидивирующе-ремиттирующее.
ЭХ является редким, тяжелым заболеванием, но потенциально поддающимся лечению. ЭХ в настоящее время относят к аутоиммунным энцефалитам. Аутоиммунные энцефалиты — группа подострых энцефалитов, которые ранее диагностировали как идиопатические. Описаны различные подгруппы аутоиммунных энцефалитов со специфическими антителами, среди них — анти-NMDAR (anti- N-methyl-D-aspartate-receptor), анти-VGKC (Voltage gate potassium channel), anti-Glu (Glutamate Acid Decarboxylase), некоторые из которых относятся к категории паранеопластических с наличием онконевральных антител (anti-Ma, anti-Hu, anti-Yo), при ЭХ специфичными являются антитела к ТПО и тиреоглобулину. Общим патофизиологическим механизмом аутоиммунных энцефалитов является то, что антитела направлены против структур центральной нервной системы. Общие клинические проявления при них неспецифичны: психиатрические симптомы, эпиприпадки, нарушения сознания, памяти, лихорадка, двигательные расстройства. Специфический диагноз подтверждается наличием определенных антител [23, 24].
Литературные наблюдения показывают, что в случаях развития атипичных нейропсихиатрических симптомов необходимо помнить об ЭХ и обследовать пациентов на наличие антитиреоидных антител.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Chong J.Y., Rowland L.P., Utiger R.D. Hashimoto encephalopathy: syndrome or myth? // Arch. Neurol. — 2003. — Vol. 60. — P. 164-171.
2. Bauer M., Goetz T., Glenn T., Whybrow P.C. The thyroidebrain interaction in thyroid disorders and mood disorders // J. Neuroendocrinol. — 2008. — Vol. 20. — P. 1101-1114.
3. Marshall G.A., Doyle J.J. Long-term treatment of Hashimoto’s encephalopathy // J. Neuropsychiatry Clin. Neurosci. — 2006. — Vol. 18. — P. 14-20.
4. Brain L., Jellinek E.H., Ball K. Hashimoto’s disease and encephalopathy // Lancet. — 1966. — Vol. 2. — P. 512-514.
5. Shaw P.J., Walls T.J., Newman P.K., Cleland P.G., Cartlidge N.E. Hashimoto’s encephalopathy: a steroid-responsive disorder associated with high anti-thyroid antibody titers-report of 5 cases // Neurology. — 1991. — Vol. 41(2 (Pt. 1)). — P. 228-233.
6. Ferracci F., Bertiato G., Moretto G. Hashimoto’s encephalopathy: epidemiologic data and pathogenetic considerations // J. Neurol. Sci. — 2004. — Vol. 217. — P. 165-168.
7. Mocellin R., Walterfang M., Velakoulis D. Hashimoto’s encephalopathy: epidemiology, pathogenesis and management // CNS Drugs. — 2007. — Vol. 21. — P. 799-811.
8. Tamagno G., Federspil G., Murialdo G. Clinical and diagnostic aspects of encephalopathy associated with autoimmune thyroid disease (or Hashimoto’s encephalopathy) // Intern. Emerg. Med. — 2006. — Vol. 1. — P. 15-23.
9. Caturegli P., De Remigis A., Rose N.R. Hashimoto thyroidi-tis: clinical and diagnostic criteria // Autoimmun. Rev. — 2014. — Vol. 13. — P. 391-397.
10. Pandit A.A., Vijay Warde M., Menon P.S. Correlation of number of intra-thyroid lymphocytes with antimicrosomal antibody titer in Hashimoto’s thyroiditis // Diagn. Cytopathol. — 2003. — Vol. 28. — P. 63-65.
11. McLachlan S.M., Rapoport B. Why measure thyroglobulin autoantibodies rather than thyroid peroxidase autoantibodies? // Thyroid. — 2004. — Vol. 14. — P. 510-520.
12. Oide T., Tokuda T., Yazaki M., Watarai M., Mitsuhashi S., Kaneko et al. Anti-neuronal autoantibody in Hashimoto’s encephalopathy: neuropathological, immunohistochemical, and biochemical analysis of two patients // J. Neurol. Sci. — 2004. — Vol. 217. — P. 7-12.
13. Fujii A., Yoneda M., Ito T., Yamamura O., Satomi S., Higa H. et al. Autoantibodies against the amino terminal of alpha-enolase are a useful diagnostic marker of Hashimoto’s encephalopathy // J. Neuroimmunol. — 2005. — Vol. 162. — P. 130-136.
14. Schauble B., Castillo P.R., Boeve B.F. et al. EEG findings in steroidresponsive encephalopathy associated with autoimmune thyroi-ditis // Clin. Neurophysiol. — 2003. — Vol. 114. — P. 32-37.
15. Tsai M.H., Lee L.H., Chen S.D., Lu C.H., Chen M.T., Chuang Y.C. Complex partial status epilepticus as a manifestation of Hashimoto’s encephalopathy // Seizure. — 2007. — Vol. 16(8). — P. 713-716. DOI: 10.1016/j.seizure.2007.05.018. PMID 17600734.
16. Nolte K.W., Unbehaun A., Sieker H. et al. Hashimoto ence-phalopathy: a brainstem vasculitis? // Neurol. — 2000. — Vol. 54. — P. 769-770.
17. Duffey P., Yee S., Reid I.N. et al. Hashimoto’s encephalopathy: postmortem findings after fatal status epilepticus // Neurol. — 2003. — Vol. 61. — P. 1124-1126.
18. Wilcox R.A., To T., Koukourou A., Frasca J. Hashimoto’s encephalopathy masquerading as acute psychosis // J. Clin. Neurosci. — 2008. — Vol. 15(11). — P. 1301-1304. DOI: 10.1016/j.jocn.2006.10.019. PMID 18313925.
19. Гусова А.Б., Кашинский А.А. Энцефалопатия Хашимото — аутоиммунное заболевание головного мозга (современные итоги изучения). — Харьков, 2013. — 232 с.
20. Horikoshi S., Miura I., Kunii Y. et al. Hashimoto encephalopathy with high plasma monoamine metabolite levels: a case report // Neuropsychiatr. Dis. and Treatment. — 2017. — Vol. 13. — P. 1043-1045.
21. Chang J.-S., Chang T.-C. Hashimoto’s encephalopathy: Report of three cases // Journal of Formosan Medical association. — 2014. — Vol. 113. — P. 862-866.
22. Mijajlovic M., Mirkovic M., Dackovic J., Zidverc-Trajkovic J., Sternic N. Clinical manifestations, diagnostic criteria and therapy of Hashimoto’s encephalopathy: report of two cases // J. Neurol. Sci. — 2010. — Vol. 288(1–2). — P. 194-6.
23. Lancaster E. The diagnosis and Treatment of Autoimmune Encephalitis // Journal of Clinical Neurology. — 2016. — Vol. 12(1). — P. 1-13.
24. Kelly B.P., Patel S.C., Marin H.L. et al. Autoimmune Encephalitis: Pathophysiology and imaging Review of an Overlooked Diagnosis // AJNR. — 2017. — Vol. 38(6). — P. 1070-1078.

/51.jpg)