Международный неврологический журнал №8 (102), 2018
Вернуться к номеру
Фармакологічна корекція стрес-індукованих вегетативних порушень та інсомнії у дітей
Авторы: Хайтович М.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
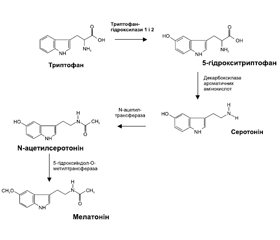
У статті наведено механізми розвитку стрес-індукованої вегетативної дисфункції й інсомнії. Обговорюється можливість застосування при даних станах комплексного препарату Сілента. Детально розглядаються фармакодинаміка його компонентів і дані доказової медицини щодо їх застосування. Описано механізми стрес-лімітуючої дії магнію (антагонізм щодо глутаматного рецептора) та L-триптофану (джерело утворення нікотинамідних коферментів, серотоніну й мелатоніну). Комбінація екстрактів квіток ромашки аптечної, листя меліси лікарської, суцвіть липи широколистої гармонізує баланс збудливих і гальмівних процесів у центральній нервовій системі; зменшує психоемоційне напруження, дратівливість, тривожність, страхи, психовегетативні прояви та інсомнію.
В статье представлены механизмы развития стресс-индуцированной вегетативной дисфункции и инсомнии. Обсуждается возможность применения при данных состояниях комплексного препарата Силента. Подробно рассматриваются фармакодинамика его компонентов и данные доказательной медицины по их применению. Описаны механизмы стресс-лимитирующего действия магния (антагонизм по отношению к глутаматным рецепторам) и L-триптофана (источник образования никотинамидных коферментов, серотонина и мелатонина). Комбинация экстрактов цветков ромашки аптечной, листьев мелиссы лекарственной, соцветий липы широколистной гармонизирует баланс возбуждающих и тормозных процессов в центральной нервной системе; уменьшает психоэмоциональное напряжение, раздражительность, тревожность, страхи, психовегетативные проявления и инсомнию.
This article presents the mechanisms of stress-induced autonomic dysfunction and insomnia development. The possibility of using combination drug Silenta in these states is discussed. The pharmacodynamics of its components and data of evidence-based medicine regarding their application are considered in detail. The mechanisms of stress-limiting action of magnesium (glutamate receptor antagonism) and L-tryptophan (a source of nicotinamide coenzymes, serotonin and melatonin) were described. A combination of extracts of Matricaria chamomilla flowers, Melissa officinalis leaves, Tilia platyphyllos Scop. will harmonize the balance of excitatory and inhibitory processes in the central nervous system. This combination will reduce psycho-emotional stress, irritability, anxiety, fears, psycho-vegetative manifestations and insomnia.
стрес; інсомнія; діти; фармакологічна корекція; Сілента
стресс; инсомния; дети; фармакологическая коррекция; Силента
stress; insomnia; children; pharmacological correction; Silenta
/62.jpg)
/64.jpg)
1. Chen X., Gianferante D., Hanlin L., Fiksdal A., Breines J.G., Thoma M.V., Rohleder N. HPA-axis and inflammatory reactivity to acute stress is related with basal HPA-axis activity // Psychoneuroendocrinology. — 2017 Apr. — 78. — 168-176. doi: 10.1016/j.psyneuen.2017.01.035.
2. Солодков A.П., Беляева Л.E., Лазуко С.С. Стресс и гипертензия // Врач-практик. — 2013. — № 3. — С. 78-80. — http://nbuv.gov.ua/UJRN/PraktLik_2013_3_20.
3. Seow L.S.E., Verma S.K., Mok Y.M. et al. Evaluating DSM-5 Insomnia Disorder and the Treatment of Sleep Problems in a Psychiatric Population // J. Clin. Sleep Med. — 2018 Feb 15. — 14(2). — 237-244. doi: 10.5664/jcsm.6942.
4. Хайтович M.В., Потаскалова В.С., Місюра O.M. Стиль життя і первинний головний біль у школярів // Соціальна педіатрія і реабілітологія. — 2017. — 3. — 19-24.
5. Хайтович М.В., Очеретько В.В., Місюра О.М. Частота і характер інсомнії в підлітків та її вплив на якість життя // Матеріали XI Конгресу педіатрів України (7–9 жовтня 2015 року, Kиїв). — К., 2015. — С. 102-103.
6. Grau K., Plener P.L. Pharmacotherapy for children and adolescents with sleep disorders: an overview // Z. Kinder Jugendpsychiatr Psychother. — 2018 Sep. — 46(5). — 393-402. doi: 10.1024/1422-4917/a000562.
7. Li Y., Starr L.R., Wray-Lake L. Insomnia mediates the longitudinal relationship between anxiety and depressive symptoms in a nationally representative sample of adolescents // Depress Anxiety. — 2018 Jun. — 35(6). — 583-591. doi: 10.1002/da.22764.
8. Місюра O.M., Хайтович M.В. Особливості інсомнії у підлітків із первинною артеріальною гіпертензією // Український вісник психоневрології. — 2018. — Т. 26, вип. 4. — С. 66-68.
9. Matheson E., Hainer B.L. Insomnia: Pharmacologic Therapy // Am. Fam. Physician. — 2017 Jul 1. — 96(1). — 29-35. — https://www.ncbi.nlm.nih.gov/pubmed/28671376.
10. Riemann D., Baglioni C., Bassetti C. et al. European guideline for the diagnosis and treatment of insomnia // J. Sleep Res. — 2017. — 26. — 675-700. doi: 10.1111/jsr.12594.
11. Nishizawa Y., Morii H., Durlach J. New Perspectives in Magnesium Research. — London: Springer, 2007. — 411 p. — https://www.springer.com/la/book/9781846283888.
12. Chubanov V., Ferioli S., Wisnowsky A. et al. Epithelial magnesium transport by TRPM6 is essential for prenatal development and adult survival // Elife. — 2016. — 5. — https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5218537.
13. Nielsen F.H. Magnesium deficiency and increased inflammation: current perspectives // J. Inflamm. Res. — 2018. — № 11. — P. 25-34. doi: 10.2147/JIR.S136742.
14. Magnesium in the Central Nervous System / Edited by R. Vink, M. Nechifor. — 2011. — https://www.adelaide.edu.au/press/titles/magnesium/magnesium-ebook.pdf.
15. De Silva D.A., Synnes A.R., von Dadelszen P., Lee T., Bone J.N.; MAG-CP, CPN and CNN collaborative groups, Magee L.A. MAGnesium sulphate for fetal neuroprotection to prevent Cerebral Palsy (MAG-CP)-implementation of a national guideline in Canada // Implement Sci. — 2018. — https://www.ncbi.nlm.nih.gov/pubmed/29325592.
16. Hoffmann J., Charles A. Glutamate and Its Receptors as Therapeutic Targets for Migraine // Neurotherapeutics. — 2018. — Vol. 15, № 2. — P. 361-370. doi: 10.1007/s13311-018-0616-5.
17. Kovacevic G., Stevanovic D., Bogicevic D. et al. A 6-month follow-up of disability, quality of life, and depressive and anxiety symptoms in pediatric migraine with magnesium prophylaxis // Magnes Res. — 2017. — Vol. 30, № 4. — P. 133-141. doi: 10.1684/mrh.2018.0431.
18. Bruni O., Angriman M. Pediatric insomnia: New insights in clinical assessment and treatment options // Arch. Ital. Biol. — 2015 Jun-Sep. — 153(2–3). — 144-156. doi: 10.12871/000398292015239.
19. Фіцнер О.А., Хайтович М.В., Брюзгіна Т.С. Вплив мелатоніну та N-ацетилцистеїну на інтенсивність ліпопероксидації у сироватці крові та центральній нервовій системі щурів з цукровим діабетом 1 типу // Український фармацевтичний журнал. — 2018. — Т. 3(56). — С. 22-29.
20. Фіцнер O.A., Хайтович М.В., Рижко I.M., Голопихo Л.I. Вплив мелатоніну та N-aцетилцистеїну на стан орієнтовно-дослідницької активності щурів за умов експериментального цукрового діабету // Клінічна фармація. — 2018. — Т. 22(3). — 38-45.
21. Kleszczynski K., Fischer T.W. Melatonin and human skin aging // Dermatoendocrinol. — 2012 Jul 1. — 4(3). — 245-252. doi: 10.4161/derm.22344.
22. Songtachalert T., Roomruangwong C., Carvalho A.F., Bourin M., Maes M. Anxiety disorders: sex differences in serotonin and tryptophan metabolism // Curr. Top. Med. Chem. — 2018 Nov 14. doi: 10.2174/1568026618666181115093136.
23. Dougherty D.M., Richard D.M., James L.M., Mathias C.W. Effects of acute tryptophan depletion on three different types of behavioral impulsivity // Int. J. Tryptophan Res. — 2010. — 3. — 99-111.
24. Höglund E., Øverli Ø., Andersson M.Å. et al. Dietary l-tryptophan leaves a lasting impression on the brain and the stress response // Br. J. Nutr. — 2017 May. — 117(10). — 1351-1357. doi: 10.1017/S0007114517001428.
25. Landsberg G., Milgram B., Mougeot I., Kelly S., de Rivera C. Therapeutic effects of an alpha-casozepine and L-tryptophan supplemented diet on fear and anxiety in the cat // J. Feline Med. Surg. — 2017 Jun. — 19(6). — 594-602. doi: 10.1177/1098612X16669399.
26. Drugs and Lactation Database (LactMed) [Internet]. — Bethesda (MD): National Library of Medicine (US), 2006.
27. Yurcheshen M., Seehuus M., Pigeon W. Updates on Nutraceutical Sleep Therapeutics and Investigational Research // Evid. Based Complement Alternat. Med. — 2015. — 2015. — 105256. doi: 10.1155/2015/105256.
28. Taliou A., Zintzaras E., Lykouras L., Francis K. An open-label pilot study of a formulation containing the anti-inflammatory flavonoid luteolin and its effects on behavior in children with autism spectrum disorders // Clin. Ther. — 2013 May. — 35(5). — 592-602. doi: 10.1016/j.clinthera.2013.04.006.
29. Theoharides T.C., Asadi S., Panagiotidou S. A case series of a luteolin formulation (NeuroProtek®) in children with autism spectrum disorders // Int. J. Immunopathol. Pharmacol. — 2012 Apr-Jun. — 25(2). — 317-323.
30. Vissiennon C., Goos K.H., Arnhold J., Nieber K. Mechanisms on spasmolytic and anti-inflammatory effects of a herbal medicinal product consisting of myrrh, chamomile flower, and coffee charcoal // Wien Med Wochenschr. — 2017 May. — 167(7–8). — 169-176. doi: 10.1007/s10354-016-0538-y.
31. Keefe J.R., Mao J.J., Soeller I., Li Q.S., Amsterdam J.D. Short-term open-label chamomile (Matricaria chamomilla L.) the-rapy of moderate to severe generalized anxiety disorder // Phytomedicine. — 2016 Dec 15. — 23(14). — 1699-1705. doi: 10.1016/j.phymed.2016.10.013.
32. Sarris J., McIntyre E., Camfield D.A // CNS Drugs. — 2013 Apr. — 27(4). — 301-319. doi: 10.1007/s40263-013-0059-9.
33. Kennedy D.O., Wightman E.L. Herbal extracts and phytochemicals: plant secondary metabolites and the enhancement of human brain function // Adv. Nutr. — 2011 Jan. — 2(1). — 32-50. doi: 10.3945/an.110.000117.
34. Alijaniha F., Naseri M., Afsharypuor S. et al. Heart palpitation relief with Melissa officinalis leaf extract: double blind, rando-mized, placebo controlled trial of efficacy and safety // J. Ethnopharmacol. — 2015. — 164. — 378-384. doi: 10.1016/j.jep.2015.02.007.
35. Heydari N., Dehghani M., Emamghoreishi M., Akbarzadeh M. Effect of Melissa officinalis capsule on the mental health of female adolescents with premenstrual syndrome: a clinical trial study // Int. J. Adolesc. Med. Health. — 2018 Jan 25. pii: /j/ijamh.ahead-of-print/ijamh-2017-0015/ijamh-2017-0015.xml.
36. Baek J.H., Nierenberg A.A., Kinrys G. Clinical applications of herbal medicines for anxiety and insomnia; targeting patients with bipolar disorder // Aust. NZJ Psychiatry. — 2014 Aug. — 48(8). — 705-715. doi: 10.1177/0004867414539198.
37. Luo Y., Shang P., Li D. Luteolin: A Flavonoid that Has Multiple Cardio-Protective Effects and Its Molecular Mechanisms // Front Pharmacol. — 2017. — 8. — 692. doi: 10.3389/fphar.2017.00692.
38. Pérez-Ortega G., Guevara-Fefer P., Chávez M., Herrera J., Martínez A., Martínez A.L., González-Trujano M.E. Sedative and anxiolytic efficacy of Tilia americana var. mexicana inflorescences used traditionally by communities of State of Michoacan, Mexico // J. Ethnopharmacol. — 2008 Mar 28. — 116(3). — 461-468. doi: 10.1016/j.jep.2007.12.007.
39. Loscalzo L.M., Wasowski C., Marder M. Neuroactive flavonoid glycosides from Tilia petiolaris DC. Extracts // Phytother. Res. — 2009 Oct. — 23(10). — 1453-1457. doi: 10.1002/ptr.2800.
40. Aguirre-Hernández E., González-Trujano M.E., Martínez A.L. et al. HPLC/MS analysis and anxiolytic-like effect of quercetin and kaempferol flavonoids from Tilia americana var. mexicana // J. Ethnopharmacol. — 2010 Jan 8. — 127(1). — 91-97. doi: 10.1016/j.jep.2009.09.044.
41. Cárdenas-Rodríguez N., González-Trujano M.E., Aguirre-Hernández E. et al. Anticonvulsant and antioxidant effects of Tilia americana var. mexicana and flavonoids constituents in the pentylenetetrazole-induced seizures // Oxid. Med. Cell Longev. — 2014. — 2014. — 329172. doi: 10.1155/2014/329172.

/63.jpg)