Асептичний некроз головки стегнової кістки (АНГСК) — тяжка хронічна поширена патологія, що становить 1,2–4,7 % від усіх дегенеративно-дистрофічних захворювань опорно-рухового апарату, за даними різних авторів. Проблема ранньої діагностики через відсутність явної симптоматики в період початку захворювання, схожість клінічних ознак з іншими патологічними станами та стрімкий розвиток хвороби призводять до характерних дегенеративних процесів. Зміна звичного ритму життя і відсутність можливості отримання медичної допомоги в зв’язку з недоліком ефективних методів лікування рано чи пізно призводять до стійкого порушення працездатності та інвалідності пацієнтів [3].
Групою ризику в розвитку даної патології є переважно чоловіче населення віком 20–50 років, схильне до впливу різних шкідливих факторів (алкоголізм, куріння, застосування кортикостероїдів, радіація), а також низки захворювань: серпоподібноклітинна анемія, коагулопатія, васкуліти, системний червоний вовчак, стан після трансплантації органів, гіперхолестеринемія, хвороба Gaucher, хвороба Caisson, хронічний панкреатит, гіпергліцеридемія, внутрішньокісткова геморагія, кесонна хвороба, хронічні захворювання печінки і нирок, що вимагають застосування таких агресивних методів лікування, як гемодіаліз, хіміотерапія та ін. [4].
Щороку в США діагностується близько 15 000 нових випадків АНГСК [42].
Вперше АНГСК описав англійський ортопед Alexander Munro в 1738 році. Jean Cruvilhier в роботах між 1829 та 1842 роками описав порушення кровотоку головки стегнової кістки як основу її деформації [39].
Природа змін, що виникають в головці стегнової кістки, до кінця не вивчена, але безсумнівною залишається травматична етіологія захворювання. На думку С. Delaunay, залежно від тяжкості травми у 10–50 % хворих з різними ушкодженнями ділянки кульшового суглоба (КС) в найближчі або віддалені терміни розвивається асептичний некроз [7]. Низка зарубіжних авторів, вивчивши сучасні методи хірургічного лікування при переломах і їх віддалені наслідки, вважають, що впливають на розвиток АНГСК вік пацієнта і відстрочка операції, але не спосіб лікування [38]. Поряд з даними висновками виділяють нетравматичні теорії походження, пов’язані з недостатністю кровопостачання (в тому числі нетиповими варіантами розвитку топографо-анатомічної картини гілок глибокої артерії стегна), збільшенням внутрішньокісткового тиску, функціональною неповноцінністю КС, токсичною дією лікарських засобів (інгібіторів протеїнтирозинкінази, гормоніндукований АНГСК), з обмінними (порушеннями ліпідного обміну), нейрогенними порушеннями. З огляду на безліч теорій походження патологічного процесу на сьогодні не існує відповідних експериментальних моделей, що дозволяють знайти причину захворювання [37].
Вивчення патогенезу захворювання протягом останнього століття не дало плідних, однотипних результатів, що зробило цю проблему, на думку багатьох фахівців, дуже складною. Наприклад, визначено, що артерії головки стегна не закінчуються сліпо, і це створює можливість тромбоемболічного механізму.
АНГСК розглядається як вторинна патологія, що виникає після перелому кісткових балок, представляючи пусковим механізмом мікротравматизацію або перевантаження суглоба, що активізують процеси перевтоми. При цьому патологічна імпульсація, спрямована з осередку ураження до кори головного мозку, сприяє формуванню зворотного сигналу, викликаючи спазм судин, застій крові і лімфи, порушення обміну речовин, накопичення продуктів розпаду, зміну фізико-хімічних властивостей кісткової тканини, а в подальшому руйнування кісткових балок з утрудненням місцевого кровообігу і, відповідно, некроз. Участь парасимпатичної нервової системи в процесі розвитку патологічного процесу також можлива, тому що патологічна імпульсація з вогнища сприяє розвитку рефлекторного спазму судин, порушуючи кровопостачання [17]. З огляду на наявність судинних розладів, дослідниками були розглянуті окремо артеріальний, венозний і змішані компоненти; в той же час Lerishe, вважаючи, що першопричиною може бути порушення ліпідного обміну, посилається на необхідність перегляду ішемічної теорії патогенезу [36].
Історично визнані основи ішемічних розладів також були підтверджені й розширені R.K. Aaron, який визначив можливість нетипових варіантів розвитку топографо-анатомічної картини гілок глибокої артерії стегна у вигляді збільшення вугла відходження обвідної артерій або повної відсутності медіальної огинаючої артерії [37].
Протягом останніх 10 років завдяки безлічі зарубіжних експериментальних моделей кількість припущень щодо патогенезу захворювання значно збільшилась. Зміни, що наступають в головці стегнової кістки, в першу чергу обумовлені місцевим порушенням кровотоку, зниженням перфузії за рахунок анатомічних особливостей живлячих судин, що призводять до розвитку ішемічних явищ. В результаті зміни кровопостачання і гідродинамічного впливу пружних деформацій виникають перерозподільчі порушення, перимедулярний венозний застій, порушення тканинного метаболізму, посилення остеокластичної резорбції витончення і спонгізація компактної речовини, збільшення кістковомозкових просторів і розвиток некрозу [21].
Ліпідні порушення, в тому числі в результаті підвищення рівня стероїдів, відіграють важливу роль в живленні суглоба і, найімовірніше, є однією з причин судинних порушень [16]. Н. Kantor вважає, що приблизно у 45 % хворих присутня тріада обмінних розладів — порушення ліпідного обміну, захворювання печінки і хронічний алкоголізм. Але, незважаючи на стрункість алкоголь-індукованої теорії, за даними D. Orlic, частота появи патології в осіб, які зловживають алкоголем, становить 3,9 %. Це говорить про участь в патогенезі інших процесів, окрім порушення ліпідного обміну. Вивчення генетичних аспектів патології показало важливу роль окисного пошкодження ДНК генопоетичних клітин кісткового мозку, поліморфізму різних генів і ендотеліальної синтази [40].
Прихильники молекулярних досліджень дійшли висновку щодо наявності причинно-спадкового зв’язку з синтезом остеопротегеріну [11] факторами росту фібробластів, рівнем лептину в кістковому мозку і втратою протеоглікану, порівнюючи з запальними змінами при артриті, вважаючи, що АНГСК може передувати запальна реакція [21].
У будь-якому випадку важливою патоморфологічною ланкою розвитку хвороби є: порушення умов транскапілярного обміну, пригнічення мінералізації, переродження червоного кісткового мозку. Формується патологічний тип кровообігу з розвитком ішемії, а в подальшому загибель кісткових клітин з утворенням зони розпаду кісткової тканини і мікрокристалізації хряща [6]. За умови зниження несучої здатності некротизованої кістки подальше порушення розподілу контактного напруження призводить до колапсу головки стегна і повного її руйнування [6]. Серед усіх теорій патогенезу особливе положення займає концепція відкладення кальційумісних кристалів в суглобовому хрящі і параартикулярних тканинах. При цьому виявляють типові типи кристалів, такі як пірофосфат кальцію, гідроксіапатит, три- і октакальцієві фосфати. Даний феномен має назву «мікрокристалічний стрес» i зустрічається в усіх хворих з асептичним некрозом, що вказує на необхідність ревізії наявних теорій патогенезу [39].
Зміни, що настають в головці стегнової кістки, як правило, супроводжуються зміною кольору, структури і форми поверхні, з’являється горбистість або шорхість хрящового покриву, при цьому зберігається гіаліновий хрящ щільної консистенції, сірого, рідше коричневого кольору з додатковими включеннями. Дистрофічні зміни хрящової і кісткової тканини супроводжуються витонченням кортикального шару, розширенням міжбалкових просторів, явищами ангіоматозу, а також рубцевого переродження капсули суглоба. З’являються ознаки жирового переродження кісткового мозку, фіброзної тканини, резорбції, некробіозу, лімфоїдно-плазмоцитарної і гістоцитарної інфільтрації строми, а в деяких випадках і запальної реакції [38].
Приблизно у 20 % випадків АНГСК не встановлюються можливі причинні фактори, і процес визначається як ідіопатичний [42].
Виділяють чотири види АНГСК: периферичний вид — локалізація патологічного вогнища в зовнішньому відділі головки стегна під суглобовим хрящем; центральний — з утворенням зони некрозу в центрі головки стегнової кістки; сегментарний — у вигляді невеликої ділянки некрозу в формі конуса у верхній або верхньозовнішньої частини; повного ураження [41].
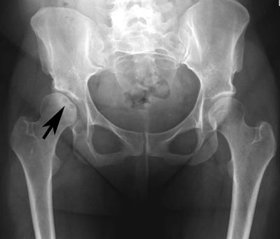
Першою відомою класификацією АНГСК стала класифікація J. Arlet та P. Ficat (1980), що базувалась на рентгенологічних змінах головки стегнової кістки (рис. 1) [40].
Автори описали 4 стадії процесу. Для першої стадії (дорентгенологічної) характерна наявність неспецифічних клінічних проявів але відсутність рентгенологічної симптоматики; для другої — зміни кісткової структури без змін на вершині головки стегнової кістки, наявність субхондрального склерозу та кіст; для третьої — секвестрація і частковий колапс остеонекротичної кісткової тканини; для четвертої стадії характерні деформація головки, нерівність суглобової щілини, наявність остеофітів.
Наступна класифікація була запропонована в 1995 році M. Steinberg [41]. Ця класифікація була сприйнята як високоспецифічна і поєднувала дані рентгенографії, магнітно-резонансної томографії (МРТ) та сцинтиграфії. Класифікація M. Steinberg наведена в табл. 1.
Схематично дана класифікація подана на рис. 2.
Наступна класифікація була запропонована Міжнародною асоціацією вивчення циркуляції крові в кістках (Association Internationale de Recherche sur la Circulation Osseuse) (Франція) (табл. 2). Ця класифікація поєднує дані рентгенографії, МРТ, сцинтиграфії та гістологічних досліджень і на сьогодні є найбільш повною та вживаною [42].
/105-1.jpg)
Розширення можливостей променевої діагностики останніми роками дозволило зробити значний крок вперед в обстеженні пацієнтів на ранніх стадіях розвитку АНГСК. Чутливість і специфічність магнітно-резонансної томографії [41] в диференціальній діагностиці даного захворювання становить 98 %, дозволяючи виявити патологічний процес на початковому етапі (І ст.) [1], комп’ютерна томографія (II ст.), рентгенографічні методи (III –IV ст.) згідно з міжнародними класифікаціями Ficat і Arlet [40]. Дорентгенологічні стадії патологічного процесу, що не діагностуються за МРТ, включають порушення кровообігу, які проявляються лише на ангіографії і сцинтиграфії [12] у вигляді підвищення внутрішньокісткового тиску і гістологічних змін. К. Kawai, проводячи низку експериментальних досліджень, виділив низку низькомолекулярних білків, спефічних для АНГСК, припустив їх використання як біомаркерів [16].
Ефективність консервативного лікування залежить перш за все від локалізації та тяжкості процесу, а також від віку та загального стану пацієнта, результат якого корелює зі стадією захворювання і повинен демонструвати комплексний підхід. Консервативна терапія традиційно включає: дотримання оптимального ортопедичного режиму (з дозованим навантаженням на уражений суглоб), лікувальну гімнастику, медикаментозну та фізіотерапію (екстракорпоральну ударно-хвильову терапію, електроімпульсну терапію, гіпербаричну оксигенацію) [26]. До фармакотерапії відноситься застосування біфосфонатів [18], низькомолекулярних гепаринів [19], осеїн-гідроксіапатичного комплексу, вазодилататорів, антиагрегантів, препаратів кальцію і вітаміну D з використанням внутрішньосуглобового введення димексиду, хондроїтину, перфторану [20], збагаченого воднем фізіологічного розчину [15, 21], збагаченої тромбоцитами плазми [8, 10, 15, 22] — з позитивною динамікою на І–ІІ стадіях. Окремі автори відзначають позитивну динаміку при пероральному використанні іматинібу з гідроксимочевиною [23]. Деякі автори, виділяючи стовбурові клітини з жирової тканини і використовуючи збагачену тромбоцитами плазму разом із гіалуроновою кислотою, повідомляють про повне одужання пацієнта при I стадії некрозу головки стегнової кістки [22, 24]. Незважаючи на безліч запропонованих методів, лікування АНГСК можливо лише на ранніх стадіях захворювання, при яких, як правило, стандартні методи дослідження не дають можливостей своєчасно розпізнати патологічний стан [26].
Існуючі хірургічні методи застосовуються з різною частотою успіху, при цьому жоден метод не можна назвати найкращим. Класичні варіанти оперативного лікування, такі як тунелізація [5, 9, 20], були неодноразово переглянуті і використовуються разом з трансплантацією мезенхімальних клітин кісткового мозку [25], рекомбінантних людських кістково-морфогенетичних білків [23], заміщенням тунелю автотрансплантатом клубової кістки [28], малогомілкової кістки [20, 27], васкуляризованим трансплaнтатом на живильній ніжці [30, 44], пористим танталовим стрижнем [43]. Розроблено методи множинної тунелізації з метою найбільшої реваскуляризації головки стегна [31], з заміщенням композитом з фосфату кальцію, декальцінований кістковим матриксом, кістковим цементом, біфазними керамічними імплантами і навіть в поєднанні з частковою синовектомією кульшового суглоба. Але, незважаючи на це, D. Zhao, згідно зі своїми останніми дослідженнями, дійшов висновку, що повне видалення танталового стрижня після тунелювання є проблемою у зв’язку з руйнуванням металоконструкції в процесі використання, а кістково-пластичні операції з використанням автотрансплантата малогомілкової кістки ускладнюються в 23 % випадків, що не виключає аналогічний відсоток ускладнень при інших методах автотрансплантації [43].
Рiзнi коригуючі остеотомії, запропоновані останнім часом: деторсійно-варизуючі, передньоротаційні, черезвертлюгові, вальгізуючі (Nakashima), подвійні підвертельні поперечні остеотомії [29, 32], змінюючи точку максимального навантаження на головку стегнової кістки, не дозволяють відновити конфігурацію суглобової поверхні при запущеному деструктивному процесі, створюючи технічні складності для подальшого ендопротезування [29, 33]. Вищевказані методи використовуються окремо, дають лише незначну динаміку, дозволяючи відстрочити радикальну операцію — тотальне ендопртезування кульшового суглоба на короткий час.
У сучасній літературі останнім часом все частіше зустрічаються дані про позитивні результати артро-скопічних методів лікування АНГСК на ранніх стадіях, застосування артроскопічного кюретажу некротизованої ділянки з введенням автогенних кісткових циліндрів. Ендоскопічна навігація, що дозволяє детально оцінювати точність і ефективність проведених хірургічних маніпуляцій, за своєю ефективністю порівнюється лише з декомпресуючими методами лікування [2, 13, 14, 34] і в майбутньому буде мати низку переваг [35]. Один із підходів до можливостей реваскуляризації головки стегнової кістки полягає в неповній лігатурній оклюзії стегнової артерії [36].
Ефективна профілактика асептичного некрозу головки стегна являє собою складне завдання, включаючи в себе ранню диспансеризацію груп ризику, сувору послідовність ведення пацієнтів при найбільш ранній діагностиці відповідної стадії процесу, дотримання комплексності реабілітаційних заходів, і практично не зустрічається в сучасній літературі.
Асептичний некроз головки стегнової кістки — поширене мультифакторіальне поліетілогічне захворювання, що вражає переважно чоловіків працездатного віку, ініціальну ланку патогенезу якого точно не вивчено. Діагностика АНГСК має значні труднощі, обумовлені як пізнім зверненням пацієнтів за медичною допомогою, так і відсутністю яскравих діагностичних ознак, виражених лише набряком кісткового мозку в початковій стадії патологічного процесу на МРТ. Традиційне консервативне лікування недостатньо ефективно і забезпечує лише короткочасне поліпшення тільки на ранніх стадіях процесу, у зв’язку з використанням препаратів з малою або недоведеною ефективністю, що дозволяють відстрочити повну заміну суглоба лише на незначний період часу. Хірургічні способи, як правило, травматичні і вимагають тривалої реабілітації, при цьому не передбачаючи стійкої тривалої ремісії, а ендопротезування пов’язане з великими ризиками нестабільності компонентів. Дана проблема є актуальною і потребує подальшого вивчення індивідуальних для кожного пацієнта факторів, стану здоров’я, супутніх захворювань (ендокринний і імунологічний статус) і рівня активності пацієнтів, удосконалення методів консервативного і оперативного лікування з метою досягнення стійкої тривалої ремісії, а можливо, і повного одужання пацієнта.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. A comparative study on the measurement of femoral head necrosis lesion using ultra-thin layer slicing and computer aided identification / S.D. Li, S.B. Xu, C. Xu et al. // Zhongguo Gu Shang. — 2016. — № 29(2). — P. 131-135.
2. Arthroscopic management and platelet-rich plasma therapy for avascular necrosis of the hip / J. Guadilla, N. Fiz, I. Andia, М. Sanchez // Кnее Surgery. Sports Тraumatology, Arthroscopy: offic. J. of The ESSКA. — 2012. — Vol. 20(2). — Р. 393-398. DOI: 10.1007/s00167-011-1587-9.
3. Avascular necrosis of femoral head as the initial manifestation of СМL. Informa Healthcare / S. Кumar, D. Вansal, М. Pralшh, Р. Shaпna // J. of Pediatric, Hematology/Oncology. — 2014. — № 31(6). — Р. 568-573. DОI: 10.3109/08880018.2013.831961.
4. Bergh С. Increased risk of revision in patients with non-traumatic femoral head necrosis // Acta Orthopaedica. — 2014. — Vol. 85(1). — Р. 11-17. DOI: 10.3109/17453674.2013.874927.
5. Chang Т. Treatment of early avascular necrosis of femoral head by core decompression combined with autologous bone marrow mesenchymal stem cells transplantation // Chinese J. of Reparative and Reconstructive Surgery. — 2010. — Vol. 24(6). — Р. 739-743.
6. Daniel М. Contact stress in hips with osteonecrosis of the femoral head / М. Daniel, S. Herman, D. Dolinar // Clinical Orthopaedics and Related Research. — 2006. — Vol. 447. — Р. 92-99. DOI: 10.1097/01.blo.0000203472.88926.с8.
7. Deleanu В. Avascular necrosis of the femoral head at 2 years after pertrochanteric fracture surgery / В. Deleanu, R. Prejbeanu, D. Vermesan et al. // Annals of Medicine and Surgery (Lond.). — 2015. — № 5. — Р. 106-109. DОI: 10.1016/j.amsu.2015.12.053.
8. Downregulation of basic fibroblast growth factor is associated, vith femoral head necrosis in broilers / Р.Е. Li, Z.L. Zhou, С.У. Shi, J.F. Hou // Poultry Science J. — 2015. — Vol. 94(5). — Р. 1052-1059. DOI: 10.3382/ps/pev071.
9. Drilling decompression for femoral head necrosis at collapse stage / М. Wei, Z.G. Wang, Y.J. Liu, Z.L. Li // Zhongguo Gu Shang. — 2015. — № 28(6). — Р. 562-566.
10. Effects of leucocyte-and platelet-rich plasma on osteogenic differentiation of bone marrow mesenchymal stem cells in treating avascular necrosis of femoral head in rabbits / J. Fang, Z. Yin, W. Wang et al. // Zhongguo Xiu Fu Chong Jian Wai Ке Za Zhi. — 2015. — № 29(2). — Р. 227-233. — http://dx.doi.org/10.1155/2016/9458396.
11. Effects of osteoprotegerin, RANК and RANКL оn bone destruction and collapse in avascular neaosis femoral head / М.Y. Xiong, L.O. Liu, S.Q. Liu et al. // Amer. J. of Transl. Research. — 2016. — № 8(7). — Р. 3133-3140. PMCID: РМС4969450.
12. F-18 fluoride positron emission tomography/computed tomography in the diagnosis of avascular necrosis of the femoral head: Comparison with magnetic resonance imaging / S. Ga–yana, А. Bhattacharya, R.К. Sen et al. // Ind. J. of Nuclear Medicine. — 2016. — 31(1). — Р. 3-8. DOI: 10.4103/0972-3919.172337.
13. Femoral Head Avascular Necrosis is Not Caused bу Arthroscopic Posterolateral Femoroplasty / R. Stoner, F. Strambi, I. Bohacek, Т. Smoljanovic // Orthopedics. — 2016. — № 39(6). — Р. 330. DOI: 10.3928/01477447-20161020-01.
14. Govaers К. Endoscopically assisted core decomprcssion in avascular necrosis of the femoral head // Acta Orthopaedica Вelgica. — 2009. — Vol. 75(5). — Р. 631-636.
15. Huang S.L. Hydrogen-rich saline attenuates steroid-associated femoral head necrosis through inhibltion of oxidative stress in а rabЬit model / S.L. Huang, J. Хiao, H.W Yan // Experimental and Theraprutic Medicine. — 2016. — № 11(1). — Р. 177-182. DOI: 10.3892/etm2015.2883.
16. Кawai К. Steroid -induced accumulation of lipid in the osteocytes of the rabbit femoral head. А histochemical and electron microscopic study / К. Каwаi, А. Tamaki, К. Нirohata. // Surg. — 1985. — Vol. 67-А, № 5. — Р. 755-763.
17. Li D. Alterations of sympathetic nerve fiЬers in avascular necrosis of femoral head // Intem. J. of Clinical and Experimental Pathology. — 2015. — Vol 8(9). — Р. 10947-10952. PMCID: РМС4637627.
18. Li Z. BCBl gene polymorphisms and glucocorticoid-induced avascular necrosis of the femoral head susceptiЬility: а meta-analysis // Іntern. Medical J. of Experimental and Clinical Research. — 2014. — Vol. 20. — Р. 2811-2816. DOI: 10.12659/MSM.891286.
19. Liu Т. Correlation between local microenvironment leptin expression and avascular necrosis of the femoral head // Chinese J. of Reparative and Reconstructive Surgery. — 2012. — Vol. 26(11). — Р. 13-19.
20. Mohanty S.P. Мanagement of non-traumatic avascular necrosis of the femoral head-a comparative analysis of the outcome of multiple small diameter drilling and core decompression with fibular grafting // Musculoskeletal Surgery. — 2016. DОI: 10.1007/s12306-016-0431-2.
21. Packialakshmi В. Poultry Femoral Head Separation and Necrosis: А Review // Avian Diseases. — 2015. — Vol 59(3). — Р. 349-354. DOI: 10.1637/11082-040715-Review.1.
22. Pak J. Complete resolution of avascular necrosis of the human femoral head treated with adipose tissue-derived stem cells and platelet-rich plasma // The f. of Intem. Med. Research. — 2014. — Vol. 42(6). — P. 1353-1362. DOI: 10.1177/0300060514546940.
23. Pan Z.X. Effect of recombinant hurnan bone morphogenetic protein 2/poly-lactide-co-glycolic acid (rhBMP-2/PLGA) with core decompression on repair of rabbit femoral head necrosis // Asian Pacific J. of Tropical Medicine. — 2014. — Vol. 7(11). — P. 895-899. DOI: 10.1016/S1995-7645(14)60156-5.
24. Proteomic Changes in the Plasma of Broiler Chickens with Femoral Head Necrosis / В. Packialakshmi, R. Liyanage, J.O. Lay Jr et al. // Biomarker Insights. — 2016. — № 11(27). — Р. 55-62. DOI: 10.4137/ВMI.S38291.
25. Roles of oxidative DNA damage of bone marrow’ hematopoietic cells in steroid-induced avascular necrosis of femoral head / Z.Q. Zhao, R. Ваi, W.L. Liu et al. // Genetics and Molecular Research. — 2016. — № 15(1). DOI: 10.4238/gmr.15017706.
26. S3 guideline. Part 2: Non-Traumatic Avascular Femoral Head Necrosis in Adults -Untreated Course and Conservative Treatment / А. Roth, J. Вeckmann, U. Smolenski et al. // Zeitschrift fur Orthopadie und Unfallchirurgie. — 2015. — № 153(5). — Р. 488-497. DOI: 10.1055/s-0035-1545903.
27. Should thorough Debridement be used in Fibular Allograft with impaction bone grafting to treat Femoral Head Necrosis: а blomechanical evaluation / G. Zhou, Y. Zhang, L. Zeng et al. // ВМС Musculoskeletal Disorders. — 2015. — № 16. — Р. 140. DOI: 10.1186/s12891-015-0593-3.
28. Steroid-induced ischemic bone necrosis of femoral head: Treatment strategies. Professional Medkal Publications / B. Wu, Z. Dong, S. Li, H. Song // Pakistan J. Med. Sciences. — 2015. — № 31(2). — Р. 471-476.
29. Total hip arthroplasty after failed curved intertrochanteric varus osteotomy for avascular necrosis of the femor head / Y. Takegami, D. Komatsu, Т. Seki et al.; Nagoya University School Of Medicine // Nagoya J. Med. Science. — 2016. — № 78(1). — Р. 89-97. PMCID: РМС4767517.
30. Treatment of bilateral avascular necrosis of femoral head by free vascularized fibula grafting with unilateral fibula as donor. Publisher: China NLМ ID: 9425194 Publication Model: Print Cited Medium: Print ISSN: 1002-1892 / Х. Liu, J. Sheng, С. Zhang et al. // Zhongguo Xiu Fu Chong Jian Wai Ке Za Zhi. — 2011. — № 25(6). — Р. 641-645.
31. Tribological changes in the articular cartilage of а human femoral head with avascular necrosis / Е.М. Seo, S.K. Shrestha, С.Т. Duong // Biointerphases. — 2015. — № 10(20). — Р. 021004. DOІ: 10.1116/1.4919020.
32. Wang L. Study on effect of sensory neuropeptide in steroid-induced avascular necrosis of femoral head // Chineк J. of Reparative and Reconstructive Surgery. — 2010. — Vol. 24(9). — Р. 1078-1081.
33. Wang Т. Analysis of risk factors for femoral head necrosis after internal ffixation in femoral neck fractures // Orthopedics. — 2014. — Vol. 37(12). — Р. е1117-23. DОI: 10.3928/01477447-20141124-60.
34. Wang W. Study on relationship between osteoporosis and mRNA expressions of vascular endothelial growth factor and bone morphogenetic protein 2 in nontraumatic avascular necrosis of femoral head // Chinese J. of Reparative and Reconstructive Surgery. — 2010. — Vol. 24(9). — Р. 1072-1077. DOI: 10.3928/01477447-20141124-60.
35. Yassin М.А. Dasatinib Induced Avascular Necrosis of Femoral Head in Adult Patient with Chronic Myeloid Leukemia // Blood Disorders. — 2015. — Vol. 8. — Р. 19-23. DOI: 10.4137 /CMBD.S24628.
36. Zhang G.P. Correlation between polymorphism of endothelial nitric oxide synthase and avascular necrosis of femoral head // Іntern. J. of Clinical and Experimental Medicine. — 2015. — Vol. 8(10). — Р. 18849-18854. PMCID: РМС4694406.
37. Aaron R.K. Osteonecrosis: etiology, pathophysiology and diagnostic / Callagan J.J., Rosenberg A.G., Rubash H.E. // The adult hip. — Philadelphia, PA: Lippincott-Raven Publishers, 1998. — Р. 455-466.
38. Petty W. Osteonecrosis: Strategies for treatment / Callagan J.J., Rosenberg A.G., Rubash H.E. // The adult hip. — Philadelphia, PA: Lippincott-Raven Publishers, 1998. — Р. 467-484.
39. Mont M.A., Hungerford D.S. Non-traumatic avascular necrosis of the femoral head // JBJS Am. — 1995. — 77(3). — Р. 459-474.
40. Arlet J., Ficat P. Non-traumatic avascular femoral head necrosis. New method of examination and new conceps // Chir. Narzadow Ruchu Ortop. Pol. — 1977. — 42(3). — Р. 269-276.
41. Steinberg M.E. Avascular necrosis: diagnosis, staging and management // J. Musculoskel Med. — 1997. — 14(11). — Р. 13-25.
42. Laverna C.J., Sierra R.J., Grieco F.R. Osteonecrosis of the femoral head // J. Am. Acad. Orthop. Surg. — 1999. — 7(4). — Р. 250-261.
43. Zhao D., Zhang Y., Wang W. Tantalum rod implantation and vascularized iliac grafting for osteonecrosis of the femoral head // Orthopaedics. — 2013. — 36(6). — Р. 789-785.
44. Kyu-Jin Cho, Kyung-Soon Parrk, Taek-Rim Yoon. Muscle pedicle bone grafting using the anterior one-third of the gluteus medius attached to the greater trochanter for treatment of Association Reseach Circulation Osseous stage II osteonecrosis of the femoral head. International orthopaedics. — 2018. — № 10. — P. 2335-2341.

/104-1.jpg)
/104-2.jpg)
/105-1.jpg)