Журнал «Здоровье ребенка» Том 13, №8, 2018
Вернуться к номеру
Медикаментозное подавление бактериальной адгезии при респираторных инфекционных заболеваниях
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГУЗУ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Адгезія бактерій зі слизовою оболонкою респіраторного тракту реалізується функціонуванням різних механізмів. Один із них — формування ниткоподібних білкових органел, відомих як пілі (фімбрії, або війки). Лікарські засоби, дія яких спрямована на механізми адгезії бактерій, здатні запобігти розвитку інфекційного процесу і формування біоплівки. Сьогодні розробляються численні лікарські засоби, дія яких спрямована на пригнічення синтезу різних компонентів пілі, у зв’язку з чим вони отримали загальну назву «піліциди». Однак антиадгезійна терапія, незважаючи на зацікавленість нею вчених, не використовується для лікування бактеріальних інфекцій. Цілком ймовірно, причинами недостатнього використання антиадгезійних препаратів при бактеріальних інфекціях є: 1) чисельність молекул адгезії бактерії; 2) залежність продукції адгезинів від стадії інфекційного процесу й ураженої тканини макроорганізму; 3) необхідність наявності в інгібіторів адгезії високого рівня афінітету. Можна припустити, що подальше вивчення безпосередніх механізмів специфічної взаємодії бактеріальних адгезинів із клітинами макроорганізму, безсумнівно, дозволить розробити нові ефективні антиадгезійні препарати, які стануть рутинними лікарськими засобами при лікуванні бактеріальних інфекцій.
Адгезия бактерий со слизистой оболочкой респираторного тракта реализуется функционированием различных механизмов. Один из них — формирование нитевидных белковых органелл, известных как пили (фимбрии или ворсинки). Лекарственные средства, действие которых направлено на механизмы адгезии бактерий, способны предотвратить развитие инфекционного процесса и формирование биопленки. В настоящее время разрабатываются многочисленные лекарственные средства, действие которых направлено на подавление синтеза различных компонентов пили, в связи с чем они получили общее название «пилициды». Однако антиадгезионная терапия, несмотря на заинтересованность ею ученых, не используется для лечения бактериальных инфекций. По всей вероятности, причинами недостаточного использования антиадгезионных препаратов при бактериальных инфекциях являются: 1) многочисленность молекул адгезии бактерии; 2) зависимость продукции адгезинов от стадии инфекционного процесса и пораженной ткани макроорганизма; 3) необходимость наличия у ингибиторов адгезии высокого уровня аффинитета. Можно предположить, что дальнейшее изучение непосредственных механизмов специфического взаимодействия бактериальных адгезинов с клетками макроорганизма, несомненно, позволит разработать новые эффективные антиадгезионные препараты, которые станут лекарственными средствами при лечении бактериальных инфекций в обычной врачебной практике.
The adhesion of bacteria on the mucosa of the respiratory tract is realized by the functioning of various mechanisms. One of them is the formation of thread-like protein organelles, known as pili (fimbriae or villi). Drugs with action directed at the mechanisms of adhesion of bacteria can prevent the development of the infectious process and the formation of biofilms. At the present time, numerous drugs are being developed, their action is aimed at suppressing the synthesis of various components of pili, and for which reason they are collectively known as pilicides. However, anti-adhesion therapy, despite obvious interest of scientists, is not used to treat bacterial infections. In all likelihood, the causes for the inadequate use of antiadhesive drugs in bacterial infections are: 1) the multiplicity of bacterial adhesion molecules; 2) the dependence of adhesin production on the stage of the infectious process and the affected tissue of macroorganism; 3) the need for a high level of affinity in adhesion inhibitors. It can be assumed that further study of the direct mechanisms of specific interaction of bacterial adhesins with the cells of a macroorganism will undoubtedly allow the development of new effective antiadhesive drugs that will be used for the treatment of bacterial infections in routine medical practice.
бактеріальна адгезія; антиадгезійні препарати; бактеріальні інфекції
бактериальная адгезия; антиадгезионные препараты; бактериальные инфекции
bacterial adhesion; antiadhesive drugs; bacterial infections
Введение
Бактериальная адгезия к поверхности слизистой оболочки респираторного тракта является первым этапом физического взаимодействия микро- и макроорганизмов, и ее эффективность предопределяет вероятность последующей бактериальной колонизации, инвазии и формирование биопленки. Достижение поверхности слизистой оболочки бактериальными агентами в определенной мере носит вероятностный характер, который зависит от множества факторов, в том числе от уровня подвижности бактерий, обеспечения питательными веществами, макро- и микроэлементами, активности мышечного, слизистого и электростатического барьера респираторного тракта макроорганизма, температуры тела и др. [9, 22, 30].
Адгезия бактерий со слизистой оболочкой респираторного тракта носит первоначально обратимый, а в последующем необратимый характер и реализуется функционированием различных механизмов: солютабными, связанными адгезинами и нитевидными цилиндрическими белковыми органеллами длиной примерно 1–1,5 мкм и диаметром около 7–10 нм, известными как пили (фимбрии, или ворсинки). Адгезины взаимодействуют преимущественно с лектинами и углеводсодержащими рецепторами. Грамположительные и грамотрицательные бактерии используют многочисленные протеины, которые осуществляют адгезию бактерии с поверхностью клетки макроорганизма. Необходимо отметить, что пили грамположительных бактерий являются поздним патогенетическим фактором. Грамотрицательные бактерии обычно образуют пили путем нековалентного взаимодействия между субъединицами пилина, а грамположительные патогены формируют пили за счет ковалентной полимеризации субъединиц пилина при помощи транспептидазы сортазы C [21, 29]. Необратимая адгезия пилиобразующих бактерий преимущественно обусловлена формированием пили 1-го типа [24].
Лекарственные средства, действие которых направлено на механизмы адгезии бактерий, способны предотвратить развитие инфекционного процесса и формирование биопленки. В настоящее время разработано несколько групп антиадгезионных лекарственных средств, которые отличаются по механизму действия, в частности препараты, блокирующие адгезины, ингибирующие биогенез адгезинов, подавляющие транслокацию адгезинов, формирование и функционирование пили, блокирующие рецепторы к бактериальным адгезинам [23, 25].
Продукты питания
Некоторые продукты питания содержат активные биологические вещества, которые обладают выраженным антиадгезионным действием.
Наиболее изученными являются растительные полифенолы, обладающие способностью блокировать адгезию бактерий. В большинстве случаев антиадгезионные активные компоненты продуктов питания и их точный механизм действия остаются неизвестными, но, вероятнее всего, они являются аналогами рецепторов или ингибиторами адгезинов (табл. 1) [28].
Химические формулы некоторых активных веществ продуктов питания, обладающих антиадгезионным действием в ротовой полости, представлены в табл. 2.
/89-1.jpg)
Препараты, блокирующие активность адгезинов
Аналоги адгезиновых рецепторов в качестве блокаторов бактериальных адгезинов
Эндогенные солютабные адгезиновые рецепторы, непосредственно взаимодействуя с бактериальными адгезинами, препятствуют их связыванию с рецепторами, ассоциированными с клеточной мембраной эпителиоцитов респираторного тракта. Нарушение данного взаимодействия исключает колонизацию бактериями слизистой оболочки и развитие инфекционного процесса. Основные лекарственные средства данной группы представляют соединения, мимикрирующие лектиновые и углеводсодержащие рецепторы (табл. 3) [27].
Грамотрицательные бактерии Pseudomonas aeruginosa связываются с гликоструктурами поверхности клеток слизистой оболочки респираторного тракта за счет двух углеводсвязывающих протеинов (лектинов): PA-IL и PA-IIL. D-галактоза или пептиды, имитирующие человеческую глюкуронилтрансферазу-1 (beta-1,3-glucuronyltransferase 1 — B3GAT1), блокируют связывание PA-IL, тогда как L-фукоза блокирует связывание PA-IIL с гликопротеинами клеток респираторного тракта [10].
Аналоги адгезинов
Синтетические аналоги адгезинов, конкурируя с бактериальными адгезинами за связи с рецепторами на поверхности мембраны клеток макроорганизма, подавляют бактериальную адгезию. Было показано, что синтетические пептидные эпитопы адгезина SspB Streptococcus gordonii и K99 энтеротоксигенных палочек Escherichia coli эффективны in vitro [8].
Нейтрализация адгезинов
Полагают, что для нейтрализации функциональной активности адгезинов могут использоваться специфические моноклональные антитела (см. 1) и секвестранты.
Так, секвестрация фукозоспецифического фактора LecB Pseudomonas aeruginosa дендримером FD2 (C-Fuc-LysProLeu) (4) (LysPheLysIle) (2) LysHisIleNH (2) (IC (50) = 0,14 мкМ ELLA) индуцирует полную дисперсию сформированных биопленок нескольких клинических изолятов Pseudomonas aeruginosa [18].
Ингибирование биосинтеза адгезинов
Одним из методов предупреждения бактериальной адгезии является ингибирование биосинтеза молекул адгезинов, особенно компонентов пили и курли (curli, от англ. curl — «завиток») или тафи (tafi, от англ. thin aggregative fimbriae — «тонкие агрегирующие нити») (рис. 1) [2, 19].
В настоящее время разрабатываются многочисленные лекарственные средства, действие которых направлено на подавление синтеза различных компонентов пили, в связи с чем они получили общее название «пилициды» [8, 24]. Процесс сборки пили типа I и P ассоциирован с шапероновым путем (chaperone-usher pathway — CUP). Пилюс состоит из двух морфологических частей: 1) структурной основной субъединицы; 2) N-концевого наконечника, необходимого для специфического связывания с рецептором клетки макроорганизма. Основная субъединица пили типа I состоит из молекул FimA (major type 1 subunit fimbrin), а минорные компоненты представлены FimF, FimG и лектинсодержащей концевой субъединицей FimH. Основная субъединица пили типа P состоит из молекул PapA (major pilin protein PapA), наконечника из молекул PapE, PapF, PapK и лектинсодержащей концевой субъединицы PapG (рис. 2) [4].
Молекулы всех субъединиц пили секретируются в развернутом состоянии через внутреннюю мембрану в периплазматическое пространство, используя SecYEG-машинерию. Шапероны FimC и PapD складывают и стабилизируют каждую молекулу основной субъединицы пили типа I и P соответственно. Комплексы шаперон-субъединицы пили затем переносятся на usher-структуры или капельдинеры FimD или PapC, которые облегчают сборку и удлинение пили [24].
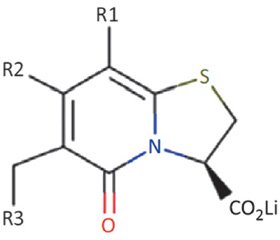
Пилициды прямо ингибируют биогенез пили типа I и P и относятся к классу молекул бициклических 2-пиридонов (рис. 3).
Пилициды, препятствуя адгезии, не влияют на рост бактерий [3]. Дополнительные исследования поверхностного плазмонного резонанса (surface plasmon resonance — SPR) показали, что пилициды препятствуют взаимодействию FimC-FimH Escherichia coli с FimD. Считают, что механизм ингибирования биогенеза пили типа I и P заключается в предотвращении переноса комплекса шаперон-субъединицы пили на капельдинеры [19].
Нитазоксанид (nitazoxanide, рис. 4) — противопаразитарный препарат, ингибирующий бактериальную адгезию, подавляя сборку пили типа I [6].
Florence Tchouaffi-Nana и соавт. [31] представили научные доказательства того, что нитазоксанид блокирует аккумуляцию коагулазонегативных бактерий Staphylococcus, включая штаммы Staphylococcus aureus, устойчивые к действию метициллина, на поверхности клетки.
Действие биарил-маннозида 22 и FN075 показано только на бактерии Escherichia coli [5, 12].
Блокирование рецепторов, связывающихся
с бактериальными факторами вирулентности
Адгезия не только является обязательным предшествующим этапом бактериальной колонизации, но и необходима для высвобождения многочисленных факторов вирулентности, которые представляют собой молекулярную основу триггерных механизмов микровозбудителя. Различные бактерии используют разные поверхностные адгезины, которые связываются со специфическими клеточными рецепторами макроорганизма (табл. 4) [16, 30].
Впервые данный подход к антиадгезионной терапии был предложен Itzhak Ofek и соавт. [26]. Продемонстрировано, что дериваты a-маннозида блокируют связывания FimH Escherichia coli с рецепторами, содержащими маннозу, линии HT-29 человеческих эпителиальных клеток [13].
Выводы
Однако антиадгезионная терапия, несмотря на свою очевидную привлекательность, не используется для лечения бактериальных инфекций. По всей вероятности, причинами недостаточного использования антиадгезионных препаратов при бактериальных инфекциях являются: 1) многочисленность молекул адгезии бактерии; 2) зависимость продукции адгезинов от стадии инфекционного процесса и пораженной ткани макроорганизма; 3) необходимость наличия у ингибиторов адгезии высокого уровня аффинитета [30].
Можно предположить, что дальнейшее изучение непосредственных механизмов специфического взаимодействия бактериальных адгезинов с клетками макроорганизма, несомненно, позволит разработать новые эффективные антиадгезионные препараты, которые станут лекарственными средствами при лечении бактериальных инфекций в обычной врачебной практике.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Абатуров А.Е., Крючко Т.А. Ингибирование эффектов, связанных с действием бактериальных факторов вирулентности, как метод лечения бактериальных пневмоний // Здоровье ребенка. — 2018. — № 2.
2. Рекстина В.В. Амилоидные белки поверхности микроорганизмов: структура, свойства и значение для медицины / В.В. Рекстина, А.А. Горковский, Е.Е. Безсонов, Т.С. Калебина // Вестник Российского государственного медицинского университета. — 2016. — № 1. — С. 4-13.
3. Berg V. Design, synthesis and evaluation of peptidomimetics based on substituted bicyclic 2-pyridones-targeting virulence of uropathogenic E. coli / V. Berg, M. Sellstedt, M. Hedenström et al. // Bioorg. Med. Chem. — 2006, Nov 15. — 14(22). — Р. 7563-81. PMID: 16904898.
4. Busch A., Phan G., Waksman G. Molecular mechanism of bacterial type 1 and P pili assembly // Philos. Trans. A Math. Phys. Eng. Sci. — 2015, Mar 6. — 373(2036). — pii: 20130153. doi: 10.1098/rsta.2013.0153.
5. Cegelski L. Small-molecule inhibitors target Escherichia coli amyloid biogenesis and biofilm formation / L. Cegelski, J.S. Pinkner, N.D. Hammer et al. // Nat. Chem. Biol. — 2009 Dec. — 5(12). — Р. 913-9. doi: 10.1038/nchembio.242.
6. Chahales P. Nitazoxanide Inhibits Pilus Biogenesis by Interfering with Folding of the Usher Protein in the Outer Membrane / Chahales P., Hoffman P.S., Thanassi D.G. et al. // Antimicrob. Agents Chemother. — 2016, Mar 25. — 60(4). — Р. 2028-38. doi: 10.1128/AAC.02221-15.
7. Chemani C. Role of LecA and LecB lectins in Pseudomonas aeruginosa-induced lung injury and effect of carbohydrate ligands / Chemani C., Imberty A., de Bentzmann S. et al. // Infect Immun. — 2009 May. — 77(5). — Р. 2065-75. doi: 10.1128/IAI.01204-08.
8. Cozens D., Read R.C. Anti-adhesion methods as novel therapeutics for bacterial infections // Expert Rev. Anti-Infect. Ther. — 2012 Dec. — 10(12). — Р. 1457-68. doi: 10.1586/eri.12.145.
9. Donlan R.M. Biofilms: microbial life on surfaces // Emerg. Infect. Dis. — 2002 Sep. — 8(9). — Р. 881-90. doi: 10.3201/eid0809.020063.
10. Gustke H. Inhibition of the bacterial lectins of Pseudomonas aeruginosa with monosaccharides and peptides / H. Gustke, R. Kleene, G. Loers et al. // Eur. J. Clin. Microbiol. Infect. Dis. — 2012 Feb. — 31(2). — Р. 207-15. doi: 10.1007/s10096-011-1295-x.
11. Haataja S. Rationally designed chemically modified glycodendrimer ligand analogues inhibit Streptococcus suis adhesin SadP in picomolar concentrations / Haataja S., Verma P., Fu O. et al. // Chemistry. — 2017, Nov 2. doi: 10.1002/chem.201704493.
12. Han Z. Lead optimization studies on FimH antagonists: discovery of potent and orally bioavailable ortho-substituted biphenyl mannosides / Z. Han, J.S. Pinkner, B. Ford et al. // J. Med. Chem. — 2012, Apr 26. — 55(8). — Р. 3945-59. doi: 10.1021/jm300165m.
13. Hartmann M. Inhibition of bacterial adhesion to live human cells: activity and cytotoxicity of synthetic mannosides / M. Hartmann, H. Papavlassopoulos, V. Chandrasekaran et al. // FEBS Lett. — 2012, May 21. — 586(10). — Р. 1459-65. doi: 10.1016/j.febslet.2012.03.059.
14. Heikkilä I. Oligosaccharides interfere with the establishment and progression of experimental pneumococcal pneumonia.
15. https://www.clearsynth.com/en/CSP01179.html
16. Hymes J.P., Klaenhammer T.R. Stuck in the Middle: Fibronectin-Binding Proteins in Gram-Positive Bacteria // Front. Microbiol. — 2016, Sep 22. — 7. — Р. 1504. doi: 10.3389/fmicb.2016.01504.
17. Idänpään-Heikkilä I., Simon P.M., Zopf D. et al. // J. Infect. Dis. — 1997 Sep. — 176(3). — Р. 704-12. PMID: 9291319.
18. Johansson E.M. Inhibition and dispersion of Pseudomonas aeruginosa biofilms by glycopeptide dendrimers targeting the fucose-specific lectin LecB / E.M. Johansson, S.A. Crusz, E. Kolomiets et al. // Chem. Biol. — 2008, Dec 22. — 15(12). — Р. 1249-57. doi: 10.1016/j.chembiol.2008.10.009.
19. Johnson B.K., Abramovitch R.B. Small Molecules That Sabotage Bacterial Virulence // Trends Pharmacol. Sci. — 2017 Apr. — 38(4). — Р. 339-362. doi: 10.1016/j.tips.2017.01.004.
20. Karygianni L. Natural Antimicrobials and Oral Microorganisms: A Systematic Review on Herbal Interventions for the Eradication of Multispecies Oral Biofilms / L. Karygianni, A. Al-Ahmad, A. Argyropoulou et al. // Front. Microbiol. — 2016, Jan 14. — 6. — Р. 1529. doi: 10.3389/fmicb.2015.01529.
21. Khare B., V.L. Narayana S. Pilus biogenesis of Gram-positive bacteria: Roles of sortases and implications for assembly // Protein Sci. — 2017 Aug. — 26(8). — Р. 1458-1473. doi: 10.1002/pro.3191.
22. King J.E., Roberts I.S. Bacterial Surfaces: Front Lines in Host-Pathogen Interaction // Adv. Exp. Med. Biol. — 2016. — 915. — Р. 129-56. doi: 10.1007/978-3-319-32189-9_10.
23. Klemm P., Vejborg R.M., Hancock V. Prevention of bacterial adhesion // Appl. Microbiol. Biotechnol. — 2010 Sep. — 88(2). — Р. 451-9. doi: 10.1007/s00253-010-2805-y.
24. Lillington J., Geibel S., Waksman G. Biogenesis and adhesion of type 1 and P pili // Biochim. Biophys. Acta. — 2014 Sep. — 1840(9). — Р. 2783-93. doi: 10.1016/j.bbagen.2014.04.021.
25. Ofek I., Hasty D.L., Sharon N. Anti-adhesion therapy of bacterial diseases: prospects and problems // FEMS Immunol. Med. Microbiol. — 2003, Oct 15. — 38(3). — Р. 181-91. PMID: 14522453.
26. Rampioni G., Leoni L., Williams P. The art of antibacterial warfare: Deception through interference with quorum sensing-mediated communication // Bioorg. Chem. — 2014 Aug. — 55. — Р. 60-8. doi: 10.1016/j.bioorg.2014.04.005.
27. Sharon N. Carbohydrates as future anti-adhesion drugs for infectious diseases // Biochim. Biophys. Acta. — 2006 Apr. — 1760(4). — Р. 527-37. DOI: 10.1016/j.bbagen.2005.12.008.
28. Signoretto C. Functional foods and strategies contrasting bacterial adhesion / C. Signoretto, P. Canepari, M. Stauder et al. // Curr. Opin. Biotechnol. — 2012 Apr. — 23(2). — Р. 160-7. doi: 10.1016/j.copbio.2011.08.006.
29. Spirig T., Weiner E.M., Clubb R.T. Sortase enzymes in Gram-positive bacteria // Mol. Microbiol. — 2011 Dec. — 82(5). — Р. 1044-59. doi: 10.1111/j.1365-2958.2011.07887.x.
30. Stones D.H., Krachler A.M. Against the tide: the role of bacterial adhesion in host colonization // Biochem. Soc. Trans. — 2016, Dec 15. — 44(6). — Р. 1571-1580. doi: 10.1042/BST20160186.
31. Tchouaffi-Nana F. Nitazoxanide inhibits biofilm formation by Staphylococcus epidermidis by blocking accumulation on surfaces / Tchouaffi-Nana F., Ballard T.E., Cary C.H. et al. // Antimicrob. Agents Chemother. — 2010 Jul. — 54(7). — Р. 2767-74. doi: 10.1128/AAC.00901-09.
32. Thomas R., Brooks T. Attachment of Yersinia pestis to human respiratory cell lines is inhibited by certain oligosaccharides // J. Med. Microbiol. — 2006 Mar. — 55(Pt 3). — Р. 309-15. doi: 10.1099/jmm.0.46102-0.

/88-1.jpg)
/90-1.jpg)
/91-1.jpg)
/92-1.jpg)
/93-1.jpg)
/94-1.jpg)
/95-1.jpg)
/96-1.jpg)
/97-1.jpg)
/97-2.jpg)
/98-2.jpg)
/98-1.jpg)