Журнал "Гастроэнтерология" Том 52, №4, 2018
Вернуться к номеру
Течение пептических гастродуоденальных язв на фоне коморбидного сахарного диабета
Авторы: Синяченко О.В., Ермолаева М.В., Гмошинский Н.В.
Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Коморбідний цукровий діабет (ЦД) 2 типу погіршує перебіг пептичних виразок шлунка (ВШ) і дванадцятипалої кишки (ВК), а також ефективність лікувальних заходів, при цьому є незалежним чинником ризику розвитку гастродуоденальних кровотеч. Серопозитивність хворих на ЦД за носійством гелікобактерної інфекції становить 50–60 %, яка реєструється на 90 % частіше, ніж в загальній популяції. Мета: проаналізувати характер перебігу гастродуоденальних виразок на тлі коморбідного ЦД, виділити прогностичні критерії. Матеріали та методи. Під спостереженням перебували 1392 пацієнти з ВШ і ВК. ЦД діагностований у 215 хворих (17 %), які увійшли до основної групи, а решта (83 %) становили групу порівняння. Співвідношення ВК : ВШ : ВК + ВШ в групі із ЦД становило 6 : 2 : 1, а серед інших обстежених — 10 : 4 : 1, співвідношення чоловіків і жінок в першій групі було 2 : 1, а в другій — 3 : 1, середній вік хворих — відповідно 52 роки, тривалість маніфестації пептичних виразок — 6 років. Індекс тяжкості хвороби становив 6 в.о., показник глюкози в крові — 10 ммоль/л, глікозильованого гемоглобіну (HbA1c) — 8 %, інсуліну — 25 мкМО/мл, коефіцієнту інсулінорезистентності (HOMA) — 12 в.о. Легкий, середньої тяжкості й тяжкий ступінь ЦД співвідносились як 1 : 2 : 1. Результати. ЦД належить до чинників ризику тяжкого перебігу ВШ і ВК, визначає локалізацію ульцерації, розміри виразок, розвиток рефлюкс-езофагіту та дуоденогастрального рефлюксу, змін фізико-хімічних адсорбційно-реологічних властивостей шлункового соку й тяжкість гістологічних ушкоджень слизової оболонки шлунка, які залежать від характеру інсулінорезистентності. Коморбідний ЦД є чинником ризику тяжкого перебігу гастродуоденальних кровотеч, впливає на кардіоваскулярні показники гемодинаміки (рівні середнього артеріального тиску, периферійного судинного опору, об’єму циркулюючої крові) та визначає 60-годинну виживаність хворих, а до прогнознегативних критеріїв належать рівні глікемії, HbA1c і НОМА. Висновки. Коморбідний ЦД значно погіршує перебіг пептичних гастродуоденальних виразок та є чинником ризику їх рецидивів.
Актуальность. Коморбидный сахарный диабет (СД) 2 типа ухудшает течение пептических язв желудка (ЯЖ) и двенадцатиперстной кишки (ЯК), а также эффективность лечебных мероприятий, при этом является независимым фактором риска развития гастродуоденальных кровотечений. Серопозитивность больных СД по носительству хеликобактерной инфекции составляет 50–60 %, которая регистрируется на 90 % чаще, чем в общей популяции. Цель: проанализировать характер течения гастродуоденальных язв на фоне коморбидного СД, выделить прогностические критерии. Материалы и методы. Под наблюдением находилось 1392 пациента с ЯЖ и ЯК. СД диагностирован у 215 больных (17 %), которые включены в основную группу, а остальные (83 %) составили группу сравнения. Соотношение ЯК : ЯЖ : ЯЖ + ЯК в группе с СД составило 6 : 2 : 1, а среди остальных обследованных — 10 : 4 : 1, соотношение мужчин и женщин в первой группе было 2 : 1, а во второй — 3 : 1, средний возраст больных — соответственно 52 года, длительность манифестации пептических язв — 6 лет. Индекс тяжести болезни составил 6 о.е., показатель глюкозы в крови — 10 ммоль/л, гликозилированного гемоглобина (HbA1c) — 8 %, инсулина — 25 мкМЕ/мл, коэффициента инсулинорезистентности (HOMA) — 12 о.е. Легкая, средней тяжести и тяжелая степень СД соотносились как 1 : 2 : 1. Результаты. СД относится к факторам риска тяжелого течения ЯЖ и ЯК, определяет локализацию ульцерации, размеры изъязвлений, развитие рефлюкс-эзофагита и дуоденогастрального рефлюкса, изменений физико-химических адсорбционно-реологических свойств желудочного сока и тяжесть гистологических повреждений слизистой оболочки желудка, которые зависят от характера инсулинорезистентности. Коморбидный СД является фактором риска тяжелого течения гастродуоденальных кровотечений, влияет на кардиоваскулярные показатели гемодинамики (уровни среднего артериального давления, периферического сосудистого сопротивления, объема циркулирующей крови) и определяет 60-часовую выживаемость больных, а к прогнознегативным критериям относятся уровни гликемии, HbA1c и НОМА. Выводы. Коморбидный СД значительно ухудшает течение пептических гастродуоденальных язв и является фактором риска их рецидивов.
Background. Comorbid diabetes mellitus (DM) type 2 worsens the course of peptic gastric ulcers (GU) and duodenal ulcer (DU) as well as the effectiveness of therapeutic measures while it is an independent risk factor for the development of gastroduodenal bleeding. Seropositivity of patients with DM as the carriers of Helicobacter infection is 50–60 %, the latter is registered 90 % more often than in the general population. The purpose was to analyze the nature of the course of gastroduodenal ulcers on the background of comorbid DM, to identify prognostic criteria. Materials and methods. 1392 patients with GU and DU were under the survey. DM was diagnosed in 215 patients (17 %) who were included in the main group and the remaining (83 %) were in the comparison group. The ratio of DU : GU: GU + DU in the group with DM was 6 : 2 : 1, and among the rest of the patients — 10 : 4 : 1. The ratio of men and women in the first group was 2 : 1, and in the second — 3 : 1, the average age of patients — 52 years, the duration of the manifestation of peptic ulcers — 6 years. The index of the severity of the disease was 6 r.u., level of blood glucose — 10 mmol/l, glycosylated hemoglobin (HbA1c) — 8 %, insulin — 25 µIU/ml, the index of insulin resistance (HOMA) — 12 r.u. The ratio of mild, moderate and severe degree of DM was 1 : 2 : 1. Results. DM is a risk factor for severe course of GU and DU, it determines the localization of ulceration, the size of ulcerations, the development of reflux esophagitis and duodenogastric reflux, the changes in the physico-chemical adsorption-rheological properties of gastric juice and the severity of histological damage to the gastric mucosa which depend on the nature of insulin resistance. Comorbid DM is a risk factor for severe gastroduodenal bleeding, it affects the cardiovascular hemodynamic parameters (the levels of average blood pressure, peripheral vascular resistance, circulating blood volume) and determines 60-hour survival of patients, and predictive criteria include the levels of glycemia, HbA1c and НОМА. Conclusions. Comorbid DM significantly worsens the course of peptic gastroduodenal ulcers and it is a risk factor for their recurrence.
пептичні гастродуоденальні виразки; перебіг; цукровий діабет
пептические гастродуоденальные язвы; течение; сахарный диабет
peptic gastroduodenal ulcers; course; diabetes mellitus
Введение
По высокому уровню распространенности и экономическим затратам на лечение пептические язвы желудка (ЯЖ) и двенадцатиперстной кишки (ЯК) входят в число наиболее актуальных проблем современной медицины [1, 2]. При этом сахарный диабет (СД) 2 типа является независимым фактором риска развития ЯЖ и ЯК [3–5], повышает частоту осложнений этих заболеваний [6], в частности, гастродуоденальных кровотечений [7–9]. Коморбидный СД увеличивает на 40–50 % смертность таких больных в течение первого месяца [10]. Летальные исходы от гастродуоденальных язвенных кровотечений при коморбидном СД наблюдаются в 2–3 раза чаще, чем у остальных пациентов, но течение ЯЖ и ЯК на фоне СД требует дальнейшего изучения [11, 12].
Цель: проанализировать характер течения гастродуоденальных язв на фоне коморбидного СД, выделить прогностические критерии.
Материалы и методы
Проведен ретроспективный анализ 1392 больных с пептическими ЯЖ и ЯК. Среди обследованных больных было 986 (70,8 %) мужчин и 406 (29,2 %) женщин в возрасте от 14 до 90 лет (в среднем (51,20 ± 0,39) года). 68,2 % от числа пациентов страдали ЯК, 24,9 % — ЯЖ, 6,9 % — ЯЖ + ЯК, т. е. соотношение ЯК : ЯЖ : ЯЖ + ЯК составило 10 : 4 : 1. Длительность клинической манифестации была равна (6,20 ± 0,28) года. Заболевание впервые дебютировало с гастродуоденального кровотечения в 38,9 % случаев, достоверно чаще (χ2 = 12,88, p < 0,001) у женщин (соответственно у 35,7 % от числа мужчин и у 46,6 % женщин). СД типа 2 диагностирован у 215 больных (17,1 %), которые включены в основную группу, а остальные (83 %) составили группу сравнения.
Всем пациентам выполнена фиброэзофагогастродуоденоскопия с использованием эндоскопов Olympus-GIF-Q20 (Япония), EXERA-II-Olympus (Япония), Fujinon-FG-1Z (Япония), 17,9 % из них — рентгенография пищевода, желудка и двенадцатиперстной кишки (аппарат Multix-Compact-Siеmens, Германия). Идентификацию хеликобактерной инфекции проводили с помощью быстрого уреазного теста и по исследованию уровня антихеликобактерных антител классов иммуноглобулинов G и A иммуноферментным методом (ридер PR2100-Sanofi diagnostic pasteur, Франция), а также с помощью диагностической тест-системы «Хелико-БЕСТ-антитела» (Россия). Тяжесть течения пептических ЯЖ и ЯК (WI) оценивали по следующей формуле: WI = ln {[(∑1 : n) + (∑2 : n) + (2 × ∑3 : n)] × g × h}, где ln — натуральный логарифм, ∑1, ∑2, ∑3 — соответственно сумма клинических, эндоскопических и гистологических признаков болезни, n — число показателей, g — степень тяжести язвенного кровотечения (индекс Альговера — Бурри), h — коэффициент, равный 2, при наличии осложнений болезни в прошлом (кровотечение, стеноз, перфорация и пенетрация язвы).
Выполняли биопсию слизистой оболочки тела желудка, его пилорического отдела и луковицы двенадцатиперстной кишки в стороне от язвы. Срезы биоптатов окрашивали гематоксилином и эозином, толуидиновым синим по Шуенинову, ставили PAS-реакцию. Проводилась гистологическая визуализация Helicobacter pylori (Нр) после окраски биопсийных срезов по Гимзе и Генте. Материалы биопсий фиксировали в 10% нейтральном формалине, забуференном по Лилли, и заливали в парафин. Результаты гистологического исследования определяли в баллах (от 0 до 3). Степень тяжести морфологических изменений (гистологический индекс — HІ) оценивали по формуле: HІ = (a + 2b + 3c) : (a + b + c + d), где a — число случаев признака в 1 балл, b — число случаев признака в 2 балла, c — число случаев признака в 3 балла, d — число случаев с отсутствием признака.
Межфазная тензиометрия желудочного сока (ЖС) выполнена с помощью компьютерного адсорбционного тензиометра МРТ2-Lauda (Германия), а с применением компьютерного тензиометра ADSA-Toronto (Германия — Канада) определяли реологические свойства ЖС и сыворотки крови. В наших исследованиях осуществлялась быстрая стрессовая деформация расширения поверхности (при t = 20 минут для крови и t = 30 минут для ЖС) с определением модуля вязкоэластичности (сooтветственно VEb и VEj). После расширения капли статическое поверхностное натяжение (EST) медленно релаксировало, т.е. возвращалось к своему первоначальному значению. Время релаксации ЖС и крови (соответственно SRj и SRb) характеризовало способность монослоя восстанавливать исходное состояние (отражало кинетику адсорбции из раствора и процессы перестройки состояний адсорбированных молекул в условиях почти равновесного монослоя). Подсчитывали соотношения VEj/VEb и SRj/SRb.
Проведенные исследования одобрены комиссией по биоэтике Донецкого национального медицинского университета, больные представили письменное информированное согласие на участие в исследовании.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного непараметрического корреляционного регрессионного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии однофакторной дисперсии (D) и многофакторной Уилкоксона — Рао (WR), различий Стьюдента (t) и Макнемара — Фишера (χ2), а также достоверность статистических показателей (р). Подсчитывали степень прогностически позитивного результата модели (PPV).
Результаты
Соотношение ЯК : ЯЖ : ЯЖ + ЯК в группе с СД составило 6 : 2 : 1, а среди остальных обследованных — 10 : 4 : 1 (χ2 = 5,94, р = 0,015). Если в основной группе показатель WI был равен (5,90 ± 0,16) о.е., то в группе сравнения без СД — (5,80 ± 0,07) о.е. Установлено влияние тяжести СД на тяжесть течения пептических язв, что продемонстрировал однофакторный дисперсионный анализ (D = 3,87, p < 0,001).
Легкая форма СД имела место у 23,3 % от числа больных, средней тяжести — у 49,3 %, тяжелая — у 27,4 %, показатели в крови глюкозы (Gl) составляли (10,70 ± 0,25) ммоль/л, гликозилированного гемоглобина (HbA1c) — (8,90 ± 0,17) %, инсулина (Ins) — (30,30 ± 1,28) мкМЕ/мл, критерия инсулинорезистентности (HOMA) — (14,50 ± 0,79) о.е., а частота выявления Нр при СД была в 2,2 раза большей (χ2 = 10,74, р < 0,001). По данным дисперсионного анализа, на носительство Нр-инфекции оказывали влияние уровни Gl (D = 8,66, p = 0,006), Ins (D = 11,02, p = 0,007), HOMA (D = 4,95, p = 0,045).
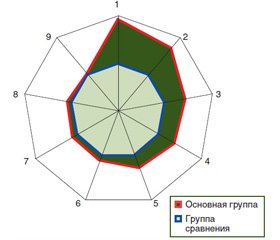
Многофакторный дисперсионный анализ Уилкоксона — Рао продемонстрировал воздействие тяжести течения СД на интегральные проявления гастродуоденальных язв (WR = 10,06, p < 0,001). Выполненный однофакторный дисперсионный анализ показал влияние тяжести коморбидного СД на локализацию ЯЖ в кардиальном отделе, в передней его стенке и на параметры объемов гастроульцераций, что нашло свое отражение на рис. 1. У больных с коморбидным СД в 6,5 раза чаще отмечали язвы в выходном отделе желудка (χ2 = 5,71, p = 0,017) и в 4,3 раза — признаки рефлюкс-эзофагита (χ2 = 9,39, p = 0,002), но в 2,4 раза реже имело место изъязвление кардии (χ2 = 4,47, р = 0,035). В основной группе больных и в группе сравнения средние размеры площади ЯЖ и их объемов были одинаковы. При этом отсутствовали влияние тяжести СД на этот показатель и корреляционные непараметрические связи Кендалла.
Тяжесть СД оказывает достоверное воздействие на формирование дуоденогастрального рефлюкса (D = 6,90, p = 0,010) и показатели объема ЯК (D = 4,25, p = 0,046). На фоне коморбидного СД дуоденогастральный рефлюкс встречался в 6,5 раза чаще, чем в группе сравнения без СД (χ2 = 16,51, p < 0,001), в 1,6 раза — локализация изъязвлений слизистой оболочки в области медиальной стенки (χ2 = 5,32, p = 0,021), но вдвое реже — в выходном отделе двенадцатиперстной кишки (χ2 = 18,99, p < 0,001). Объем дуоденальных язв имел прямые корреляционные связи со степенью тяжести коморбидного СД (τ = +0,115, p = 0,048).
От наличия у больных с пептическими гастродуоденальными язвами СД зависели WI (D = 2,19, p = 0,032), а также возникновение рефлюкс-эзофагита (D = 4,02, p = 0,049) и параульцерозных эрозий слизистой оболочки желудка (D = 8,40, p = 0,005), первый из которых диагностирован на фоне СД на 67 % чаще (χ2 = 3,90, p = 0,048), а второй в группе сравнения без СД вообще не встречалcя (χ2 = 15,82, p < 0,001).
Тельца Русселя при гистологическом исследовании гастробиоптатов обнаружены у 64,1 % от числа больных, наличие фибрина в железах — у 70,2 %, снижение высоты эпителиоцитов — у 45,8 %, нейтрофильная инфильтрация — у 68,7 %, уменьшение глубины желудочных ямок — у 48,9 %, изменения конфигурации эпителиоцитов — у 64,1 %, клеточная воспалительная инфильтрация — у 97 %, утолщение желудочных валиков — у 61,1 %, лимфоплазмоцитарная инфильтрация — у 98,5 %. Показатель НІ в основной группе составил (1,730 ± 0,235) о.е., а в группе сравнения он был на 1/4 меньшим ((1,110 ± 0,117) о.е.; t = 2,39, p = 0,020). Коморбидный СД влияет на частоту телец Русселя (D = 3,05, p = 0,035) и наличие фибрина в железах (D = 2,79, p = 0,048). Эти показатели в основной группе были чаще выявлены соответственно на 61 % (χ2 = 6,01, p = 0,014) и 42 % (χ2 = 4,06, p = 0,044), а кроме сказанного, СД сопровождался вдвое более частым обнаружением уменьшения глубины желудочных ямок (χ2 = 7,12, p = 0,008) и на 63 % — клеточной воспалительной инфильтрации (χ2 = 7,73, p = 0,005).
Как видно из рис. 2, коморбидный СД проявляется достоверно большими на 93 % параметрами частоты нейтрофильной инфильтрации слизистой оболочки желудка и на 74 % — наличия фибрина в железах. На наличие телец Русселя и фибрина в железах желудка при гастродуоденальной язвенной болезни влияет концентрация гликемии (соответственно D = 4,05, p = 0,048 и D = 3,86, p = 0,045), на утолщение желудочных валиков и уменьшение глубины желудочных ямок — содержание инсулинемии (D = 3,78, p = 0,048 и D = 4,03, p = 0,041) и НОМА (D = 5,11, p = 0,021 и D = 4,32, p = 0,034), причем параметр последнего оказывает также достоверное воздействие на уменьшение глубины желудочных ямок (D = 4,02, p = 0,041) и изменения конфигурации эпителиоцитов (D = 5,11, p = 0,021). Степень выраженности нейтрофильной инфильтрации зависит от уровней в крови HbA1c (D = 4,42, p = 0,032), Ins (D = 3,99, p = 0,042), HOMA (D = 4,40, p = 0,032).
Непараметрический коэффициент корреляции Кендалла показал существование прямых корреляционных связей со степенью инсулинорезистентности таких гистологических критериев, как утолщение желудочных валиков (τ = +0,467, р = 0,020), уменьшение глубины желудочных ямок (τ = +0,483, р = 0,016), изменение конфигурации эпителиоцитов (τ = +0,465, р = 0,021), наличие телец Русселя (τ = +0,524, р = 0,009), степень клеточной нейтрофильной (τ = +0,576, р = 0,004) и лимфоплазмоцитарной (τ = +0,462, р = 0,021) инфильтрации. Эти связи во многом обусловлены уровнем инсулинемии, а между концентрацией в крови Ins и параметром HI существует достоверная прямая корреляция (τ = +0,466, p = 0,020).
Обсуждение
С учетом выполненного дисперсионного и корреляционного анализа сделано следующее заключение, имеющее определенную практическую значимость (PPV = 66,6 %): показатель HOMA > 21 о.е. (> M + SD больных с гастродуоденальными язвами и коморбидным СД) является прогнознеблагоприятным фактором и указывает на тяжелое морфологическое поражение слизистой оболочки желудка. На выраженность эндоскопических признаков пептических гастродуоденальных язв негативно влияет уровень в крови больных СД HbA1c. Сказанное касается развития рефлюкс-эзофагита (D = 4,48, p = 0,048) дуоденогастрального рефлюкса (D = 5,79, p = 0,033), рыхлости, гиперемии и эрозий слизистой оболочки желудка (соответственно D = 5,73, p = 0,020; D = 3,93, p = 0,043; D = 6,74, p = 0,023), формирования деформаций луковицы двенадцатиперстной кишки (D = 11,77, p = 0,002) и ее эрозий (D = 5,43, p = 0,023). На наш взгляд, уровень HbA1c > 11 % (> M + SD больных с гастродуоденальными язвами и коморбидным СД) является прогнознеблагоприятным фактором и указывает на выраженные язвенные эндоскопические изменения желудка и двенадцатиперстной кишки (PPV = 69,5 %).
На рис. 3 представлены прямые корреляционно-регрессионные связи Пирсона показателя HI с разными гистологическими признаками гастробиоптатов, а на рис. 4 — обратные соотношения Hi с параметрами реологического состояния ЖС у больных с гастродуоденальными язвами. Уровень ESTj у таких больных без коморбидного СД составил (38,50 ± 0,87) мН/м, VEj — (20,70 ± 3,18) мН/м, VEj/VEb — (357,30 ± 42,47) о.е., SRj — (249,80 ± 20,19) с, SRj/SRb — (78,80 ± 6,01) %, тогда как наличие СД сопровождалось достоверным уменьшением на 12 % показателя динамической межфазной активности ЖС (t = 2,54, p = 0,014) и на 41 % — соотношения релаксационных свойств ЖС и сыворотки крови (t = 2,82, p = 0,008).
Установлена обратная корреляционная связь Пирсона между показателями SRj и HI (r = –0,380, p = 0,019). Кроме того, мы выделили физико-химические адсорбционно-реологические параметры ЖС, которые одновременно имели достоверные дисперсионные и корреляционные связи Кендалла с гистологическими изменениями слизистой оболочки желудка. Отмечены негативные соотношения времени релаксации ЖС с уровнями утолщения желудочных валиков (D = 3,80, p = 0,049; t = –0,292, p = 0,002), изменения конфигурации эпителиоцитов (D = 2,89, p = 0,048; τ = –0,259, p = 0,006), уменьшения глубины желудочных ямок (D = 3,91, p = 0,014; τ = –0,319, p = 0,001), со степенью нейтрофильной (D = 5,60, p = 0,002; τ =–0,342, p < 0,001) и лимфоплазмоцитарной инфильтрации (D = 3,51, p = 0,037; τ = –0,303, p = 0,001). Степень рыхлости слизистой оболочки желудка обратно связана с показателем ESTj (D = 2,45, p = 0,009; τ = –0,248, p = 0,006), эрозирования слизистой двенадцатиперстной кишки — с VEj (D = 2,22, p = 0,025; τ = –0,220, p = 0,021).
Таким образом, коморбидный СД увеличивает тяжесть течения гастродуоденальных язв, степень выраженности гистологических признаков изменений слизистой оболочки желудка, повышает частоту Нр-носительства и нарушений адсорбционно-реологических свойств ЖС. С учетом данных литературы в этой связи дадим некоторые комментарии.
Общность патогенетических построений пептических ЯЖ/ЯК и СД связывают со сниженной продукцией гипофизом поверхностно-активного мелатонина (N-ацетио-5-метокситриптамина) [13], дисбалансом системы оксидазотных синтетаз и гиперпродукцией провоспалительных цитокинов [14], что продемонстрировано на больных людях и экспериментальных животных (крысах линии Вистар). Еще одним общим фактором патогенеза СД и гастродуоденальных язв является эндотелиальная дисфункция сосудов [15]. У так называемых диабетических крыс с моделью пептических гастродуоденальных язв повышается активность индуцибельной оксидазотной синтетазы, провоспалительных цитокинов и ядерного фактора κВ, а также процессы перекисного окисления липидов [16].
Частота Нр при наличии коморбидного СД выше, чем при ЯЖ и ЯК без такой эндокринной патологии [17, 18]. Серопозитивность больных СД по Нр составляет около 60 % [19], а носительство инфекции регистрируется на 90 % чаще, чем в общей популяции, что прямо коррелирует с уровнями в крови фактора некроза опухоли α, маннозосвязанного лектина и липопротеинов низкой плотности. С хеликобактерной инфекцией у таких больных тесно связаны генотипы rs1800450 AA и rs1800620 [20].
Выводы
1. Коморбидный СД в соотношении легкой, средней и тяжелой степени 1 : 2 : 1 наблюдается у 17 % от числа больных с гастродуоденальными пептическими язвами.
2. СД чаще сопровождается сочетанной патологией в желудке и двенадцатиперстной кишке, носительством хеликобактерной инфекции, определяет локализацию ульцерации, размеры изъязвлений, развитие рефлюкс-эзофагита и дуоденогастрального рефлюкса, изменений физико-химических адсорбционно-реологических свойств ЖС.
3. Тяжесть гистологических параметров повреждений слизистой оболочки желудка на фоне СД зависит от степени инсулинорезистентности.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о финансировании: статья подготовлена исключительно за счет личного участия авторов.
Информация о вкладе каждого автора:
Синяченко О.В. — концепция, дизайн исследования, написание текста; Ермолаева М.В. — обработка материалов, анализ данных литературы; Гмошинский Н.В. — сбор материалов, оформление иллюстраций.
1. Peptic ulcer disease in healthcare workers: a nationwide population-based cohort study / H.Y. Lin, S.F. Weng, H.J. Lin [et al.] // PLoS One. — 2015. — Vol. 10, № 8. — E. 0135456.
2. Risk factors for adverse course of gastric and duodenal peptic ulcer / O.M. Komar, N.M. Kizlova, O.D. Trylevych, V.V. Kravchenko // Wiad. Lek. — 2018. — Vol. 71, № 1–2. — P. 160-164.
3. Effects of rebamipide on gastrointestinal symptoms in patients with type 2 diabetes mellitus / S. Park, S.Y. Park [et al.] // Diabetes Metab. J. — 2016. — Vol. 40, № 3. — P. 240-247.
4. Exendin-4, a glucagon-like peptide-1 analogue accelerates healing of chronic gastric ulcer in diabetic rats / Y.C. Chen, C.C. Ho, C.H. Yi [et al.] // PLoS One. — 2017. — Vol. 12, № 11. — E. 0187434.
5. Chi T.Y. Risk factors associated with nonsteroidal anti-inflammatory drugs (NSAIDs)-induced gastrointestinal bleeding resulting on people over 60 years old in Beijing / T.Y. Chi, H.M. Zhu, M. Zhang // Medicine. — 2018. — Vol. 97, № 18. — E. 0665.
6. Efficacy of two bariatric surgeries in type 2 diabetic patients with a body mass index of 25-27.5 / H. Yu, X.L. Dai, H.B. Zhang [et al.] // Nan Fang Yi Ke Da Xue Xue Bao. — 2017. — Vol. 37, № 5. — P. 693-697.
7. Tachecí I. Peptic ulcer disease in patients with diabetes mellitus / I. Tachecí, J. Bures // Vnitr. Lek. — 2011. — Vol. 57, № 4. — P. 347-350.
8. Peng Y.L. Diabetes is an independent risk factor for peptic ulcer bleeding: a nationwide population-based cohort study / Y.L. Peng, H.B. Leu // J. Gastroenterol. Hepatol. — 2013. — Vol. 28, № 8. — P. 1295-1299.
9. Association of vagus nerve severance and decreased risk of subsequent type 2 diabetes in pepticulcer patients: An Asian population cohort study / S.C. Wu, W.T. Chen, C.W. Fang [et al.] // Medicine. — 2016. — Vol. 95, № 49. — E. 5489.
10. Wei F. Diabetes increases morbidity and mortality rates in peptic ulcer bleeding: An updated systematic review and meta-analysis / F. Wei, X. Lin // Turk. J. Gastroenterol. — 2016. — Vol. 27, № 4. — P. 304-311.
11. Causes and outcome of upper gastrointestinal bleeding in emergency endoscopy unit of Ain Shams University Hospital / R. Elwakil, M.A. Reda, S.M. Abdelhakam [et al.] // J. Egypt Soc. Parasitol. — 2011. — Vol. 41, № 2. — P. 455-467.
12. Murata A. The influence of diabetes mellitus on short-term outcomes of patients with bleeding pepticulcers / A. Murata, S. Matsuda // Yonsei. Med. J. — 2012. — Vol. 53, № 4. — P. 701-707.
13. Melatonin as a therapeutic factor in gastric ulcer healing under experimental diabetes / M. Magierowski, K. Jasnos, I. Brzozowska [et al.] // Przegl. Lek. — 2013. — Vol. 70, № 11. — P. 942-946.
14. New insight into oseophageal injury and protection in physiologically relevant animal models / O. Zayachkivska, I. Pshyk-Titko, N. Hrycevych, M. Savytska // J. Physiol. Pharmacol. — 2014. — Vol. 65, № 2. — P. 295-307.
15. Association of endothelial progenitor cells and peptic ulcer treatment in patients with type 2 diabetes mellitus / Z. Nie, L. Xu, C. Li [et al.] // Exp. Ther. Med. — 2016. — Vol. 11, № 5. — P. 1581-1586.
16. Ameliorative effects of telmisartan in diabetic rats with indomethacin-induced gastric ulceration / A.A. Fouad, A.I. Al-Sultan, M.T. Yacoubi, W. Gomaa // Eur. J. Pharmacol. — 2010. — Vol. 637, № 1–3. — P. 162-170.
17. Non-invasive diagnosis of type 2 diabetes in Helicobacter pylori infected patients using isotope-specific infrared absorption measurements / S. Som, G. Dutta Banik, A. Maity [et al.] // Isotopes Environ. Health Stud. — 2018. — Vol. 24, № 4. — P. 1-11.
18. Tseng C. H. Metformin and Helicobacter pylori infection in patients with type 2 diabetes / C.H. Tseng // Diabetes Care. — 2018. — Vol. 41, № 4. — P. 42-43.
19. The association between Helicobacter pylori seropositivity and risk of new-onset diabetes: a prospective cohort study / M. Zhou, J. Liu, Y. Qi [et al.] // Diabetologia. — 2018. — Vol. 61, № 2. — Р. 300-307.
20. Association of mannose-binding lectin rs1800450 and tumor necrotic factor-α rs1800620 polymorphism with Helicobacter pylori in type II diabetes mellitus / E. Mortazavi, B. Eslami, P. Aghahosseini [et al.] // Monoclon. Antib. Immunodiagn. Immunother. — 2017. — Vol. 36, № 5. — P. 236-241.

/19-1.jpg)
/20-1.jpg)
/20-2.jpg)