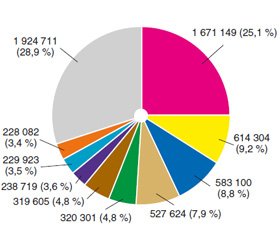
Рак молочної залози (РМЗ) залишається онкологічним захворюванням номер один у жінок у світі (рис. 1), у тому числі в Україні, що робить це захворювання актуальною проблемою багатьох досліджень. Щорічно у світі діагностують близько 1,67 мільйона нових випадків РМЗ, що становить 25 % від усіх видів раку [1, 2].
Провідну роль у лікуванні цього захворювання відіграє системна протипухлинна терапія. Тенденції лікування РМЗ направлені на персоніфікацію тактики медикаментозної терапії, що викликає необхідність більш поглибленого дослідження будови пухлини й пошуку та впровадження нових маркерів, які впливатимуть на ефективність терапії, призначеної хворим.
Більшість програм протипухлинної терапії включають хоча б один цитостатик, дія якого направлена на пошкодження молекули ДНК, а процеси репарації пошкодженої цією терапією ДНК визначають життєздатність і активність клітин злоякісних пухлин. Це робить дослідження порушень у системі репарації ДНК перспективним напрямком щодо персоніфікації тактики лікування. Головну роль у процесах репарації ДНК відіграють топоізомерази [3].
Функції й механізми дії топоізомераз
Топоізомерази — ферменти, що каталізують топологічні зміни кільцевої молекули ДНК шляхом утворення тимчасових одно- або дволанцюгових розривів. Існує два типи топоізомераз: І і ІІ. Перша топоізомераза, що належала до типу І (ТОР І), була описана James C. Wang у 1971 році при дослідженні ДНК Escherichia coli й була названа протеїном ω [4]. Пізніше, у 1976 році, Martin Gellert описав топо–ізомеразу ІІ типу (ТОР ІІ) [5]. ТОР I розривають лише один ланцюг із подвійної спіралі ДНК і не витрачають на це енергії. ТОР ІІ розривають обидва ланцюги подвійної спіралі ДНК і проводять крізь розрив інший дволанцюговий сегмент, що потребує енергетичних трат аденозинтрифосфату. Топоізомерази обох типів поділяються на 4 підтипи: Іα, Іβ, ІІα і ІІβ. Підтипи ферментів різних типів різняться механічно й структурно, але підтипи одного типу мають механічні й структурні подібності.
Одноланцюгові розриви виконуються за рахунок залишку амінокислоти тирозину, що здійснює нуклеофільний напад на фосфатну групу ДНК, утворюючи фосфотирозин. Фермент при цьому зв’язується з кінцем 3’- або 5’-фосфату, що вивільнився. Залежно від цього ТОР І поділяються на підтипи:
— ТОР Іα зв’язуються з 5’-фосфатом і знімають лише негативну надспіралізацію (пере- або недокручування топологічно замкнених ланцюгів ДНК, у результаті чого вісь подвійної спіралі ДНК сама закручується в спіраль вищого порядку);
— ТОР Іβ зв’язуються з 3’-фосфатом і знімають як позитивну, так і негативну надспіралізацію.
Внесення дволанцюгових розривів відбувається за рахунок зв’язування тирозинів топоізомерази з ДНК з утворенням 5’-фосфатних зв’язків. ТОР ІІ також має α та β підтипи, у яких є ряд особливостей:
— ТОР ІІα необхідні для росту клітини;
— експресія ТОР ІІβ відбувається в клітинах, що перебувають у стані спокою, практично всіх тканин протягом усього клітинного циклу, і вони не є необхідними для виживання клітин [6].
Щоб полегшити швидкий поділ клітин, ракові клітини потребують більш високої активності топо–ізомераз, тому, як правило, їх висока експресія відмічається в швидкозростаючих ракових клітинах [7]. Набуті знання про молекулярні механізми канцерогенезу дозволили сформувати напрям пошуку ефективних протипухлинних засобів: перевагу мають ті засоби, що спрямовують свою дію на певну ціль у раковій клітині при найменшому пошкодженні непухлинних клітин. Онкоферменти, що обумовлюють відмінні властивості пухлинних клітин (прискорену проліферацію, стійкість при дії несприятливих зовнішніх чинників тощо), можуть бути цілями протипухлинної терапії. Багато низькомолекулярних сполук здатні проникати до ядра клітин і взаємодіяти з ДНК або ДНК-залежними ферментами. Наслідком такої взаємодії є порушення структури й функціонування ДНК: змінюється локальна конформація макромолекули, викликаються розриви ланцюгів, порушуються матричні синтези. Це призводить до порушення клітинного циклу й життєздатності клітини, за рахунок чого і досягається терапевтичний ефект — затримка проліферації і/або загибель пухлини [8].
Завдяки науковому прогресу стала можливою ідентифікація чітких внутрішньоклітинних цілей цитостатиків і встановлення молекулярних механізмів їх дії. Найпопулярнішими методами діагностики топоізомераз є імуногістохімічний (ІГХ) і флуоресцентна гібридизация in situ (FISH). ІГХ — метод виявлення точної локалізації того чи іншого клітинного або тканинного компонента (антигену) завдяки зв’язуванню його з позначеними антитілами. FISH — це молекулярно-цитогенетичний метод, що застосовується для детекції наявності або відсутності послідовностей ДНК на хромосомі. Топоізомерази належать до біомаркерів, рівень експресії яких аналізується в такому дослідженні, як MI Profile (аналіз біомаркерів солідних пухлин) лабораторії CARIS.
Інгібітори топоізомераз — це хімічні сполуки, які блокують дію топоізомерази та є ферментами, що контролюють зміни структури ДНК, каталізуючи розрив і приєднання фосфодіестеронової основи ДНК-ниток протягом нормального клітинного циклу. Також цим інгібіторам властивий антибактеріальний ефект. Інгібітори топоізомераз поділяються на дві групи залежно від дії на каталітичну функцію ферментів. Перша група — специфічні інгібітори, або топоізомеразні «отрути», а друга — неспецифічні інгібітори, або супресори. Антрациклінові антибіотики, що широко використовуються при хіміотерапії РМЗ, за механізмом дії є інгібіторами топоізомераз. Представниками антрациклінових антибіотиків є: даунорубіцин, доксорубіцин, епірубіцин, ідарубіцин, мітоксантрон.
Пригнічення активності ТОР ІІα протипухлинними засобами в лікуванні РМЗ
Дослідження D. Almeida et al., у якому метою була оцінка прогностичної цінності гена TOP IIα при прогнозуванні ефективності неоад’ювантного лікування РМЗ, показало, що зміна гена TOP IIα спостерігалась у 22,6 % хворих. Ці пухлини були агресивнішими, частіше HER2/neu-позитивними, також у цих пацієнтів зустрічався запальний тип РМЗ. Результати цього дослідження також показали вищий рівень відповіді на лікування на основі антрациклінів серед пацієнтів зі зміною гена TOP IIα (21,4 % проти 8,3 %) і тенденцію до збільшення загальної виживаності (92,08 міс. проти 73,40 міс.) [9].
У дослідженні А. Nikolenyi et al. 48 % хворих мали позитивну експресію ТОР ІІα. Метою дослідження було оцінити ефективність антрациклінів у ад’ювантному лікуванні. Дослідження показало, що в пухлинах ТОР ІІα-позитивних хворих був вищим рівень Ki67, відсутня залежність між ТОР ІІα і наявністю або відсутністю ER і PR. Загальна виживаність була більшою серед ТОР ІІα-позитивних хворих, ніж серед ТОР ІІα-негативних. Також автори дослідження відмітили, що безрецидивна виживаність і загальна виживаність були кращими в ER/PR-негативних ТОР ІІα-позитивних хворих, і дійшли висновку, що ТОР ІІα є предиктивним маркером ефективності антрациклінвмісних схем ад’ювантної терапії у хворих на РМЗ [10].
Цікавим є дослідження X. An et al., у якому брали участь 434 пацієнти з І–ІІ стадіями люмінального РМЗ, які отримали хірургічне лікування. З них у 127 (29,3 %) була надмірна експресія ТОР ІІα. Дослідження показало зв’язок надмірної експресії ТОР ІІα з вищим рівнем Ki67 і нижчим ступенем диференціювання пухлини. Пацієнти з високим рівнем ТОР ІІα показали більш коротку віддалену виживаність без метастастазів (DMFS). Автори дослідження дійшли висновку, що ТОР ІІα може бути потенційним предиктором появи пізніх рецидивів у цієї групи пацієнтів [11].
S. Norimura et al. у своєму дослідженні аналізували тканини пухлин 68 хворих із РМЗ, які проходили хіміотерапевтичне лікування, на експресію трьох маркерів: TIMP-1, B-tub і ТОР ІІα. Серед цих хворих 8,32 ± 10,10 % були позитивні щодо експресії ТОР ІІα. Серед усієї групи частота відповіді на антрациклінові схеми лікування становила 70,5 %. Дослідники дійшли висновку, що визначення експресії цих маркерів може бути корисним при прогнозуванні відповіді на хіміотерапевтичне лікування [12].
Дослідження T.A. Järvinen et al. мало протилежний результат. У ньому брали участь 55 пацієнток, які отримували однакову хіміотерапію епірубіцином. Результати дослідження показали відсутність зв’язку між експресією ТОР ІІα й ефектом від лікування епірубіцином [13].
119 пацієнток із РМЗ брали участь у дослідженні Т. Petit et al. Усі пацієнтки отримали однакову хіміотерапію (6 курсів за схемою FEC). Відповідь на лікування оцінювалась клінічно й за допомогою комп’ютерної томографії. Результати дослідження не показали зв’язку між високим рівнем експресії HER2/neu або ТОР ІІα і відповіддю на лікування [14].
Висновки
РМЗ — поширена патологія, на дослідження якої направлено багато зусиль. Сучасні можливості дозволяють прицільно досліджувати кожну пухлину, що дає змогу персоніфікувати тактику лікування даної патології. Стандарти лікування на сьогодні ґрунтуються на визначенні фенотипу пухлини на основі аналізу загальноприйнятих маркерів: ER, PR, HER2/neu та Кі67. Однак з огляду на ряд побічних ефектів препаратів для хіміотерапії, особливо кардіотоксичність антрациклінів, підбір пацієнтів для лікування антрацикліновими схемами має бути більш персоніфікованим. Це робить важливим напрямком дослідження із вивчення топоізомераз як потенційних мішеней даної групи препаратів у терапії РМЗ.
Незважаючи на те, що чутливість топоізомераз до антрациклінових антибіотиків відома давно, у світі продовжують відкривати нові препарати, мішенями яких є ці ферменти.
Ряд досліджень виявляють залежність між ефективністю хіміотерапії за антрацикліновими схемами й рівнем експресії ТОР ІІα, на той час як інші дають протилежний результат.
З наукової точки зору ТОР ІІα залишається цікавим ферментом, продовження дослідження якого може принести практичну користь у прогнозуванні відповіді на хіміотерапію й розумінні процесів хіміорезистентності.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін. Рак в Україні 2016–2017 // Бюлетень Національного канцер-–реєстру України. — 2018. — № 19. — С. 7.
2. Ferlay J., Soerjomataram I., Dikshit R. еt al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012 // IJC. — 2015. — Vol. 136(5). — Р. 359-386.
3. Hanahan D., Weinberg R.A. Hallmarks of cancer: The next generation // Cell. — 2011. — Vol. 144. — Р. 646-674.
4. Wang J.C. Interaction between DNA and an Escherichia coli protein ω // J. Mol. Biol. — 1971. — Vol. 55(3). — Р. 523-533.
5. Gellert M., Mizuuchi K., O’Dea M.H., Nash H.A. DNA gyrase: an enzyme that introduces superhelical turns into DNA // Proc. Natl. Acad. Sci. USA. — 1976. — Vol. 73(11). — Р. 3872-3876.
6. Woessner R.D., Mattern M.R., Mirabelli C.K. et al. Proli–feration- and cell cycle-dependent differences in expression of the 170 kilodalton and 180 kilodalton forms of topoisomerase II in NIH-3T3 cells // Cell Growth Differ. — 1991. — Vol. 2. — Р. 209-214.
7. Fry A.M., Chresta C.M., Davies S.M., Walker M.C., Harris A.L., Hartley J.A., Masters J.R., Hickson I.D. Relationship between topoisomerase II level and chemosensitivity in human tumor cell lines // Cancer Res. — 1991. — Vol. 51(24). — Р. 6592-6595.
8. Деженкова Л.Г., Цветков В.Б., Штиль А.А. Ингибиторы топоизомераз I и II: химическая структура, механизмы действия и роль в химиотерапии опухолей // Успехи химии. — 2014. — T. 83, № 1. — С. 82-94.
9. Almeids D., Gerhard R., Leitao D. et al. Topoisomerase II-alfa gene as a predictive marker of response to anthracyclines in breast cancer // Pathol. Res Pract. — 2014. — Vol. 210(10). — Р. 675-679.
10. Nikolenyi A., Uhercsak G., Csenki M. et al. Tumour Topo–isomerase II Alpha Protein Expression and Outcome After Adjuvant Dose-Dense Anthracycline-Based Chemotherapy // Pathol. Oncol. Res. — 2012. — Vol. 18. — Р. 61-68.
11. An X., Xu F., Luo R. et al. The prognostic significance of topoisomerase II alpha protein in early stage luminal breast cancer // BMC Cancer. — 2018. — Vol. 18. — Р. 331.
12. Norimura S., Kontani K., Kubo T. et al. Candidate biomar–kers predictive of anthracycline and taxane efficacy against breast cancer // J. Cancer Res Ther. — 2018. — Vol. 14(2). — Р. 409-415.
13. Järvinen T.A., Holli K., Kuukasjärvi Т. et al. Predictive va–lue of topoisomerase II alpha and other prognostic factors for epirubicin chemotherapy in advanced breast cancer // Br. J. Cancer. — 1998. — Vol. 77(12). — Р. 2267-73.
14. Petit T., Wilt M., Velten M. et al. Comparative value of tumour grade, hormonal receptors, Ki-67, HER-2 and topoisomerase II alpha status as predictive markers in breast cancer patients treated with neoadjuvant anthracycline-based chemotherapy // Eur. J. Cancer. — 2004. — Vol. 40(2). — Р. 205-11.

/12-1.jpg)