Вступ
У світовій науковій літературі з’являється дедалі більше публікацій, присвячених питанню сигнальних лімфатичних вузлів (СЛВ). Більша частина з них носить описовий характер з деякою статистичною обробкою даних щодо досвіду певного центру з ідентифікації чи біопсії СЛВ (БСЛВ). Наявні результати багатоцентрових рандомізованих досліджень. Значно менше публікацій типу метааналізів чи систематичних оглядів, що обумовлює необхідність критичної оцінки наявної інформації.
Концепція СЛВ є перспективним напрямком досліджень, присвячених хірургічному лікуванню солідних пухлин. Вона дозволяє на підставі патогістологічного дослідження (іноді з використанням імуногістохімічного дослідження) дати об’єктивну оцінку N-критерію поширеності пухлинного процесу та, відповідно, індивідуалізувати показання до лімфодисекцій (ЛД) та/або призначення інших видів протипухлинної терапії. Це, в свою чергу, дозволяє зменшити пов’язані з ЛД ускладнення у групи пацієнтів, яким об’єм хірургічного втручання на лімфоколекторі може бути зменшений, або, навпаки, на підставі даних про вторинне ураження СЛВ розширити об’єм хірургічного втручання та/або ЛД з обґрунтованим призначенням інших методів протипухлинного лікування у післяопераційному періоді.
Метою даного дослідження був огляд рекомендацій European Society of Medical Oncology (ESMO), National Comprehensive Cancer Network (NCCN) та публікацій у Cochrane Library, що були присвячені питанню онкологічної ефективності БСЛВ та ЛД у лікуванні первинних солідних пухлин різних локалізацій.
Матеріали та методи
Розглянуто чинні рекомендації щодо лікування хворих з первинними солідними пухлинами різних локалізацій, в яких у аспекті хірургічного лікування розглядається концепція СЛВ та її місце поруч з традиційним підходом до ЛД, що обґрунтовується з точки зору доказової медицини виходячи з онкологічних результатів її впровадження. Всі матеріали опубліковані англійською мовою та наявні у вільному доступі на офіційних веб-ресурсах ESMO (https://www.esmo.org/Guidelines), NCCN (https://www.nccn.org/professionals/physician_gls/default.aspx) та Кохранівської бібліотеки (https://www.cochranelibrary.com). Виконано огляд всіх чинних рекомендацій згідно з вищенаведеними критеріями та виокремлено ті, що мають відношення до поточного огляду літератури. У пошуковій системі сайту Кохранівської бібліотеки застосовано пошуковий запит sentinel lymph node, в дослідження включені публікації з розділу Cochrane Reviews. Результати аналізу згруповані за локалізаціями онкологічного процесу.
Результати
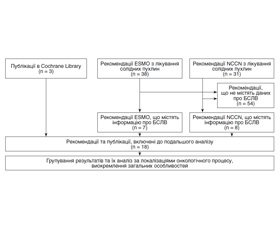
За пошуковим запитом на сайті Кохранівської бібліотеки знайдено 3 огляди літератури. Первинний пошук рекомендацій ESMO та NCCN виявив 38 та 31 публікацію відповідно. З них для подальшого аналізу виокремлено 7 та 8 рекомендацій відповідно. Блок-схема пошуку та його результати коротко наведені на рис. 1 і в табл. 1.
Рак молочної залози. Питанню БСЛВ при раку молочної залози присвячена значна кількість публікацій, у тому числі і результатів рандомізованих клінічних досліджень. Доказова база з даної проблематики станом на 2017 р. представлена Кохранівським оглядом літератури. Методика має місце у лікуванні згідно з рекомендаціями ESMO та NCCN.
Згідно з результатами Кохранівського огляду, при порівнянні групи хворих, яким було виконано біопсію СЛВ, з групою традиційної ЛД виявлено відсутність значимих відмінностей у загальній виживаності (відношення ризиків (HR) = 1,05; 95% довірчий інтервал (ДІ) 0,89–1,25), частоті локальних рецидивів (HR = 0,94; 95% ДІ 0,24–3,77), локорегіонарних рецидивів (HR = 0,96; 95% ДІ 0,74–1,24) та віддаленого метастазування (HR = 0,80; 95% ДІ 0,42–1,53). Лімфедема спостерігалась рідше після біопсії СЛВ порівняно з ЛД (відношення шансів 0,04–0,60). У підсумку порівняння різних підходів до лікувальної тактики на аксилярних ЛВ автори зазначають, що біопсія СЛВ і семплінг аксилярних ЛВ є альтернативою для стадіювання. ЛД клінічно і радіологічно неуражених аксилярних ЛВ є неприйнятною практикою при раку молочної залози [1].
Рекомендації ESMO є більш ранніми (опубліковані в 2015 році). В них зазначається, що використання радіофармпрепарату у комбінації з барвником або індоціаніну зеленого дозволяє ідентифікувати СЛВ у 97 % хворих з низькими показниками хибнонегативних результатів і прийнятним рівнем аксилярних рецидивів після біопсії СЛВ. Процедура дозволяє зменшити частоту післяопераційних ускладнень та скоротити терміни госпіталізації [2].
Наявність мікрометастазів чи ізольованих пухлинних клітин в СЛВ при раку молочної залози не впливає на тактику хірургічного лікування, рутинне застосування імуногістохімічного дослідження СЛВ не доцільне, що підтверджується дослідженнями IBCSG 23-01 та ACOSOG Z0010. Якщо регіонарні ЛВ клінічно інтактні, але, за даними біопсії СЛВ, в них виявляються метастази, то, за результатами дослідження AMAROS, подальше лікування аксилярної ділянки з використанням променевої терапії є ефективним незалежно від наявності факторів ризику. Наведені результати досліджень потребують підтвердження та не поширюються на пацієнток, чиї характеристики відрізняються від популяції згаданих досліджень [2].
При місцево-поширеному раку молочної залози також можливо використовувати біопсію СЛВ, якщо на момент діагностики ураження регіонарних ЛВ описувалось як cN0-cN1 з ефектом повної відповіді після проведеної системної протипухлинної терапії (ycN0). Застосування біопсії СЛВ у таких хворих потребує застосування подвійного контрастування, маркування на початку лікування уражених ЛВ та мінімальної кількості видалених СЛВ, що дорівнює 3 шт. [3].
Рекомендації NCCN зазначають, що для стадіювання аксилярних ЛВ перевага має надаватись саме біопсії СЛВ (при клінічно неуражених ЛВ І–ІІІа стадії). У випадку підозри на вторинне ураження ЛВ їх стан необхідно оцінити перед оперативним втручанням за допомогою тонкоголкової аспіраційної біопсії чи трепан-біопсії для визначення категорії хворих, які потребуватимуть аксилярної ЛД. Після біопсії СЛВ відмічається зниження частоти ускладнень з боку верхньої кінцівки (біль, лімфедема, порушення чутливості) порівняно з аксилярною ЛД. Відсутні вірогідні відмінності в інформативності визначення стану ЛВ між групами біопсії СЛВ та ЛД І і ІІ рівнів [4].
Патоморфологічна оцінка стану СЛВ може бути виконана як за допомогою гематоксиліну та еозину, так і з використанням імуногістохімічного дослідження. Останнє наразі не рекомендоване для рутинного використання, оскільки його адитивний ефект для загальної виживаності не був показаний згідно з дослідженням ACOSOG Z0010. Імуногістохімічне дослідження може бути інформативним і доцільним при сумнівних результатах гематоксилін-еозинового гістологічного дослідження [4].
Біопсія СЛВ без аксилярної ЛД як самостійний метод, згідно з результатами дослідження ACOSOG Z0011, може бути застосована при РМЗ з критерієм первинної пухлини T1–2, кількості вторинно уражених СЛВ 1–2, відсутності передопераційної системної терапії, хірургічному втручанні в об’ємі лампектомії та запланованій променевій терапії на всю молочну за–лозу [4].
Аксилярна ЛД І–ІІ рівня рекомендована для пацієнток з клінічно ураженими ЛВ, що підтверджено результатами тонкоголкової аспіраційної біопсії або трепан-біопсії, та при неможливості визначити СЛВ. Для пацієнток з клінічно інтактними ЛВ, яким було виконано мастектомію та планується променева терапія, опромінення аксилярних ЛВ може замінити аксилярну ЛД І–ІІ рівня у відношенні локального контролю. Традиційна аксилярна ЛД І–ІІ рівня потребує видалення щонайменше 10 ЛВ для адекватного стадіювання. Аксилярна ЛД має бути розширена до ІІІ рівня при підозрі на ураження ЛВ ІІ–ІІІ порядку. Пацієнтки, яким не виконувалось ні аксилярної ЛД, ні опромінення аксилярних ЛВ, знаходяться у групі підвищеного ризику щодо виникнення іпсілатерального рецидиву в ЛВ [4].
Рак шийки матки. Рекомендації ESMO припускають, що біопсія СЛВ може відігравати важливу роль у лікуванні раку шийки матки, проте доказова база є недостатньою [5].
Згідно з рекомендаціями NCCN, біопсія СЛВ може бути корисною для зменшення показань до тазової ЛД у пацієнток з ранніми стадіями (І–ІІа) раку шийки матки. Результати проспективних досліджень підтверджують, що завдяки високій інформативності БСЛВ можливо безпечно уникати тазової ЛД у значної частки хворих. За даними метааналізу, рівень ідентифікації СЛВ становить 89–92 %, чутливість — 89–90 %. Поздовжнє дослідження SENTICOL показало можливість визначення нетипових шляхів лімфовідтоку завдяки впровадженню методики СЛВ [6].
Рекомендовано застосовувати MSKCC алгоритм для біопсії СЛВ у хворих на рак шийки матки, який полягає не тільки у видаленні контрастованих ЛВ, а й інших підозрілих на вторинне ураження ЛВ (незалежно від наявності їх контрастування) та виконанні іпсілатеральної тазової ЛД за відсутності СЛВ. Найбільша інформативність СЛВ досягається у пацієнток з пухлинами менше 2 см та з використанням малоінвазивного хірургічного доступу. Рекомендовано використовувати комбінацію радіофармпрепаратів з синіми барвниками, показана висока інформативність ідентифікації СЛВ з використанням флуоресцентів [6].
Рак тіла матки. Стандарти хірургічного лікування ESMO, опубліковані в 2013 р., передбачають виконання тазово-поперекової ЛД при раку тіла матки стадії Іа G3, Ib G1-3, II стадії. Біопсія СЛВ розглядається як перспективний напрямок, що потребує подальших досліджень [7].
Згідно з ESMO-ESGO-ESTRO консенсусом, біопсія СЛВ залишається експериментальним втручанням, проте значна кількість даних свідчить про її доцільність, бо вона призводить до збільшення частки пацієнтів із діагностованими мікрометастазами та ізольованими пухлинними клітинам в ЛВ, проте важливість цих знахідок залишається невідомою [8].
Згідно з рекомендаціями NCCN, біопсія СЛВ може використовуватись у хворих на рак тіла матки (в тому числі при гістологічних типах групи високого ризику), її роль наразі аналізується. Проспективні та ретроспективні дослідження показали, що порівняно з системною ЛД біопсія СЛВ дозволяє збільшити частоту виявлення метастатичного ураження ЛВ з низьким показником хибнонегативних результатів (< 5 %). Результати багатоцентрового проспективного дослідження FIRES свідчать про чутливість методики 97,2 % та прогностичну значущість негативної відповіді 99,6 %. Відповідні рандомізовані контрольовані дослідження відсутні [9].
Методику СЛВ можна застосовувати за відсутності даних за вторинне ураження ЛВ (за результатами інструментальних методів дослідження) та відсутності ознак поширення пухлинного процесу за межі матки (за даними ревізії). Біопсія СЛВ не застосовується у хворих на саркому матки. Аналогічно хворим на рак шийки матки застосовується MSKCC алгоритм. Розширені рекомендації, основані на останніх даних світової літератури щодо біопсії СЛВ при раку тіла матки, опубліковані спілкою онкогінекологів (Society of Gynecologic Oncology — SGO) [9].
Рак вульви. За результатами Кохранівського огляду (2014 р.), біопсія СЛВ характеризується чутливістю 91–95 % (залежно від техніки контрастування), прогностична цінність негативної відповіді становить понад 95 %. Використання біопсії СЛВ з радіофармпрепарат-вмісним контрастуванням дозволяє зменшити частоту пахово-стегнової ЛД на 70 % при ранньому раку вульви. Показники виживаності з використанням біопсії СЛВ порівняно з традиційним підходом до ЛД при раку вульви залишаються невідомими [10].
Згідно з рекомендаціями NCCN, хірургічне лікування раку вульви включає виконання пахово-стегнової ЛД або біопсії СЛВ (при відсутності попередніх хірургічних втручань на вульві). Для пухлин менше 4 см, розташованих на 2 см латеральніше серединної лінії, при клінічно інтактних ЛВ виконується одностороння біопсія СЛВ, при центральних локалізаціях — двостороння. Біопсія СЛВ має виконуватись до вульвектомії. За відсутності контрастованих СЛВ виконується іпсілатеральна пахово-стегнова ЛД [11].
Безпечність біопсії СЛВ показана за результатами багатоцентрового обсерваційного дослідження, частота рецидивів при медіані спостереження 35 міс. становила 2,3 %, рівень 3-річної виживаності — 97 %. Відмічено зниження частоти ранніх та пізніх ускладнень після біопсії СЛВ порівняно з пахово-стегновою ЛД [11].
Обсерваційне дослідження GROINSS-V було проведено на вищезазначеній когорті з залученням пацієнтів з вторинно ураженими ЛВ (33 %). Визначався ризик метастатичного ураження несигнальних ЛВ, який коливався від 4,2 % для ізольованих пухлинних клітин до 62,5 % для метастазів в СЛВ розмірами понад 10 мм. Результати дослідження GOG 173 свідчать про чутливість біопсії СЛВ 91,7 %, прогностичну значущість негативної відповіді 96,3 %, частоту хибнонегативних відповідей 3,7 % (для пухлин до 4 см — 2 %). За даними системних оглядів та метааналізу, частота ідентифікації СЛВ становить 87 % (з використанням РФП і барвника), хибнонегативних відповідей — 6,4 %. Частота рецидивів при біопсії СЛВ, поверхневій та повній пахово-стегновій ЛД становить 3,4, 6,6 та 1,4 % відповідно. Наразі триває дослідження GROINSS-VІІ/GOG 270, яке має відповісти, що є ефективнішим за наявності вторинного ураження СЛВ, — ЛД чи променева терапія [11].
Рак статевого члена. Рекомендації ESMO та NCCN є фактично ідентичними у питанні біопсії СЛВ у лікуванні раку статевого члена. Ключовим моментом для досягнення високої інформативності біопсії СЛВ є дотримання протоколу так званої динамічної біопсії СЛВ. Вона включає в себе ідентифікацію СЛВ з використанням радіофармпрепаратів і барвників, клінічне обстеження з виконанням, за потреби, на доопераційному етапі тонкоголкової аспіраційної біопсії ЛВ під контролем ультрасонографії, імуногістохімічне дослідження серійних зрізів СЛВ [12, 13].
Динамічна біопсія СЛВ показана за відсутності пахово-стегнової лімфаденопатії у пацієнтів групи високого ризику за наявності лімфоваскулярної інвазії, ≥ pT1G3 або ≥ T2 (будь-який ступінь диференціації). За наявності метастатичного ураження СЛВ рекомендована пахово-стегнова ЛД. Тазова ЛД показана за наявності двох або більше вторинно уражених іпсілатеральних пахово-стегнових ЛВ або при екстранодальному метастатичному поширенні. Двостороння тазова ЛД показана за наявності чотирьох і більше (сумарно з обох сторін) вторинно уражених ЛВ. Для раку статевого члена не характерні skip-метастази, тазові ЛВ завжди уражаються після пахово-стегнових [12, 13].
Виконання протоколу динамічної біопсії СЛВ дозволяє досягти рівня хибнонегативних результатів 5 %. Обсерваційне дослідження (1956–2012 рр.) показало, що динамічна біопсія СЛВ дозволяє покращити 5-річну виживаність у пацієнтів з клінічно інтактними ЛВ з 82 до 91 % (р = 0,021) [12, 13].
Пахово-стегнова лімфаденопатія у хворих на рак статевого члена у 30–50 % має реактивний характер. Для диференційної діагностики лімфаденопатії можливе призначення протягом 6 тижнів антибіотикотерапії та виконання черезшкірної тонкоголкової аспіраційної біопсії під контролем ультразвукового дослідження. Динамічна біопсія СЛВ не рекомендована при наявності пахово-стегнової лімфаденопатії [12, 13].
Пухлини голови та шиї. У рекомендаціях NCCN зазначається, що біопсія СЛВ може використовуватись як предиктор лімфогенного метастазування при плоскоклітинному раку ротової порожнини. Біопсія СЛВ є альтернативою ЛД при Т1–2 раку ротової порожнини. Її застосування можливе також при раку губи. Відмічається зменшення частоти ускладнень та кращий косметичний ефект. Частота ідентифікації СЛВ становить близько 95 %, чутливість — 93 %, прогностична цінність негативної відповіді — 88–100 %. Відмічено аналогічні показники виживаності після біопсії СЛВ порівняно з ЛД. При метастатичному ураженні СЛВ показано виконання селективної (І–ІІІ рівня) або радикальної (І–V рівня) шийної ЛД [14].
Плоскоклітинний рак шкіри. Біопсія СЛВ при не–аногенітальному плоскоклітинному раку шкіри за рекомендаціями NCCN використовується для визначення контингенту хворих, які потребують ЛД чи променевої терапії. Проспективні обсерваційні та ретроспективні дослідження, метааналізи сповіщають про знаходження субклінічних метастазів у ЛВ у 7–21 % хворих (12–17 % — за даними більшості досліджень) [15].
При відсутності вторинного ураження ЛВ, за результатами біопсії СЛВ, метастази в ЛВ були пізніше діагностовані у 2–7 % хворих. На додачу до цих хибнонегативних випадків є пацієнти з локальними рецидивами чи метастатичним ураженням ділянок, які не досліджувались при біопсії СЛВ. Таким чином, загальний показник частоти рецидивів/метастазів після біопсії СЛВ становить 7–12 % [15].
Біопсія СЛВ може мати прогностичний вплив, проте невідомо, чи є позитивний онкологічний ефект біопсії СЛВ при вторинно уражених ЛВ з виконанням подальшої ЛД чи променевої терапії. Залишаються також невідомими критерії для відбору на біопсію СЛВ пацієнтів із плоскоклітинним раком шкіри [15].
Меланома шкіри. Аналогічно раку молочної залози меланома є іншим напрямком активних досліджень та впровадження концепції СЛВ у клінічну практику. В огляді літератури Кохранівської спільноти та ESMO представлені дані станом на 2015 р., більш актуалізована інформація наведена в рекомендаціях NCCN.
Відповідно до результатів Кохранівського огляду, біопсія СЛВ при меланомі не має переваг у загальній виживаності порівняно з традиційним визначенням контингенту хворих для ЛД чи спостереження. Відмічено кращу безрецидивну 10-річну виживаність після біопсії СЛВ (HR = 0,75; 95% ДI 0,63–0,89). Рецидивування меланоми після біопсії СЛВ рідше було локорегіонарним (RR = 0,56; 95% ДI 0,45–0,69), у той час як значно частіше були діагностовані віддалені метастази (HR = 1,33; 95% ДI 1,03–1,72). Наявна доказова база визнана недостатньою для того, щоб рекомендувати біопсію СЛВ як альтернативу спостереженню [16].
Згідно з рекомендаціями ESMO, біопсія СЛВ рекомендована для більш точного стадіювання хворих з меланомою товщиною понад 1 мм або понад 0,75 мм за наявності негативних факторів (виразкування, високий мітотичний індекс) [17].
У рекомендаціях NCCN зазначається, що біопсія СЛВ дозволяє точно стадіювати меланому шкіри завдяки патогістологічній оцінці регіонарних ЛВ, що має прогностичне значення при І/ІІ клінічній стадії захворювання. Після біопсії СЛВ від 5 до 40 % хворих на меланому шкіри з клінічною стадією І–ІІ переходять до ІІІ стадії [18].
Біопсія СЛВ не рекомендована при меланомі тонше 0,8 мм за Бреслоу без виразкування (виключення — позитивний глибокий край резекції), бо у цих випадках частота вторинного ураження ЛВ становить менше 5 % [18].
Для хворих з меланомою Т1b (тонше 0,8 мм за Бреслоу з виразкуванням чи 0,8–1,0 мм з/без виразкування) або Т1а (тонше 0,8 мм за Бреслоу з іншими негативними факторами, такими як високий мітотичний індекс, особливо у молодих осіб, лімфоваскулярна інвазія, або комбінація цих факторів) вірогідність ураження СЛВ становить 5–10 %, тому рекомендовано виконання біопсії СЛВ у даного контингенту хворих [18].
Для пацієнтів зі стадією Іb (Т2а) або ІІ (товщина пухлини понад 1 мм) вірогідність ураження СЛВ становить понад 10 %, виконання біопсії СЛВ рекомендовано [18].
У випадку, коли інформація, отримана при біопсії СЛВ, не впливатиме на подальшу тактику лікування, слід відмовитись від її виконання, незважаючи на групу ризику. Точність біопсії СЛВ може бути нижчою після попередньої широкої ексцизії, заміщення ротаційними клаптями чи шкірними трансплантатами, але це не виключає її застосування згідно з показаннями. Біопсія СЛВ виконується до широкого висічення пухлини. Виключення — пухлина знаходиться близько до ложа лімфодренування, що може спотворювати картину радіологічної діагностики, тому у таких випадках можливе видалення першим етапом первинної пухлини. При меланомі шкіри нижньої кінцівки можливе контрастування СЛВ здухвинної ділянки, які знаходяться проксимальніше і є ЛВ другого порядку після поверхневих стегнових. Їх біопсію можна не проводити. Проте, якщо вони відносяться до інших шляхів лімфовідтоку чи є сумніви щодо вторинного ураження, їх потрібно видаляти. Інтервальні (in-transit) чи ектопічні СЛВ визначаються проксимальніше типових ЛВ і також видаляються. Біопсія СЛВ може виконуватись у випадку in-transit-метастазів і локальних рецидивів меланоми [18].
СЛВ не відправляються на дослідження замороженими зрізами, вони фіксуються формальдегідом і досліджуються у парафінових блоках. На дослідження направляється цілий СЛВ. Серійні зрізи виконуються через 2 мм. СЛВ досліджуються стандартно з гематоксиліном і еозином, а також з використанням імуногістохімічних маркерів (HMB45, S100, MELAN-A, SOX-10) [18].
За наявності вторинного ураження СЛВ показано виконання ЛД відповідної ділянки. Пахово-стегнова ЛД має доповнюватись видаленням здухвинних і затульних ЛВ у випадку клінічно позитивних пахово-стегнових ЛВ або наявності 3 і більше вторинно уражених ЛВ тієї ж ділянки. Тазова і пахова ЛД показані за наявності результатів комп’ютерної томографії на користь ураження тазових ЛВ чи за наявності метастатичного ураження ЛВ Розенмюллера — Клоке [18].
Проспективне рандомізоване багатоцентрове дослідження ІІІ фази MSLT I підтвердило важливу роль біопсії СЛВ як тесту для більш точного стадіювання хворих. Біопсія СЛВ порівняно зі спостереженням не впливає на загальну виживаність, проте покращує безрецидивну на 7 і 10 % для меланоми товщиною 1,2–3,5 мм та понад 3,5 мм відповідно. Покращення безрецидивної виживаності спостерігалось більшою мірою за рахунок вузлових рецидивів у групі спостереження. Частота хибнонегативних результатів становила < 20 %. Статус СЛВ є найбільш важливим прогностичним фактором щодо виживаності. За наявності ураженого СЛВ вірогідність ураження несигнальних ЛВ становить 21 % [18].
Проспективне рандомізоване дослідження ІІІ фази DeCOG-SLT було присвячене порівнянню пацієнтів з меланомою, у яких, за результатами біопсії СЛВ, було виявлено вторинне ураження ЛВ. Показано, що подальша ЛД не покращувала показники безрецидивної та загальної виживаності порівняно з активним спостереженням. Дослідження MSLT IІ є значно більшим міжнародним проспективним рандомізованим дослідженням, що закінчило набір пацієнтів і має дати відповідь, чи впливає ЛД на виживаність хворих з метастатично ураженими СЛВ [18].
Висновки
Аналізуючи публікації у Cochrane Library, рекомендації ESMO та NCCN, що були присвячені питанню онкологічної ефективності біопсії СЛВ порівняно з традиційними підходами до ЛД у лікуванні первинних солідних пухлин різних локалізацій, ми звернули увагу на такі особливості. Незважаючи на велику кількість публікацій, присвячених даному питанню (наприклад, понад 14 000 у базі PubMed) та їх значне розмаїття (фактично всі солідні пухлини), доказова база залишається слабкою. Це пояснюється більшою мірою тим, що завдяки науково-технічному прогресу з’являються нові методики для ідентифікації СЛВ. Дослідницькі групи активно займаються їх дослідженням, розробкою відповідних методик лімфографії та біопсії СЛВ, порівнянням з іншими існуючими методиками.
Питання об’ємів і показань до ЛД при солідних пухлинах є одним із найбільш дискутабельних у сучасній онкохірургії. Традиційні підходи до ЛД змінюються, що пов’язано не лише з розвитком системної та локальної протипухлинної терапії, а й з внеском концепції СЛВ, яка в ряді випадків змушує переглядати питання лімфогенного метастазування. Ідентифікація та біопсія СЛВ дозволяє індивідуалізувати підходи до ЛД, виходячи з особливостей лімфодренування у конкретного пацієнта.
Для ідентифікації СЛВ у шийній, аксилярній чи пахово-стегновій ділянці найбільшу інформативність мають комбіновані методи з використанням барвника та радіофармпрепарату. Останній дозволяє транскутанно локалізувати СЛВ, завдяки чому для подальшої його біопсії немає потреби у великих розрізах і значній хірургічній травмі з метою ревізії відповідного лімфоколектора. Що стосується абдомінальних і тазових ЛВ, то тут більш інформативним є застосування флуоресцентної лімфографії (особливо в умовах малоінвазивних втручань).
Неоднозначним залишаються підходи до патогістологічного дослідження. Наприклад, якщо для меланоми шкіри не рекомендовані заморожені зрізи, то при раку шийки матки, навпаки, за їх результатами інтраопераційно може вирішуватись питання щодо доцільності подальшого хірургічного лікування загалом. Імуногістохімічне дослідження СЛВ є обов’язковим при раку статевого члена та меланомі, у той час як при раку молочної залози, навпаки, є недоцільним, оскільки навіть наявність мікрометастазів не впливає на подальшу тактику хірургічного лікування.
Залишається достеменно невідомою доцільність тазової ЛД як адитивного компоненту при пахово-стегнових ЛД у хворих на плоскоклітинний рак шкіри, меланому шкіри та рак статевого члена. В той час як у хворих на рак вульви, навпаки, питання профілактичного та терапевтичного впливу на тазові ЛВ є прерогативою нехірургічних методів протипухлинного лікування і наразі аналогічні підходи розглядаються як альтернатива пахово-стегновій ЛД.
Спільною точкою зору щодо онкологічних хворих залишається необхідність біопсії (тонкоголкової аспіраційної, трепан-біопсії чи ексцизійної) за підозри на метастатичне ураження ЛВ чи при лімфаденопатії. Її наявність може свідчити про реактивні зміни, метастатичне ураження, наявність синхронного первинно-множинного неопластичного процесу чи рецидиву раніше діагностованого злоякісного новоутворення. Відсутність контрастованих СЛВ є показанням до застосування традиційних підходів до ЛД при відповідній онкологічній патології.
Розбіжності у висновках і рекомендаціях, що були наведені в поточнму огляді, пояснюються використанням як вихідних даних результатів різних досліджень. Рекомендації NCCN завдяки постійному динамічному оновленню містять найбільш актуалізовану інформацію. Враховуючи активний розвиток концепції СЛВ, накопичені за декілька років результати досліджень дозволяють обґрунтовано змінювати погляди на її місце у лікуванні онкологічних нозологій. Рекомендації ESMO та огляди Кохранівської спільноти, присвячені СЛВ, мають вже переважно історичне значення, і у більшості випадків їх застосування потребує критичного підходу з урахуванням результатів досліджень і метааналізів, що були опубліковані пізніше.
Упровадження у клінічну практику концепції СЛВ не може бути виконано одномоментно. Критично важливим є наявність досвідченої групи фахівців, які залучаються до лікувально-діагностичного процесу в аспекті СЛВ, що зазначається майже в усіх рекомендаціях ESMO та NCCN. Це стосується не лише хірургів, а й патогістологів і радіологів. Крива навчання хірурга методиці ідентифікації та біопсії СЛВ є варіабельною величиною, емпіричним показником, за даними різних авторів, є близько 30–50 випадків. Більш об’єктивною величиною, що дозволяє безпечно використовувати біопсію СЛВ як самостійну складову діагностично-лікувального процесу, є онкологічно прийнятний рівень хибнонегативних результатів, що становить менше 5 %. Не менш важливим аспектом є урахування можливостей ад’ювантного лікування, що мають відповідати плану лікування. Використання лише посилання на рекомендації профільної спільноти щодо методики біопсії СЛВ, але застосування відмінних підходів до ад’ювантного лікування є неприйнятним, оскільки лікування онкологічних хворих має розглядатись як єдиний комплексний процес.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Bromham N., Schmidt-Hansen M., Astin M., Hasler E., Reed M.W. Axillary treatment for operable primary breast cancer // Cochrane Database Syst. Rev. — 2017 Jan 4. — 1. — CD004561. — doi: 10.1002/14651858.
2. Senkus E., Kyriakides S., Ohno S. et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. — 2015 Sep. — 26(Suppl. 5). — Р. 8-30. — doi: 10.1093/annonc/mdv298.
3. Cardoso F., Senkus E., Costa A. et al. 4th ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 4) // Ann. Oncol. — 2018 Aug 1. — 29(8). — Р. 1634-1657. — doi: 10.1093/annonc/mdy192.
4. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Breast Cancer, version 1, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: March 20, 2018.
5. Marth C., Landoni F., Mahner S. et al. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. — 2017 Jul 1. — 28(Suppl. 4). — Р. 72-83. — doi: 10.1093/annonc/mdx220.
6. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Cervical Cancer, version 1, 2019. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: August 9, 2018.
7. Colombo N., Preti E., Landoni F. et al. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. — 2013 Oct. — 24(Suppl. 6). — Р. 33-8.
8. Colombo N., Creutzberg C., Amant F. et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: diagnosis, treatment and follow-up // Ann. Oncol. — 2016 Jan. — 27(1). — Р. 16-41. — doi: 10.1093/annonc/mdt353.
9. National Comprehensive Cancer Network (NCCN) NCCN Clinical Practice Guidelines in Oncology: Uterine Neoplasms, version 2, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: May 25, 2018.
10. Lawrie T.A., Patel A., Martin-Hirsch P.P. et al. Sentinel node assessment for diagnosis of groin lymph node involvement in vulval cancer // Cochrane Database Syst. Rev. — 2014 Jun. — 27(6). — CD010409. — doi: 10.1002/14651858.
11. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Vulvar Cancer (Squamous Cell Carcinoma), version 2, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: October 27, 2017.
12. Van Poppel H., Watkin N.A., Osanto S. et al. Penile cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. — 2013 Oct. — 24(Suppl. 6). — Р. 115-24. — doi: 10.1093/annonc/mdt286.
13. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Penile Cancer, version 2, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: March 26, 2018.
14. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers, version 2, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: June20, 2018.
15. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Squamous Cell Skin Cancer, version 2, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: October 5. 2017.
16. Kyrgidis A., Tzellos T., Mocellin S. et al. Sentinel lymph node biopsy followed by lymph node dissection for localised primary cutaneous melanoma // Cochrane Database Syst. Rev. — 2015 May. — 16(5). — CD010307. — doi: 10.1002/14651858.
17. Dummer R., Hauschild A., Lindenblatt N. et al. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. — 2015 Sep. — 26(Suppl. 5). — Р. 126-32. — doi: 10.1093/annonc/mdv297.
18. National Comprehensive Cancer Network (NCCN) NCCN Clinical Practice Guidelines in Oncology: Melanoma, version 3, 2018. — Available from: https://www.nccn.org/professionals/physician_gls/default.aspx#site Accessed: July 1, 2018.

/16-1.jpg)
/16-2.jpg)