Вступ
Пухлини головного мозку становлять 85–90 % всіх випадків пухлин центральної нервової системи (ЦНС) [1]. Метастази в головний мозок (МГМ) зустрічаються в 10 разів частіше, ніж первинні пухлини ЦНС, і діагностуються у 10–20 % онкологічних хворих. Частота виявлення МГМ неухильно зростає, що можна пояснити рядом факторів. По-перше, це може бути пов’язано зі збільшенням доступності та удосконалення методів діагностики пухлин головного мозку (ГМ). По-друге, з упровадженням скринінгових обстежень ГМ у пацієнтів із пухлинами, які мають високу частоту метастазування в ЦНС. По-третє, удосконалення методів лікування злоякісних пухлин, що призводить до збільшення загальної виживаності хворих і, як наслідок, до збільшення ризику розвитку МГМ [2]. Злоякісні пухлини всіх локалізацій із різною частотою здатні метастазувати в ГМ. 75 % всіх випадків метастатичного ураження ГМ становлять хворі на рак легень (40–50 %), молочної залози (15–25 %) та меланому (5–20 %) [1]. Серед решти 25 % найбільш часто МГМ зустрічаються при нирково-клітинному (4–17 %) та гастроінтестинальному раку (0,6–3 %) [3, 4]. При аутопсії МГМ виявляються в 1,5–3 рази частіше, що становить понад 65 % при раку легень, 30–40 % у хворих із меланомою та у 30 % — з раком молочної залози. Близько 85 % метастатичних уражень локалізується в півкулях ГМ, 15 % — у мозочку і 5 % — у стовбурі ГМ [5]. З огляду на велику поширеність і відсутність загальноприйнятих клінічних рекомендацій з лікування хворих із МГМ у даній роботі наведено огляд існуючих прогностичних факторів, що визначають тактику лікування, представлено дані про роль гематоенцефалічного бар’єра (ГЕБ) у патогенезі та ефективності терапії МГМ, розглянуто можливі механізми розвитку резистентності до системної протипухлинної терапії (СППТ), шляхи їх подолання, а також відображені результати досліджень щодо вивчення ефективності застосування СППТ у хворих із МГМ солідних пухлин.
Визначення прогнозу у хворих із МГМ
Наявність МГМ значно погіршує прогноз перебігу онкологічного захворювання, а медіана виживаності хворих коливається у межах 2,79–25,3 міс. та залежить від ряду факторів, на які необхідно зважати при визначенні тактики лікування пацієнтів із МГМ. У табл. 1 представлені шкали оцінки прогнозу перебігу захворювання у хворих із церебральними метастазами [6].
/29-1.jpg)
Наведені в табл. 1 шкали оцінки прогнозу виживаності хворих із МГМ мають ряд недоліків, які обмежують їх використання в рутинній клінічній практиці та клінічних дослідженнях. Так, шкала RPA (Recursive Partitioning Analysis) може бути використана винятково у випадку, якщо пацієнту показано проведення тільки опромінення всього головного мозку (ОВГМ). Ця шкала не може бути використана у хворих, яким проводили паліативне хірургічне втручання, стереотаксичну радіохірургію (СРХ) та/або СППТ, які значущо впливають на виживаність пацієнтів. Ще одним недоліком шкали RPA є те, що вона не враховує кількість і розмір метастатичних вогнищ у ГМ, що поряд з іншими факторами визначає тактику лікування хворих. Недоліками системи Rotterdam Score є те, що вона не враховує вік пацієнта, кількість і розмір метастатичних вогнищ у ГМ. Найбільш повною прогностичною системою є шкала SIR (Score Index for Radiosurgery), але вона не знайшла широкого застосування в клінічній практиці, тому що не враховує системний вплив на захворювання. Шкала BSBM (Basic Score for Brain Metastases) є аналогом RPA і враховує вплив СРХ на виживання хворих із МГМ, але не враховує вік пацієнтів і ефективність медикаментозної терапії. У 2007 р. була запропонована система GPA (Graded Prognostic Assessment), яка враховує 4 фактори: вік, загальний стан пацієнта (індекс Карновського (ІК)), наявність екстракраніальних метастазів і кількість вогнищ у ГМ. У ряді досліджень було доведено прогностичну значущість цих показників, а шкала GPA визнана найбільш об’єктивною і найбільш часто використовуваною системою оцінки прогнозу виживаності пацієнтів із МГМ. Однак система GPA не враховує вплив на прогноз перебігу МГМ типу первинної пухлини, що мають різну чутливість до медикаментозної та променевої терапії. З метою врахування впливу гістологічного і молекулярного типу первинної пухлини була розроблена система DS-GPA (Disease Specific Graded Prognostic Assessment). У табл. 2 подані фактори прогнозу і показники виживаності хворих із МГМ при раку легень, меланомі, раку молочної залози, нирково-клітинному та гастроінтестинальному раку [7–9].
/30-1.jpg)
Прогностичні бали відіграють важливу роль у визначенні тактики лікування хворих із МГМ. Пацієнтам з поганим прогнозом доцільність призначення паліативної терапії є дискутабельною, а у хворих із добрим прогнозом мультимодальна паліативна терапія може збільшити показники виживаності [10]. Також системи прогнозу перебігу захворювання можуть бути використані з метою збільшення об’єктивності та обґрунтованості результатів клінічних випробувань з вивчення ефективності лікування хворих із МГМ зло–якісних пухлин різних локалізацій.
Роль гематоенцефалічного бар’єра в розвитку МГМ
Гематоенцефалічний бар’єр є фізіологічною перешкодою, що відіграє ключову роль у колонізації ГМ клітинами злоякісних пухлин і визначає ефективність медикаментозної терапії. ГЕБ є фізіологічною перешкодою для проникнення клітин злоякісних пухлин у паренхіму мозку. Ендотеліальні клітини служать механічним бар’єром, а астроцити та мікроглія здатні знищувати пухлинні клітини. Однак після подолання ГЕБ метастатичні клітини захищені від імунної системи організму і впливу більшості лікарських засобів, а церебральні ендотеліальні клітини, астроцити і мікроглія секретують речовини, необхідні для росту і проліферації пухлинних клітин [11].
Проникність ГЕБ залежить від його функціонального стану, а також від морфологічних і молекулярно-генетичних особливостей пухлинних клітин, що пояснює здатність клітин деяких злоякісних пухлин відносно легко долати цей високоселективний бар’єр. Зменшення щільності з’єднання церебральних ендотеліальних клітин призводить до підвищення проникності ГЕБ, яке виявлено при хворобі Альцгеймера, розсіяному склерозі, первинних і метастатичних пухлинах ГМ [12]. У хворих із церебральними метастазами раку легень при дослідженні первинної пухлини виявлено, що наявність експресії генів CDH2, KIFC1 і FALZ є фактором, який визначає здатність клітин раку легень метастазувати в ГМ. Ген CDH2 кодує синтез N-кадгеринів (кадгеринів-2 або нейральних кадгеринів (NCAD)), який бере участь у процесі метастазування пухлин, включаючи міграцію та інвазію пухлинних клітин, зокрема, в ЦНС. Також у хворих на недрібноклітинний рак легень експресія онкогену DCUN1D1, пов’язаного з плоскоклітинною карциномою, може сприяти проникненню пухлинних клітин через ГЕБ і розвитку МГМ. При раку передміхурової залози підвищена експресія KLF6-SV1 є предиктором більш низької виживаності хворих, а також асоціюється з високим ризиком метастазування пухлини в лімфатичні вузли, головний мозок і кістки [13]. В клітинах раку молочної залози ідентифіковані декілька факторів, які сприяють проникненню пухлинних клітин через ГЕБ. До них відносяться: циклооксигеназа-2 (СОХ2), гепарин-зв’язуючий епідермальний фактор росту — подібний фактор росту (HB-EGF) і ST6GALNAC5 ((альфа-N-ацетил-нейрамініл-2,3-бета-галактози-1,3)-N-ацетил–галактозамінід-альфа-2,6-сіалілтрансфераза 5 ST6). Експресія гена ST6GALNAC5 визнана найбільш специфічним маркером міграції клітин РМЗ через ГЕБ, тому що СОХ2 і HB-EGF виявлені при метастазах не тільки в ГМ, а й в легені. У дослідженнях in vitro виявлено здатність клітин меланоми збільшувати проникність ГЕБ шляхом зменшення трансендотеліальної стійкості ендотеліальних клітин. Потенційними маркерами ризику виникнення церебральних метастазів у хворих із меланомою шкіри можуть служити експресія меланотрансферину (MELTF, CD228, MAP97, MTF1, MTf, MFI2) і перетворювача сигналу та активатора транскрипції 3 (STAT3). Вважається, що наявність MELTF на поверхні клітин меланоми визначає їх здатність проникати через ГЕБ. Високі рівні STAT3 в МГМ у порівнянні з клітинами первинної меланоми шкіри вказують на тісний зв’язок між експресією STAT3 і міграцією клітин пухлини в ГМ [11]. Отже, виявлення специфічних маркерів, відповідальних за проникнення пухлинних клітин через ГЕБ, може слугувати основою для розробки специфічних методів профілактики МГМ.
Головним фактором, що визначає резистентність МГМ до медикаментозних методів лікування, є наявність в ГЕБ еффлюксних транспортерів (переносники/насоси, які здійснюють зворотний транспорт речовин та перешкоджають проникненню лікарських засобів у ГМ). В табл. 3 представлені основні еффлюксні транспортери, що перешкоджають проникненню цитостатиків у паренхіму ГМ, а також їх субстрати та інгібітори [14].
/31-1.jpg)
Р-глікопротеїд (Pgp, gp170) — білок, який кодується геном MDR1 (multdrug resistance 1), основною функцією якого є активне виведення з цитоплазми клітини в міжклітинне середовище великої кількості речовин, зокрема і лікарських засобів. У судинному сплетенні ГМ молекули Pgp виявлені в апікальній частині секреторних клітин і на базальній мембрані капілярів ГМ, що дозволяє переносити більшу частину субстратів Pgp з ендотелію і паренхіми ГМ у цереброспінальну рідину та кров. Роль Pgp у підтримці ГЕБ детально вивчена в дослідженнях in vivo. Так, у мишей із нокаутом гена MDR1 виявлено підвищений вплив на ГМ введених парентерально субстратів Р-глікопротеїду в порівнянні з диким типом тварин. Введення інгібіторів Pgp тваринам супроводжувалося підвищенням проникнення в ГМ субстратів Pgp, зокрема цитостатиків (вінкристин, паклітаксел, даунорубіцин та ін.). Аналогічні результати використання інгібіторів P-глікопротеїду (верапаміл і циклоспорин А) для підвищення проникності ГЕБ були отримані у людей [7].
Білки, пов’язані з множинною лікарською резистентністю (multidrug resistance-associated proteins, MRP) — протеїни сімейства транспортерів ABCC (ATP binding cassette subfamily C), які є важливими компонентами, що визначають вибіркову проникність ГЕБ для лікарських засобів. MRP1, MRP2 і MRP5 розташовані переважно в апікальній частині ендотеліальних клітин ГМ, а MRP4 розподілені однаково в апікальній і базальній частині ендотеліоцитів церебральних капілярів [15]. У судинному сплетенні MRP1, як і Р-глікопротеїн, локалізуються в апікальній частині секреторних клітин та забезпечують перенесення в цереброспінальну рідину речовин, які надходять у клітину гематогенно. В дослідженнях in vivo у мишей з нокаутом гена білка MRP1 виявлено більш високе накопичення субстратів MRP1, включаючи етопозид, у порівнянні з тваринами дикого типу. При введенні інгібітора MRP1 (пробенецид) виявлено дворазове збільшення концентрації флуоресцеїну в ЦНС [7].
Білок резистентності раку молочної залози (breast cancer-resistant protein, BCRP, ABCG2). ABCG2 (ATP binding cassette subfamily G member 2) — еффлюксний транспортер, названий білком резистентності раку молочної залози через те, що вперше виявлений у клітинах MCF-7 клітинної лінії раку молочної залози, резистентний до хіміотерапії [16]. BCRP також є важливим компонентом, що визначає проникність ГЕБ, а його вміст в ендотелії ЦНС більше концентрації Р-глікопротеїну та MRP1. У мишей з нокаутом гена BCRP1 виявлено збільшення в 2,5 раза концентрації іматинібу в паренхімі ГМ у порівнянні з тваринами дикого типу. Введення інгібітора BCRP (елакридар) тваринам дикого типу веде до збільшення проникнення іматинібу в 4,2 раза, а у мишей з нокаутом гена MDR1 елакридар призводить до підвищення поглинання церебральними клітинами субстратів BCRP — празозину та мітоксантрону [17].
У метастатичних пухлинах ГМ будова ГЕБ має певні особливості. На відміну від нормальної судинної мережі мозку в МГМ виявлено збільшення периваскулярного простору, а також збільшення кількості та активності піноцитозних вакуолей в ендотеліальних клітинах, що характерно для судин пухлинної природи, а не для ЦНС. Таким чином, ГЕБ у метастатичних пухлинах більш проникний, ніж в нормальній паренхімі ЦНС, і, скоріше, є капілярним бар’єром, ніж повноцінним ГЕБ [7].
Вплив променевої терапії на ГЕБ
Променева терапія є стандартом паліативної допомоги пацієнтам із МГМ. У дослідженнях in vivo після впливу іонізуючого випромінювання в ГМ щурів виявлено такі зміни: розширення просвіту кровоносних судин, збільшення ядер ендотеліальних клітин, потовщення стінки кровоносних судин, гіпертрофія астроцитів, зниження на 60 %, в порівнянні з контрольною групою тварин, експресії Р-глікопротеїну [7]. Ці зміни в ГМ щурів стали передумовою для формування гіпотези про збільшення проникності ГЕБ під впливом іонізуючого випромінювання, що може сприяти проникненню цитостатиків у пухлину і, як наслідок, підвищувати ефективність СППТ хворих із МГМ. У дослідженні D.H. Murrell і співавт. (2016) у мишей після опромінення всього головного мозку з СОД, еквівалентною середній терапевтичній дозі для людини, на 1-й і 11-й день після ОВГМ будь-яких змін проникності ГЕБ не виявлено. Слід зазначити, що результати клінічних досліджень з вивчення ефективності застосування комбінації променевої і хіміотерапії недостатньо переконливі [18]. Отже, питання зміни проникності ГЕБ через дію іонізуючого випромінювання на ГМ у наш час є дискутабельним і вимагає подальшого вивчення.
Методи збільшення проникнення лікарських засобів у МГМ
Для безперешкодного проникнення в ЦНС речовини повинні мати певні фізико-хімічні властивості, а саме низьку молекулярну масу, ліпофільність і низьку (або відсутність) іонізацію при фізіологічних значеннях рН. Фізико-хімічні властивості більшості цитостатиків не відповідають відміченим вище характеристикам, що визначає їх обмежену проникність у ЦНС. Це стало передумовою для розробки методів збільшення доставки протипухлинних лікарських засобів у МГМ. Існує кілька способів поліпшення доставки речовин в ЦНС: тимчасове відкриття ГЕБ в умовах осмотичного удару, застосування хімічних переносників (транспортерів), збільшення дози та кратності введення цитостатика, використання імплантатів з біодеградуючих матеріалів і т.п. Всі методи збільшення доставки цитостатиків у ЦНС можна віднести до одного або кількох із трьох основних підходів: зміна хімічної структури, та/або фізико-хімічних властивостей, і/або дози (концентрації) лікарських засобів, збільшення проникності ГЕБ і використання альтернативних шляхів введення. Низька ефективність більшості підходів поряд із необхідністю виконання технічно складних маніпуляцій, які супроводжуються тяжкими побічними ефектами й ускладненнями, значною мірою лімітують їх застосування в повсякденній клінічній практиці [19].
Найбільш використовуваними в рутинній клінічній практиці методами поліпшення доставки цитостатиків у клітини пухлин ЦНС є використання наночастинок та інгібіторів еффлюксних транспортерів (табл. 3). Застосування наночастинок для цільової доставки цитостатиків має ряд переваг: подолання хіміорезистентності, збільшення біодоступності та специфічності лікарського засобу, зменшення терапевтичної дози без втрати ефекту і, як наслідок, зниження частоти і тяжкості побічних ефектів. Результати клінічних досліджень з вивчення ефективності використання нано–частинок із цитостатиками слугували основою для використання даних лікарських засобів як стандартної терапії злоякісних пухлин різних локалізацій. У табл. 4 наведені цитостатики з використанням наночастинок, застосування яких схвалено Управлінням з санітарного нагляду за якістю харчових продуктів і медикаментів США (Food and Drug Administration, FDA) для лікування хворих із МГМ [20].
/33-1.jpg)
Результати клінічних досліджень щодо вивчення ефективності цитостатиків із використанням наночастинок та інгібіторів еффлюксних транспортерів у хворих із МГМ є обнадійливими, але необхідні подальші дослідження з вивчення біорозподілу, фармакокінетики, токсичності та побічних ефектів терапії для включення їх у клінічні протоколи лікування пухлин ЦНС.
Визначення тактики паліативної терапії хворих із МГМ
Тактика лікування пацієнтів із МГМ залежить від таких факторів: загальний стан хворого (індекс Карновського), кількість, розміри та локалізація метастатичних вогнищ у ГМ, тип первинної пухлини, наявність екстракраніальних метастазів. У табл. 5 подані можливі варіанти паліативного лікування хворих із МГМ залежно від сукупності перерахованих вище предиктивних факторів [7].
Зважаючи на дані, наведені у табл. 5, паліативна терапія не показана тільки хворим, у яких виявлено прогресування захворювання після проведення декількох видів протипухлинної терапії і при стійкому тяжкому загальному стані (індекс Карновського менше 50 %) після проведення адекватної супровідної (симптоматичної) терапії [21].
Системна протипухлинна терапія МГМ
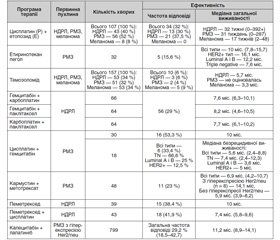
Дані про ефективність системної протипухлинної терапії у хворих із МГМ досить суперечливі. Так, системна протипухлинна терапія є ефективним методом лікування хворих із МГМ, особливо у випадках наявності метастатичних вогнищ в інших органах, тому що прогресування екстракраніальних метастазів набагато частіше є причиною смерті хворих [22]. Проте, за відсутності екстракраніальних уражень ефективність СППТ сумнівна, через те, що ГЕБ служить природним бар’єром для більшості цитостатиків і причиною резистентності метастатичних пухлин ГМ до системної терапії. У дослідженнях з вивчення ефективності хіміотерапії МГМ різних солідних пухлин частота відповіді вогнищ у ГМ на проведену терапію становила від 4 до 38 % [23]. Існує обмежена кількість даних про ефективність цитостатиків, отриманих у рандомізованих дослідженнях, що перешкоджає розробці загальноприй–нятої стратегії ефективної системної терапії МГМ, особливо у пацієнтів без екстракраніальних метастазів і/або з прогресією після проведення локальної терапії (хірургічне втручання, променева терапія). У табл. 6 подані результати застосування хіміотерапії для лікування хворих із МГМ різних локалізацій.
/34-1.jpg)
У дослідженні V. Franciosi і співавт. (1999) використовували таку комбінацію: цисплатин 100 мг/м2 (в 1-й день) + етопозид 100 мг/м2 (у 1, 3 і 5-й день або в 4, 6 і 8-й день) внутрішньовенно 1 раз у 3-му тижні, 6 циклів для лікування 107 пацієнтів із МГМ недрібноклітинного раку легень (НДРЛ), раку молочної залози (РМЗ) і меланоми. Клінічний ефект терапії (повна регресія + часткова регресія) зафіксований у 37,5 % пацієнтів з РМЗ і у 30 % з НДРЛ. Результати цього дослідження дозволяють рекомендувати дану програму хіміотерапії для лікування хворих із МГМ НДРЛ і РМЗ у випадках наявності екстракраніальних метастазів і/або первинної пухлини в легенях [24].
У третій фазі дослідження BEACON у 67 з 852 пацієнток із поширеним РМЗ зареєстровані МГМ. Ефективність застосування етиринотекану пеголу (145 мг/м2 внутрішньовенно 1 раз у 21-й день) як монохіміотерапії оцінена у 32 хворих на РМЗ у період з 2011 по 2013 рік. У даному дослідженні не зафіксовано жодного випадку повної клінічної регресії (ПР) метастатичних вогнищ у ГМ, часткова регресія (ЧР) виявлена тільки у 5 (15,6 %) і у 14 (43,8 %) хворих відзначено прогресування. Середня тривалість життя пацієнтів без ознак прогресії становила 3,1 міс. (1,8–4,0), а медіана виживаності — 10 міс. (7,8–15,7). Ефективність етиринотекану пеголу у хворих із МГМ РМЗ залежала від молекулярного типу пухлини та дорівнювала: 16,1 міс. при HER2+ типі, 12,2 міс. при Luminal A і В типах і 7,6 міс. при Triple negative РМЗ. Результати дослідження BEACON дозволяють рекомендувати етиринотекан пегол для лікування МГМ у хворих із HER2 + люмінальними типами РМЗ [26].
У дослідженні S. Siena і співавт. (2010) 157 пацієнтів з церебральними метастазами: НДРЛ — 53 (34 %) хворих, РМЗ — 51 (32 %), меланоми — 53 (34 %) — вивчали ефективність перорального застосування темозоломіду 150 мг/м2 в день (1–7-й дні та 15–21-й дні кожні 28 днів або 35 днів). У 1 (< 1 %) пацієнта з НДРЛ зафіксована повна регресія вогнищ у ГМ, у 9 (6 %) — часткова регресія, стабілізацію пухлинних вогнищ виявлено у 31 (20 %). Середня тривалість життя пацієнтів без ознак прогресії була 66, 58 і 56 днів для НДРЛ, РМЗ і меланоми відповідно. Медіана загальної виживаності хворих із НДРЛ становила 172 дні, з меланомою — 100 днів і не оцінювалася в групі РМЗ. Результати даного дослідження свідчать про низьку ефективність монотерапії темозоломідом з високою щільністю дози у пацієнтів із МГМ меланоми, НДРЛ і РМЗ [26].
У третій фазі дослідження M.J. Edelman і співавт. (2010) оцінювали ефективність програм поліхіміотерапії (ПХТ), які включали гемцитабін, паклітаксел і карбоплатин, у 194 пацієнтів із МГМ НДРЛ. Всіх пацієнтів розподілили на три групи: 1-ша група (n = 66) отримувала ПХТ за програмою: гемцитабін 1000 мг/м2 (в 1-й і 8-й день) + карбоплатин AUC 5,5 (в 1-й день) внутрішньовенно 1 раз у 3 тижні; 2-га група (n = 64) — гемцитабін 1000 мг/м2 (в 1-й і 8-й день) + паклітаксел 200 мг/м2 (в 1-й день) внутрішньовенно 1 раз у 3 тижні; 3-тя група (n = 64) — карбоплатин AUC 5,5 (в 1-й день) + паклітаксел 225 мг/м2 (в 1-й день) внутрішньовенно 1 раз у 3 тижні. У всіх групах хворим проводили до 6 циклів ПХТ або до прогресування захворювання. За результатами дослідження, всі три програми показали однакову клінічну ефективність у хворих із МГМ НДРЛ. Медіана виживаності становила 7,6 міс. (6,3–10,1) для пацієнтів 1-ї групи, 8,2 міс. (4,6–10,5) — для 2-ї групи, 7,7 міс. (6,1–10,2) — для 3-ї групи [27].
У двох дослідженнях оцінювалась ефективність лікування хворих на РМЗ з МГМ за програмою: цисплатин + гемцитабін. У дослідженні D.R. Naskhletashvili і співавт. (2010) 30 хворим із МГМ РМЗ проводили ПХТ за програмою: цисплатин 50 мг/м2 (в 1-й і 8-й день) + гемцитабін 1000 мг/м2 (в 1-й і 8-й день) внутрішньовенно кожні 3–4 тижні. Клінічно значущий ефект терапії (ПР + ЧР) зафіксований у 6 (53,3 %) хворих, а медіана загальної виживаності становила 10 міс. [28]. Схожі результати отримані C. Erten і співавт. (2013) при призначенні програми: цисплатин 30 мг/м2 (в 1-й і 8-й день) + гемцитабін 1000 мг/м2 (в 1-й і 8-й день) внутрішньо–венно 1 раз у 21-й день. Частота ПР + ЧР залежала від молекулярного типу первинної пухлини і дорівнювала 33,4 % для всіх типів РМЗ у цілому, 66,6 % — для Triple negative РМЗ, 25 % — у хворих з люмінальними типами і 12,5 % серед пацієнток з HER2+ типом РМЗ. Показники загальної виживаності хворих, включених до цього дослідження, не опубліковані. Медіана безрецидивної виживаності також залежала від типу РМЗ і була найбільшою у пацієнток з Triple negative РМЗ — 7,4 міс. (2,4–12,3), у хворих із HER2+ типом — 5 міс., при люмінальних типах — 3,6 міс. і 5,6 міс. (2,6–8,8) для всіх типів РМЗ [29].
W. Jacot і співавт. (2010) вивчали ефективність застосування програми: кармустин 100 мг/м2 (в 1-й день) + метотрексат 600 мг/м2 (1-й і 15-й день) внутрішньо–венно кожні 28 днів. Пацієнтам з гіперекспресією Her2/neu одночасно з кожним циклом ПХТ призначали трастузумаб 4 мг/кг (1-й і 15-й день) внутрішньо–венно. У 11 (23 %) хворих виявлено ПР + ЧР. Середня тривалість життя пацієнтів без ознак прогресії була 4,2 міс. (2,8–5,3), а медіана виживаності становила 6,9 міс. (4,2–10,7) без урахування молекулярного типу РМЗ. Медіана виживаності відрізнялася у хворих з гіперекспресією Her2/neu і без гіперекспресії Her2/neu і становила 14,1 і 5,9 міс. відповідно [30].
Ефективність пеметрекседу у хворих на НДРЛ з МГМ оцінювали в декількох дослідженнях. А. Bearz і співавт. (2009) повідомили про клінічно значущу ефективність монотерапії пеметрекседом 500 мг/м2 (внутрішньовенна інфузія в 1-й день кожні 3 тижні) у 15 (38,4 %) із 39 хворих з МГМ НДРЛ, яка використовувалася як 2-га або 3-тя лінія терапії. Медіана виживаності хворих досягла 10 міс. F. Barlesi та співавт. (2011) оцінювали ефективність 6 циклів ПХТ за програмою: пеметрексед 500 мг/м2 + цисплатин 75 мг/м2 (внутріш–ньовенна інфузія в 1-й день кожні 3 тижні). ПР + ЧР зафіксована у 18 (41,9 %) із 43 хворих з МГМ НДРЛ, а медіана виживаності хворих становила 7,4 міс. (5,8–9,6). Призначення ОВГМ одночасно з проведенням програми пеметрексед + цисплатин значно підвищує ефективність лікування згідно з результатами, отриманими X.X. Dinglin і співавт. (2013). Клінічно значущий ефект програми: пеметрексед + цисплатин + ОВГМ виявлено у 28 (68,3 %) із 41 хворого з МГМ НДРЛ при медіані загальної виживаності 12,6 міс. [31].
Ефективність призначення капецитабіну і лапатинібу для лікування хворих із МГМ РМЗ з гіперекспресією Her2/neu вивчалася в численних дослідженнях. Метааналіз 12 досліджень, в яких взяли участь 799 хворих з МГМ Her2/neu-позитивного РМЗ виявив, що загальна частота відповіді була 21,4 % (11,7–35,9). Після виключення з аналізу даних хворих, які отримували монотерапію лапатинібом, загальна частота відповіді дорівнювала 29,2 % (18,5–42,7). Медіана загальної виживаності хворих — 11,2 міс. (8,9–14,1) при середній тривалості життя пацієнтів без ознак прогресії була 4,1 міс. (3,1–6,7) [32].
Результати застосування таргетної терапії для лікування хворих з МГМ злоякісних пухлин різних локалізацій наведені в табл. 7.
У дослідженні T. Iuchi і співавт. (2013) оцінювали ефективність лікування 41 хворого з МГМ аденокарциноми легені з мутацією рецепторів епідермального фактора росту (EGFR). Хворим призначали гефітиніб по 250 мг/день до прогресування пухлини або розвитку неприйнятної токсичності терапії. Частота відповіді пухлини на терапію виявлена у 87,8 % хворих, а медіана виживаності становила 21,9 міс. (18,5–30,3). Середня тривалість життя пацієнтів без ознак прогресії була 14,5 міс. (10,2–18,3) [33].
N.K. Gerber і співавт. в 2014 р. представили результати лікування 110 хворих з МГМ EGFR-мутованої аденокарциноми легень. Залежно від проведеного лікування пацієнтів розподілили на 3 групи: 1-й групі (n = 63) хворих призначали ерлотиніб до прогресії хвороби або розвитку у хворих явищ неприйнятної токсичності терапії, 2-й групі (n = 32) проводили лише ОВГМ, 3-й групі (n = 15 ) — тільки СТРГ. Медіана загальної виживаності всіх 110 хворих становила 33 міс.: 26 міс. у 1-й групі, 35 міс. і 63 міс. у 2-й і 3-й групах відповідно [34].
У 2-й фазі мультицентричного дослідження вивчалася ефективність перорального застосування вемурафенібу по 960 мг 2 рази на день у 146 хворих з МГМ меланоми та наявністю мутації BRAF V600Е. Хворих розподілили на дві когорти: когорта 1 (n = 90) — пацієнти, які раніше не отримували локальну терапію (променева терапія або хірургічне втручання) з приводу МГМ, а проведена раніше системна терапія не включала інгібітори BRAF або MEK; когорта 2 (n = 56) — хворі з прогресуванням МГМ меланоми після раніше проведеної локальної терапії. Частота клінічно значущого ефекту терапії становила 18 % в обох когортах (16 і 10 пацієнтів в 1-й і 2-й когортах відповідно). Середня тривалість життя пацієнтів без ознак прогресії в ГМ була 3,7 міс. (0,03–33,4) в когорті 1 і 4,0 міс. (0,3–27,4) в когорті 2. Медіана загальної виживаності — 8,9 міс. (0,6–34,5) і 9,6 (0,7–34,3) в когорті 1 і 2 відповідно [35].
У 2-й фазі дослідження BREAK-MB вивчалася ефективність перорального застосування дабрафенібу по 150 мг 2 рази на день у 172 хворих з метастазами в паренхіму ГМ меланоми та наявністю мутації BRAF V600Е (139 хворих) і V600Е (33 хворих). Хворих розподілили на дві когорти: когорта 1 (n = 89) — пацієнти, які раніше не отримували локальну терапію (променева терапія або хірургічне втручання) з приводу МГМ; когорта 2 (n = 83) — хворі з інтракраніальним прогресуванням меланоми після раніше проведеної локальної терапії МГМ. Частота клінічно значущого ефекту терапії дорівнювала в когорті 1 у 39 і 31 % пацієнтів з наявністю мутації V600E і V600K відповідно, а в когорті 2 у 7 % хворих з мутацією V600E і у 22 % з мутацією V600K. Медіана загальної виживаності у хворих з мутацією V600E становила 7,6 і 7,2 міс., а також 3,7 і 5,0 міс. при наявності мутації V600K в когорті 1 і 2 відповідно. Середня тривалість життя пацієнтів без ознак прогресії була 3,7 міс. при мутації V600E і V600K в когорті 1 і 2 відповідно, при мутації BRAF V600K 1,8 міс. в когорті 1, і 3,8 міс. в когорті 2 при BRAF V600K-мутації [36].
В дослідженні P. Xing і співавт. (2016) оцінювали ефективність застосування кризотинібу у 20 хворих з метастазами в ГМ ALK-позитивного НДРЛ. Клінічно значуща відповідь на терапію зафіксована у 15 % пацієнтів. Середня тривалість життя без ознак прогресії захворювання становила 21,2 міс., при медіані загальної виживаності — 10,3 міс. [37].
Ефективність перорального застосування церитинібу (750 мг на добу) для лікування МГМ у хворих з ALK-позитивного НДРЛ оцінювалася в дослідженнях ASCEND-1, ASCEND-2 і ASCEND-3. У дослідженні ASCEND-1 у 124 пацієнтів з ALK-позитивним НДРЛ виявлені МГМ, з яких 98 хворих раніше отримували терапію інгібіторами ALK (кризотиніб) до прогресування, і 26 осіб, яким раніше не призначали інгібітори ALK. Вимірювані цільові метастатичні вогнища до початку лікування виявлено у 14 хворих (10 пацієнтів раніше отримували кризотиніб і 4 — раніше не отримували інгібітори ALK). У 7 з них (4 пацієнти після раніше проведеної терапії інгібіторами ALK і 3 без попередньої терапії) виявлена часткова регресія і у 3 хворих — стабілізація вогнищ в ГМ (всі лікувалися раніше ALK-інгібіторами). Медіана виживаності хворих без ознак прогресування становила 6,9 міс. (5,4–8,4) для всіх хворих або 6,7 міс. (4,9–8,4) для пацієнтів, які раніше лікувалися інгібіторами ALK, і 8,3 міс. (4,6 — немає даних) для пацієнтів, які раніше не отримували анти-ALK-терапію [38]. Ефективність церитинібу у хворих з МГМ ALK-позитивного НДРЛ після стандартних програм платиновмісної хіміотерапії, у яких виявлено прогресування захворювання менше ніж через 30 днів прийому кризотинібу, оцінювали в дослідженні ASCEND-2. Із 140 хворих клінічно значущу відповідь на терапію зафіксовано у 54 (38,6 %) хворих, а медіана виживаності без ознак прогресування становила 5,7 міс. (5,4–7,6) [39]. Ефективність церитинібу у хворих, які раніше не отримували терапію інгібіторами ALK, вивчали в дослідженні ASCEND-3. Серед 124 хворих з ALK-позитивним НДРЛ, включених у дослідження, у 50 (40 %) пацієнтів виявлено МГМ, з яких променева терапія вогнищ у ГМ проведена 27 (54 %) хворим. Медіана виживаності без ознак прогресування — 10,8 міс. (7,3 — відсутні), а клінічно значущу відповідь на терапію (ПР + ЧР) виявлено у 27 (58 %) хворих [40].
S.M. Gadgeel і співавт. (2016) проаналізували результати двох досліджень (NP28761 і NP28673) з вивчення ефективності та безпеки застосування алектинібу (600 мг 2 рази на добу, перорально) для лікування ALK-позитивного НДРЛ у хворих з МГМ, у яких виявлено прогресування захворювання після раніше проведеної терапії кризотинібом. Вимірювані вогнища в ГМ виявлено у 50 (37 %) пацієнтів, невимірювані метастатичні вогнища в ГМ — у 86 (63 %). У пацієнтів з вимірюваними вогнищами в ГМ відповідь на терапію зафіксовано у 32 (64 %) пацієнтів (ПР = 22 %) проти 37 (43 %) хворих (ПР = 27 %) з невимірюваними МГМ. У пацієнтів, які проходили променеву терапію МГМ (n = 95) до призначення алектинібу, частота загальної відповіді на терапію становила 35,8 % проти 58,5 % у хворих (n = 41), які раніше не отримували променеву терапію [41].
У другій фазі проспективного нерандомізованого дослідження BRAIN вивчалася ефективність комбінації: бевацизумаб (15 мг/кг) + карбоплатин (AUC 6) + паклітаксел (200 мг/м2) — внутрішньовенні інфузії кожні 3 тижні як перша лінія терапії неплоскоклітинного НДРЛ з безсимптомними, що раніше не лікувалися, МГМ. Часткова регресія та стабілізація інтракраніальних метастазів зафіксована у 42 (62,7 %) і 18 (26,9 %) відповідно. Медіана безрецидивної виживаності становила 6,7 міс. (5,7–7,1), а 6-місячна виживаність — 56,5 %. Медіана загальної виживаності дорівнювала 16 місяцям [42].
В ретроспективному багатоцентровому дослідженні Y.S. Yap і співавт. (2012) оцінювали ефективність анти-Her2/neu-терапії у хворих із МГМ РМЗ і наявністю гіперекспресії Her2/neu. Ретроспективно проаналізовано дані 280 пацієнток з МГМ Her2/neu + РМЗ 260 (92,9 %), яким проводили променеву терапію, 160 (57,1 %) — хіміотерапію і 114 (40,7 %) — анти-Her2/neu-терапію. З 114 хворих, які отримували анти-Her2/neu-терапію, 56 (49,1 %) пацієнток приймали трастузумаб, 30 (26,3 %) — лапатиніб і 28 (24,6 %) — комбіновану терапію трастузумаб + лапатиніб. Медіана виживаності була значно більше у пацієнток, які отримували комбіновану анти-Her2/neu-терапію і становила: 10,5 міс. (8,3–17,7) в групі пацієнтів, які приймали тільки трастузумаб, 21,4 міс. (12,5–27,1) в групі лапатинібу і 25,9 міс. (18,5–30,1) у хворих з групи трастузумаб + лапатиніб [43].
Ефективність застосування іпілімумабу для лікування хворих на меланому з МГМ вивчалася K. Margolin і співавт. (2012). Хворих (n = 72) з меланомою залежно від наявності клінічних проявів МГМ розподілили на 2 когорти: когорта А (n = 51) — пацієнти без клінічних проявів МГМ, когорта В (n = 21) — хворі з симптомами ураження ГМ, яким призначали глюкокортикоїди. Всі пацієнти отримували іпілімумаб по 10 мг/кг внутрішньовенно кожні 3 тижні — всього 4 введення. Частота клінічної відповіді пухлини на терапію становила 18 % в когорті А і 5 % в когорті В. Загальне виживання протягом 1 року дорівнювало 31 % і 19 % при медіані загальної виживаності 7 міс. (4,1–10,8) і 3,7 міс. (1,6–7,3) в когорті А і В відповідно [44].
У 2-й фазі дослідження Italian Network for Tumor Biotherapy (NIBIT) — M1 у 20 хворих із безсимптомними метастазами меланоми в ГМ призначали комбіновану системну терапію: іпілімумаб (по 10 мг/кг внутрішньовенно кожні 3 тижні — всього 4 введення) і фотемустин (по 100 мг/м2 внутрішньовенно щотижня — всього 3 введення). Підтримуюча терапія проводилася за схемою: фотемустин кожні 3 тижні починаючи з 9-го тижня терапії і іпілімумаб кожні 12 тижнів із 24-го тижня від початку системної терапії до прогресування захворювання, або відмови пацієнта, або до появи надмірної токсичності. Сімом хворим (35 %) до призначення системного лікування проводили променеву терапію. Частота клінічної відповіді пухлини на терапію становила 5 % при імунологічній частоті відповіді пухлини 50 %. При медіані спостереження 39,9 міс. 3-річна загальна виживаність дорівнювала 27,8 %, а медіана загальної виживаності — 12,7 міс. (2,7–22,7) [45].
S.B. Goldberg і співавт. (2016) опублікували результати 2-ї фази дослідження ефективності пембролізумабу у 36 хворих із безсимптомними МГМ НДРЛ (n = 18) і меланоми (n = 18). Експресію PD-L1 у пухлинній тканині виявлено тільки у пацієнтів із НДРЛ. Усім хворим призначали терапію пембролізумабом по 10 мг/кг внутрішньовенно кожні 2 тижні до прогресування захворювання. Клінічна частота відповіді вогнищ у ГМ на терапію становила 33 % при НДРЛ і 22 % при меланомі. При медіані спостереження в групі хворих з МГМ меланоми 11,6 міс. (8,5–13,9) медіана виживаності не була досягнута (НД), а в групі НДРЛ 6,8 міс. (3,1–7,8) медіана загальної виживаності дорівнювала 7,7 міс. (3,5–НД) [46].
Висновки
За останні десятиріччя досягнуто значного прогресу в діагностиці, визначенні прогнозу перебігу та лікуванні хворих із МГМ різних злоякісних пухлин. Впровадження шкал для оцінки прогнозу загальної виживаності хворих є важливим кроком визначення тактики лікування хворих з МГМ у рутинній клінічній практиці, що дає можливість збільшити обґрунтованість і застосування результатів клінічних досліджень з ви–вчення ефективності різних методів лікування. Проте великим недоліком існуючих прогностичних шкал є те, що вони не враховують смертність хворих внаслідок екстракраніальної прогресії злоякісної пухлини. Локальна терапія, що включає ОВГМ, СРХ, хірургічне лікування або їх комбінацію, є стандартом лікування більшості хворих із МГМ солідних пухлин, а застосування СППТ мало другорядне значення. Однак застосування методів локальної терапії є недосить ефективним через те, що показники загальної виживаності хворих із МГМ залишаються низькими, особливо при наявності метастатичних уражень в інших (крім ЦНС) органах. Низька ефективність стандартної СППТ при метастазах у ГМ обумовлена бар’єрною функцією ГЕБ. Численні еффлюксні транспортери перешкоджають проникненню в ЦНС більшості лікарських засобів, які традиційно застосовуються для лікування метастазів в інших органах. До перспективних методів подолання ГЕБ можна віднести модифікацію фізико-хімічних властивостей існуючих і розробку нових лікарських засобів, а також застосування інгібіторів еффлюксних транспортерів. Результати досліджень з вивчення ефективності цитостатиків із використанням наночастинок і інгібіторів еффлюксних транспортерів у хворих з МГМ є обнадійливими, але необхідні подальші дослідження з вивчення біорозподілу, фармакокінетики, токсичності та побічних ефектів терапії для включення їх у клінічні протоколи лікування пухлин ЦНС. Подальші дослідження механізмів метастазування і факторів, що провокують високий ризик прогресування злоякісних пухлин у ГМ, можуть слугувати основою для розробки методів профілактики МГМ. Застосування мультидисциплінарного підходу для вироблення тактики лікування пацієнтів з використанням шкал оцінки прогнозу перебігу сприятиме більш обґрунтованому призначенню променевої терапії, хірургії, системної протипухлинної і симптоматичної терапії для збереження неврологічної і нейрокогнітивної функцій, а також якості життя хворих.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Mehta M., Vogelbaum M.A., Chang S. et al. Neoplasms of the central nervous system. In: DeVita V.T. Jr, Lawrence T.S., Rosenberg S.A. Cancer: Principles and Practice of Oncology. 9th ed. — Philadelphia, Pa: Lippincott Williams & Wilkins, 2011. — P. 1700-49.
2. Villano J.L., Durbin E.B., Normandeau C., Thakkar J.P., Moirangthem V., Davis F.G. Incidence of brain metastasis at initial presentation of lung cancer // Neuro Oncol. 2015; 17(1): 122-128. — doi: 10.1093/neuonc/nou099.
3. Ippen F.M., Mahadevan A., Wong E.T., Uhlmann E.J., Sengupta S., Kasper E.M. Stereotactic radiosurgery for renal cancer brain metastasis: Prognostic factors and the role of whole-brain radiation and surgical resection // Journal of Oncology. 2015: 636918. — doi: 10.1155/2015/636918, 0.44.
4. Christensen T.D., Spindler K.L., Palshof J.A., Nielsen D.L. Systematic review: brain metastases from colorectal cancer-Incidence and patient characteristics // BMC Cancer. 2016; 16: 260. — doi: 10.1186/s12885-016-2290-5.
5. Wilhelm I., Molnar J., Fazakas C., Hasko J., Krizbai I.A. Role of the blood-brain barrier in the formation of brain metastases // Int. J. Mol. Sci. 2013; 14: 1383-1411. — doi: 10.3390/ijms14011383.
6. Vernur V.A., Ahluwalia M.S. Prognostic scores for brain metastasis patients: use in clinical practice and trial design // Chin. Clin. Oncol. 2015; 4(2): 18. — doi: 10.3978/j.issn.2304-3865.2015.06.01.
7. Lin X., DeAngelis L.M. Treatment of Brain Metastases // Journal of Clinical Oncology. 2015; 33 (30): 3475-3484. — doi: 10.1200/JCO.2015.60.9503.
8. Sperduto P.W., Yang T.J., Beal K. et al. Estimating Survival in Patients with Lung Cancer and Brain Metastases: An Update of the Graded Prognostic Assessment for Lung Cancer using Molecular Markers (Lung-molGPA) // JAMA Oncology, published online Nov 17, 2016. — doi: 10.1001/jamaoncol.2016.3834.
9. Sperduto P.W., Jiang W., Brown P.D. et al. Estimating Survival in Melanoma Patients with Brain Metastases: An Update of the Graded Prognostic Assessment for Melanoma Using Molecular Markers (Melanoma-molGPA) // Int. J. Radiat. Onc. Biol. Phys. 2017, on-line 10/17/17, print issue 11/15/17.
10. Liubota R., Cheshuk V., Vereshchako R., Zotov O., Zaychuk V., Anikusko N., Liubota I. The impact of locoregional treatment on survival of patients with primary metastatic breast cancer// Exp. Oncol. 2017; 39 (1): 75-77.
11. Wrobel J.K., Toborek M. Blood-brain barrier remodeling during brain metastasis formation // Mol. Med. 2016; 22: 32-40. — doi: 10.2119/molmed.2015.00207.
12. Abbott N.J., Ronnback L., Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier // Nat. Rev. Neurosci. 2006; 7(1): 41-8. — doi: 10.1038/nrn1824.
13. Rahmathulla G., Toms S.A., Weil R.J. The molecular biology of brain metastasis // J. Oncol. 2012; 2012723541. — doi: 10.1155/2012/723541.
14. Deeken J.F., Löscher W. The blood-brain barrier and cancer: Transporters, treatment, and Trojan horses // Clin. Cancer Res. 2007; 13: 1663-1674. — doi: 10.1158/1078-0432.CCR-06-2854.
15. Zhang Y., Schuetz J.D., Elmquist W.F., Miller D.W. Plasma membrane localization of multidrug resistance-associated protein homologs in brain capillary endothelial cells // J. Pharmacol. Exp. Ther. 2004; 311: 449-55.
16. Horsey A.J., Cox M.H., Sarwat S., Kerr I.D. The multidrug transporter ABCG2: still more questions than answers // Biochem. Soc. Trans. 2016; 44: 824-830. — doi: 10.1042/BST20160014.
17. Agarwal S., Uchida Y., Mittapalli R.K., Sane R., Terasaki T., Elmquist W.F. Quantitative proteomics of transporter expression in brain capillary endothelial cells isolated from P-glycoprotein (P-gp), breast cancer resistance protein (Bcrp), and P-gp/Bcrp knockout mice // Drug. metabolism and disposition: the biological fate of chemicals. 2012; 40: 1164-1169.
18. Murrell D.H., Zarghami N., Jensen M.D., Chambers A.F., Wong E. & Foster P.J. Evaluating changes to blood-brain barrier integrity in brain metastasis over time and after radiation treatment // Translational Oncology. 2016; 9(3): 219-227.
19. Sandipan R. Strategic Drug Delivery Targeted to the brain // A Review. Der. Pharmacia Sinica. 2012; 3 (1): 76-92.
20. Cerna T., Stiborova M., Adam V., Kizek R., Eckschlager T. Nanocarrier drugs in the treatment of brain tumors // J. Cancer Metastasis Treat. 2016; 2: 407-16.
21. Kostaras X., Cusano F., Kline G.A., Roa W., Easaw J. Use of dexamethasone in patients with high-grade glioma: a clinical practice guideline // Curr. Oncol. 2014; 21(3): e493-503.
22. Ahluwalia M.S., Vogelbaum M.V., Chao S.T., Mehta M.M. Brain metastasis and treatment // F1000Prime Rep. 2014; 6: 114.10.12703/P6-114.
23. Lombardi G., Di Stefano A.L., Farina P., Zagonel V., Tabou–ret E. Systemic treatments for brain metastases from breast cancer, non-small cell lung cancer, melanoma and renal cell carcinoma: an overview of the literature // Cancer Treat. Rev. 2014; 40: 951-9.
24. Harry C. Brastianos, Daniel P. Cahill, Priscilla K. Brastianos, Systemic Therapy of Brain Metastases // Current. Neurology and Neuroscience Reports, 2015, 15, 2.
25. Cortés J., Rugo H.S., Awada A., Twelves C., Perez E.A., Im S.-A. et al. Prolonged survival in patients with breast cancer and a history of brain metastases: results of a preplanned subgroup analysis from the randomized phase III BEACON trial // Breast. Cancer Res. Treat. 2017; 165(2): 329-41. — doi: 10.1007/s10549-017-4304-7.
26. Chamberlain M.C., Baik C.S., Gadi V.K., Bhatia S., Chow L. Systemic therapy of brain metastases: non-small cell lung cancer, breast cancer, and melanoma // Neuro-Oncology. 2017; 19 (1): i1-i24. — doi: 10.1093/neuonc/now197.
27. Metro G., Chiari R., Ricciuti B. et al. Pharmacotherapeutic options for treating brain metastases in non-small cell lung cancer // Expert. Opin. Pharmacother. 2015; 16: 2601-13. — doi: 10.1517/14656566.2015.1094056.
28. Naskhletashvili D.R., Gorbunova V.A., Bychkov M.B., Chmutin G.E., Karahan V.B., Aloshin V.A., Moskvina E.A. Gemcitabine plus cisplatin in patients with heavily pretreated breast cancer with brain metastases // Journal of Clinical Oncology. 2010 (suppl; abstr 1125); 28: 7s.
29. Erten C., Demir L., Somali I., Alacacioglu A., Kucukzeybek Y., Akyol M., Can A., Dirican A., Bayoglu V., Tarhan M.O. Cisplatin plus gemcitabine for treatment of breast cancer patients with brain metastases; a preferential option for triple negative patients? // Asian Pac. J. Cancer Prev. 2013; 14(6): 3711-3717. — doi: 10.7314/APJCP.2013.14.6.3711.
30. Jacot W., Gerlotto-Borne M.C., Thezenas S., Poude–roux S., Poujol S., About M., Romieu G. Carmustine and methotrexate in combination after whole brain radiation therapy in breast cancer patients presenting with brain metastases: a retrospective study // BMC Cancer. 2010; 10: 257. — doi: 10.1186/1471-2407-10-257.
31. Inno A., Di Noia V., D’Argento E., Modena A., Gori S. State of the art of chemotherapy for the treatment of central nervous system metastases from non-small cell lung cancer // Transl. Lung. Cancer Res. 2016; 5: 599-609.
32. Petrelli F., Ghidini M., Lonati V., Tomasello G., Borgonovo K., Ghilardi M. et al. The efficacy of lapatinib and capecitabine in HER-2 positive breast cancer with brain metastases: a systematic review and pooled analysis // Eur. J. Cancer. 2017; 84: 141-8.10.1016/j.ejca.2017.07.024.
33. Iuchi T., Shingyoji M., Sakaida T. et al. Phase II trial of gefitinib alone without radiation therapy for Japanese patients with brain metastases from EGFR-mutant lung adenocarcinoma // Lung. Cancer. 2013; 82(2): 282-287.
34. Gerber N.K., Yamada Y., Rimner A., Shi W., Riely G.J., Beal K., Yu H.A., Chan T.A., Zhang Z., Wu A.J. Erlotinib versus radiation therapy for brain metastases in patients with EGFR-mutant lung adenocarcinoma // Int. J. Radiat. Oncol. Biol. Phys. 2014; 89: 322-329. — doi: 10.1016/j.ijrobp.2014.02.022.
35. McArthur G.A., Maio M., Arance A., Nathan P., Blank C., Avril M.F., Garbe C., Hauschild A., Schadendorf D., Hamid O., Fluck M., Thebeau M., Schachter J., Kefford R., Chamberlain M., Makrutzki M., Robson S., Gonzalez R., Margolin K. Vemurafenib in metastatic melanoma patients with brain metastases: an open-label, single-arm, phase 2, multicentre study // Ann. Oncol. 2017; 28: 634-41. — doi: 0.1093/annonc/mdw641.
36. Azer M.W., Menzies A.M., Haydu L.E., Kefford R.F., Long G.V. Patterns of response and progression in patients with BRAF-mutant melanoma metastatic to the brain who were treated with dabrafenib // Cancer. 2014; 120: 530-6.
37. Xing P., Wang S., Hao X. et al. Clinical data from the real world: efficacy of Crizotinib in Chinese patients with advanced ALK-rearranged non-small cell lung cancer and brain metastases // Oncotarget. 2016; 7: 84666-84674.
38. Shaw A., Mehra R., Tan D.S.W. et al. Ceritinib (LDK378) for the treatment of patients with ALK-rearranged (ALK+) non-small cell lung cancer (nsclc) and brain metastasis (bm) in the ascend-1 trial // Neuro. Oncol. 2014; 16(suppl 5): 39.
39. Crino L., Ahn M.J., De Marinis F. et al. Multicenter Phase II Study of Whole-Body and Intracranial Activity With Ceritinib in Patients With ALK-Rearranged Non-Small-Cell Lung Cancer Previously Treated With Chemotherapy and Crizotinib: Results From ASCEND-2 // J. Clin. Oncol. 2016; 34: 2866-73. 10.1200/JCO.2015.65.5936.
40. Felip E., Orlov S., Park K. et al. Ascend-3: a single-arm, open-label, multicenter phase II study of ceritinib in alki-naive adult patients (pts) with ALK-rearranged (ALK+) non-small cell lung cancer (nsclc) [abstract 8060] // J. Clin. Oncol. 2015; 33.
41. Gadgeel S.M., Shaw A.T., Govindan R. et al. Pooled Analysis of CNS Response to Alectinib in Two Studies of Pretreated Patients With ALK-Positive Non-Small-Cell Lung Cancer // J. Clin. Oncol. 2016; 34: 4079-85.
42. Besse B., Le Moulec S., Mazières J., Senellart H., Barlesi F., Chouaid C. et al. Bevacizumab in patients with nonsquamous non-small cell lung cancer and asymptomatic, untreated brain metastases (BRAIN): a nonrandomized, phase II study // Clin. Cancer. Res. 2015; 21: 1896-903.
43. Yap Y.S., Cornelio G.H., Devi B.C. Brain metastases in Asian HER2-positive breast cancer patients: anti-HER2 treatments and their impact on survival // Br. J. Cancer. 2012; 107: 1075-1082.
44. Margolin K., Ernstoff M.S., Hamid O., Lawrence D., –McDermott D., Puzanov I. et al. Ipilimumab in patients with melanoma and brain metastases: an open-label, phase 2 trial // Lancet Oncol. 2012; 13: 459-65.
45. Di Giacomo A.M., Ascierto P.A., Queirolo P., Pilla L., Ridolfi R., Santinami M., Testori A., Simeone E., Guidoboni M., Maurichi A., Orgiano L., Spadola G., Del Vecchio M. et al. Three-year follow-up of advanced melanoma patients who received ipilimumab plus fotemustine in the Italian Network for Tumor Biotherapy (NIBIT)-M1 phase II study // Ann. Oncol. 2015; 26: 798-803.
46. Goldberg S.B., Gettinger S.N., Mahajan A., Chiang A.C., Herbst R.S., Sznol M. et al. Pembrolizumab for patients with melanoma or non-small-cell lung cancer and untreated brain metastases: early analysis of a non-randomised, open-label, phase 2 trial // Lancet Oncol. 2016; 17: 976-83.

/29-1.jpg)
/30-1.jpg)
/31-1.jpg)
/33-1.jpg)
/33-2.jpg)
/34-1.jpg)
/36-1.jpg)