Вступ
Посттравматичні посткоматозні стани тривалого розладу свідомості — це група синдромів, що характеризують порушення свідомості і в той же час стадійність її відновлення після гострої тривалої церебральної коми, яка виникла внаслідок тяжкої черепно-мозкової травми (ЧМТ) (Царенко С.В., Зайцев О.С., 2012). До групи цих синдромів входять посткоматозні синдроми пригніченої свідомості, синдроми реінтеграції свідомості, перехідні синдроми й синдроми ясної свідомості (Доброхотова Т.А., Зайцев О.С., 1993).
Сам термін «посткоматозні», відповідно до чисельних літературних джерел (Боголепов Н.К., 1962; Доброхотова Т.А., Гриндель О.М., Брагина Н.Н., 1985), є синонімом «підгострі» чи «затяжні» зміни свідомості, однак не містить прив’язки до конкретного часового проміжку після травми. Адже на противагу переліченим термінологічним синонімам [1], де гострий період після катастрофи триває 1 місяць, а порушення свідомості вважають затяжною, чи підгострою, комою, термін «посткоматозні стани» базується на тому, що фактор часу у визначенні рівня порушення свідомості після травматичної коми є не найінформативнішим критерієм (Коновалов А.Н., Васин Н.Я., 1992; Плам Ф., Познер Дж.Б., 1986; Зайцев О.С., 1993). Пацієнт виходить із коми завжди і щоразу через вегетативний статус (ВС), який може тривати день, місяць і рік, так само, як і може «залишитись» в ньому та на будь-якому іншому рівні відновлення свідомості на тривалий час чи навіть назавжди (Зайцев О.С., 2011).
Практика вітчизняної і зарубіжної медицини останніх десятиріч яскраво свідчить про те, що виживаність пацієнтів, не доступних до продуктивного контакту і яким встановлено трахеостомічну канюлю, назогастральний зонд, сечовий катетер, поза межами відділень реанімації та інтенсивної терапії досить низька. До останнього часу приклади того, що «вегетатики» чи «апаліки» тривало знаходяться в амбулаторних умовах, де підтримується їх життєздатність, є скоріше виключенням, аніж правилом.
Такий рівень існування проблеми травматичних посткоматозних станів привів до поширеного судження, що виходжувати «вегетатиків», застосовувати до них навіть апаратні способи відновного лікування є майже безнадійним ділом.
Існуючі сучасні технології [1–6], що вже роками використовуються в країнах Європи, США, Японії і мають успішний соціально-економічний і професійний імідж, у нашій державі представлені спорадично і не набули широкого використання, або мають штучно звужений спектр застосування, незважаючи навіть на те, що значно зросла доступність реабілітаційних послуг для пацієнтів з наслідками тяжкої черепно-мозкової травми у вигляді вегетативного статусу.
Як це не дивно, але літературних даних і компетентних некомерційних повідомлень з приводу клініко-неврологічних особливостей вегетативного статусу під час високотехнологічної нейрореабілітації виявилась досить обмежена кількість (Лендрайтене Э.В., Крищюнас А.Й., 2010).
На противагу цьому є достатньо робіт [7, 8], які описують загальні симптоми та прояви вегетативного статусу і реабілітаційні заходи і схеми реабілітаційного лікування, які відносяться до ери 60–90-х років минулого сторіччя (Курако Ю.В., Вайсфельд Д.Н., 1981), причому детального опису ключових моментів симптоматики, залежностей виходу на вищі стадії відновленої свідомості та подібної чіткої інформації знайти не вдалося.
Виникла потреба переглянути існуючі протоколи та стандарти лікування цих посттравматичних станів, навіть якщо вони до цього часу вважились некурабельними чи по своєму прогнозу несприятливими, або через грубу інвалідність чи короткий термін життя пацієнтів. А щоб найуспішніше виконати дану мету, перш за все треба ще раз, по-новому, з’ясувати ключові особливості клініко-неврологічної картини посттравматичного вегетативного статусу, на підставі яких можна коригувати (розширяти, доповнювати) існуючу тактику реабілітації та розробляти високоінформативні прогностичні моделі.
Мета дослідження: вивчити клініко-неврологічні особливості хворих у вегетативному статусі після тяжкої ЧМТ під час відновного лікування та реабілітації, які можуть мати обґрунтоване прогностичне значення для оцінки його ефективності, та оцінити інформативність шкали/класифікації Т.А. Доброхотової для опису даного рівня посткоматозного розладу свідомості.
Матеріали та методи
В основу роботи покладено аналіз 220 хворих із травматичними посткоматозними розладами свідомості, які обстежувалися і проходили курси нейрореабілітаційного лікування в ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України» та в ТОВ «Науково-практичний центр нейрореабілітації «Нодус» з січня 2007 по липень 2018 року включно.
Скарги, анамнестичні дані та дані динаміки хвороби, катамнезу вивчалися згідно з історіями стаціонарного та амбулаторного хворого, уніфікованими в ТОВ «НПЦНР «Нодус» та ДУ «Інститут нейрохірургії ім. А.П. Ромоданова НАМНУ» в 2010 році, розширеними і доповненими у наступні роки.
Клініко-неврологічне обстеження включало в себе додатково обов’язковий огляд офтальмолога, отоневролога, психоневролога, фізіотерапевта та, за показаннями, кардіолога, пульмонолога, хірурга, ортопеда-травматолога, анестезіолога/реаніматолога, гастроентеролога, уролога.
Інтерпретацію отриманих даних клініко-неврологічного обстеження здійснювали з урахуванням параклінічних, інструментальних і нейрофізіологічних даних на момент госпіталізації пацієнтів у клініку, в контрольних точках оцінки ефективності реабілітаційного лікування.
У неврологічному статусі визначали наявність загальномозкової та вогнищевої неврологічної симптоматики. Увагу звертали на функцію черепно-мозкових нервів (наявність/відсутність коркових, бульбарних порушень), розлади чутливості (порушення простої (больової, тактильної, вібраційної, температурної) і складної (двомірно-просторового чуття, суглобово-м’язового відчуття) видів чутливості) та рухові порушення (зміни м’язового тонусу (включаючи вертикальний і горизонтальний постуральний тонус), сили, об’єму активних рухів, м’язового опору, патологічні рухові пози, спонтанні мимовільні рухи) [9]. Крім того, значення мали вираженість/відсутність поверхневих і глибоких рефлексів, наявність/відсутність патологічних рефлексів, а також статокоординаторні порушення функції стояння, ходіння, направлені рухові реакції. Обов’язковим було визначення стану вегетативної нервової системи (наявність вегетативних кризів судинно-рефлекторного характеру, гіпертермії, гіпергідрозу/ангідрозу) та стану контролю за тазовими функціями.
Окремо виділяли дослідження мовлення (наявність/відсутність моторної, сенсорної афазії) та вищих кіркових функцій: стан емоцій, пам’яті, мислення, волі, уваги, відчуттів.
Однак найбільшою зоною інтересу у досліджуваних хворих був стан їх свідомості, який в гострому, проміжному та віддаленому періоді захворювання визначали за шкалами коми Глазго (ШКГ), О.Р. Шахновича та класифікацією посткоматозних станів Т.А. Доброхотової [10]. Це дало змогу оцінювати пробуджуваність пацієнта і кількісно-якісний зміст свідомості в момент огляду пацієнта, а також в динаміці.
Враховуючи те, що у 100 % хворих мали місце тривалі розлади свідомості у вигляді затяжної коми різної глибини не менше 10 діб, притому що всі без винятку хворі проходили стадію відновлення свідомості у вигляді ВС різної тривалості [11] (від декількох днів до декількох місяців), стан і динаміку посткоматозного порушення свідомості протягом усього періоду з моменту травми оцінювали симультанно за всіма цими шкалами та класифікацією. І лише тоді, коли пацієнт долав стадію вегетативного статусу, з того часу і до кінця спостереження за хворим здійснювали рангову оцінку рівня свідомості, використовуючи лише класифікацію Т.А. Доброхотової, тому що вона найбільш точно і повно відображала динаміку відновлення психічних функцій та активності пацієнта, особливо на фоні інтенсивного відновного лікування й реабілітації.
За вегетативний стан, згідно з рекомендаціями Американської асоціації неврологів (1993), які були погоджені та затверджені на Європейському конгресі в Брюсселі в 2001 році, [1] приймали посткоматозний стан, при якому у пацієнта відсутні ознаки усвідомлення себе й оточуючого світу, відсутність усвідомлених повторюваних відповідей на слухові, зорові, тактильні та больові стимули, відсутність довільної рухової активності при різко підвищеному м’язовому тонусі, відновлення циклу «сон — бадьорість», де функціональна активність гіпоталамуса і стовбуру мозку достатня для спонтанного адекватного дихання та серцебиття при умові збереження краніальних і спінальних рефлексів і нетримання сечі й калу [1, 11]. Персистуючим ВС [1, 11] вважали при умові його тривалості більше 1 місяця, а перманентним ВС — неможливість відновлення свідомості. При збереженні тривалості персистуючого стану більше 12 місяців з моменту ЧМТ ВС вважали перманентним [1, 11].
Рівень свідомості визначали за шкалою коми Глазго [12] і шкалою О.Р. Шахновича [10, 13], які дозволяли якісно та кількісно оцінити глибину порушеної свідомості. У клінічних ситуаціях, де бальна оцінка шкали коми Глазго не узгоджувалась з клінічним рівнем свідомості чи оцінюваний параметр мав непостійне вираження, наприклад, коли в одній пробі на біль реєструвалось «патологічне згинання кінцівок», а вже через короткий час — «патологічне розгинання», яке знову змінювалось на «патологічне згинання», шкалу О.Р. Шахновича доповнювали (деталізували) на основі зведеної бальної оцінки, встановлювали той чи інший рівень свідомості.
Для більш детального стадійного відображення поточного рівня посткоматозної свідомості на конкретний момент клініко-неврологічного обстеження пацієнта в ході відновного лікування та реабілітації перевагу надавали використанню класифікації Т.А. Доброхотової (1985) [10, 14], яка передбачала посиндромне стадійне відображення стану та динаміки свідомості і включала чотири синдроми, кожен з яких поділений на стадії, які одна за одною змінюють клінічний прояв відновлення свідомості в часі на основі появи та закріплення типової відмінної риси (симптому чи продуктивного розладу), притаманної лише для даної стадії. Реєстрація даної клініко-неврологічної риси дозволяла не тільки достеменно стверджувати про ту чи іншу стадію відновлення свідомості, а й оцінювати прогноз відновлення свідомості до преморбідного психічного стану.
Рівень спастики визначали за шкалою м’язової спастичності Ашворт [15] при надходженні пацієнта, а також під час реабілітаційного лікування: щодня — у пацієнтів із синдромами пригніченої свідомості, 1 раз на тиждень — із синдромами реінтеграції свідомості й перехідними синдромами, 1 раз на місяць — у хворих із синдромами ясної свідомості. Причому протипоказанням до проведення занять з кінезіотерапії у хворих з синдромами пригніченої свідомості, синдромами реінтеграції свідомості вважали рівень спастики 4–5 балів за шкалою Ашворт, в той час коли у пацієнтів з перехідними синдромами та синдромами ясної свідомості — 5 балів за шкалою Ашворт.
Для оцінки болю використовували модифіковану шкалу болю ВРІТ [16–18] (Critical Care Pain Observation Tool). Вона включала в себе 4 категорії ознак: вираз обличчя; рухові реакції; напруження м’язів верхніх кінцівок; звукові/мовленнєві реакції (у неінтубованих) або опір вентилятору (у інтубованих пацієнтів).
Максимальне значення балів (10) свідчило про збережену реакцію пацієнта з посткоматозним порушенням свідомості на біль або наявність болю під час рухів (пасивного повертання хворого в ліжку), в той час коли 0 балів свідчило про повну ареактивність на біль, навіть при умові відсутності наркотичної седації чи знеболення. У випадках наявності у пацієнта трахеостомічної канюлі визначення пункту «дотримання штучної вентиляції легень» даної шкали проводили на незначний рух і подразнення трахеостомічної канюлі після повної санації мокротиння або слизу, наявність яких могла спотворити результат оцінки. У випадках, коли стан пацієнта в анамнезі класифікувався як позамежова кома, а на момент проведення даного тестування пацієнт знаходився в вегетативному статусі, подразнення трахеї та бронхів спеціальним катетером також зараховували як значення, валідне для даної шкали.
Дослідження рівня щоденної активності та дезадаптації до життєдіяльності проводили за шкалою Бартел та індексом Бартел (Barthel ADL Index) [19], визначеним на її основі.
Клінічні результати організації травматичної хвороби в наслідки або стани оцінювали за розширеною шкалою наслідків Глазго (Glasgow Outcome Scale Extended, GOSE/GOS) [20–24].
Статистичну обробку отриманих даних проводили з використанням пакету прикладних програм Statistica 6, пакету комп’ютерного аналізу Office Excel 2016, вибіркового методу: вибіркової середньої, похибки середньої; для визначення вірогідності різниці між групами — непараметричні методи: критерій χ2 для порівняння якісних показників та t-критерій для порівняння кількісних параметрів; для порівняння двох незалежних груп — метод Манна — Уїтні.
Результати
Ретельно фіксуючи рівень свідомості пацієнтів на початку спостереження, коли тривала церебральна кома організовувалась у першу стадію відновлення посткоматозного порушення свідомості — вегетативний статус, а потім, в ході реабілітаційного лікування, коли одні хворі продовжували залишатися у ВС, а інші переходили на вищі рівні відновленої свідомості, виявили, що неврологічна загальномозкова і вогнищева симптоматика так само закономірно змінюється від стадії до стадії, що потребує її розгляду окремо в кожному з періодів посткоматозного розладу свідомості.
В момент включення пацієнта в дослідження рівень свідомості, що відповідав вегетативному статусу при оцінці за шкалами, мав клінічно незначну та статистично вірогідну слабку (r = 0,89) девіацію балів за шкалами коми Глазго та Шахновича. В той час, коли за шкалою коми Глазго у 96 % випадків (n = 211; N = 220) рівень свідомості становив 8 балів, а у 4 % (n = 9; N = 220) — 7 балів, за кількісно-якісною шкалою Шахновича всі без виключення хворі мали 51 бал і градацію рівня свідомості — сопор (апалічний синдром). При співставленні даної бальної оцінки з класифікацією Т.А. Доброхотової визначено належність даного рівня порушення свідомості до синдромів пригніченої свідомості, стадія І — вегетативний статус (табл. 1).
Слід відмітити, що саме шкала/класифікація Т.А. Доброхотової найкраще описувала даний рівень посткоматозного розладу свідомості, оскільки на основі рушійної ознаки чітко відділяла дану стадію від коми та інших стадій посткоматозного відновлення свідомості.
Пацієнти поводилися в ліжку повністю пасивно, положення кінцівок у всіх без виключення випадках — патологічне, вимушене. Фазове відношення біологічних ритмів «сон — бадьорість» у 74,09 % (n = 163; N = 220) хворих було інвертоване, а у решти відповідало циклу «день — ніч» зі зміщенням на 2–4 години вперед.
Загальномозкова симптоматика у 22,27 % (n = 49; N = 220) пацієнтів у ВС проявлялася пароксизмальним перебігом гіпертензивного синдрому внаслідок ліквородинамічних порушень, у 49,54 % (n = 109; N = 220) — епілептичними нападами, що мали тенденцію до частішання.
Основними проявами гіпертензивного синдрому були рвота й наростання загального напруження, неспокою хворого, наростання центральних вегетативних порушень: тотальний гіпергідроз, гіпертермія, а також поява неспання.
Епілептичні напади у 29,35 % (n = 32; N = 109) випадків проявлялися фокальними судомами у кінцівках незалежно від домінуючої сторони ураження, а у 70,65 % (n = 77; N = 109) переходили у вторинно-генералізовані тоніко-клонічні судоми, які потребували у 40,25 % (n = 31; N = 77) в постіктальному періоді інтенсивних реанімаційних заходів із відновлення спонтанного дихання та гемодинаміки.
Неврологічна вогнищева симптоматика характеризувалась неспецифічними симптомами, які були проявом власне первинного ураження головного мозку, а її топічний характер свідчив за сегментарний (стовбуровий) або надсегментарний (супрасегментарний) рівень без достеменних ознак латералізації.
Дослідження функції черепно-мозкових нервів виявило розлади у 79,54 % (n = 175; N = 220) хворих, що найчастіше проявлялися ознаками ураження лицьового й окорухового нерва. Так, у 28,18 % (n = 62; N = 220) досліджуваних виявлено центральний парез лицьового нерву, в той час коли у 19,54 % (n = 43; N = 220) хворих виявлено парез окорухового нерва. Слід відмітити, що парез окорухового нерва у 31 хворого (72,09 %; N = 43) був представлений синдромом Вебера. Інших альтернуючих синдромів діагностовано не було.
Рефлекторна сфера складалася з рефлексів, що замикались на рівні стовбура головного мозку та спинного мозку.
Зорові моторні рефлекси у випадках без ушкодження окорухового нерва були збережені, хоча і мали різну вираженість. Зареєстровано співдружні швидкі та повільні рухи очних яблук (при парезах ІІІ пари черепно-мозкових нервів, рухи на неураженій стороні також були збережені), однак у жодному з випадків спостереження об’єктивні підстави стверджувати, що мала місце реакція слідкування за предметами та зоровими подразниками, відсутні.
Оковестибулярний рефлекс діагностувався у 114 пацієнтів (в іншої частини були виставлені протипоказання через характер пошкодження: в анамнезі — лікворея, отогематорея тощо) і в основному мав різко затухаючий або відсутній «швидкий» компонент та виражений «повільний» компонент, що нагадував тонічну реакцію повороту очей в сторону подразника, яка утримувалася декілька секунд.
Реакція зіниць на світло відновилася лише у 70 % (n = 154; N = 220) хворих, які вийшли в дану стадію травматичної хвороби після тривалої коми. У решти пацієнтів, в анамнезі яких відмічали тяжкі окорухові порушення, ознаки вклинення стовбурових структур, спостерігалася одно/двобічна офтальмоплегія або діагностувалася одно/двобічна вторинна атрофія, реакція на світло була млява чи ледь помітна або взагалі відсутня. Так само у цих хворих зберігалася анізокорія.
Відносно збереженими виявилися рефлекси відкривання та закривання рота, мімічні рефлекси і рефлекси з м’язів язика. У 19,54 % хворих (n = 43; N = 220) спостерігався тризм, відкривання рота було короткочасним з виділенням слини. Жувальні рухи виникали спонтанно і мали характер автоматизму, часто поєднувалися зі скреготом зубів через високий тонус жувальних м’язів.
Окремими частими оральними автоматизмами, навіть на нетипові подразники, був прояв хоботкового рефлексу та рефлекс Марінеску — Радовичі, на висоті яких посилювалося тривале тонічне змикання нижньої щелепи.
Порушення координації ковтання та власне ковтального рефлексу виявлено в усіх без винятку випадках. Причому акт ковтання порушував/перебивав патологічний (несвоєчасний) акт жування, який був неефективний і не призводив до подрібнення значної частини введеної порції рідкої їжі/води, а скоріше нагадував автоматизм. Зауважимо, характер їжі значення не мав — пацієнт починав жувати воду чи велику кількість слини, яка скопилася в роті. Дисоціація рухових актів язика, глотки, мімічної мускулатури призводила до того, що харчовий комок/порція слини, рідини спонтанно затікала в гортань, глотку, а інша просто витікала з рота, через що деякі хворі починали кашляти, іноді виникав блювотний рефлекс. Така ситуація доповнювалась пригніченим кашльовим рефлексом, що спричинювало часто аспірацію і потребу негайної санації. Слід зазначити, що порушений кашльовий рефлекс також мав місце в усіх хворих основної групи дослідження, у 14 % (n = 31; N = 220) випадків був взагалі відсутній, а в 11 хворих так і не відновився.
Блювотний рефлекс викликався в усіх хворих, однак у 58,63 % (n = 129; N = 220) випадків мав значне порушення координації з актом дихання, закриванням голосової щілини та підніманням м’якого піднебіння, що призводило до попадання блювотних мас в трахею чи ніс.
Мигальний рефлекс так само реєструвався в усіх пацієнтів. Крім того, спонтанне мигання було характерним для пацієнтів у стані бадьорості. Ознак коркового контролю частого мигання у відповідь на рух руками перед очима у пацієнта не підтверджено.
Розладів вісцеральних стовбурових рефлексів (серцевого, дихального) не виявлено у жодного хворого.
Сухожилкові рефлекси були значно підвищені та дисоційовані по осі тіла, рефлексогенні зони даних рефлексів розширені, що свідчило про повне збереження сегментарного спінального рівня та втрату різною мірою коркового контролю над їх реалізацією. Гіперрефлексія часто поєднувалася з клонусами стоп і кистей.
Вищеописані зміни спінальних рефлексів доповнювалися патологічними рефлексами Бабінського, Россолімо, Бехтерева, які у 87,27 % (n = 192; N = 220) були двосторонніми.
У жодного хворого не вдалося виявити черевні рефлекси.
Серед інших примітивних рефлексів у 35 % (n = 77; N = 220) пацієнтів зафіксовано хватальний рефлекс і варіанти рефлексу Моро. Так, пацієнти могли хвилинами триматися за якісь предмети чи за руку лікаря, якщо проводили пробу з підтягуванням.
Кореляційного зв’язку між змінами в рефлекторній сфері та тривалістю перебування в даній стадії посткоматозного порушення свідомості, а тим більше виходом на вищі рівні відновленої свідомості не встановлено.
Активних рухів у жодного пацієнта в вегетативному статусі не відмічено, незважаючи навіть на больові подразники. Тетрапарез, що був в структурі центрального коркового синдрому, мав місце у 100 % випадків (N = 220), лише з тією відмінністю, що у 81,36 % (n = 179; N = 220) хворих виявити ознаки латералізації в цій стадії посттравматичного розладу свідомості об’єктивно клінічно не вдавалося, а у решти — 18,64 % (n = 41; N = 220) можна було припустити домінування сторони ураження за гемітипом.
Слід відмітити, що у 12 (5,45 %; N = 220) хворих об’єм пасивних рухів у нижніх кінцівках у ділянках кульшових суглобів був обмежений через виявлені ускладнення тривалого імобілізаційного синдрому — гетеротопічні осифікати. Ці осифікати зберігалися в даних пацієнтів протягом усього періоду спостереження, оскільки були незрілими і, за даними інструментальних методів дослідження, добре кровопостачалися. Жоден пацієнт, у якого вони були діагностовані, не досяг рівня ясної свідомості. Більше того, з 24 випадків перманентного ВС 8 мали гетеротопічні осифікати кульшових суглобів, 2 — колінних. У 4 із них — двосторонньої локалізації.
М’язовий тонус у всіх групах м’язів різко підвищений і неспецифічно наростав при різних подразниках. Характер змін тонусу базово визначався як центральний пірамідний, хоча і мав ознаки змін за екстрапірамідним типом, особливо у пацієнтів, які знаходилися у ВС більше 3 місяців. Жодного випадку м’язової гіпотонії в цій стадії травматичної хвороби у досліджуваних хворих не діагностовано. Загалом у досліджуваних хворих виявляли декортикаційну і децеребраційну ригідність, які протягом навіть доби могли змінювати одна одну. Проте слід зазначити, що у пацієнтів, у яких діагностували перманентний ВС, частота реєстрації децеребраційного м’язового тонусу різко наростала і лише в подальшому доповнювалася явищами м’язової гіпотонії.
Реципрокні м’язові взаємодії порушені. Вертикальний і горизонтальний позний тонус (формування пози чи познотонічні реакції) дискоординований.
Рівень м’язової ригідності — спастики за шкалою Ашворт щоденно коливався, однак у 83,18 % (n = 183; N = 220) протягом усього перебування в ВС становив 4 бали і у 16,82 % — 3 бали за шкалою Ашворт відповідно.
Даний рівень м’язової спастики формував і типовий об’єм пасивних рухів у великих і дрібних суглобах.
Розлади простої та складної, поверхневої та глибокої чутливості мали грубий центральний характер і переважно проявлялися лише незначними руховими актами: відсмикування кінцівки, загального надмірного здригання (стартл-рефлекс), вісцеральними рефлексами (наростання частоти серцевих скорочень, частоти дихання) та вегетативними реакціями (гіпергідроз, підвищення температури тіла, тиску) у відповідь на тривалі або інтенсивні раптові подразники, переважно больові, без жодних ознак локалізації чи захисту. У деяких хворих (9,54 %; n = 21; N = 220) можна було помітити типову стереотипну зміну міміки у вигляді «гримаси болю», залипання мигання чи, навпаки, його почастішання, що доповнювалися ледь чутним стоном.
Оцінка больової реакції за модифікованою шкалою болю ВРІТ становила в усіх хворих у ВС інтервал 3–5 балів (макс. значення — 10 балів).
У психоемоційному статусі у 74,09 % (n = 163; N = 220) пацієнтів виявляли повну амімію, навіть на больові подразники. Лише решта пацієнтів (25,91 %) проявляли лімбічні емоційні реакції на повороти в ліжку, перестилання, переодягання, що за своїм вираженням були варіантами «гримаси болю». Жодних психоемоційних реакцій диференціації «свій — чужий» зареєстровано не було. Так само не зареєстровано жодної поведінкової реакції.
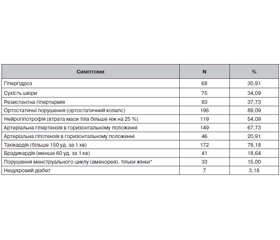
Центральні вегетативні та нейроендокринні порушення (з ознаки ураження гіпоталамуса) діагностовані у 100 % хворих, мали найбільшу варіабельність за симптомами і їх поєднанням і проявлялися в основному судинно-рефлекторними, обмінно-метаболічними (ендокринними) і трофічними реакціями. Найчастіші симптоми вказаних порушень подані в табл. 2.
Розлади функції тазових органів виявлені у кожного хворого основної групи дослідження і мали центральний корковий генез, що клінічно проявлялося нетриманням сечі, калу. Симптоматика тазових розладів була найбільш резистентною до лікування і у більшості пацієнтів зберігалася навіть на стадії перехідних синдромів відновлення свідомості.
Ознаки порушення в периферичній нервовій системі починали проявлятися у хворих у персистуючому вегетативному статусі (ближче до 9-го місяця після тяжкої ЧМТ) чи перманентному вегетативному статусі (n = 24; N = 220), мали характер вторинних змін та ускладнень травматичної хвороби і клінічно проявлялися полірадікулоневропатіями з вираженими гіпотрофіями м’язів, зниженням сухожилкових рефлексів, зниженням раніше високого м’язового тонусу на фоні наростання явищ поліорганної недостатності.
Клінічний результат організації травматичної хвороби в стадію ВС мав оцінку за шкалою наслідків Глазго в 2 бали.
Обговорення
Таким чином, отримані результати неврологічних розладів чутливості, вегетативних порушень, нейроендокринних розладів, порушення функції тазових органів, які були діагностовані у пацієнтів у стадії ВС, мігрували і в стадію акінетичного мутизму. Їхнє індивідуальне вираження вкладалося в загальні клінічні закономірності неврологічної картини, властивої для обох цих стадій посткоматозного відновлення свідомості. Ознак ураження периферичного нейромоторного апарату у пацієнтів, які перейшли з вегетативного статусу в стадію акінетичного мутизму, впродовж усієї її тривалості виявлено не було. Індекс повсякденної активності Бартел становив 0 балів.
Висновки
1. Кореляційного зв’язку між змінами в неврологічному статусі, особливо у рефлекторній, руховій, чутливій сферах, та тривалістю перебування в даній стадії посткоматозного порушення свідомості, а тим більше виходом на вищі рівні відновленої свідомості не встановлено.
2. Специфічна неврологічна вогнищева симптоматика відсутня, а клініко-неврологічна картина характеризувалася виключно топіко-функціональними особливостями первинно уражених структур головного мозку на сегментарному та надсегментарному рівнях.
3. Єдиними факторами, з якими виявлено стійкий прямолінійний кореляційний зв’язок прогнозу виходу з ВС на вищі рівні посткоматозної свідомості, були варіант клінічної форми тяжкої ЧМТ і глибина коми, що передувала ВС. Саме хворі з комою ІІІ, спричиненою ДАП в результаті ДТП, так і не вийшли з ВС в межах року після тяжкої ЧМТ. Майже кожний третій пацієнт відновився лише до стану мінімальної свідомості, в якій залишався надалі.
4. Відмінна неврологічна картина, яка по осьовим ознакам виявлялася в динаміці відновлення свідомості, свідчила лише за початок нового етапу/стадії відновлення та викривала активні зони інтересу/цілі для можливого/необхідного лікувального (реабілітаційного) впливу з метою покращення загального стану пацієнта, якості його життя і через поки невідомі механізми (можливо, активізований чи доповнений саногенез) сприяння швидшому переходу до максимально вищого рівня свідомості.
Список литературы
1. PET scanning and neuronallossin acute vegetative state / Laureys S., Faymonville M.E., Moonen G. et. al. // Lancet. — 2000. — Vol. 355. — P. 1825-1826.
2. Classification of traumatic brain injury for targeted therapies / Saatman K., Duhaime A., Bullock R. еt al. // J. Neurotrauma. — 2008. — 25. — Р. 719-738.
3. Coma and cerebral imaging / W.F. Haupt, H.C. Hansen, R.W. Janzen, R. Firsching, N. Galldiks // Springerplus. — 2015. — Vol. 16, № 4. — P. 180-185.
4. Mechanism-based MRI classification of traumatic brain stem injury and its relationship to outcome / Mannion R., Cross J., Bradley P. et al. // J. Neurotrauma. — 2007. — Vol. 24. — P. 128-135.
5. Shulman R.G. Insights from neuroenergetics into the interpretation of functional neuro-imaging: an alternative empirical model for studying the brain's support of behavior / R.G. Shulman, F. Hyder, D.L. Rothman // J. Cereb. Blood Flow Metab. — 2014. — Vol. 34, № 11. — P. 1721-1735.
6. Tononi G. Consciousness: here, there and every where? / G. Tononi, C. Koch // Philos. Trans. R. Soc. Lond. B Biol. Sci. — 2015. — Vol. 19. — P. 1668-1671.
7. Максакова О.М. Командная работа как путь к возвращению сознания / О.А. Максакова // Вопросы нейрохирургии. — 2014. — Т. 78, № 1. — C. 57-69.
8. Schlaug G. Musicians and music making as a model for the study of brain plasticity / G. Schlaug // Prog. Brain Res. — 2015. — Vol. 217. — P. 37-55.
9. Пуцилло М.В., Винокуров А.Г., Белов А.І. Нейрохірургічна анатомія / Під ред. акад. А.Н. Коновалова. — М., 2007.
10. Зайцев О.С., Царенко С.В. Нейрореаниматология. Выходы из комы (терапия посткоматозных состояний). — М.: Литасс, 2012. — С. 24-25.
11. Laureys S., Berré J., Goldman S. Cerebral function in coma, vegetative state, minimally conscious state, locked-insyndrome and brain-death / Vincent J.L. // 2001 Year book of Intensive Care and Emergency Medicine. — Berlin: Springer-Verlag, 2001. — Р. 386-396.
12. Педаченко Е.Г., Шлапак, И.П., Гук А.П., Пилипенко М.Н. Черепно-мозговая травма: современные принципы неотложной помощи: Уч.-метод. пособие. — К.: ЗАО «Випол», 2009. — 216 с.
13. Canavero S., Massa-Micon B., Cauda F., Montanaro E. Bifocal extradural cortical stimulation-induced recovery of consciousness in the permanent post-traumatic vegetative state // J. Neurol. — 256(5). — Р. 834-6. PMID 19252808.
14. Sharova E.V., Zaitsev O.S., Korobkova E.V., Zakharova N.E., Pogosbekian E.L., Chelyapina M.V., Fadeeva L.M., Potapov A.A. Analysis of behavioral and EEG correlatives of attention in the dynamics of recovery of consciousness following severe brain injury // Neurology, Neuropsychiatry, Psychosomatics. — 2016. — 8(3). — Р. 17-25.
15. Парфенов В.А. Спастичность // Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / Под ред. О.Р. Орловой, Н.Н. Яхно. — М.: Каталог, 2001 — С. 108-123.
16. Gélinas C. Nurses’ Evaluations of the Feasibility and the Clinical Utility of the Critical-Care Pain Observation Tool // Pain Management Nursing. — 2010. — 11(2). — Р. 115-125.
17. Gélinas C., Arbour C. Behavioral and physiological indicators during a nociceptive procedure in conscious and unconscious mechanically ventilated adults: Similar or different? // Journal of Critical Care. — 2009. — 24. — 628. — Р. e7-e17.
18. Gélinas C., Fillion L., Puntillo K.A. Item selection and Content validity of the Critical-Care Pain. — 2009.
19. Sherrington C., Lord S.R. Reliability of simple portable tests of physical performance in older people after hip fracture // Clin. Rehabil. — 2005. — 19. — Р. 496-504.
20. Крылов В.В., Пирадов М.А., Белкин А.А. и др. Шкалы оценки тяжести нарушений функций центральной нервной системы // Интенсивная терапия: Национальное руководство в 2 т. / Под ред. Б.Р. Гельфанда, А.И. Салтанова. — М.: ГЭОТАР-Медиа, 2011. — Т. 1. — С. 325-960.
21. Педаченко Е.Г., Гук А.П. Оценка качества жизни больных после черепно-мозговой травмы: современные подходы (укр.) // Український нейрохірургічний журнал. — 2007. — № 4. — С. 40-42.
22. Потапов О.О. Особливості процесу гемокоагуляції у хворих з черепно-мозковою травмою // Український нейрохірургічний журнал. — 2000. — № 1(9).
23. Jennett B., Bond M. Assessment of outcome after severe brain damage // Lancet. — 1975. — Vol. 1. — P. 480-484. PMID 46957.
24. Wright J. Glasgow Outcome Scale — Extended // Encyclopedia of Clinical Neuropsychology / Kreutzer J.S., DeLuca J., Caplan B. — New York, Dordrecht, Heidelberg, London: Springer Science + Business Media, 2011. — DOI: 10.1007/978-0-387-79948-3.

/105.jpg)
/107.jpg)