Архив офтальмологии Украины Том 6, №3, 2018
Вернуться к номеру
Роль герпесвірусів і вірусу папіломи людини у виникненні птеригіуму
Авторы: Риков С.О., Усенко К.О., Могілевський С.Ю., Зябліцев С.В.
Національна медична академія післядипломної освіти імені П.Л. Шупика МОЗ України, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Справочник специалиста
Версия для печати
На сьогодні лікування птеригіуму залишається однією із невирішених проблем сучасної офтальмології, так само як і його рецидивування після хірургічного лікування. Основним способом лікування птеригіуму залишається хірургічний, а основним післяопераційним ускладненням — рецидив, відсоток якого залишається досить високим незалежно від вибору методу хірургічного лікування. Загальновідомі етіологічні фактори його виникнення, зокрема вплив ультрафіолетового випромінювання, давно відомі географічні райони ендемічного поширення, але останнім часом науковці почали вивчати проблему виникнення й рецидивування птеригіуму більш детально. Усім відомо про дослідження взаємозв’язку птеригіуму з генними мутаціями. Крім того, у виникненні птеригіуму велике значення надається герпесвірусам і вірусам папіломи людини. Однак їх роль до кінця не з’ясована, дані щодо їх поширеності в різних етнічних популяціях хворих відрізняються. У роботі вперше наведені дані про зв’язок наявності у пацієнтів вірусу простого герпесу, цитомегаловірусу, вірусу Епштейна — Барр і вірусу папіломи людини з виникненням і рецидивуванням птеригіуму у хворих з української популяції (м. Київ). Виявлення цих вірусів у операційному матеріалі пацієнтів досліджуваної групи переконливо вказувало на важливу роль вірусів у етіології й патогенезі птеригіуму.
На сегодняшний день лечение птеригиума остается одной из нерешенных проблем современной офтальмологии, так же как и его рецидивирование после хирургического лечения. Основным способом лечения птеригиума является хирургический, а основным послеоперационным осложнением — рецидив, процент которого остается достаточно высоким независимо от способа хирургического лечения. Общеизвестны этиологические факторы его возникновения, в частности влияние ультрафиолетового излучения, географические районы эндемического распространения давно известны, но в последнее время ученые начали изучать проблему возникновения и рецидивирования птеригиума более детально. Всем известно об исследовании взаимосвязи птеригиума с генными мутациями. Кроме того, в возникновении птеригиума большое значение придается герпесвирусам и вирусам папилломы человека. Однако их роль до конца не выяснена, данные по их распространенности в различных этнических популяциях больных различаются. В работе впервые приведены данные о связи наличия у пациентов вируса простого герпеса, цитомегаловируса, вируса Эпштейна — Барр и вируса папилломы человека с возникновением и рецидивированием птеригиума у больных украинской популяции (г. Киев). Выявление этих вирусов в операционном материале пациентов исследуемой группы убедительно указывало на важную роль вирусов в этиологии и патогенезе птеригиума.
Background. Nowadays, the treatment of pterygium remains one of the unresolved problems of modern ophthalmology, as well as its recurrence after the surgical treatment. The main method of pterygium treatment is surgical, and the main postoperative complication is a relapse, the percentage of which remains rather high regardless of the method of surgical treatment. Etiological factors of its occurrence, in particular ultraviolet, are well known, as well as geographical areas of endemic spread, but recently, scientists have begun more detailed study of the problem of pterygium occurrence and recurrence. It’s already known about the study of the relationship of pterygium with gene mutations. In addition, herpes viruses and human papillomavirus (HPV) have great significance in the onset of pterygium. However, their role is not fully understood, data on their prevalence in various ethnic populations of patients are different. The purpose of the study was to investigate the role of herpesviruses: herpes simplex virus (HSV), cytomegalovirus (CMV), Epstein-Barr virus (EVB) and HPV in the onset of pterygium in patients from the Ukrainian population (Kyiv). Materials and methods. A total of 203 patients (232 eyes) with pterygium and 25 patients with conjunctivitis (control group) were examined. The verification of viruses was carried out by the real time polymerase chain reaction using DNA-technology reagents (Russia). The amplification was carried out in the automatic amplifier DT-lite (DNA-technology, Russia). Results. Viral infection in the pterygium tissue was detected in 50.9 % of cases, including herpesviruses — 33.6 % and HPV — 34.0 %. Among herpesviruses, HSV was found in 15.1 % of cases, CMV — 7.3 % and EBV — 11.2 %. Among HPV, types 6 (34.2 %), 11 (24.1 %), 16 (21.5 %) and 18 (20.2 %) were detected. Types 6 and 11 were predominantly found at the early stages and were not detected at stage IV, while types 16 and 18, on the contrary, were not detected at stage I and peaked at stage IV (p = 7.95E-4). In 32.1 % of patients, a double mixed infection was detected. The most frequent combination was the presence of HSV and HPV (30.6 % of all mixed infections). Three viruses were detected in 3 cases (2.5 %) in the following combinations: HSV + CMV + HPV (2) and HSV + EBV + HPV (1). Conclusions. Thus, viruses were detected in half of the eyes with pterygium, and in half of such cases, herpes viruses were detected (most often — HSV), and in the second half — HPV. These data convincingly pointed to the important role of viruses in the etiology and pathogenesis of pterygium.
птеригіум; вірус простого герпесу; цитомегаловірус; вірус Епштейна — Барр; вірус папіломи людини
птеригиум; вирус простого герпеса; цитомегаловирус; вирус Эпштейна — Барр; вирус папилломы человека
pterygium; herpes simplex virus; cytomegalovirus; Epstein-Barr virus; human papillomavirus
Вступ
Птеригіум — доброякісне фіброваскулярне новоутворення, що характеризується наростанням кон’юнктивальної тканини на рогівку в напрямку від лімба до її центру за рахунок гіперпроліферації лімбальних клітин, яка супроводжується неоваскуляризацією, і має форму трикутника з основою, зверненою до лімбу, частіше з носової сторони, рідше з темпоральної, іноді має поширений характер. Наше останнє дослідження показало, що окрім загальновідомих факторів, які впливають на етіологію виникнення птеригіуму, таких як вплив ультрафіолетового випромінювання, є ще маловивчені, але не менш важливі, наприклад мутації гена BRAF [16]. Основним способом лікування птеригіуму залишається хірургічний, а основним післяопераційним ускладненням — його рецидив. Зазвичай використовують дві методики хірургічного лікування птеригіуму: Арльта — з повним його висіченням і Мак-Рейнольдса — з його заворотом.
Нами раніше сповіщалося про відсоток післяопераційних рецидивів птеригіуму залежно від методу хірургічного лікування [15].
Роль ультрафіолетового випромінювання як тригера розвитку птеригіуму не викликає сумнівів [1–3], але на сучасному етапі з’ясовано, що кофакторами розвитку хвороби можуть бути різноманітні чинники зовнішнього й внутрішнього середовища, віруси, спадковість, етнічна приналежність та інші [4]. Останніми роками з’являються дослідження, що свідчать про етіологічну роль папіломавірусів, які виконують роль тригера в запуску механізмів надмірної клітинної проліферації [5, 6]. М. Gallagher зі співавт. ще у 2001 році виявили наявність вірусу папіломи людини (ВПЛ) у 90 % зразків пацієнтів із папіломами кон’юнктиви та 50 % хворих на птеригіум, при цьому вірус не був виявлений жодного разу в контрольній групі пацієнтів [5]. За даними [7], інфекція ВПЛ 16/18 була виявлена у 24 % випадків у тканині птеригіуму (31/129), але не в нормальній кон’юнктиві, а онкопротеїн HPV16/18 E6 був визначений у 48,3 % ДНК-позитивних випадків (15/31).
Окрім ВПЛ, асоціацію птеригіуму визначали також і з іншими онкогенними вірусами, у тому числі: простим герпесом (ВПГ), вірусом Епштейна — Барр (ВЕБ), цитомегаловірусом (ЦМВ), адже дані щодо поширеності вірусного інфікування у хворих також різняться [8]. Ретроспективний аналіз, який провели автори, показав, що при дослідженні пацієнтів із Греції ВПГ був виявлений у 22–45 % випадків, а ЦМВ — у 40 % пацієнтів із птеригіумом [8]. В. Otlu зі співавт. (2009) на підставі обстеження турецьких хворих зробили висновок, що не тільки ВПЛ, але й ВЕБ може брати участь в етіопатогенезі птеригіуму [9].
Тож питання про роль вірусів у етіології птеригіуму залишається відкритим, а чисельні дані щодо асоціації вірусів герпесу й папіломи дають підстави для суперечливих висновків. Вочевидь необхідні подальші дослідження в цьому напрямку, оскільки отримання позитивних результатів дозволить проводити пошук нових ефективних методів лікування з урахуванням вірусного етіопатогенезу.
Мета дослідження — вивчити роль герпесвірусів (ВПГ, ЦМВ, ВЕБ) і ВПЛ у виникненні птеригіуму у хворих з української популяції (м. Київ).
Матеріали та методи
Дослідження проведено у відділенні Київської міської клінічної лікарні «Центр мікрохірургії ока» на базі кафедри офтальмології Національної медичної академії післядипломної освіти імені П.Л. Шупика. Усього обстежені 203 пацієнти (232 ока) з птеригіумом. Чоловіків було 108, жінок — 95. Вік пацієнтів становив 35–65 років. Середня давність захворювання — 2,5–2,7 року. Як контрольну групу залучено 25 хворих із кон’юнктивітом.
Стадію птеригіуму перед операцією визначали згідно з класифікацією A.L. Anduze [4]: I стадія — початкова, коли наростання спостерігається тільки в ділянці лімбу, зазвичай без змін у гостроті зору й рефракції; II стадія — головка птеригіуму знаходиться на середині відстані між лімбом і проекцією краю помірно розширеної зіниці; характерна поява неправильного астигматизму рогівки в зоні безпосередньо перед головкою птеригіуму, а в оптичній зоні визначається правильний астигматизм незначного ступеня; гострота зору — 0,9–0,7; III стадія — головка птеригіуму знаходиться на рогівці біля краю проекції звичайного діаметра зіниці, астигматизм унаслідок потовщення горизонтального меридіану рогівки досягає 13 діоптрій, гострота зору може знижуватись до 0,5; IV стадія — головка птеригіуму досягає центра рогівки (проекції центру зіниці), переважає значно виражений неправильний або правильний астигматизм (2,5–7,5 діоптрії), гострота зору може бути знижена до 0,3–0,2; V стадія — головка птеригіуму заходить за центр рогівки й може поширюватись далі, рефракцію визначити неможливо, гострота зору нижче від 0,1.
Відповідно до цієї класифікації I стадія була встановлена на 32 очах (14 %), IІ стадія — на 88 очах (38 %), IІІ стадія — на 91 оці (39 %), IV стадія — на 21 оці (9 %), V стадії не було встановлено в жодному випадку.
Фрагменти тканини птеригіуму, що були видалені під час операції, збирали в контейнери з фізіологічним розчином, маркували і до процедури виділення ДНК заморожували при температурі –70 оС. У день проведення аналізу проби гомогенізували в 0,5 мл фізіологічного розчину у фарфоровій ступці. Надалі вірусну ДНК виділяли за допомогою набору реактивів «Проба-ГС» (ТОВ «ДНК-технологія», РФ). Методом полімеразної ланцюговій реакції в реальному часі визначали наявність ВПГ, ЦМВ, ВЕБ, ВПЛ (типи 6, 11, 16 і 18). Виявлення в матеріалі ДНК вірусів проводили з використанням наборів реактивів виробництва ТОВ «ДНК-технологія» (РФ). Ампліфікацію пробірок з реакційною сумішшю проводили в ампліфікаторі «ДТ-lite» (ТОВ «ДНК-технологія», РФ) з використанням програм ампліфікації, рекомендованих виробником, комплекту реагентів у реальному часі.
Для статистичного аналізу результатів дослідження використовували пакет MedStat і MedCalc v. 15.1 (MedCalc Software bvba).
Результати та обговорення
У контрольній групі (25 хворих, які проходили обстеження й лікування в клініці з приводу кон’юнктивіту) герпесвіруси й ВПЛ не були виявлені в жодному випадку. Поширеність вірусів у хворих на птеригіум відображено на рис. 1.
З 232 випадків інфекція в тканині птеригіуму виявлена загалом у 118 випадках (50,9 %), у тому числі герпесвіруси — у 78 (33,6 %) і ВПЛ — у 79 (34,0 %) випадках. Серед герпесвірусів ВПГ був виявлений у 35 випадках (15,1 %), ЦМВ — у 17 (7,3 %) і ВЕБ — у 26 (11,2 %). Отже, можна заключити, що віруси було виявлено в половини очей із птеригіумом, причому в половині випадків виявлялися герпесвіруси (найчастіше ВПГ), а у другій половині — ВПЛ.
Поширеність вірусів у хворих на птеригіум за стадіями наведена в табл. 1.
Аналіз структури поширеності вірусів за стадіями птеригіуму показав, що частота герпесвірусів загалом мала тенденцію до збільшення відповідно до стадії патологічного процесу, але статистичний аналіз показав, що ці зсуви не мали статистичної значущості (р = 0,437).
Велику частоту виявлення в тканині птеригіуму ВПЛ спостерігали й інші автори [7–9]. У нашому дослідженні ВПЛ був виявлений у 34,0 % випадків. При цьому частота за групами суттєво не відрізнялася, варіюючи від 28,6 % у хворих IV групи до 43,7 % у хворих І групи.
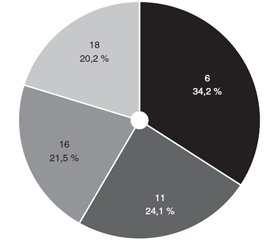
У даному дослідженні були виявлені 6, 11, 16 і 18-й типи ВПЛ (рис. 2) у 34,2 % (27 хворих), 24,1 % (19 хворих), 21,5 % (17 хворих) і 20,2 % (16 хворих) відповідно. Отже, найчастіше виявлявся 6-й тип, решта інших типів мали приблизно рівний розподіл.
Статистичний аналіз структури типів ВПЛ за стадіями наведений у табл. 3.
Типи 6 і 11 переважно виявлялися при перших стадіях і не виявлялися при IV стадії, тоді як типи 16 і 18, навпаки, не виявлялися при І стадії і сягали максимуму при IV стадії (по 50,0 %). Висока вірогідність таких зсувів (р = 7,95Е–4) давала змогу висловити припущення, що типи ВПЛ асоційовані зі стадіями птеригіуму.
У даному досліджені віруси були виявлені в тканині птеригіуму 112 хворих (118 очей). Серед них у 36 хворих (32,1 %) була виявлена подвійна мікст-інфекція. Частота вірусних поєднань наведена в табл. 2.
Найчастішим поєднанням була наявність ВПГ і ВПЛ (30,6 % від усіх випадків мікст-інфекції). У даному дослідженні у 24 хворих (11,8 %) птеригіум був двобічним. При обстеженні на наявність вірусів було визначено, що двобічне пошкодження одним й тим самим вірусом визначалося в 6 хворих (25,0 %), тоді як у 18 хворих (75,0 %) вірусне пошкодження було однобічним. У всіх випадках двобічного пошкодження був виявлений ВПГ.
М. Piecyk-Sidor зі співавт. (2009) у своєму дослідженні визначали імовірний зв’язок між розвитком птеригіуму й папіломавірусною інфекцією [10]: наявність ВПЛ не є обов’язковим етіологічним чинником даного захворювання, але є одним із вірогідних факторів, що збільшують ризик розвитку патології. ДНК вірусу була виявлена у 27,6 % випадків, тоді як у контрольній групі без зміни кон’юнктиви — у 9,7 % [10]. Типи вірусу папіломи різняться за їх потенціальними властивостями ініціації неопластичних процесів: низький онкогенний ризик мають типи 6, 11, 42, 43, 44, а високий — 16, 18, 31, 45, 56. ВПЛ високого онкогенного ризику був виявлений у 56 % випадків, а низького онкогенного ризику — у 37,5 % [10]. Тож, зважаючи на мультифакторну природу птеригіуму, можна вважати, що ВПЛ має суттєве значення як фактор ризику розвитку захворювання. Наші дослідження цілком підтвердили таку думку. Більше того, нами показана можлива асоціація ВПЛ високого онкогенного ризику з найбільш тяжкими стадіями птеригіуму.
В огляді N. Di Girolamo (2012) за даними пошукової системи PubMed знайдено 34 дослідження, присвячених ВПЛ і птеригіуму [11]. Загалом показник поширеності вірусу становив 18,6 % (136/731). Найчастіше були виявлені типи 6, 11, 16 і 18. Ці дані також цілком узгоджуються з отриманими нами результатами.
За даними гістологічних досліджень, птеригіум характеризується не тільки проліферативними, але й дегенеративними змінами [11]. У 2000 році E.T. Detorakis зі співавт. запропонували щодо етіології птеригіуму теорію подвійного удару: перший удар — мутагенна дія ультрафіолетового випромінювання, другий удар вже постраждалим від зовнішнього фактора клітинам завдає вірусна інфекція [12].
Білок р53 необхідний для зупинки клітинного циклу, репарації ДНК і запуску процесу апоптозу, результати дослідження даного білка при розвитку птеригіуму суперечливі [7, 13, 14]. Відомо, що ВПЛ 16, що має високий онкогенний ризик, через убіквітин-протеоліз викликає деградацію білка р53, тож даний механізм може пояснювати проліферативну активність клітин лімбу внаслідок дії цього вірусу.
Щодо герпесвірусів, то, враховуючи отримані результати, необхідно шукати механізми їх можливого впливу на виникнення й розвиток птеригіуму, адже вони зустрічалися з такою ж частотою, як і ВПЛ (33,6 і 34,0 %).
Висновки
1. Вірусна інфекція у тканині птеригіуму виявлена в 50,9 % випадків, у тому числі герпесвіруси — у 33,6 % і ВПЛ — у 34,0 % випадків. Серед герпесвірусів ВПГ був виявлений у 15,1 %, ЦМВ — у 7,3 % і ВЕБ — у 11,2 %.
2. Серед ВПЛ були виявлені типи 6 (34,2 %), 11 (24,1%), 16 (21,5 %) і 18 (20,2 %). Типи 6 і 11 переважно виявлялися при перших стадіях і не виявлялися при IV стадії, тоді як типи 16 і 18, навпаки, не виявлялися при І стадії й сягали максимуму при IV стадії (р = 7,95Е–4).
3. У 32,1 % хворих була виявлена подвійна мікст-інфекція. Найчастішим поєднанням була наявність ВПГ та ВПЛ (30,6 % від всіх випадків мікст-інфекції). Три віруси було виявлено в 3 випадках (2,5 %) у таких поєднаннях: ВПГ + ЦМВ + ВПЛ (2) і ВПГ + ВЕБ + ВПЛ (1).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Сердюк В.Н. Птеригиум. Этиология, патогенез, лечение. Современный взгляд / В.Н. Сердюк, Л.Ю. Пилипенко // Офтальмология. Восточная Европа. — 2015. — № 4(27). — С. 92-99.
2. Мальцев Е.В. Моделювання птерігіуму / Е.В. Мальцев, В.Я. Усов, Н.Ю. Крицун // Офтальмологический журнал. — 2013. — № 2(451). — С. 79-82.
3. Geographical prevalence and risk factors for pterygium: a systematic review and meta-analysis / L. Liu, J. Wu, J. Geng [et al.] // BMJ Open. — 2013. — Vol. 3 (11). — e003787.
4. Маложен С.А. Птеригиум: этиология, патогенез, лечение / С.А. Маложен, С.В. Труфанов, Д.А. Крахмалева // Вестник офтальмологии. — 2017. — № 133 (5). — C. 76-83.
5. Human papillomavirus in pterygium / M. Gallagher, A. Giannoudis, C. Herrington, P. Hiscott // Br. J. Ophthalmol. — 2001. — Vol. 85(7). — P. 782-784.
6. Occurrence of human papillomavirus in pterygia / M. Piecyk-Sidor, M. Polz-Dacewicz, Z. Zagórski, T. Zarnowski // Acta Ophthalmol. — 2009. — Vol. 87. — P. 890-895.
7. HPV infection and p53 inactivation in pterygium / Y.Y. Tsai, C.C. Chang, C.C. Chiang [et al.] // Mol. Vis. — 2009. — Vol. 15. — P. 1092-1097.
8. Chalkia A.K. Viral involvement in the pathogenesis and clinical features of ophthalmic pterygium (Review) / A.K. Chalkia, D.A. Spandidos, E.T. Detorakis // Int. J. Mol. Med. — 2013. — Vol. 32(3). — P. 539-543.
9. Investigation of human papillomavirus and Epstein-Barr virus DNAs in pterygium tissue / B. Otlu, S. Emre, P. Turkcuoglu [et al.] // Eur. J. Ophthalmol. — 2009. — Vol. 19. — P. 175-179.
10. Occurrence of human papillomavirus in pterygia / M. Piecyk-Sidor, M. Polz-Dacewicz, Z. Zagoorski, T. Zarnowski // Acta Ophthalmologica. — 2009. — Vol. 87. — P. 890-895.
11. Di Girolamo N. Association of human papilloma virus with pterygia and ocular-surface squamous neoplasia / N. Di Girolamo // Eye. — 2012. — Vol. 26. — P. 202-211.
12. Detorakis E.T. Molecular genetic alterations and viral presence in ophthalmic pterygium / E.T. Detorakis, E.E. Drakonaki, D.A. Spandidos // Int. J. Mol. Med. — 2000. — Vol. 6(1). — P. 35-41.
13. Non-invasive detection of HPV DNA in exfoliative samples from ophthalmic pterygium: a feasibility study / A.K. Chalkia, S. Derdas, G. Bontzos [et al.] // Graefes Arch. Clin. Exp. Ophthalmol. — 2018. — Vol. 256(1). — P. 193-198.
14. The expression and significance of p53 protein and Ki-67 protein in pterygium / V. Ljubojević, R. Gajanin, L. Amidžić, Z. Vujković // Vojnosanit Pregl. — 2016. — Vol. 73 (1). — P. 16-20.
15. Риков С.О. Рецидивування птеригіума після різноманітних методик хірургічного лікування: 1 рік спостереження / С.О. Риков, С.Ю. Могилевський, К.О. Усенко // Питання експериментальної та клінічної медицини. Донецький національний медичний університет ім. М. Горького. — 2014. — Вип. 18, № 3. — С. 98-102.
16. Усенко К.О. Модифікований метод хірургічного лікування птеригіума / К.О. Усенко // Архів офтальмології України. — Т. 6, № 2. — С. 50-57.

/44-1.jpg)
/45-1.jpg)
/45-2.jpg)
/46-1.jpg)