Журнал «Практическая онкология» Том 2, №1, 2019
Вернуться к номеру
Затримка циклів та редукція дози хіміотерапії знижують ефективність лікування хворих на рак яєчників
Авторы: Колеснік О.П., Каджоян А.В., Кабаков А.О., Кузьменко В.О.
Запорізький обласний онкологічний диспансер, м. Запоріжжя, Україна
Запорізький державний медичний університет, м. Запоріжжя, Україна
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
Щорічно у всьому світі діагностується 205 тис. нових випадків раку яєчників (РЯ) та 125 тис. смертей від даної патології. Стандартним підходом до лікування пацієнток з III–IV стадіями епітеліального РЯ є первинна циторедукція з подальшою ад’ювантною хіміотерапією або неоад’ювантна хіміотерапія з подальшою циторедукцією. Численні дослідження продемонстрували безпеку і добру переносимість комбінованої паліативної хіміотерапії (ПХТ) на основі препаратів платини у пацієнток з РЯ, однак у частини пацієнток токсичність, викликана використанням хіміопрепаратів, призводить до затримки циклів та редукції доз ПХТ. У метааналізі, який провели Olawaiye і співавт. (2018 р.), оцінено вплив модифікації дози ПХТ на результат лікування пацієнток з РЯ. У дослідженні в групі пацієнток без модифікації доз ПХТ медіана безрецидивної виживаності становила 17,5 місяця, в той час як у пацієнток з модифікаціями доз ПХТ даний показник становив 9,9 місяця (р = 0,001). У пацієнток без модифікації доз ПХТ спостерігалася статистично значуща перевага за показником загальної виживаності (ЗВ) (48,0 проти 28,7 місяця у пацієнток з модифікаціями доз ПХТ) (р = 0,021). В іншому дослідженні в пацієнток, у яких затримка циклів спостерігалася 1 раз, медіана ЗВ становила 2,5 року, у жінок з 2 та більше затримками циклів медіана ЗВ становила 1,7 року (p = 0,03), в той час як у жінок без затримки доз даний показник становив 4,0 року (p = 0,02). І затримка з проведенням циклів ПХТ, і редукція доз хіміопрепаратів є факторами, здатними знижувати ефективність хіміотерапії. Необхідно уникати вищевказаних явищ для забезпечення ефективності хіміотерапії раку яєчників.
Ежегодно во всем мире диагностируется 205 тыс. новых случаев рака яичников (РЯ) и 125 тыс. смертей от данной патологии. Стандартным подходом к лечению пациенток с III–IV стадиями эпителиального РЯ является первичная циторедукция с последующей адъювантной химиотерапией или неоадъювантная химиотерапия с последующей циторедукцией. Многочисленные исследования продемонстрировали безопасность и хорошую переносимость комбинированной паллиативной химиотерапии (ПХТ) на основе препаратов платины у пациенток с РЯ, однако у части пациенток токсичность, вызванная использованием химиопрепаратов, приводит к задержке циклов и редукции доз ПХТ. В метаанализе, который провели Olawaiye и соавт. (2018), оценено влияние модификации дозы ПХТ на результат лечения пациенток с РЯ. В исследовании в группе пациенток без модификации доз ПХТ медиана безрецидивной выживаемости составила 17,5 месяца, в то время как у пациенток с модификациями доз ПХТ данный показатель составлял 9,9 месяца (р = 0,001). У пациенток без модификации доз ПХТ наблюдалось статистически значимое преимущество по показателю общей выживаемости (ОВ) (48,0 против 28,7 месяца у пациенток с модификациями доз ПХТ) (р = 0,021). В другом исследовании у пациенток, у которых задержка циклов наблюдалась 1 раз, медиана ОВ составляла 2,5 года, у женщин с 2 и более задержками циклов медиана ОВ составила 1,7 года (p = 0,03), в то время как у женщин без задержки доз данный показатель составлял 4,0 года (p = 0,02). И задержка с проведением циклов ПХТ, и редукция доз химиопрепаратов являются факторами, способными снижать эффективность химиотерапии. Необходимо избегать вышеуказанных явлений для обеспечения эффективности химиотерапии рака яичников.
Every year, 205,000 new cases of ovarian cancer (OC) and 125,000 deaths from this pathology are diagnosed worldwide. The standard approach to treating patients with epithelial OC stages III–IV is primary cytoreduction with subsequent adjuvant chemotherapy or neoadjuvant chemotherapy followed by cytoreduction. Numerous studies have shown the safety and good tolerability of combined platinum-based palliative chemotherapy (PCT) in patients with OC, but in some patients, the toxicity caused by the use of chemotherapeutic agents results in delay in cycles and reduced PCT doses. In the meta-analysis conducted by Olawaiye et al. (2018), the effect of PCT dose modification on treatment outcomes in patients with OC was evaluated. In the study, in the group of patients without PCT dose modification, the median of disease-free survival was 17.5 months, whereas in patients with PCT dose modification, this indicator was 9.9 months (p = 0.001). Patients without PCT dose modification showed a statistically significant advantage in terms of the overall survival (OS) (48.0 versus 28.7 months in patients with PCT dose modification) (p = 0.021). In another study, in patients with one time delay in cycles, the median OS was 2.5 years, in women with 2 or more delays in cycles, median OS was 1.7 years (p = 0.03), while in women without dose delays, this indicator was 4.0 years (p = 0.02). The delay in PCT cycles, as well as the reduction of chemotherapy doses, are factors that can reduce the effectiveness of treatment, so the above phenomena must be avoided to ensure the effectiveness of chemotherapy for ovarian cancer.
рак яєчників; поліхіміотерапія; затримка циклів; редукція дози; ефективність лікування
рак яичников; полихимиотерапия; задержка циклов; редукция дозы; эффективность лечения
ovarian cancer; polychemotherapy; delay in cycles; dose reduction; the effectiveness of treatment
Щорічно у всьому світі діагностується 205 тис. нових випадків раку яєчників (РЯ) та 125 тис. смертей від даної патології. У зв’язку з цим РЯ є найнесприятливішим онкогінекологічним захворюванням [1]. У США в 2016 році було зареєстровано 22 280 нових випадків захворюваності та 14 240 (63,9 %) — смертності від РЯ відповідно [2]. В Україні, згідно з даними канцер–реєстру, в 2016 році виявлено 3392 нових випадки захворюваності та 1823 (53,7 %) випадки смерті від РЯ. Стандартним підходом до лікування пацієнток з III–IV стадіями епітеліального РЯ є первинна циторедукція з подальшою ад’ювантною хіміотерапією або неоад’ювантна хіміотерапія з подальшою циторедукцією [3].
В останні роки відзначається прогрес у лікуванні поширеного РЯ. Так, показники 5–річної загальної виживаності (ЗВ) у пацієнток з III–IV стадіями РЯ в 1977 році становили 37,0 %, а в 2006 році — 45,0 % відповідно. Це сталося за рахунок використання сучасних хіміопрепаратів, а саме карбоплатину та паклітакселу, що на сьогодні є стандартом лікування пацієнток з РЯ III–IV стадій [4]. Так само ЗВ покращилася за рахунок вдосконалення хірургічної техніки (проведення циторедуктивної операції) [5] і використання внутрішньочеревного шляху введення хіміопрепаратів [6–16]. Сучасні рекомендації з хіміотерапевтичного лікування РЯ вказують на необхідність проведення шести курсів хіміотерапії. Збільшення кількості циклів або дози хіміотерапії не призводить до покращення показників ЗВ і безрецидивної виживаності (БРВ) [21].
Численні дослідження продемонстрували безпеку та добру переносимість комбінованої паліативної хіміо–терапії (ПХТ) на основі препаратів платини у пацієнток з РЯ, однак у частини пацієнток токсичність, викликана використанням хіміопрепаратів, призводить до затримки циклів ПХТ [26–34].
Редукція доз і затримка проведення циклів хіміотерапії були вивчені в декількох клінічних дослідженнях [17–20].
У дослідженні Family і співавт. (2016 р.) вивчалося питання редукції дози і затримки проведення циклів ПХТ у пацієнтів із злоякісними новоутвореннями. У дослідження включено 3995 пацієнтів, із них 204 пацієнтки з РЯ. Взагалі у 37 % пацієнтів спостерігалася затримка циклів ПХТ, тоді як у 26 % було зниження дози.
Кількість циклів ПХТ, що потребували затримки проведення або зниження доз хіміопрепаратів, збільшувалася залежно від наявності анемії після попереднього циклу лікування. Всього такі цикли відзначені в 39,8–62,8 % пацієнтів (залежно від ступеня анемії). У 26,0 % пацієнтів затримка циклу або редукція доз ПХТ спостерігалася з інших причин (тромбоцитопенія, лейкопенія та ін.).
Так само в клінічних дослідженнях вивчалося питання впливу модифікації доз ПХТ на показники ЗВ і БРВ. Так, в дослідження GOG–182 включені па–цієнтки з III–IV стадією РЯ, які отримували хіміотерапію на основі карбоплатину (AUC–6) і паклітакселу (175 мг/м2). Пацієнткам, у яких спостерігалася значна токсичність, виконувалася модифікація дози хіміотерапії (зменшення дози та/або затримка циклу). У дослідженні продемонстровано, що БРВ і ЗВ були статистично значимо пов’язані з модифікацією дози хіміопрепаратів [22].
У метааналізі, який провели Olawaiye і співавт. (2018 р.) [22], оцінено вплив модифікації дози ПХТ на результат лікування пацієнток з РЯ, а саме на показники ЗВ і БРВ. Найбільш поширена схема ПХТ в даному дослідженні — карбоплатин (AUC–6) і паклітаксел 175 мг/м2 в перший день циклу. Дана схема призначалася кожні 3 тижні протягом 6–8 циклів. Редукція дози в даному дослідженні описана як зниження дози ПХТ ≥ 15 % від дози 1–го циклу, а затримка циклу ПХТ — як затримка проведення ПХТ на ≥ 3 тижні від попереднього циклу. В цілому в дослідження включено 738 пацієнток з III–IV стадіями РЯ. Зниження дози або затримка циклу ПХТ були потрібні у 229 (31 %) пацієнток.
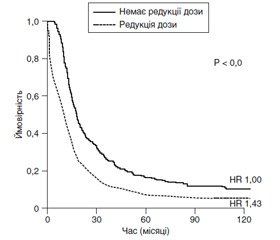
Показники БРВ і ЗВ показані на рис. 1, 2. Медіана БРВ в групі без модифікації доз ПХТ становила 17,5 місяця (95% ДІ 16,4–19,1), в той час як у пацієнток з модифікаціями доз ПХТ даний показник становив 9,9 місяця (95% ДІ 6,67–12,5), р = 0,001. Медіана ЗВ у пацієнток без модифікації доз ПХТ становила 48,0 місяця (95% ДІ 42,7–53,3), в той час як у пацієнток з модифікаціями доз ПХТ даний показник становив 28,7 місяця (95% ДІ 22,3–35,0), р = 0,021 [22].
Таким чином, на підставі отриманих даних можна дійти висновку, що редукція доз хіміопрепаратів є фактором, здатним впливати на ефективність проведеного лікування у пацієнток з РЯ.
Раніше проведені дослідження так само показують, що відсутність редукції дози та затримки циклів ПХТ пов’язана з максимальною ефективністю проведеного лікування [17, 26].
Так, в 2015 році опубліковані результати дослідження Joseph та ін. [28], в якому автори оцінили вплив затримки циклів і зниження доз ПХТ на ЗВ у літніх пацієнток з II–IV стадіями РЯ.
З 157 пацієнток, які отримали хіміотерапію, шість циклів ПХТ завершили 106 (67,5 %) жінок, із яких у 55 (35 %) спостерігалася редукція дози, а у 72 (46 %) була щонайменше одна затримка циклу ПХТ. Затримка циклів ПХТ здійснювалася через такі фактори, як анемія (n = 22), нейтропенія (n = 16) і алергічні реакції (n = 5) відповідно. У пацієнток, які завершили очікувану кількість циклів ПХТ, показники редукції дози та затримки циклів ПХТ становили 35 та 47 % відповідно.
На рис. 3 показано дані ЗВ пацієнток, у яких затримка циклів спостерігалася 1 раз, медіана ЗВ становила 2,5 року (А), у жінок з 2 та більше затримками циклів медіана ЗВ становила 1,7 року (Б) (p = 0,03), в той час як у жінок без затримки доз даний показник становив 4,0 року відповідно (А, Б) (p = 0,02). Однак редукція дози ПХТ не впливала на ЗВ пацієнток з РЯ (p = 0,41).
Щоб оцінити незалежні фактори, пов’язані з ЗВ, був проведений багатофакторний аналіз, що включав вік пацієнток, стадію захворювання, затримку проведення циторедукції, ступінь циторедукції, загальну кількість отриманих циклів і затримку циклів ПХТ (табл. 1).
Ці дані свідчать про те, що затримка циклу ПХТ у пацієнток з РЯ є незалежним негативним прогностичним фактором ЗВ [28].
Затримка проведення циклів ПХТ і редукція доз хіміопрепаратів є факторами, здатними знижувати ефективність проведеного лікування. З усіх згаданих раніше досліджень найчастішою причиною затримки циклів і редукції доз ПХТ є гематологічна токсичність, а саме анемія, тромбоцитопенія, лейкопенія та нейтропенія.
Рішенням даної проблеми є профілактика даних станів шляхом проведення премедикації до та після введення ПХТ, що, в свою чергу, дає можливість конт–ролювати гематологічні показники.
Згідно з рекомендаціями NCCN (Національна все–осяжна мережа раку) та ЕSМО (Європейське співтовариство медичної онкології) 2018 року, рекомендовано профілактику та лікування даних станів. Так, для лікування анемії використовуються дві групи препаратів. До першої групи належать препарати заліза, однак дані препарати доцільно приймати при умові абсолютного (рівень сироваткового феритину менше 30 нг/мл та сатурація трансферину менше 15 %) або відносного дефіциту заліза (рівень сироваткового феритину менше 800 нг/мл
та сатурація трансферину менше 20 %) незалежно від рівня гемоглобіну. Друга група препаратів включає стимулятори еритропоезу. Згідно з даними метааналізу Clark (2002), при використанні еритропоетинів спостерігалось зменшення кількості гемотрансфузій та покращення якості життя онкологічних пацієнтів. На сьогодні до використання у клінічній практиці схвалено такі препарати: епоетин α, епоетин β та дарбепоетин α.
Одним із найрозповсюдженіших та найнебезпечніших небажаних явищ при використанні хіміотерапії є лейкопенія. Згідно з рекомендаціями NCCN, використання колонієстимулюючих факторів рекомендовано пацієнтам, у яких ризик розвитку фебрильної нейтропенії > 10 %. Згідно з метааналізом Shitara (2010), використання стимуляторів лейкопоезу для лікування вторинної лейкопенії покращує прогноз пацієнтів за рахунок утримання інтенсивності дози. На сьогодні препаратами з найвищим ступенем доказовості є філграстим та пегфіл–грастим.
На сьогодні невирішеним залишається питання лікування тромбоцитопенії, викликаної прийомом хіміопрепаратів. Карбоплатин і паклітаксел загрожують високою частотою розвитку тромбоцитопенії (58 і 59 % відповідно) і відстроченням проведення циклів ПХТ [35]. Загальноприйнятим протипоказанням до проведення хіміотерапії є зниження рівня тромбоцитів до < 100 × 109/л [36]. Традиційним підходом до терапії даного стану є переливання тромбоцитарної маси при рівні тромбоцитів < 20 × 109/л при наявності геморагічних симптомів або тромбоконцентрату при рівні тромбоцитів < 10 × 109/л незалежно від клінічних проявів.
Іншим фармакотерапевтичним методом корекції тромбоцитопенії, викликаної хіміотерапією, є застосування рекомбінантного тромбопоетину людини (рлТПО). Слід підкреслити, що агоністи тромбопоетинових рецепторів (ельтромбопаг) і аналоги тромбопоетину людини (роміплостим), згідно з інструкціями цих препаратів, не мають показань до застосування при тромбоцитопенії, індукованій хіміотерапією.
На ринку України представлений оригінальний препарат рекомбінантного тромбопоетину людини — Емаплаг. Консенсус ради експертів країни — виробника рлТПО рекомендує його застосування з метою лікування тромбоцитопенії, викликаної хіміотерапією, при рівнях тромбоцитів < 75 × 109/л [37].
Дослідження американських онкологів щодо застосування рекомбінантного тромбопоетину людини з метою профілактики вказує на можливість досягнення доброго клінічного результату. Потреба у трансфузії тромбоцитів у пацієнтів, які отримували рлТПО короткими курсами (від 2 до 4 введень препарату) з метою профілактики тромбоцитопенії, індукованої хіміотерапією, була суттєво нижчою, ніж в групі контролю (11 проти 47 %) [38].
Незважаючи на досягнуті успіхи у лікуванні тромбоцитопенії, викликаної хіміотерапією, дане питання потребує подальшого вивчення.
Таким чином, проведення паліативної хіміотерапії на основі препаратів платини є важливим методом лікування пацієнтів з раком яєчників, що дозволяє істотно збільшити показники загальної та безрецидивної виживаності. Слід підкреслити, що затримка із проведенням циклів ПХТ, так само як і редукція доз хіміопрепаратів, є факторами, здатними знижувати ефективність лікування. Необхідно уникати вищевказаних явищ для забезпечення ефективності хіміотерапії раку яєчників.
Необхідні подальші пошуки прогностичних і перед–бачуваних чинників розвитку негативних явищ після ПХТ з метою розробки профілактичних і лікувальних заходів, спрямованих на запобігання даним явищам, та, як наслідок, уникнення модифікації доз ПХТ або затримки проведення циклів ПХТ.
Конфлікт інтересів. Не заявлений.

/8-1.jpg)
/9-1.jpg)
/9-2.jpg)