Журнал «Здоровье ребенка» Том 14, Додаток 1, 2019 Дитяча гастроентерологія та нутриціологія
Вернуться к номеру
Діагностичний алгоритм і особливості ведення дітей із патологією печінки
Авторы: Бабаджанян О.М., Волошина Л.Г., Павленко Н.В., Слободянюк О.Л.
Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Розглянуто діагностичний алгоритм, що включає комплексне дослідження, обґрунтована необхідність оцінювати отримувані результати з урахуванням віку й статі дитини, розглянуті особливості ведення дітей із патологією печінки й механізми дії урсодезоксихолевої кислоти на організм людини, подані результати клінічних досліджень і спостережень щодо використання препарату урсодезоксихолевої кислоти для лікування дітей з ураженнями печінки.
Рассмотрен диагностический алгоритм, включающий комплексное исследование, обоснована необходимость оценивать полученные результаты с учетом возраста и пола ребенка, рассмотрены особенности ведения детей с патологией печени и механизмы действия урсодезоксихолевой кислоты на организм человека, представлены результаты клинических исследований и наблюдений по использованию препарата урсодезоксихолевой кислоты для лечения детей с заболеваниями печени.
The paper deals with the diagnostic algorithm including a comprehensive study, substantiates the necessity to evaluate the results obtained taking into account the age and sex of the child. The article considers the features of management of children with liver pathology and the mechanisms of action of ursodeoxycholic acid on the human body as well as the results of clinical research and observations on the use of the ursodeoxycholic acid for the treatment of children with liver diseases.
урсодезоксихолева кислота; діти; захворювання печінки
урсодезоксихолевая кислота; дети; заболевания печени
ursodeoxycholic acid; children; liver diseases
У зв’язку з тим, що останнім часом спостерігаються неухильне зростання кількості випадків хронічних захворювань печінки, прогресуючий перебіг захворювань, істотні ускладнення, несприятливий прогноз, виникає необхідність подальшої оптимізації їх базисної терапії [3, 19].
Підставою, що визначає терапію хронічних захворювань печінки в дітей, є нозологічний принцип, тобто виділення окремих нозологічних форм захворювань і відповідно до цього усунення етіологічних факторів або корекція патогенезу захворювання [3, 7].
Дуже важливим є раннє розпізнавання захворювання, що дозволяє уникнути прогресування дисфункції печінки, робить можливою успішну метаболічну підтримку дитини. Особливе значення це має для дітей першого року життя, бо їх гепатобіліарна система чутлива до пошкодження через незрілість метаболічних процесів, недостатність транспорту протеїнів або зміни функції органел. Ці особливості призводять до зміни проникності чи неефективності транспорту в межах системи, що сприяє початку або хронізації холестазу [14, 15, 28].
Своєчасне розпізнавання тяжкого захворювання печінки в дитини залишається серйозною проблемою, адже в більшості випадків мають місце фактично ідентичні початкові прояви захворювання, іноді — мінімальна клінічна картина з обмеженою кількістю проявів. Наявність же великої кількості різноманітних позапечінкових синдромів маскує основне захворювання. У деяких випадках лікар може запідозрити захворювання печінки в дитини з жовтяницею, гепатомегалією, коагулопатією; в інших випадках це може бути випадкове виявлення відхилень при дослідженні сироватки крові. Відхилення від нормальних лабораторних показників часто є єдиним проявом явного печінкового захворювання й може визначатися задовго до появи типових клінічних проявів [3, 13, 17, 19, 25].
У дітей перших місяців життя клінічна картина ураження печінки може включати жовтяничне забарвлення шкіри й слизових оболонок, гепатолієнальний і геморагічний синдроми, появу слабко забарвлених чи ахолічних випорожнень, а також темної або пінистої сечі, що обумовлено холеурією. Слід зазначити, що навіть за наявності екстра- або інтрагепатичної обструкції певна кількість пігменту може міститися в калі новонароджених через десквамацію клітин у випорожненнях, що містять пігмент. Це явище може провокувати хибну впевненість у відсутності обструкції, але в цьому разі випорожнення розпадаються на шматочки і добре видно, що пігмент є лише поверхневим, внутрішня частина випорожнень у кращому випадку має колір глини.
Діти старшого віку з хронічними захворюваннями печінки в деяких випадках не мають патогномонічних симптомів ураження печінки, можуть пред’являти скарги на слабкість, підвищену втомлюваність. Проте чим старша дитина, тим частіше в клінічній картині виражені позапечінкові синдроми. Усі позапечінкові синдроми умовно поділяють на 3 групи. Перша група — пов’язані з імунокомплексними реакціями: папульозний акродерматит, рецидивуючі дерматити, вузлувата еритема, рецидивуюча кропив’янка, геморагічний васкуліт, вузликовий періартеріїт, мембранозно-проліферативний або тубулоінтерстиціальний гломерулонефрит, печінкова гломерулопатія з нефротичним синдромом або без нього, мембранозна нефропатія, доброякісні артропатії, інтерстиціальний пульмоніт, інтерстиціальний фіброз легеневої тканини, тиреоїдит, сіалоаденіт, синдром Шегрена, панкреатопатія, мієлосупресія, тромбоцитопенія або тромбоцитопатія, гіпо- або апластична анемія, лейкопенія, імунна цитопенія. Друга група синдромів асоційована з гормональним дисбалансом: малинове забарвлення язика, бруднуватий відтінок шкіри, потовщення нігтьових фаланг за типом барабанних паличок, капілярити, телеангіектазії, пальмарна й плантарна еритема. Третя група — синдроми, пов’язані з ендокринними розладами: транзиторні гормональні розлади гіпофізарно-гонадної системи, дисфункція щитоподібної залози, хронічна інсулінова недостатність, хронічна недостатність надниркових залоз [13, 19].
Залежно від віку змінюється не лише клінічна картина, але й етіологія захворювання печінки. Основні групи захворювань печінки, що спостерігаються в дітей, — токсичні, інфекційні, метаболічні, автоімунні, судинні й інфільтративні. Хронічні вірусні гепатити В і С виявляються в пацієнтів незалежно від віку, як і захворювання печінки, викликані експозицією гепатотоксичних препаратів, і пухлини [1, 4, 9, 11, 19].
У ранньому дитинстві найчастіше виявляються холестатичні порушення (біліарна атрезія, що частіше зустрічається в дівчат, кіста холедоху, недостатність внутрішньопечінкових жовчних проток, хвороба й синдром Byler, хвороба й синдром Caroli, синдром Alagille, холелітіаз), ідіопатичний неонатальний гепатит (більш поширений серед хлопчиків, особливо недоношених, і дітей, які народилися з недостатньою масою тіла), а також захворювання, що його імітують (кістозний фіброз, недостатність a-1-антитрипсину, гіпопітуїтаризм, гіпотиреоз, гемосидероз), інфекційні й метаболічні захворювання (синдром Zellweger, порушення метаболізму жовчних кислот, тирозинемія, хвороба Niemann — Pick, галактоземія, фруктоземія, хвороба накопичення глікогену IV типу), тривале парентеральне харчування. У деяких випадках холестаз має функціональний характер — при гіподинамії, гіпотонії, стресі, голодуванні, порушенні режиму харчування, переохолодженні, прийомі ліків, і розвивається в результаті моторно-тонічної дисфункції жовчного міхура, жовчних проток (внутрішньо- і позапечінкових) і сфінктерів: Одді, Люткенса, Міріцці [17–20].
Пігментні гепатози є вродженими захворюваннями, але діагностуються в більшості випадків у різні вікові періоди: синдром Кріглера — Найяра — у перші дні життя, синдром Жильбера — переважно в підлітковому віці, синдром Дабіна — Джонсона — Ротора — незалежно від віку [6, 8, 12, 26].
У дітей старшого віку й підлітків частіше зустрічаються автоімунний гепатит (АІГ), неалкогольна жирова хвороба печінки (НАЖХП) і хвороба Вільямса [24, 27]. На автоімунний гепатит у переважній більшості хворіють дівчата, особливо за наявності в анамнезі акне, артриту, аменореї. Хоча дана нозологічна одиниця також зустрічається у хлопчиків і дітей молодшого віку. Так, під нашим наглядом перебуває хлопчик із гістологічно підтвердженим автоімунним гепатитом, у якого в 4 роки з’явилася невмотивована слабкість, а при обстеженні виявлені гепатолієнальний синдром, синдром цитолізу, холестазу, високі титри специфічних автоантитіл. Як зазначено в рекомендаціях EASL (2015), автоімунний гепатит спостерігається в будь-яких популяціях і всіх вікових групах. Діагностика автоімунного гепатиту ґрунтується на аналізі клінічних проявів, даних лабораторних та інструментальних методів дослідження. У зарубіжній літературі вони отримали назву «HISORt-критерії» (Нistology, imaging, serology, other organ involvement and response to corticosteroids), обов’язковим є виявлення циркулюючих автоантитіл ANA або SMA + ≥ 1 : 20; LKM + ≥ 1 : 10; АNСА;
SLA/LP), асоційованих із поліклональною гіпергаммаглобулінемією (IgG або g-глобуліни), і наявність характерної гістологічної картини за відсутності маркерів вірусного гепатиту. Необхідно зазначити, що анти-SLA/LP — єдині автоантитіла, специфічні для АІГ, мають високу діагностичну значущість, що незалежно від титру дозволяє впевнено діагностувати захворювання. У деяких випадках титри й специфічність автоантитіл протягом хвороби можуть змінюватися, у дітей титри можуть служити цінними біомаркерами активності процесу й показником відповіді на лікування. У більшості дітей має місце співіснування ознак АІГ і первинного склерозуючого холангіту або як мінімум виражений холестаз. Агресивний перебіг захворювання, дані про те, що невчасна діагностика погіршує прогноз, обґрунтовують раннє застосування медикаментозної терапії — з моменту встановлення діагнозу. На сьогодні всім дітям із діагностованим АІГ призначається імуносупресивна терапія, що повинна тривати мінімум 3 роки і не менше від 24 місяців після повної нормалізації рівня амінотрансфераз і IgG [7, 28].
За оцінкою експертів ВООЗ (2017), ожиріння є однією з глобальних проблем сучасного суспільства: до 15 % дітей мають це захворювання, і їх число невпинно зростає. За останні три десятиліття кількість дітей з ожирінням зросла більше ніж у 15 разів. Ожиріння є важливим фактором ризику виникнення гастроентерологічної патології, зокрема неалкогольної жирової хвороби печінки, що зустрічається в 68 % дітей з ожирінням [16]. Розрізняють дві морфологічні форми НАЖХП: неалкогольний жировий гепатоз (НАЖГ) і неалкогольний стеатогепатит (НАСГ). За відсутності лікування відбувається трансформація НАЖГ у НАСГ із подальшим розвитком фіброзу й цирозу. У літературі описані спостереження, коли на фоні НАСГ у дітей віком 6–8 років розвинувся цироз печінки [15].
Нерідко зустрічаються як гострі — тривалістю до 6 місяців, так і хронічні лікарські гепатити — тривалістю понад 6 місяців. Діагностується лікарський гепатит відповідно до міжнародних критеріїв оцінки лікарських уражень печінки: наявність інтервалу між прийомом препарату й розвитком гепатотоксичної реакції від 5 до 90 днів; нормалізація рівня печінкових ферментів протягом 30 днів для гепатоцелюлярного й 180 днів — для холестатичного ураження печінки; виключення альтернативної причини шляхом детального обстеження.
Ретельно зібраний анамнез може стати підказкою щодо існування й типу захворювання печінки: наявність гемодіалізу, хірургічних втручань, отримання препаратів крові, використання гепатотоксичних препаратів, наркотиків дає можливість підозрювати інфекцію або токсичне ураження.
Коло патологічних станів печінки дуже широке, але більшість захворювань супроводжуються порушенням функції печінки. При підозрі на захворювання печінки призначається специфічне дослідження функції печінки (Liver function tests — LFT) для її оцінки. Послідовно спостерігаючи в динаміці й оцінюючи дані показники, можна отримати інформацію щодо прогнозу, реакції на терапію і ступеня дисфункції печінки. Однак тест LFT не є повністю точним, оскільки серед низки зазвичай одержуваних параметрів тільки два є істинними показниками печінкової функції — протромбіновий час і рівні сироваткового альбуміну, обидва оцінюють синтетичну функцію печінки. Усі інші по суті є непрямими показниками печінкової функції, багато з них змінюються і в інших ситуаціях, окрім захворювання печінки.
Підвищення аланінамінотрансферази (АЛT) більш специфічне для наявності захворювання печінки, оскільки її виявляють тільки в низькій концентрації в інших тканинах. Навпаки, аспартатамінотрансфераза (AСT) міститься у високих концентраціях у багатьох тканинах, включно із серцевими й скелетними м’язами, нирками, підшлунковою залозою й еритроцитами, тому при ізольованому її підвищенні потрібно виключити інші захворювання. Коензимом обох ензимів є вітамін В6, тому стійкі низькі показники AСT і AЛT свідчать, що має місце недостатність вітаміну В6. У цілому показники амінотрансфераз не дають інформації щодо специфічних діагнозів, не мають прогностичної цінності. Діти з дуже високими показниками можуть почуватися добре, однак визначення рівня амінотрансфераз корисне для моніторингу стану дитини.
Лужна фосфатаза (ЛФ) локалізується в першу чергу в мембрані канальців клітин печінки, отже, підвищений сироватковий рівень ЛФ зазвичай вказує на обструктивне захворювання печінки й розвиток синдрому холестазу. Однак ЛФ виявляється в інших тканинах, включаючи кістки, нирки й тонкий кишечник. При захворюваннях печінки важливим є фракціонування білірубіну. При некон’югованій білірубінемії серйозне захворювання печінки є малоймовірним, але необхідно виключити гемоліз, вроджені порушення метаболізму білірубіну, ядерну жовтяницю в новонародженого. Наявність кон’югованої білірубінемії пов’язана із серйозним захворюванням печінки й вказує на холестаз.
Гамма-глутамілтрансфераза (ГГT) міститься в епітелії малого жовчного протоку, а також всередині гепатоцитів; у підшлунковій залозі, селезінці, мозку, грудних залозах, тонкому кишечнику й особливо в нирках. Підвищення сироваткової ГГT не є специфічним для захворювання печінки, стимулом для її утворення в печінці є жовчні кислоти, отже, низький рівень ГГT може свідчити про недостатнє утворення або порушення екскреції жовчних кислот із гепатоцитів. Синтез жовчних кислот у печінці, їх кон’югація й секреція підтримують рівень холестерину, полегшують потік жовчі й забезпечують поверхневі активні детергентні молекули, що покращують інтестинальну абсорбцію ліпідів, сприяючи балансу між абсорбцією жовчних кислот із кишечника та їх захопленням гепатоцитами. За відсутності змін клубової кишки сироваткові рівні жовчних кислот є надійним показником цілісності ентерогепатичної циркуляції. Хоч жовчні кислоти сироватки й не дають специфічної інформації про тип наявного захворювання печінки, вони є підвищеними в дітей із хронічними захворюваннями печінки, у яких рівні білірубіну, як і раніше, можуть бути в нормі.
Біохімічні відхилення, пов’язані із захворюваннями печінки, не обмежуються відхиленнями LFT. Визначення хлоридів поту необхідне для виключення кістозного фіброзу. Дослідження вмісту заліза й феритину важливе для діагностики гемохроматозу, а рівня сукцинілацетону — для діагностики тирозинемії. Аналіз і культуру сечі слід завжди отримувати в будь-якої дитини з жовтяницею, оскільки уросепсис зазвичай пов’язаний з кон’югованою гіпербілірубінемією.
Обов’язково всім дітям із патологією печінки призначається дослідження маркерів вірусних гепатитів, оскільки саме вірусні гепатити є однією з найпоширеніших причин розвитку хронічних гепатитів у дітей. При виявленні в дитини хронічного вірусного гепатиту В або С спостереження й лікування проводяться відповідно до наказів МОЗ України № 723 від 04.11.2015; № 233 від 02.04.2014; № 729 від 18.07.2016 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги дорослим та дітям «Вірусний гепатит C» і № 613 від 21.06.2016 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Вірусний гепатит В у дітей».
Усі хронічні дифузні захворювання печінки мають спільні основи патогенезу — порушення функції й структурної цілісності мембран гепатоцитів, порушення процесів енергоутворення в мітохондріях, розвиток гепатоцелюлярного (інтралобулярного) холестазу й цитолізу, окислювального стресу на фоні виснаження антиоксидантного захисту, ендотоксемії з пригніченням ретикулоендотеліальної системи й антиоксидантного захисту, дисбаланс жовчних кислот і холестеринутримуючих компонентів у жовчі, порушення проліферації, синтезу білків, детоксикації, перекисного окислення ліпідів, цитокінової регуляції з активацією імунокомпетентних клітин, посилення автоімунних реакцій із підвищенням синтезу антитіл, у тому числі перехресно реагуючих, надмірне утворення циркулюючих імунних комплексів, що призводить до розвитку апоптозу й некрозу гепатоцитів, які починають переважати над проліферацією, неухильна деградація структури шляхом розвитку й прогресування печінково-клітинної недостатності, фіброзу й цирозу.
Більшість патологічних станів печінки супроводжується порушенням будь-якої з перерахованих функцій печінки або багатьох із них, з переважанням тих чи інших. Тому, незалежно від призначеного етіотропного лікування — противірусної терапії при хронічних вірусних гепатитах або імуносупресивної терапії при АІГ, хворим призначаються препарати, що впливають на патогенетичні механізми, які лежать в основі захворювань печінки. З цією метою обґрунтовано призначення урсодезоксихолевої кислоти (УДХК). Застосування УДХК для лікування захворювань печінки й біліарного тракту має давню історію: більш ніж 2000 років тому лікарі Стародавнього Китаю призначали «печінковим» хворим суху ведмежу жовч, що містить у високій концентрації УДХК; у 1954 році був описаний метод синтезу УДХК, у 1975 році доведена можливість десатурації жовчі й розчинення холестеринових каменів, а в 1981 році — покращання біохімічних показників печінки при використанні УДХК, що й стало підставою для розширення терапевтичних можливостей УДХК і її призначення для лікування не тільки жовчнокам’яної хвороби, а й інших захворювань печінки. Урсодезоксихолева кислота являє собою нетоксичну третинну жовчну кислоту, що утворюється в кишечнику й печінці, у нормі міститься в жовчі людини в невеликих кількостях — не більше ніж 5 % від загального пулу жовчних кислот. Вона є більш полярною й гідрофільною порівняно з іншими жовчними кислотами, що обумовлює практично повну відсутність токсичності. На сьогодні добре відомі й апробовані численні специфічні ефекти УДХК: антихолестатичний, холеретичний, цито-/гепатопротективний, про-/антиапоптичний, імуномодулюючий, гіпохолестеринемічний, літолітичний, антифібротичний, антиоксидантний, антинеопластичний. УДХК конкурує з токсичними жовчними кислотами в процесі абсорбції в тонкій кишці і на мембранах гепатоцитів, обумовлюючи протективну дію; виконує роль сигнальної молекули, що регулює низку метаболічних шляхів і модулює свій власний біосинтез; надає метаболічний ефект, впливаючи на ендокринні рецептори, що обумовлює нормалізацію обміну холестерину, зниження інсулінорезистентності й сироваткового рівня глюкози, маси тіла; регулює метаболізм ліпідів, проліферацію й диференціацію холангіоцитів; перешкоджає розвитку й прогресуванню атеросклерозу; зупиняє розвиток фіброзу й цирозу печінки. Прийом УДХК зумовлює підвищення бактерицидності жовчі й кишкового вмісту, пригнічення бактеріального росту в кишечнику, купірування бродильної й гнильної диспепсії. Отже, УДХК виконує важливі функції й за рамками кишково-печінкової осі, діючи як системний метаболічний інтегратор [2, 5, 10].
З огляду на її властивості УДХК має показання до застосування як в основній, так і в супутній терапії. Саме УДХК є оптимальним препаратом для патогенетичної терапії широкого спектра захворювань печінки й жовчовивідних шляхів через вплив на максимальне число ланок патогенезу. З огляду на фізіологічну роль УДХК її введення ззовні є кращим терапевтичним рішенням уже з перших днів захворювання, можливе її застосування й на етапі діагностичного пошуку [2, 19, 23].
Важливо враховувати, що при захворюваннях печінки за рахунок вираженого порушення її функцій може значно порушуватися метаболізм фармакологічних препаратів із розвитком неконтрольованих побічних ефектів. У зв’язку з цим у таких хворих можливе застосування лише абсолютно показаних і вірогідно безпечних лікарських засобів.
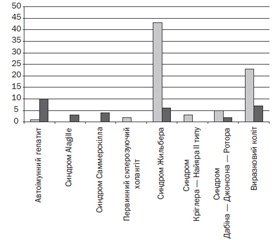
Найбільший позитивний досвід застосування УДХК накопичений щодо використання препарату Урсофальк, Dr. Falk Pharma GmbH, Фрайбург (із 1987 року). У даний час близько 85 % дітей із захворюваннями печінки, які перебувають під нашим спостереженням, отримують Урсофальк у рекомендованих дозах, при цьому близько 23 % — впродовж понад 10–15 років. Із 1987 р. нами не було зареєстровано жодного випадку непереносимості препарату Урсофальк, що вимагав би його відміни. Виробляється Урсофальк у Німеччині на заводі Losan Pharma з якісної субстанції зі застосуванням сучасних технологій, що дозволяє забезпечити стабільність діючої речовини й обумовлює тривалий термін зберігання — 5 років. Розподіл дітей (n = 232), які отримували терапію препаратом Урсофальк, подано в табл. 1 і на рис. 1.
Щодо окремих нозологічних форм спостерігається тенденція до розподілу пацієнтів за статтю. Дані розподілу за статтю серед дітей із захворюваннями печінки подані на рис. 2.
Слід зазначити, що до групи спостереження належали діти з хронічними вірусними гепатитами В або С, які не отримували специфічної противірусної терапії з різних причин: наявність протипоказань, ранній вік (до 3 років), велика кількість побічних ефектів противірусної терапії, відмова батьків.
Терапія в таких дітей включала дієту, охоронний режим і, з урахуванням багатофакторності захворювання, Урсофальк у дозі 10–15 мг/кг маси тіла на добу (одноразово увечері курсами по три місяці два рази на рік) протягом всього терміну спостереження. Призначення препарату Урсофальк дітям із хронічними вірусними гепатитами дозволило контролювати стан функції печінки й нормалізувати рівні трансаміназ, лужної фосфатази, білірубіну, гамма-глутамілтрансферази.
Один із кращих результатів застосування УДХК був відзначений у групі дітей із гострими й хронічними лікарськими гепатитами, які отримували терапію препаратом Урсофальк у дозі 10–15 мг/кг маси тіла на добу двічі на рік курсами по три місяці (тривало) — відповідно до тривалості призначення гепатотоксичних препаратів. Уже через два тижні від початку терапії в усіх пацієнтів нормалізувалися показники LFT, білірубіну, крім того, відзначалося значне зменшення диспептичних скарг (нудота, гіркота в роті тощо), тяжкості в правому підребер’ї. Подальше призначення препарату Урсофальк дозволяло підтримувати нормальне функціонування печінки.
Усім дітям з автоімунним гепатитом призначався Урсофальк на фоні імуносупресивної терапії глюкокортикоїдами й антиметаболітами курсами по три місяці в дозі 15 мг/кг маси тіла на добу. Двом пацієнткам ми були змушені призначити Урсофальк постійно в дозі 10 мг/кг маси тіла на добу, бо при зменшенні дози або спробі відмінити препарат значно наростав синдром холестазу. Отже, на сьогодні одна з дівчат отримує Урсофальк безперервно вже 10 місяців, а інша — 21 місяць. Ще дві дівчинки в стані стійкої ремісії після скасування імуносупресивної терапії продовжують прийом препарату Урсофальк упродовж 3 років у дозі 5 мг/кг
маси тіла на добу двічі на рік курсами по 3 місяці. У цій групі дітей застосування препарату Урсофальк дозволило зменшити прояви або не допустити розвитку синдрому холестазу.
Як гепатопротектор і з метою контролю функцій печінки дітям із дефіцитом a-1-антитрипсину в складі комплексної терапії призначався Урсофальк курсами по три місяці двічі на рік у дозі 10–15 мг/кг маси тіла на добу.
Виражена позитивна динаміка — нормалізація LFT, швидке значне зменшення синдрому холестазу — була відзначена у дітей з уродженими синдромами внутрішньопечінкового холестазу (синдром Alagille, хвороба Byler, недиференційований прогресуючий сімейний внутрішньопечінковий холестаз, несиндромальна форма гіпоплазії жовчних проток, синдром Саммерскілла). Вони отримували Урсофальк залежно від вираженості холестазу: від 10 до 25 мг/кг маси тіла на добу постійно. У двох випадках ми були змушені призначити дозування 30 мг/кг маси тіла на добу, але при отриманні позитивної динаміки зменшили дозу до 15 мг/кг маси тіла на добу. Трьом дітям була проведена ортотопічна трансплантація печінки, на сьогодні діти перебувають на постійній імуносупресивній терапії й отримують Урсофальк двічі на рік курсами по 3 місяці в дозі
10 мг/кг маси тіла на добу.
Доцільним у випадку НАЖХП є призначення УДХК [22], тому всім дітям цієї групи призначався Урсофальк у дозі 10–15 мг/кг на добу два рази на рік курсами по 3 місяці, що сприяло нормалізації біохімічних показників печінки й показників білково-холестеринового обміну: рівня холестерину, тригліцеридів, ліпопротеїдів низької й дуже низької щільності, коефіцієнту атерогенності, що свідчить на користь нормалізації синтезу ліпопротеїдів у печінці.
З кожним роком збільшується кількість дітей із криптогенним гепатитом, природно, всі вони перебувають на етапі діагностичного пошуку, і також природно, що всі вони отримують Урсофальк двічі на рік курсами по 3 місяці в дозі 10–15 мг/кг маси тіла на добу (тривалістю від 1 року до 11 років) під контролем біохімічних проб печінки. Призначення препарату Урсофальк дозволило контролювати функціональний стан печінки й запобігати прогресуванню її дисфункції.
На сьогодні ми маємо досвід лікування трьох хлопчиків із гістологічно підтвердженим первинним склерозуючим холангітом (ПСХ). У двох із них ПСХ був асоційований з виразковим колітом, у клінічній картині захворювання мали місце гепатолієнальний синдром, прояви тотального коліту, виражені синдроми холестазу й цитолізу, збільшений титр перинуклеарних антинейтрофільних цитоплазматичних антитіл. В одного хлопчика був безсимптомний перебіг захворювання, діагноз було встановлено вже на стадії сформованого біліарного цирозу печінки. Усім дітям із ПСХ призначався Урсофальк у дозі 15–20 мг/кг маси тіла на добу тривало, хлопчикам з наявністю виразкового коліту при вираженому запальному процесі призначалися коротким курсом глюкокортикостероїди й месалазин (салофальк). Призначення препарату Урсофальк хворим на ПСХ мало на меті не тільки вплив на патологічний процес у печінці, а й зниження, з урахуванням даних про роль УДХК, ризику розвитку колоректальної дисплазії в пацієнтів із виразковим колітом і первинним склерозуючим холангітом, а також вирішення питання канцерпревенції [19, 28].
У всіх дітей із пігментними гепатозами (синдроми Жильбера, Кріглера — Найяра II типу, Дабіна — Джонсона — Ротора), які перебували під нашим спостереженням, мали місце функціональні порушення жовчного міхура й жовчовивідних шляхів, метаболічні порушення складу жовчі з підвищенням індексу літогенності, прояви холестазу. Із патогенетичних позицій для корекції обмінних порушень печінки, стабілізування клітинних мембран гепатоцитів, нівелювання холестатичних проявів, регулювання евакуації жовчі протоковою системою й зменшення рефлюксних порушень найбільш обґрунтованим є призначення УДХК. Тому всім дітям із пігментними гепатозами призначалися превентивні курси препарату Урсофальк у дозі 10 мг/кг на добу протягом 3 місяців 2 рази на рік.
На фоні терапії в усіх дітей нормалізувалися показники рівня білірубіну. Окрім того, відзначалося зменшення диспептичних скарг, тяжкості в правому підребер’ї. Препарат мав чітко виражену дію на прояви астенічного синдрому, ймовірно, за рахунок зниження рівня білірубіну в крові. До кінця другого тижня прийому препарату психоемоційний стан дітей значно покращився. При катамнестичному спостереженні у 27 дітей, які отримували Урсофальк два рази на рік курсом по 3 місяці протягом декількох років (від 3 до 7), у жодному випадку не розвинулася жовчнокам’яна хвороба. У 6 дітей, які на момент призначення терапії мали сформовану I стадію жовчнокам’яної хвороби, була зафіксована регресія. Отже, призначення таргетної терапії препаратом УДХК дозволяє запобігти розвитку холестазу й холелітіазу.
Окрему групу становили діти з виразковим колітом. Підставою для виділення цієї групи є наші багаторічні спостереження, які свідчать про вкрай різноманітні ураження печінки в даної групи дітей. Як правило, діти з виразковим колітом мають клінічну картину ураження кишечника й великий спектр позакишкових проявів. У деяких випадках кишкові симптоми хвороби можуть бути відсутніми або перебігають субклінічно, можливий дебют захворювання лише з позакишкових проявів, що передують класичним кишковим симптомам і обумовлюють тяжкість захворювання. Не завжди можна провести чітку межу між ураженням печінки як варіантом позакишкових проявів або як супутнім захворюванням. Правильне трактування позакишкових симптомів сприяє своєчасному встановленню діагнозу й призначенню адекватної терапії, що, у свою чергу, дозволяє домогтися більш стійкої ремісії, уникнути ускладнень і перешкоджає формуванню резистентності до лікування. Позакишкові прояви можуть бути реактивними станами — відповіддю різних органів і систем на запалення в кишечнику, які, як правило, маніфестують клінічно відповідно до ступеня активності й тривалості виразкового коліту, або асоційованими станами, що мають спільні патогенетичні механізми розвитку, можуть передувати клінічним проявам виразкового коліту або перебігати незалежно. Добре відомі предиктори ураження печінки у хворих на виразковий коліт: генетична схильність пов’язана з певними гаплотипами HLA-системи, наявність автоантитіл pANCA й ANA, порушення імунної толерантності й вираженість автоімунної агресії (рівень порушень імунітету, перехресно реагуючих антитіл), характер ураження кишечника (активність, поширеність), ступінь метаболічних порушень (мальабсорбції, детоксикації).
Під нашим наглядом перебували 23 хлопчика й 7 дівчаток із виразковим колітом, з них у 10 були метаболічні порушення: у 6 дітей із тривалим перебігом захворювання розвинулась жовчнокам’яна хвороба, у 4 — неалкогольна жирова хвороба печінки (стеатогепатит); у 4 мали місце автоімунні порушення — у 2 був ПСХ, у 2 — автоімунний гепатит. У всіх інших дітей (16) були виявлені синдроми цитолізу й холестазу або ізольований синдром цитолізу. З них у чотирьох синдроми холестазу й цитолізу передували кишковим проявам. Тому всім дітям із виразковим колітом призначався на фоні базисної терапії Урсофальк у дозі 10–15 мг/кг на добу протягом 3 місяців 2 рази на рік. Дана терапія дозволила домогтися зменшення некрозу гепатоцитів, нормалізації ферментативного статусу, стимуляції виділення жовчі, захищала біліарну систему від токсичного впливу жовчних кислот і сприяла редукції проявів жовчнокам’яної хвороби.
Динамічне спостереження за дітьми, які отримували Урсофальк, дозволило відзначити практично в усіх клінічне й біохімічне покращення. Ефект лікування хворих препаратом Урсофальк підтверджується такими даними: відбулося зменшення внутрішньо- і позапечінкового холестазу (про що свідчить зниження рівня ферментів холестазу: лужної фосфатази, гамма-глутамілтранспептидази); нормалізація рівня жовчних кислот крові; зменшення процесів цитолізу в печінці (що підтверджується зниженням рівня ферментів цитолізу: аланін- і аспартатамінотрансферази); зменшення вираженості жовтяниці за рахунок зниження рівня загального й кон’югованого білірубіну; зниження рівня холестерину в жовчі, що сприяє розчиненню холестеринових жовчних каменів і запобігає їх утворенню; зменшення інтенсивності свербежу, зниження гіперімуноглобулінемії, у тому числі рівня IgM. Призначення таргетної терапії препаратом Урсофальк дітям із порушенням обміну білірубіну дозволяє запобігти розвитку холестазу й холелітіазу.
Для своєчасного визначення стадії фіброзу й контролю за його розвитком на тлі терапії, а також для оцінки некрозапального процесу в печінковій тканині низці дітей був проведений «Фібротест». У всіх обстежених дітей було визначено вірогідне зменшення некрозапального процесу і, що видається нам важливим, зменшення прогресування фіброзу — зниження стадії фіброзу. Наприклад, зниження з F3 до Fl у хлопчика з криптогенним гепатитом, який отримував Урсофальк у дозі 15 мг/кг маси тіла двічі на рік по три місяці упродовж 3 років; зниження з F2 до F0 у хлопчика з хронічним вірусним гепатитом С з помірним ступенем активності й високим вірусним навантаженням (108), який отримував Урсофальк у дозі 15 мг/кг маси тіла двічі на рік по три місяці упродовж 5 років. Отже, тривалий прийом препарату Урсофальк поліпшує гістологічну картину печінки й уповільнює прогресування фіброзу. При катамнестичному спостереженні в усіх дітей, які отримували Урсофальк два рази на рік протягом 3 місяців, у жодному випадку не розвинулася жовчнокам’яна хвороба, а в дітей, які на початок призначення терапії мали сформовану I стадію жовчнокам’яної хвороби, була зафіксована регресія.
Висновки
— Дітям із підозрою на ураження печінки необхідно ретельно вивчати анамнез захворювання, життя й сімейний, проводити комплексне дослідження: специфічне дослідження функцій печінки — LFT, маркери вірусних гепатитів, рівень циркулюючих автоантитіл ANA, SMA, LKM, АNСА, SLA/LP, асоційованих із поліклональною гіпергаммаглобулінемією (IgG або g-глобуліни) і наявність характерної гістологічної картини; за необхідності — генетичне дослідження, рівень церулоплазміну, міді, a-1-антитрипсину; оцінювати результати необхідно з урахуванням віку й статі дитини.
— Проведені дослідження показали позитивний вплив препарату Урсофальк на стан дітей із захворюваннями печінки.
— Для запобігання розвитку необоротних змін у печінці лікування хворих препаратом Урсофальк можливо й необхідно починати якомога раніше, навіть на етапі діагностичного пошуку.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Bush H., Golabi P., Younossi Z.M. Pediatric Non-Alcoholic Fatty Liver Disease // Children (Basel). — 2017, Jun 9. — 4(6). — pii: E48. — https://doi.org/10.3390/children4060048.
2. Cheng K., Ashby D., Smyth R. Ursodeoxycholic acid for Cystic Fibrosis-related liver disease (Cochrane Review) // The Cochrane Library, Cochrane Database Syst. Rev. — 2014 Dec 15. — 12. — CD000222. doi: 10.1002/14651858.CD000222.pub3.
3. Gerok V., Blum H.E. Liver and biliary disease systems: Translated from German. — M.: MED Рress-inform, 2009.
4. Ghany et al. An update on treatment of genotype 1 chronic hepatitis C virus infection: 2011 practice guideline by the American Association for the Study of Liver Diseases // Hepatology. — 2011 Oct. — 54(4). — 1433-44. doi: 10.1002/hep.24641.
5. Guarino M.P., Cocca S., Altomare A. et al. UDCA in the treatment of diseases of the gallbladder: unfinished the story Guarino M.P., Cocca S., Altomare A. et al. // World J. Gastroenterol. — 2013 Aug 21. — 19(31). — 5029-5034. doi: 10.3748/wjg.v19.i31.5029.
6. Hu R.T., Wang N.Y., Huang M.J., Huang C.S., Chen D.S., Yang S.S. Multiple variants in UGT1A1 gene are factors to develop indirect hyper-bilirubinemia // Hepatobiliary Surg. Nutr. — 2014 Aug. — 3(4). — 194-8. DOI: 10.3978/j.issn.2304-3881.2014.08.04.
7. Ian D., Agata D., F. Williams, Balistreri D. Evaluation of Liver Diseases in the Pediatric Patient // Pediatric in Review. — 2001. — Vol. 20, № 11. — P. 376-389.
8. Kringen M.K., Piehler A.P., Grimholt R.M., Opdal M.S., Haug K.B., Urdal P. Serum bilirubin concentration in healthy adult North-Europeans is strictly controlled by the UGT1A1 TA-repeat variants // Plos one. — February, 2014. — 28(10). — 1643-7. DOI: 10.1371/journal.pone.0090248.
9. Nunnari G., Pinzone M.R., Cacopardo B. Lack of clinical and histological progression of chronic hepatitis C in individuals with true persistently normal ALT: the result of a 17-year follow-up // J. Viral Hepat. — 2013, Apr. — 20(4). — e131-7. doi: 10.1111/jvh.12029.
10. Okada K., Shoda J., Taguchi K. Ursodeoxycholic acid stimulates Nrf2_mediated hepatocellular transport, detoxification, and antioxidative stress systems in mice // Am. J. Physiol. Gastrointest. Liver Physiol. — 2008. — August 7. doi:10.1152/ajpgi.90321.2008.
11. Pinheiro N.C. et al. Refractory pruritus in primary biliary cirrhosis // BMJ Case Rep. 2013 Nov 14. — 2013. pii: bcr2013200634. doi: 10.1136/bcr-2013-200634.
12. Shiu T.Y., Huang H.H., Lin H.H., Shih Y.L., Chu H.C., Chang W.K., Hsieh T.Y. Restriction fragment length polymorphism effectively identifies exon 1 mutation of UGT1A1 gene in patients with Gilbert’s Syndrome // Liver. Int. — 2015 Aug. — 35(8). — 2050-6. — DOI: 10.1111/liv.12785.
13. Silverio A.O. et al. Are the spider angiomas skin markers of hepatopulmonary syndrome? // Arq. Gastroenterol. — 2013 Jul-Sep. — Vol. 50(3). — Р. 175-179. doi: 10.1590/S0004-28032013000200031.
14. Uto H., Mawatari S., Kumagai K. et al. Clinical features of hepatitis C virus carriers with persistently normal alanine aminotransferase levels // Hepat. Mon. — 2012, Feb. — 12(2). — 77-84. doi: 10.5812/hepatmon.829.
15. Valenti L., Alisi A., Galmozzi E. et al. I148M patatin like phospholipase domain containing 3 gene variant and severity of pediatric nonalcoholic fatty liver disease // Hepatology. — 2010. — 52 (4). — 1274-80. doi 10.1002/hep.23823.
16. Абатуров А.Е., Крючко Т.А., Кривуша Е.Л., Пода О.А. Эффективность гепатопротекторной терапии бетаин-аргининовым комплексом «Бетаргин» при применении у детей с неалкогольной жировой болезнью печени // Современная педиатрия. — 2018. — № 3(91). — С. 102-111.
17. Бабаджанян Е.Н. Опыт использования уросодезоксихолевой кислоты у детей с органическими заболеваниями печени // Здоровье ребенка. — 2015. — Темат. выпуск (62). — С. 37-42.
18. Бабаджанян О.М., Шутова О.В., Волошина Л.Г., Ганзій О.Б., Каафарані Аббас, Слободянюк О.Л. Таргетна терапія синдрома Жильбера // Здоровье ребенка. — 2017. — Т. 12, № 2.1.
19. Белоусов Ю.В., Белоусова О.Ю., Бабаджанян Е.Н., Волошина Л.Г. и др. Детская гастроэнтерология: Учебник. — Харьков, 2013. — 520 с.
20. Губергриц Н.Б. Доброкачественные гипербилирубинемии: всегда ли они абсолютно доброкачественные? // Новости медицины и фармации. — 2011. — № 21–22 (393–394).
21. Дубровина Г.М., Ботвиньев О.К., Колотилина А.И. Сочетание синдрома Жильбера с заболеваниями желудочно-кишечного тракта // РЖГГК. — 2014. — № 3. — С. 13 -21.
22. Звенигородская Л.А., Мельникова Н.В. Гиполипидемическая терапия у больных с неалкогольной жировой болезнью печени: место гепатопротекторов // Гастроэнтерология. Прилож. к журналу Consilium Medicum. — 2009. — № 1. — С. 32-6.
23. Эль-Райфе Н., Готтранд Ф. Роль урсодезоксихолевой кислоты в лечении холестаза у детей // Consilium medicum Ukraina. — 2008. — № 10.
24. Скрипник И.Н. Избыточный вес как основа НАСГ и актуальная медико-социальная проблема // Здоров’я України. — 2009. — № 20(225). — С. 6-7.
25. Скрыпник И.Н., Маслова А.С. Доброкачественные гипербилирубинемии // Новости медицины и фармации. — 2012. — 18 (431).
26. Сорокман Т.В., Попелюк Н.О., Макарова О.В. Синдром Жильбера: термінологія, епідеміологія, генетика, патогенез // Здоровье ребенка. — 2016. — № 8(76). — С. 82-85. DOI:10.22141/2224-0551.8.76.2016.90830.
27. Степанов Ю.М., Абатуров О.Є., Завгородня Н.Ю., Скирда І.Ю. Неалкогольна жирова хвороба печінки в дітей: сучасний погляд на можливості діагностики та лікування (II частина) // Гастроентерологія. — 2015. — № 2(56). — С. 58-67.
28. Циммерман С. Первичный склерозирующий холангит: современные представления // Клиническая медицина. — 2014. — № 1. — С. 5-10.
29. Звенигородская Л.А., Мельникова Н.В. Гиполипидемическая терапия у больных с неалкогольной жировой болезнью печени: место гепатопротекторов // Гастроэнтерология. Прилож. к журналу Consilium Medicum. — 2009. — № 1. — С. 32-6.

/34-1.jpg)
/35-1.jpg)