Журнал «Боль. Суставы. Позвоночник» Том 9, №1, 2019
Вернуться к номеру
Ефективність та безпечність ібандронової кислоти: фокус на результати рандомізованих досліджень і метааналізів
Авторы: Григор’єва Н.В.
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
В огляді наведені сучасні дані щодо ефективності, безпечності й переносимості пероральної й парентеральної форм ібандронової кислоти, а також прихильності до її використання в комплексному лікуванні системного остеопорозу та його ускладнень за даними рандомізованих клінічних випробувань і метааналізів. Крім того, подані результати порівняльних досліджень щодо ефективності ібандронової кислоти й інших бісфосфонатів, проаналізовані її переваги й перспективи використання.
В обзоре представлены современные данные об эффективности, безопасности и переносимости пероральной и парентеральной форм ибандроновой кислоты, а также приверженности к ее использованию в комплексном лечении системного остеопороза и его осложнений по данным рандомизированных клинических испытаний и метаанализов. Кроме того, представлены результаты сравнительных исследований эффективности ибандроновой кислоты и других бисфосфонатов, проанализированы ее преимущества и перспективы использования.
This review provides current data about the efficacy, safety and tolerability of oral and parenteral forms of ibandronic acid, as well as its use in the complex treatment of systemic osteoporosis and its complications according to the results of randomized clinical trials and meta-analysеs. In addition, the results of comparative studies on the efficacy of ibandronic acid and other bisphosphonates are presented, its advantages and perspectives are analyzed.
ібандронова кислота; ібандронат; Бонвіва; остеопороз; огляд
ибандроновая кислота; ибандронат; Бонвива; остеопороз; обзор
іbandronic acid; іbandronate; Bonvivа; osteoporosis; review
На сьогодні, незважаючи на значні успіхи в лікуванні системного остеопорозу та його ускладнень, збільшення загальної тривалості життя населення в цілому й кількості постменопаузальних жінок зокрема сприяє зростанню частоти остеопоротичних переломів, зниженню якості життя хворих і збільшенню медико–соціальних витрат на профілактику й лікування захворювання [1, 2]. Серед антиостео–поротичних засобів, які на сьогодні використовують для лікування остеопорозу та його ускладнень, найчисленнішу групу становлять бісфосфонати (БФ), що ефективно зменшують темпи кісткової резорбції й знижують ризик низькоенергетичних переломів різної локалізації.
Місце ібандронату в лінійці бісфосфонатів
Ібандронова кислота, або ібандронат (ІБ), є представником класу БФ, відомих ще з середини XIX століття: вони були вперше синтезовані в 1865 р. Проте лише з 60–х років минулого сторіччя на основі БФ були створені лікарські засоби для лікування захворювань кісткової тканини й порушень метаболізму кальцію.
Бісфосфонати були відкриті при дослідженні їх аналогів — пірофосфатів, з якими БФ мають схожі хімічні й фізичні властивості. Пірофосфати широко використовуються як інгібітори корозії або комплексні агенти в різних галузях промисловості при виробництві тканин, мінеральних добрив, пральних порошків, продуктів нафтопереробки завдяки їх властивості розчинювати карбонат кальцію. Основною структурною одиницею пірофосфатів є зв’язок Р–О–Р, тоді як у БФ атом кисню замінений на атом вуглецю (Р–С–Р), що забезпечує їх стійкість до ферментативного гідролізу й розширює спектр дії [3–6].
Залежно від хімічної будови БФ поділяють на два класи: ті, що не містять атом азоту (етидронат, клодронат, тилудронат та ін.), і азотумісні БФ (памідронат, алендронат, ібандронат, ризедронат, золедронат та ін.), які відрізняються не тільки за будовою, тропністю до кристалів гідроксилапатиту й силою інгібуючої дії ферментів мевалонатного шляху, але й за клінічною ефективністю. Представники першого класу БФ метаболізуються внутрішньоклітинно остеокластами до цитотоксичних аналогів аденозинтрифосфату, тоді як азотумісні БФ мають більш виражену антирезорбтивну активність за рахунок індукції апоптозу шляхом гальмування дії ферменту фарнезилпірофосфатсинтетази в остеокластах і їх попередниках [3–6].
На сьогодні БФ використовують для лікування системного остеопорозу, хвороби Педжета, недосконалого остеогенезу й метастатичних ушкоджень кісток.
Ібандронат є натрієвою сіллю 1–гідрокси–3–метилпентиламінопропіліден–бісфосфонової кислоти, високоактивним БФ, що ефективно знижує темпи резорбції кісткової тканини й позитивно впливає на ризик переломів. Ібандронат містить гідроксильну групу, що збільшує силу зв’язку з кістковою тканиною, на першому радикалі бічного ланцюга й азотну групу, пов’язану з трьома вуглецевими радикалами, на другому радикалі. Ці структурні особливості збільшують антирезорбційні властивості ІБ порівняно з алендронатом і ризедронатом у 2 і 4 рази відповідно [7]. Порівняно з алендронатом ІБ більшою мірою пригнічує активність фарнезилпірофосфатсинтетази, що, на думку деяких авторів, може пояснити більш швидкий початок його дії. Крім того, він має більшу спорідненість до кристалів гідроксилапатиту порівняно з ризедронатом, що може впливати на його розподіл у кістковій тканині різних регіонів скелета [3, 4]. На сьогодні завдяки результатам численних рандомізованих досліджень і метааналізів ІБ широко використовують у формах для перорального й парентерального прийому в багатьох країнах Європи та Америки для лікування системного остеопорозу та його ускладнень.
Ефективність ібандронату: результати рандомізованих досліджень
Одне з перших рандомізованих подвійних сліпих плацебо–контрольованих досліджень ефективності й безпечності перорального ІБ BONE (iBandronate Osteoporosis vertebral fracture trial in North America and Europe) [8], що тривало 3 роки, оцінювало ефективність і безпечність 2 доз (2,5 мг/д чи 20 мг через день, 12 доз кожні 3 міс.) у 2946 жінок віком 55–80 років, які були в постменопаузі щонайменше 5 років і мали в анамнезі переломи тіл хребців (від одного до чотирьох на рівні Th4–L4) і показники мінеральної щільності кісткової тканини (МЩКТ) на рівні поперекового відділу хребта від –2 до –5 SD (за показником Т згідно з результатами двохенергетичної рентгенівської абсорбціометрії (ДРА)) принаймні в одному поперековому хребці (L1–L4). Важливо зазначити, що, незважаючи на можливі побічні ефекти усіх пероральних БФ щодо шлунково–кишкового тракту (ШКТ), пацієнти з даною патологією не були виключені з цього дослідження. Додатково всі пацієнтки отримували 500 мг/д кальцію і 400 МО/д холекальциферолу. Первинною кінцевою точкою даного дослідження були нові морфометрично підтверджені вертебральні переломи (МПВП). Дослідження продемонструвало вірогідне зниження кількості нових МПВП в обох групах, які отримували ІБ, порівняно з плацебо (зниження відносного ризику (ВР) на 62 і 50 %; р < 0,01 для обох підгруп) через 3 роки лікування й клінічно значущих переломів тіл хребців (КЗПХ) на 49 і 48 % відповідно (р < 0,05 для обох підгруп) без вірогідних відмінностей між групами активного лікування. Зниження ВР невертебральних переломів (НВП) було продемонстровано лише в підгрупі з показником T (за даними ДРА) ≤ –3,0 SD, що становило 69 % через 3 роки лікування.
Проведені в подальшому рost hoc аналізи даного дослідження встановили вірогідне зменшення частоти нових помірно виражених і виражених вертебральних деформацій при використанні перорального ІБ порівняно з плацебо (зменшення ВР через 1 рік на 59 % (р = 0,02), 2 роки (р = 0,0004), 3 роки (р < 0,0001)) [9] без вірогідних відмінностей ефективності препарату у хворих, молодших чи старших від 70 років [10].
Оскільки тривалий щоденний прийом препаратів, зокрема БФ, негативно впливає на показники комплаєнтності, можливість використання режимів з більш рідким прийомом препаратів має надзвичайно важливе значення для досягнення терапевтичного ефекту.
У рандомізованому подвійному дослідженні за участю 235 жінок віком 53–80 років (постменопаузальний період щонайменше 3 роки й показник Т (за даними ДРА) на рівні поперекового відділу хребта –2,0 SD) порівняння перорального щоденного прийому 2,5 мг ІБ з його щотижневим прийомом (20 мг) протягом 48 тижнів також продемонструвало вірогідне збільшення показників МЩКТ на 3,4 і 3,5 % на рівні L1–L4 відповідно, на рівні стегнової кістки — на 2,1 і 1,7 % відповідно [11].
Ефективність і безпечність ще більш рідкого призначення ІБ (1 раз на місяць) вивчена у 2–річному мультицентровому рандомізованому подвійному сліпому плацебо–контрольованому дослідженні MOBILE (Monthly Oral iBandronate In LadiEs) [12–14], у якому взяли участь 1609 постменопаузальних жінок з остеопорозом із різних країн світу віком 55–80 років з тривалістю постменопаузи щонайменше 5 років і показником Т (за результатами ДРА) на рівні поперекового відділу хребта від –2,5 до –5,1 SD. Для аналізу було виділено 4 групи, які приймали ІБ перорально: 2,5 мг щоденно, 50 мг двічі протягом місяця, 100 мг одноразово щомісяця чи 150 мг одноразово щомісяця. Усі учасники дослідження отримували додатково щоденно 500 мг кальцію і 400 МО холекальциферолу. Аналіз результатів встановив вірогідне збільшення показників МЩКТ поперекового відділу хребта на 3,9; 4,3; 4,1 і 4,9 % у вище–зазначених групах відповідно, проте показники жінок, які отримували 150 мг ІБ щомісячно, були вірогідно вищими порівняно з іншими режимами прийому (р < 0,01). Показники МЩКТ стегнової кістки також збільшувались на 2–3 % у всіх групах без вірогідних відмінностей між ними.
Продовжене 5–річне порівняльне дослідження ефективності 100 і 150 мг ІБ щомісячно також продемонструвало збільшення показників МЩКТ хребта відповідно на 8,2 % (95% довірчий інтервал (ДІ): 7,2–9,2 %) і 8,4 % (95% ДІ: 7,5–9,4 %). Подальша динаміка показників МЩКТ хребта при прийомі ІБ у дозі 150 мг/міс через 3, 4 і 5 років лікування становила 1,3; 1,8 і 2 % відповідно. Через 1, 2 і 3 роки лікування МЩКТ стегнової кістки збільшилася на 3,4 % (95% ДІ: 2,8–4,0 %) при використанні ІБ у дозі 100 мг/міс і на 4,1 % (95% ДІ: 3,5–4,7) — у групі, яка отримувала ІБ у дозі 150 мг/міс. Через 5 років лікування МЩКТ стегнової кістки збільшилась на 3,0 і 3,5 % відповідно у групах, які отримували ІБ у дозі 100 і 150 мг/міс ІБ.
Ефективність і безпечність 2 схем внутрішньовенного введення ІБ (2 мг кожні 2 міс. або 3 мг кожні 3 міс.) порівняно з його пероральним застосуванням (2,5 мг щодня) проаналізована у 2–річному рандомізованому дослідженні DIVA (The Dosing IntraVenous Administration) [15, 16] за участю 1395 жінок у пост–менопаузі (тривалість 3 роки й більше) віком 55–80 років і показником Т (за даними ДРА) на рівні L2–L4 менше від –2,5 SD. Дане дослідження продемонструвало вірогідне збільшення МЩКТ хребта через 1 рік лікування у вищезазначених групах на 5,1; 4,8 і 3,8 %, при цьому показники при парентеральному прийомі ІБ були вірогідно вищими порівняно з відповідними при пероральному прийомі (р < 0,01). МЩКТ стегнової кістки через 1 рік лікування становила у вищезазначених групах 2,6; 2,4 і 1,8 % відповідно, при цьому ефективність парентерального введення ІБ була вірогідно вищою (р = 0,05).
У 5–річному відкритому довгостроковому продовженні даного дослідження за участю 781 жінки, які приймали парентерально ІБ у режимі 2 мг кожні 2 місяці чи 3 мг кожні 3 місяці, продемонстровано збільшення показників МЩКТ поперекового відділу хребта через 5 років лікування на 8,4 і 8,1 % відповідно. МЩКТ стегнової кістки вірогідно зростала протягом перших 3 років спостереження з подальшим плато на 4–5–му році терапії в обох групах.
У подвійному сліпому плацебо–контрольованому рандомізованому дослідженні III фази [17] за участю 2862 жінок віком 55–76 років із постменопаузальним остеопорозом і переломами тіл хребців в анамнезі (до 4 на рівні L1–L4, показник T від –2,0 до –5,0 SD у ≥ 1 хребці) оцінена ефективність двох парентеральних доз ІБ (1,0 і 0,5 мг один раз на 3 міс.) щодо запобігання остеопоротичним переломам. Усі досліджувані додатково отримували вітамін D (400 МО) і кальцій (500 мг) щоденно. Первинною кінцевою точкою була частота нових МПВП через 3 роки лікування. Незважаючи на тенденцію до зниження частоти вищезазначених переломів у групах активного лікування порівняно з плацебо (9,2; 8,7 і 10,7 % у групах 1 мг, 0,5 мг і плацебо відповідно), а також частоти НВП і переломів стегнової кістки зокрема, величина цього зниження була субоптимальною й недостатньою для досягнення статистичної значущості. У досліджуваних дозах парентеральне введення ІБ викликало дозозалежне, але порівняно невелике збільшення МЩКТ поперекового відділу хребта (4,0 і 2,9 % відповідно) і зменшення рівня біохімічних маркерів кісткового ремоделювання порівняно з плацебо. У зв’язку з отриманими результатами авторами зроблено висновок про недостатньо високу дозу ІБ для лікування постменопаузального остеопорозу й необхідність використання більш високих доз.
Ця гіпотеза отримала своє підтвердження в рандомізованому подвійному сліпому плацебо–конт–рольованому дослідженні IRIS (Intermittent Regimen intravenous Ibandronate Study) [18], у якому проводили порівняння ефективності 1 та 2 мг парентерального введення ІБ щоквартально у 520 жінок віком 55–75 років із постменопаузальним остеопорозом (показник Т на рівні L1–L4 < –2,5 SD). Терапія з використанням 2 мг ІБ через 12 міс. лікування приводила до вірогідно кращої динаміки показників МЩКТ і маркерів кісткового ремоделювання, ніж доза 1 мг і плацебо (динаміка МЩКТ на рівні поперекового відділу хребта становила відповідно 5,0; 2,8 і –0,4 %, на рівні стегнової кістки — 2,9; 2,2 і 0,6 %), з порівнянною частотою побічних реакцій. Динаміка показника резорбції кісткової тканини — телопептиду колагену I типу (CTX) у сироватці крові й сечі становила 62,5 і 61 % відповідно для дози 2 мг і 43,5 і 42 % — для дози 1 мг.
Деякі дослідники висловлюють погляд, що парентеральна терапія ІБ має переваги щодо зниження ризику переломів порівняно з прийомом пероральної форми. У рандомізованому подвійному сліпому плацебо–контрольованому дослідженні ІІІ фази MOVEST (Monthly Oral VErsus intravenouS ibandronaTe) оцінено ефективність і безпечність щомісячного перорального чи парентерального (внутрішньовенного) введення ІБ у японських жінок. У 422 амбулаторних пацієнток віком ≥ 55 років із пост–менопаузальним остеопорозом вивчена динаміка показників МЩКТ поперекового відділу хребта (первинна точка) через 12 міс. терапії IБ перорально (100 мг/міс разом із парентеральним плацебо) чи внутрішньовенно (1 мг/міс, ліцензована доза в Японії, разом із пероральним плацебо). Встановлено вірогідне збільшення показників МЩКТ в обох групах: динаміка показників порівняно з вихідними при пероральному прийомі становила 5,22 % (95% ДІ: 4,65–5,80 %), при парентеральному — 5,34 % (95% ДІ: 4,78–5,90 %) і не відрізнялась залежно від способу прийому препарату. Відмінності між групами становили –0,23 % (95% ДІ: від –0,97 до 0,51). Динаміка показників МЩКТ в інших регіонах скелета вірогідно не відрізнялась між групами, як і показники біохімічних маркерів кісткового ремоделювання. Дані щодо безпечності й комплаєнтності не відрізнялися від даних, отриманих у попередніх рандомізованих дослідженнях [19].
Надалі авторами проаналізована ефективність ІБ у різних підгрупах хворих [20]. При поділі обстежених на групи залежно від вихідних значень МЩКТ хребта (показник T (за даними ДРА) ≥ –3,0 або < –3,0 SD на момент включення в дослідження) встановлено, що динаміка показників МЩКТ становила 4,42 % (95% ДІ: 3,64–5,21 %) і 5,79 % (95% ДI: 4,99–6,59 %) відповідно. При використанні різних форм препарату (пероральна чи парентеральна) збільшення показників МЩКТ хребта становило 4,60 % (95% ДI: 3,77–5,44 %) і 5,83 % (95% ДI: 5,07–6,58 %) відповідно.
Збільшення показника МЩКТ у пацієнтів із переломами тіл хребців або без них в анамнезі становило 5,21 % (95% ДI: 4,11–6,31 %) і 5,23 % (95% ДI: 4,55–5,91 %) при використанні пероральної форми ІБ і 5,01 % (95% ДI: 3,83–6,19 %) і 5,49 % (95% ДI: 4,86–6,12 %) — при використанні парентеральної форми й не відрізнялось у групах. Розподіл обстежених за віком (< 75 та ≥ 75 років) виявив вірогідне збільшення показників МЩКТ на 5,46 % (95% ДI: 4,83–6,09 %) і 4,51 % (95% ДI: 3,17–5,85 %) відповідно при використанні перорального ІБ і 5,25 % (95% ДI: 4,64–5,86 %) і 5,77 % (95% ДI: 4,24–7,31 %) відповідно — при використанні його парентеральної форми. Відсутність відмінностей щодо ефективності ІБ встановлено й при поділі пацієнтів за вихідним рівнем вітаміну D (≥ 20 або < 20 нг/мл) і лікуванням БФ в анамнезі.
Ефективність і безпечність застосування 150 мг/міс перорального ІБ у чоловіків віком ≥ 30 років з низькими показниками МЩКТ (первинного походження, ідіопатичного характеру чи пов’язаних з гіпогонадизмом (n = 132)) продемонстрована у 12–місячному рандомізованому подвійному сліпому плацебо–контрольованому дослідженні STRONG (STudy Researching Osteoporosis iN Guys). Усі чоловіки додатково отримували карбонат кальцію (1000 мг/д) і вітамін D (400 МО/д). Автори підтвердили вірогідно більше підвищення показників МЩКТ поперекового відділу хребта через 12 міс. лікування в групі, яка отримувала ІБ, порівняно з плацебо (3,5 проти 0,9 % відповідно; різниця 2,6 %; p < 0,001). Подібна динаміка показників отримана й при аналізі МЩКТ на рівні стегнової кістки (1,8 проти –0,3 %; різниця 2,1 %; p < 0,001), її шийки (1,2 проти –0,2 %; різниця 1,4 %; p = 0,01) і великого вертлюга (2,2 проти 0,4 %; різниця 1,7 %; p < 0,005). У чоловіків, які завершили участь у дослідженні й дотримувались рекомендацій щодо лікування, відсоток зниження середнього рівня біохімічних маркерів кісткового ремоделювання (сироваткових CTX і кістково–специфічної лужної фосфатази (BSAP)) від вихідного рівня був також більшим при використанні ІБ порівняно з плацебо (p ≤ 0,001 для обох показників), при цьому була відмічена добра переносимість препарату й висока прихильність до лікування [21].
Позитивний ефект ІБ у лікуванні системного остеопорозу та його ускладнень отриманий і в інших рандомізованих дослідженнях (MOTION (The Monthly Oral Therapy with Ibandronate for Osteoporosis intervention), MOVER (MOnthly intraVenous ibandronatE versus daily oral Risedronate), TRIO (Тhree oral bisphosphonate therapies on the peripheral skeleton in postmenopausal osteoporosis) та ін.).
Безпечність і переносимість ібандронату
На сьогодні у численних рандомізованих і постмаркетингових дослідженнях продемонстровано добрий профіль безпечності різних БФ у лікуванні системного остеопорозу. Загальновідомо, що характер і частота побічних реакцій при застосуванні БФ відрізняються залежно від форми введення і частоти прийому [3, 4]. Для пероральних БФ більш частими побічними реакціями є прояви з боку ШКТ — езофагіт, диспепсія, нудота, абдомінальний біль тощо, тоді як для парентеральних форм — грипоподібні реакції. При коректному підборі форми й режиму введення й урахуванні анамнестичних особливостей хворого вони рідко є причиною переривання лікування. Тяжкими, хоча й рідкісними ускладненнями при прийомі БФ є атипові переломи стегнової кістки й остеонекроз верхньої щелепи, проте вони більш часто виникають при застосуванні надвисоких доз БФ, які використовують у хворих з онкологічною патологією, а також при проведенні імуносупресивної терапії.
Безпечність пероральних і парентеральних форм ІБ у хворих із системним остеопорозом і його ускладненнями доведена в багатьох дослідженнях. Так, порівняльна оцінка перорального прийому щоденної (2,5 мг) і щомісячної (150 мг) дози ІБ протягом 12 міс. спостереження у дослідженні MOBILE продемонструвала порівнянну частоту побічних реакцій при обох режимах призначення препарату. Частота усіх побічних реакцій, пов’язаних із прийомом препарату при використанні дози 150 мг/міс, становила 30,0 %, тяжких побічних реакцій, пов’язаних з прийомом препарату, — 0,3 %. Побічні ефекти з боку верхніх відділів ШКТ зареєстровано у 18 %, і їх частка була співставна з відповідною в групі пацієнтів, які прий–мали нестероїдні протизапальні препарати (18 %). Щоденний пероральний прийом ІБ демонстрував вищу частоту побічних реакцій з боку верхніх відділів ШКТ (38 %) порівняно з щомісячною –пероральною терапією (20 %). Грипоподібні симптоми після використання парентеральних форм ІБ тривали не більше 72 годин і були більш частими при використанні щомісячної пероральної форми (8 %) порівняно з щоденною (3 %). 5–річні рандомізовані дослідження щодо безпеки пероральних і парентеральних форм ІБ не виявили випадків зниження функції нирок, остеонекрозу щелепи чи атипових переломів.
Подібний профіль переносимості ІБ продемонстрований і в іншому рандомізованому дослідженні — DIVA. Найбільш частими побічними реакціями були диспепсія (3,4–4,1 %), біль в епігастрії (3,0–4,1 %), артралгія (2,4–3,6 %) і грипоподібні реакції (0,9–4,1 %) за відсутності збільшення частоти побічних реакцій з боку нирок чи остеонекрозу щелепи. Частота усіх побічних реакцій, пов’язаних із прийомом препарату при використанні дози 150 мг/міс, становила 39,0 й 33,0 % на тлі парентеральної щоквартальної терапії ІБ.
Прихильність до терапії ібандронатом
На сьогодні важливою проблемою, що виникає при лікуванні остеопорозу, є належна прихильність до довготривалого використання антиостеопоротичних засобів [22–24]. І хоча ця проблема не є специфічною для хворих з остеопорозом, а актуальна й для пацієнтів з іншими хронічними захворюваннями, які вимушені тривало приймати терапію, сучасна фармацевтична галузь розвивається в напрямку створення лікарських засобів із більш зручним для хворого режимом більш рідкого введення препаратів. У численних дослідженнях продемонстровано, що щоденний і щотижневий прийом антиостеопоротичних засобів пов’язаний з низькою прихильністю до антиостеопоротичної терапії, що, безумовно, впливає на її результати.
На сьогодні в численних мультицентрових дослідженнях продемонстрована краща прихильність до використання щомісячного чи щоквартального прийому ІБ порівняно з іншими пероральними антиостеопоротичними засобами. Так, у 6–місячних рандомізованих дослідженнях BALTO (Boniva ALendronate Trial in Osteoporosis) І [25] і ІІ [26] вивчено прихильність до використання антиостеопоротичних препаратів у 692 постменопаузальних жінок (BALTO І — 342 жінки із США, BALTO ІІ — 350 жінок із США, Франції й Німеччини). Пацієнтки були поділені на 2 групи: І група отримувала ІБ 150 мг один раз на місяць протягом 3 міс., ІІ група — алендронат 70 мг 1 раз на тиждень. Через 3 міс. без будь–якої перерви відбулась заміна препаратів, і така терапія тривала ще 3 міс. В обох дослідженнях більшою прихильність до лікування була в групі жінок, які отримували терапію 1 раз на місяць (71,4 та 70,6 % (p < 0,0001) у BALTO І і ІІ відповідно). Більшість обстежених віддавали перевагу терапії 1 раз на місяць (61,2 та 81,5 % у BALTO І і ІІ відповідно). 74,6 % жінок у дослідженні BALTO І і 76,6 % — у дослідженні BALTO ІІ вважали терапію 1 раз на місяць більш зручною порівняно з щотижневим лікуванням алендронатом.
Інше 6–місячне порівняльне рандомізоване відкрите мультицентрове дослідження щодо вивчення прихильності до антиостеопоротичного лікування ІБ (150 мг 1 раз на місяць) та алендронатом (70 мг 1 раз на тиждень) PERSIST (PERsistence Study of Ibandronate verSus alendronte) проведене у Великій Британії за участю 1103 постменопаузальних жінок. Дослідження проводили лікарі первинної ланки з обмеженим лімітом часу (для максимального наближення процедур дослідження до умов реальної клінічної практики). Крім медикаментозної терапії, пацієнтки 1–ї групи були залучені до програми їх підтримки, яка існує у Великій Британії для ІБ і включає отримання інформаційного листка щодо остеопорозу й телефонний дзвінок за 1–3 дні до запланованого прийому препарату спеціально навченої медсестри, яка нагадує пацієнтам про необхідність прийому препарату, його режим і відповідає на запитання хворого щодо лікування. Дане дослідження також підтвердило кращу прихильність до терапії ІБ на тлі додаткової інформаційної підтримки пацієнта (56,6 % у першій групі та 38,6 % у другій групі, p < 0,0001). Частка жінок, які приймали алендронат і не завершили участь у дослідженні, була вірогідно вищою (25,3 %) порівняно з відповідним показником у групі, що приймала ІБ (19,6 %, р = 0,02), незважаючи на відсутність відмінностей у частоті побічних реакцій, які стали причиною вибування хворих з дослідження (р = 0,93). Хоча б один побічний ефект протягом дослідження відмічено в 68,5 % жінок, які приймали ІБ, і 74,3 % пацієнток, які отримували алендронат (без статистично вірогідних відмінностей між групами) [27].
Ще одне 6–місячне мультицентрове відкрите дослідження CURRENT із залученням 1678 постменопаузальних жінок, які отримували пероральні БФ з подальшим прийомом ІБ (150 мг 1 раз на місяць), продемонструвало вірогідне збільшення показника задоволеності терапією (з 17,0 % на момент початку прийому ІБ до 80,1 % через 6 міс. прийому). 73,6 % пацієнток надавали перевагу щомісячному прийому 150 мг ІБ порівняно з 8,1 % жінок, які надавали перевагу щотижневому прийому БФ [28].
Порівняльне 12–місячне проспективне відкрите мультицентрове дослідження пероральної (150 мг/міс) і парентеральної (3 мг щоквартально) дози PRIOR [29, 30] у постменопаузальних жінок з остеопорозом та остеопенією, які в минулому перервали прийом (щоденний чи щотижневий) БФ через побічні реакції з боку ШКТ, встановило високий показник прихильності як до пероральної (69,7 %), так і до парентеральної (82,9 %) терапії ІБ без вірогідних відмінностей показників між групами.
Окремо слід відмітити, що результати, отримані щодо ефективності й безпечності пероральної (150 мг щомісячно) і парентеральної (3 мг щоквартально) форм ІБ, отримані в рандомізованих дослідженнях із використанням оригінальної молекули, що зареєстрована в Україні як препарат під назвою Бонвіва. Даних щодо ефективності й безпечності генеричних форм ІБ, зокрема, у результатах порівняльних клінічних досліджень у доступній літературі не виявлено.
Оцінка ефективності ібандронату за даними метааналізів
Після успішного завершення рандомізованих досліджень BONE, MOBILE і DIVA, у яких була продемонстрована добра ефективність і безпечність використання ІБ у лікуванні системного остеопорозу, а також широкого застосування препарату в клінічній практиці, з’явились численні метааналізи [31–36], у яких проаналізовані накопичені дані щодо використання ІБ. У зв’язку з різною доступністю пероральних і парентеральних доз ІБ для коректного аналізу й зіставлення даних у них використовували показник річної кумулятивної експозиції (annual cumulative exposure, ACE) — доза препарату (в мг) на загальну кількість річних доз і коефіцієнт абсорбції (0,6 % для пероральних форм і 100 % — для внутрішньовенного використання). Для подальшого аналізу виділяли такі групи відповідно до показника АСЕ: висока (10,8 мг; 150 мг ІБ перорально щомісяця, 3 мг кожні 3 міс. чи 2 мг кожні 2 міс. парентерально), середня (5,5–7,2 мг) чи низька (2,0–4,0 мг; 2,5 мг щодня) категорія АСЕ.
В одному з перших метааналізів, проведених S.T. Harris і співавт. [31], який включав дані 8710 пацієнтів, використання високих доз ІБ за показником АСЕ призводило до зниження скоригованого ризику основних НВП (на 34,4 %, р = 0,03), усіх НВП (на 29,9 %, р = 0,041) і клінічно значущих переломів (на 28,8 %, р = 0,01) порівняно з групою плацебо. У пацієнтів, які отримували високі дози ІБ (за АСЕ), зареєстрована більша тривалість періоду до настання основних НВП (р = 0,03), усіх НВП (р = 0 ,025) і клінічно значущих переломів (р = 0,002).
У метааналізі, проведеному А. Cranney та співавт. [32] з використанням даних 8 рандомізованих досліджень (9753 пацієнти), також продемонстровано вірогідне зменшення ризику НВП у пацієнтів із високим рівнем АСЕ (150 мг ІБ перорально щомісяця, 3 мг кожні 3 міс. чи 2 мг кожні 2 міс. парентерально) порівняно з низьким його рівнем (2,5 мг/д перорального ІБ). Об’єднання вищих доз ІБ згідно з показником АСЕ (високої й середньої категорії) порівняно із застосуванням низьких (за результатами 2 рандомізованих досліджень) призводило до вірогідного зниження показників ризику НВП (ВР 0,62; 95% ДІ: 0,40–0,97; р = 0,04).
Ще один метааналіз, проведений А.І. Sebba та спів–авт. [33], що об’єднував дані 8710 пацієнтів з чотирьох рандомізованих досліджень ІІІ фази, вивчав взаємозв’язок між дозою ІБ, динамікою показників МЩКТ і ризиком переломів. Було продемонстровано, що МЩКТ хребта й стегнової кістки вірогідно збільшувалась зі зростанням дози ІБ. Негативний обернений зв’язок було виявлено між частотою усіх клінічно зареєстрованих переломів і показником МЩКТ хребта (р = 0,005), тоді як зв’язок між НВП і показниками МЩКТ стегнової кістки був нелінійним і невірогідним.
У 2014 році опубліковано ще один аналіз клінічної ефективності й безпечності ІБ [34], проведений на основі інформації з 168 публікацій за 2003–2013 роки, у який включені результати проведених рандомізованих досліджень і трьох попередніх метааналізів. На думку авторів, використання високих доз ІБ (150 мг перорально щомісячно чи внутрішньовенно щоквартально) порівняно з низькими (перорально 2,5 мг/д) приводить до більш вираженої динаміки показників МЩКТ й сприяє кращим показникам комплаєнтності.
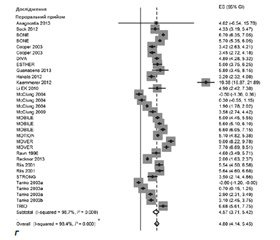
Ще один недавній метааналіз ефективності ІБ, опублікований у 2015 році [35], який включав дані з 1985 по 2015 рік з аналізом 34 досліджень (13 639 пацієнтів) з електронних баз даних EBSCO, Embase, Google Scholar, Ovid SP, PubMed, Scopus і Web of Science, за участю пацієнтів, які приймали ІБ (рис. 1), підтвердив вірогідне підвищення показників МЩКТ поперекового відділу хребта порівняно з вихідними показниками на 4,80 % (95% ДІ: 4,14–5,45 %; р < 0,0001). Відповідні показники при пероральному й внутрішньовенному прийомі ІБ становили 4,57 % (95% ДІ: 3,71–5,42 %) і 5,22 % (95% ДІ: 4,37–6,07 %), р < 0,0001 для обох показників. Усі режими прийому препарату приводили до вірогідного збільшення показників МЩКТ, крім двох пероральних (0,5 та 1 мг/д щодня). Лікування ІБ приводило до вірогідного підвищення показників МЩКТ стегнової кістки (загальний показник для усіх груп 2,30 % (95% ДІ: 1,96–2,64 %), 2,13 % (95% ДІ: 1,70–2,55 %) для пероральної форми введення і 2,63 % (95% ДІ: 2,07–3,20 %) для парентеральної форми (р < 0,0001 для усіх показників)). Прийом ІБ вірогідно знижував рівні сироваткових маркерів кісткової резорбції на 46,53 % (95% ДІ: від –53,16 до –39,91 %) для С–кінцевого телопептиду колагену 1–го типу, на 24,03 % (95% ДІ: від –31,28 до –16,77 %) для BSAP і на 50,17 % (95% ДІ: від –64,13 до –36,20 %) для N–кінцевого пропептиду проколагену 1–го типу (PINP) відповідно (р < 0,0001), при цьому рівень паратиреоїдного гормону в крові залишався незмінним. Даний метааналіз не виявив вірогідних відмінностей в ефективності парентеральної чи пероральної форм ІБ.
У ще одному аналізі, проведеному Z. Ma та спів–авт. [36] щодо виявлення предикторів ефективності ІБ у лікуванні системного остеопорозу (34 дослідження, 11 090 осіб, які приймали ІБ, 46 % із них мали переломи в анамнезі), встановлено, що збільшення тривалості лікування (від 1 до 5 років), вік, перелом в анамнезі, нижчі вихідні рівні показника Т (за даними ДРА) й вищі вихідні рівні CTX були пов’язані з вищою ефективністю ІБ у позитивній динаміці МЩКТ як поперекового відділу хребта, так і стегнової кістки. Нижчі рівні вітаміну D й вищі рівні BSAP до початку лікування були пов’язані з більшим зростанням показника МЩКТ лише на рівні поперекового відділу хребта. Крім того, у пост–менопаузальних жінок з остеопорозом чи зниженими показниками МЩКТ, як на рівні поперекового відділу хребта, так і стегнової кістки більша їх динаміка була пов’язана з тривалістю постменопаузального періоду, тоді як знижений індекс маси тіла був пов’язаний лише з динамікою показника МЩКТ на рівні поперекового відділу хребта [36].
Порівняльна оцінка ефективності різних бісфосфонатів у лікуванні системного остеопорозу
На сьогодні продовжуються накопичуватись дані щодо ефективності й безпечності ІБ як залежно від форми його введення, так і порівняно з іншими БФ. Так, у 12–місячному оглядовому дослідженні VIBE (The eValuation of IBandronate Efficacy) з використанням двох національних баз даних при порівнянні частоти переломів більше ніж у 64 тис. пацієнтів, які мешкають у США, вивчено ефективність пероральних ІБ (щомісячний прийом) і алендронату й ризедронату (щотижневий прийом) [37]. У результаті дослідження встановлено, що частота будь–яких клінічних переломів в осіб, які приймали ІБ, була вірогідно нижчою (скоригований ВР 0,82, 95% ДІ: 0,66–1,00; р = 0,05) порівняно з пероральною щотижневою терапією алендронатом чи ризедронатом. Частота вертебральних переломів у пацієнтів, які отримували терапію ІБ, була вірогідно нижчою (скоригований ВР 0,36, 95% ДІ: 0,18–0,75, р = 0,006) порівняно з щотижневою терапією БФ, при цьому не встановлено вірогідних відмінностей між препаратами щодо зниження ризику переломів стегнової кістки.
У 2–річному відкритому рандомізованому конт–рольованому дослідженні TRIO [38] порівнювали вплив на периферичний скелет трьох антиостеопоротичних препаратів — ібандронату (Bonviva, Roche, 150 мг/міс), алендронату (Fosamax, Merck, 70 мг/тиждень) і ризедронату (Actonel, Warner Chilcott, 35 мг/тиждень). Усі обстежувані додатково отримували кальцій (1200 мг/д) і вітамін D (800 МО/д). У дослідженні взяли участь 172 постменопаузальні жінки віком 53–84 роки з показником Т (згідно з результатами ДРА) ≤ –2,5 SD на рівні хребта та/чи стегнової кістки або < –1,0 SD і низькоенергетичним переломом в анамнезі. Для моніторингу стабільності пристрою вивчали МЩКТ жінок у пременопаузі віком 33–40 років. Для оцінки ефективності лікування використовували не тільки вимірювання МЩКТ за допомогою ДРА (на рівні поперекового відділу хребта, стегнової й променевої кісток, усього скелета), але й ультразвукову денситометрію (п’яткової кістки й фаланг), периферичну кількісну комп’ютерну томографію (МЩКТ променевої й великогомілкової кісток), рентгенабсорбціо–метрію (МЩКТ фаланг). Авторами встановлено, що збільшення МЩКТ поперекового відділу хребта й усього скелета було вірогідно більшим у пацієнтів, які отримували ІБ та алендронат, ніж при використанні ризедронату. Вимірювання МЩКТ периферичного скелета виявило вірогідні зміни лише на рівні п’яткової й променевої кісток (регіон 33 %), показника широкосмугового ослаблення ультра–звуку за даними ультразвукової денситометрії в усіх трьох групах незалежно від виду БФ.
У подальшому оцінка динаміки біохімічних маркерів кісткового ремоделювання в жінок, які брали участь у дослідженні TRIO [39], виявила зниження рівня CTX і PINP до цільових у 70 % жінок незалежно від виду терапії, при чому більш виражене зниження через 12 тижнів терапії було в осіб, у яких їх рівні були вищими за норму на початку дослідження, — на 63 % (різниця 13 %, 95% ДІ: 0–27,1, р = 0,049), при добрих показниках комплаєнтності — на 67 % (різниця 15,9 %, 95% ДI: 6,3–25,5, р = 0,001). Динаміка показників МЩКТ була вищою у «відповідачів» на терапію порівняно з «невідповідачами», а вираженість змін біохімічних маркерів кісткового ремоделювання була більшою в групах жінок, які отримували Bonviva чи Fosamax порівняно з пацієнтками, які отримували Actonel.
Порівняння ефективності й безпечності однакової дози (150 мг/міс) ІБ і ризедронату, проведене з використанням баз даних MedLine і BIOSIS [40], продемонструвало вірогідне зменшення ВР нових вертебральних переломів на тлі прийому як ризедронату (на 41 %, р = 0,003), так і ІБ (на 49 %, р < 0,001) проти плацебо через 3 роки у двох рандомізованих дослідженнях III фази, при цьому ризик НВП знижувався на 39 %. При призначенні ризедронату (150 мг один раз на місяць) відзначалися менше зниження рівня маркерів ремоделювання кісткової тканини й відсутність відмінностей показників МЩКТ порівняно з його щоденним прийомом, тоді як призначення ІБ (150 мг один раз на місяць) привело до зниження біохімічних маркерів ремоделювання кісткової тканини до рівня пременопаузальних жінок, а показники динаміки МЩКТ у цій групі були вірогідно вищими, ніж при щоденному використанні препарату. Інтермітуючий режим призначення ІБ (150 мг 1 раз на місяць) демонстрував свою ефективність у зниженні ризику переломів у двох об’єднаних аналізах на відміну від ризедронату [40].
Український досвід використання ІБ у вигляді оригінального препарату Бонвіва оцінено в порівняльному дослідженні, проведеному В.В. Поворознюком і співавт. [41] за участю 39 постмено–паузальних жінок віком 55–69 років з низькими показниками МЩКТ (Т за даними ДРА ≤ –2,0 SD на рівні поперекового відділу хребта та/або стегнової кістки). Автори оцінювали динаміку вертебрального больового синдрому (ВБС) і показників ДРА. У даному дослідженні продемонстровано вірогідне зменшення вираженості ВБС на момент опитування вже через 3 міс. лікування (р = 0,008), яке було вірогідним і через 6 (р = 0,005) і 12 (р = 0,04) місяців. Крім того, встановлено вірогідне зменшення вираженості мінімального рівня болю (у найкращий період хвороби) через 6 (р < 0,05), 9 (р = 0,02) і 12 (р = 0,03) місяців терапії на відміну від показників групи порівняння. Через 12 міс. лікування встановлено вірогідне зменшення вираженості ВБС на момент опитування на 43,7 % і мінімального рівня болю (у найкращий період хвороби) — на 22,4 %. За період річного спостереження не виявлено вірогідних відмінностей показників вираженості середнього й максимального рівня болю, проте позитивна їх динаміка спостерігалась лише в пацієнток, які отримували Бонвіву.
Аналіз показників МЩКТ на рівні поперекового відділу хребта виявив їх вірогідне збільшення (р < 0,05) вже через 6 міс. лікування (2,5 %) на тлі відсутності вірогідних відмінностей у пацієнток групи порівняння. Позитивний вплив ІБ на показники МЩКТ хребта спостерігався і через 9 ( р < 0,001) і 12 (р < 0,02) місяців, динаміка показника становила 4,4 та 4,7 % відповідно за відсутності вірогідних відмінностей у хворих контрольної групи.
Прийом препарату Бонвіва також приводив до вірогідного, хоча й менш вираженого підвищення показника МЩКТ шийки стегнової кістки через 9 (р < 0,05) і 12 (р < 0,007) місяців, динаміка показника становила 1,6 і 2,8 % відповідно, тоді як зміни в контрольній групі були невірогідними (динаміка показника становила 0,6 і –0,3 %). Також авторами отримано вірогідне зростання показника МЩКТ усієї стегнової кістки (через 6 (р < 0,001), 9 (р < 0,0004) та 12 (р < 0,0002) місяців терапії, динаміка становила 2,1, 3,5 і 4,3 % відповідно) на тлі відсутності вірогідних змін у контрольній групі.
Отже, на сьогодні в численних рандомізованих дослідженнях, а також за результатами 5 існуючих метааналізів ІБ довів свою ефективність і безпечність при пероральному й парентеральному введенні в лікуванні системного остеопорозу з більшим зниженням ризику МПВП (50–62 %), усіх клінічно значущих переломів (48–49 %) й дещо меншим (30–38 %) зниженням ризику НВП через 3 роки лікування. Проте цей вплив на ризик НВП зростав (до 69 %) у підгрупах при аналізі ефективності препарату в пацієнтів з показником Т ≥ –3 SD (за даними ДРА). На сьогодні ІБ, як представник БФ, включений до європейських і американських рекомендацій щодо лікування остеопорозу в постменопаузальних жінок [42], чоловіків [43], а також глюкокортикоїд–індукованого остеопорозу [44]. Добра переносимість препарату, можливість використання як пероральних, так і парентеральних форм, високі показники комплаєнтності за рахунок використання інтермітуючих режимів (1 раз на місяць для пероральних форм і щоквартально для внутрішньовенних) дозволяє рекомендувати його для більш широкого впровадження в клінічну практику.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.

/42-1.jpg)