Журнал «Здоровье ребенка» Том 14, №3, 2019
Вернуться к номеру
Частота функціональних розладів біліарного тракту в дітей з атопічним дерматитом
Авторы: Сорокман Т.В., Макарова О.В.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Актуальність. Як відзначають багато авторів, тяжкість перебігу та вираженість атопічного дерматиту (АД) багато в чому залежать від функціонального стану органів травлення. Мета: дослідити частоту та проаналізувати особливості перебігу атопічного дерматиту в дітей із порушеннями в біліарній системі. Матеріали та методи. Проведене дослідження 168 дітей віком від 1 до 18 років, хворих на АД. Діагноз АД у дітей встановлювали згідно з діагностичними критеріями J.M. Hanifin та G. Rajka (1980). Усі пацієнти і їх батьки були анкетовані з використанням карти обстеження. Визначали загальний та специфічні IgE (педіатрична панель). Стан біліарної системи вивчали за допомогою ультрасонографії, біохімічних показників сироватки крові. Статистична обробка результатів досліджень здійснювалась за допомогою стандартних алгоритмів варіаційної статистики. Результати. За даними анкетування виявлені такі фактори ризику розвитку АД у дітей і підлітків: обтяжена спадковість (53,5 %), прояви алергії на першому році життя (62,5 %), високі рівні IgЕ (52,3 %); чинники, що викликають загострення АД (тригери): змішані алергени — 23,8 %, харчові алергени — 71,4 %, лікарські алергени — 17,8 %, побутові алергени — 5,9 %, пилкові алергени — 3,4 %, температурний фактор — 1,7 %, психоемоційний фактор — 1,7 %, неуточнені — 24,6 %; штучне вигодовування з народження — 13,1 %. Загальна тривалість маніфестації: до року — 11,3 %, від 1 до 5 років — 44,9 %, від 5 до 10 років — 23,8 %, понад 10 років — 20,3 %. Cереднє значення за шкалою SCORAD у пацієнтів із легким ступенем АД становило 14,01 ± 0,63 бала, із середнім ступенем АД — 31,04 ± 0,92 бала, у пацієнтів із тяжким ступенем — 56,17 ± 5,23 бала. Середній бал за шкалою EASI в обстежених пацієнтів віком від 5 до 7 років становив 8,67 ± 0,46. Підвищений рівень IgE відзначався у 52,3 %. При активному опитуванні та огляді ознаки функціонального розладу біліарного тракту виявлені в більшості пацієнтів — 109 (64,8 ± 3,2 %) дітей. При УЗД у 45 (42,8 %) із 109 дітей, які мали скарги, встановлено дисфункцію жовчного міхура. Збільшення розмірів печінки (до 10 %) без зміни ехоструктури та ехогенності спостерігалося у 26 (23,8 ± 0,8 %) дітей із АД. Висновки. З огляду на високу частоту функціональних порушень біліарного тракту дітям з АД доцільно проводити ультразвукове дослідження органів гепатобіліарної системи. На основі отриманих даних важливо проводити відповідну корекцію виявлених порушень у комплексному лікуванні АД.
Актуальность. Как отмечают многие авторы, тяжесть течения и выраженность атопического дерматита (АД) во многом зависят от функционального состояния органов пищеварения. Цель: исследовать частоту и проанализировать особенности течения атопического дерматита у детей с нарушениями билиарной системы. Материалы и методы. Обследовано 168 детей в возрасте от 1 до 18 лет с АД. Диагноз АД у детей выставляли согласно диагностическим критериям J.M. Hanifin и G. Rajka (1980). Все пациенты и их родители были анкетированы с использованием карты обследования. Изучали общий и специфические IgE (педиатрическая панель). Состояние билиарной системы изучали с помощью ультрасонографии, биохимических показателей сыворотки крови. Статистическая обработка результатов исследований осуществлялась с помощью стандартных алгоритмов вариационной статистики. Результаты. По данным анкетирования выявлены следующие факторы риска развития АД у детей и подростков: наследственность (53,5 %), проявления аллергии на первом году жизни (62,5 %), высокие уровни IgЕ (52,3 %); факторы, способствующие обострению АД (триггеры): смешанные аллергены — 23,8 %, пищевые аллергены — 71,4 %, лекарственные аллергены — 17,8 %, бытовые аллергены — 5,9 %, пыльцевые аллергены — 3,4 %, температурный фактор — 1,7 %, психоэмоциональный фактор — 1,7 %, неустановленные — 24,6 %; искусственное вскармливание с рождения (13,1 %); общая продолжительность манифестации АД: до года — 11,3 %, от 1 до 5 лет — 44,9 %, от 5 до 10 лет — 23,8 %, более 10 лет — 20,3 %. Среднее значение по шкале SCORAD у пациентов с легкой степенью АД составило 14,01 ± 0,63 балла, со средней степенью АД — 31,04 ± 0,92 балла, у пациентов с тяжелой степенью — 56,17 ± 5,23 балла. Средний балл по шкале EASI у обследованных пациентов в возрасте от 5 до 7 лет составил 8,67 ± 0,46. Повышенный уровень IgE отмечался у 52,3 % детей. При активном опросе и осмотре признаки функционального расстройства билиарного тракта обнаружены у большинства пациентов — 109 (64,8 ± 3,2 %) детей. При УЗИ у 45 (42,8 %) из 109 детей, которые имели жалобы, установлена дисфункция желчного пузыря. Увеличение размеров печени (до 10 %) без изменения эхоструктуры и эхогенность наблюдалось у 26 (23,8 ± 0,8 %) детей с АД. Выводы. С учетом высокой частоты функциональных нарушений билиарного тракта детям с АД целесообразно проводить ультразвуковое исследование органов пищеварительной системы. На основе полученных данных важно проводить соответствующую коррекцию выявленных нарушений в комплексном лечении АД.
Background. According to the data of numerous authors, the severity of atopic dermatitis (AD) strongly depends on the functional state of the digestive system. The purpose of the study is to analyze frequency and peculiarities of atopic dermatitis course in children with disorders in the biliary system. Materials and methods. A total of 168 children aged 1 to 18 years old with AD were studied. Diagnosis of AD in children was verified according to the diagnostic criteria of J.M. Hanifin and G. Rajka (1980). All patients and their parents were questioned using a survey record. General and specific IgE (pediatric panel) was determined. State of the biliary system was assessed using ultrasonography, biochemical parameters of blood serum. Statistical processing of research results was performed using standard algorithms of variation statistics. Results. According to the questionnaire results, the following risk factors for the development of AD in children and adolescents are found: burdened heredity (53.5 %), allergic manifestations during the 1st year of life (62.5 %), high IgE levels (52.3 %); factors causing exacerbation of AD (triggers): mixed allergens — 23.8 %, food allergens — 71.4 %, medicinal allergens — 17.8 %, household allergens — 5.9 %, pollen allergens — 3.4 %, temperature factor — 1.7 %, psychoemotional factor — 1.7 %, not specified — 24.6 %; artificial feeding from birth (13.1 %); the total duration of manifestation: up to a year — 11.3 %, from 1 to 5 years — 44.9 %, from 5 to 10 years — 23.8 %, more than 10 years — 20.3 %. The mean scoring value for SCORAD in patients with mild AD levels was 14.01 ± 0.63 points, with an average grade of AD of 31.04 ± 0.92 points, and in patients with severe degrees of 56.17 ± 5.23 points. The average score on the EASI scale in the examined patients aged 5 to 7 years was 8.67 ± 0.46 points. The elevated IgE level was registered in 52.3 %. The active survey and observation revealed the signs of functional disorder of the biliary tract in the majority of patients — 109 (64.8 ± 3.2 %) children. The ultrasound examination demonstrated gallbladder dysfunction in 45 (42.8 %) out of 109 children with complaints. Increase liver (up to 10 %) without changes in echostructure and echogenicity was observed in 26 (23.8 ± 0.8 %) children with AD. Conclusions. Given a high frequency of functional disorders of the biliary tract in children with AD, it is recommended to perform an ultrasound examination of the hepatobiliary system and to make the appropriate correction of the revealed violations in the complex treatment of AD on the basis of the obtained data.
діти; атопічний дерматит; функціональні розлади біліарного тракту
дети; атопический дерматит; функциональные расстройства билиарного тракта
children; atopic dermatitis; functional disorders of the biliary tract
Вступ
За визначенням Collegium Internationale Allergologicum (CIA), атопічний дерматит (AД) — хронічне запальне захворювання, яке має рецидивні екзематозні ураження шкіри, що супроводжуються інтенсивним свербежем [1]. Розвиток AД ґрунтується на генетичній схильності, яка визначає як бар’єрну функцію шкіри, так і переважну запальну реакцію Т-хелперів 2-го типу (T-helper 2 (Th2)). Поширеність АД динамічно зростає. Так, у дослідженнях [2], проведених на початку 1960-х років, встановили поширеність АД не більше ніж 3 %. Результати Міжнародного стандартизованого епідеміологічного дослідження (The International Study of Asthma and Allergies in Childhood, ISAAC) показали зростання показника поширеності АД у дітей в різних країнах з 2005 до 2012 року з 5–7 % до 15–40 % [3]. У дослідженні [4] також показане зростання поширеності АД. В Україні поширеність АД коливається від 5 до 20 % [5, 6]. Існуюча сьогодні тенденція до зростання частоти алергічних захворювань, у тому числі й атопічного дерматиту, високий ризик розвитку тяжких ускладнень, які погіршують якість життя хворих та їх близьких, свідчать про актуальність даної проблеми [7–11]. У численних дослідженнях показано, що в кожної дитини, хворої на АД, визначаються порушення з боку шлунково-кишкового тракту, який виконує функцію захисного бар’єра для будь-яких патогенів, що надходять цим шляхом. Захворювання органів травлення є однією з причин виникнення й підтримки хронічних дерматозів у людини. Як відзначають багато авторів, тяжкість перебігу та вираженість АД багато в чому залежать від функціонального стану органів травлення [12–18].
Мета: дослідити частоту та проаналізувати особливості перебігу атопічного дерматиту в дітей із порушеннями в біліарній системі.
Матеріали та методи
Проведено дослідження 168 дітей віком від 1 до 18 років, хворих на АД, які перебували на лікуванні в Чернівецькій обласній дитячій клінічній лікарні впродовж 2012–2018 рр. Середній вік обстежених з АД становив 9,4 ± 0,6 року, серед них 88 хлопчиків та 80 дівчаток. Критеріями включення були: вік пацієнтів від 1 року до 18 років; проживання в Чернівецькій області; підтверджений діагноз АД; інформована згода пацієнта та його батьків. Критеріями виключення були: вік дітей до 1 року; поєднана алергічна та інша патологія запального генезу. Контрольну групу становили 30 практично здорових дітей. Критеріями включення дітей у групу порівняння були: відсутність алергічних захворювань, хронічних та інфекційних захворювань; необтяжений спадковий анамнез щодо атопії; відповідність показників загального аналізу крові й сечі віковій нормі.
Діагноз АД у дітей встановлювали згідно з діагностичними критеріями J.M. Hanifin та G. Rajka (1980) [19]. Діти розподілені на групи за тяжкістю клінічного перебігу захворювання (легкий, середньотяжкий, тяжкий). Тяжкість АД встановлювали за допомогою дерматологічного індексу SCORAD-TIS (Scoring of Atopic Dermatitis — The Item Severity). Проводили оцінку тільки об’єктивних даних із визначенням індексу за формулою: SCORAD-TIS = А / 5 + 7В / 2, де: А — поширеність шкірних уражень, В — інтенсивність клінічних проявів. При цьому враховували 6 ознак інтенсивності уражень у вигляді еритеми, набряку/папул, мокнуття/кірок, екскоріації, ліхеніфікації, сухості за шкалою від 0 до 3 балів: 0 — відсутність, 1 — слабко виражена, 2 — помірно виражена, 3 — різко виражена. Поширеність оцінювали за правилом «дев’ятки», де за одиницю прийнята площа долонної поверхні кисті.
У дітей віком 5–7 років використовували шкалу Eczema Area Severity Index (EASI) [20]. Спочатку розраховували площу ураження шкірних покривів: оцінювали окремо для голови й шиї, тулуба, верхніх і нижніх кінцівок від 1 бала до 6 балів залежно від відсотка уражених ділянок (табл. 1).
Інтенсивність вираженості морфологічних змін оцінювали в діапазоні від 0 до 3 балів: 0 — ураження відсутні, 1 — слабко виражені, 2 — помірно виражені, 3 — максимальна інтенсивність. Формула: EASI = A + B + C + D, де A — голова/шия: (E + I + + Ex + L) x Area x 0,2; B — тулуб: (E + I + Ex + L) ´ ´ Area ´ 0,3; C — верхні кінцівки: (E + I + Ex + L) ´ ´ Area ´ 0,2; D — нижні кінцівки: (E + I + Ex + L) ´ ´ Area ´ 0,3. Якщо EASI дорівнює 3–6, то загострення вважали легким, 7–9 — середньотяжким, 10 і понад — тяжким.
Усі пацієнти та їх батьки були анкетовані з використанням карти обстеження, що включала відомості про дебют захворювання, спадкову схильність, наявність супутньої патології та інших чинників ризику.
Параклінічні методи дослідження включали: периферичний аналіз крові з підрахунком лейкоцитарної формули та рівня еозинофілів, копроцитограму, визначення загального IgE в сироватці крові методом твердофазового хемілюмінесцентного імунометричного аналізу (тест-системи Immulite/Immulite 1000 Total IgE, «Simens», США) і специфічних IgE — педіатрична панель, методом імуноферментного аналізу (тест-системи «Euroimmun», Німеччина). Стан біліарної системи вивчали за допомогою ультрасонографії, біохімічних показників сироватки крові з визначенням активності печінкових ферментів: АЛТ, АСТ, ГГТП, загального білірубіну і його фракцій, загального холестерину, лужної фосфатази. Діагноз функціонального розладу біліарного тракту встановлювали відповідно до Уніфікованого клінічного протоколу медичної допомоги дітям із функціональними розладами жовчного міхура та сфінктера Одді (наказ МОЗ України № 59 від 29.01.2013 р.). Усім дітям на 2-й день обстеження проводили УЗД органів черевної порожнини вранці натще за стандартною методикою на апаратах «ALOKA-4000» (Японія), «Vivid S5» (Корея) конвексним датчиком із частотою 1,5–6 МГц і лінійним датчиком із частотою 4–13 МГц. У комплексне УЗД входили органи черевної порожнини: печінка, жовчний міхур, підшлункова залоза, селезінка. При дослідженні печінки й селезінки визначали розміри, структуру, ехогенність, контур, судинний рисунок, діаметр ворітної та селезінкової вен. Оцінювали форму та розміри жовчного міхура, товщину стінок, уміст його просвіту, а також діаметр і стінки жовчних проток.
Статистична обробка результатів досліджень здійснювалась за допомогою стандартних алгоритмів варіаційної статистики, для розрахунків використовували комп’ютерну програму Excel (Microsoft Office, США), Statistica 6.0 та on-line калькулятор SISA (Simple Interactive Statistical Analysis), із використанням кореляційного та параметричного аналізу. Середні величини подані у вигляді M ± m, де М — середнє значення показника, m — стандартна похибка середнього; n — обсяг аналізованої групи.
Результати та обговорення
Розподіл дітей відповідно до статі та тяжкості перебігу АД наведено в табл. 2 та на рис. 1.
Залежно від ступеня тяжкості АД діти розподілені на три групи. Першу групу становили пацієнти з АД легкого перебігу — 44 (28,5 %) дитини, другу групу — діти з АД середнього ступеня тяжкості — 100 (59,5 %) осіб, третю — діти з АД тяжкого безперервно-рецидивуючого перебігу — 24 (14,2 %) пацієнти.
За даними анкетування виявлені такі фактори ризику розвитку АД у дітей і підлітків:
1. Сприятливі фактори: обтяжена спадковість (алергічні захворювання в родичів) — 53,5 %, перебіг алергії в дитини: прояви алергії на першому році життя — 62,5 %, високі рівні IgЕ — 52,3 %.
2. Чинники, що викликають загострення АД (тригери): змішані алергени — 23,8 %, харчові алергени — 71,4 %, лікарські алергени — 17,8 %, побутові алергени — 5,9 %, пилкові алергени — 3,4 %, температурний фактор — 1,7 %, психоемоційний фактор — 1,7 %, неуточнені — 24,6 %.
3. Вигодовування: штучне з народження — 13,1 %, грудне менше ніж 6 місяців — 5,9 %, грудне понад 6 місяців — 53,5 %.
4. Загальна тривалість маніфестації: до року — 11,3 %, від 1 до 5 років — 44,9 %, від 5 до 10 років — 23,8 %, понад 10 років — 20,3 %.
У 100 % пацієнтів відзначалася сухість шкірних покривів. Звертало на себе увагу те, що сухість шкірних покривів у пацієнтів спостерігалася не тільки в осередках ураження, а й поза зонами ураження. Найбільш часто при огляді в дітей з АД відзначали екскоріації й розчоси — у 93,2 %, еритему — у 72 %, хейліт — у 44 %, папульозні елементи — у 38,1 %, фолікулярний гіперкератоз — у 32,2 %, тріщини за вухами — у 29,7 %. Найрідше траплялися екзема сосків — 1,7 % випадків, серединна тріщина губи — 0,5 %.
У досліджуваних пацієнтів з АД середній бал за шкалою SCORAD становив 32,53 ± 1,37 бала. Cереднє значення за шкалою SCORAD у пацієнтів із легким ступенем АД становило 14,01 ± 0,63 бали, із середнім ступенем АД — 31,04 ± 0,92 бала, у пацієнтів із тяжким ступенем — 56,17 ± 5,23 бала.
Середній бал за шкалою EASI в обстежених пацієнтів віком від 5 до 7 років становив 8,67 ± 0,46. Із 46 (27,3 %) дітей віком 5–7 років, які були включені в дослідження, легкий перебіг зареєстровано в 10 (21,7 %) осіб, середньої тяжкості — у 30 (65,3 %) та тяжкий перебіг — у 6 (13 %) дітей.
Скарги, що вказують на порушення функцій жовчовивідної системи, діти висловлювали рідко, проте при активному опитуванні та огляді такі симптоми, як нестійке або спастичне випорожнення, ознаки стеатореї, періодичний біль у животі, нудота й блювота після прийому жирної їжі, а також пальпаторне збільшення печінки й позитивні міхурові симптоми були виявлені в більшості пацієнтів — 109 (64,8 ± 3,2 %) дітей.
Патологія жовчного міхура проявлялася деформацією у вигляді перегинів його тіла або дна в 24,4 ± 2,4 % дітей. У 10 (5,9 %) дітей у просвіті міхура визначали повні й неповні перегородки.
Правильна форма жовчного міхура виявлена в 65,6 ± 1,8 % пацієнтів серед усіх дітей; вона превалювала в кожній групі, а лабільний перегин виявлено в 11 ± 3,2 % дітей. У всіх стінки міхура були тонкі, уміст міхура гомогенний. Деформація жовчного міхура зустрічалася в кожної четвертої дитини з першої групи і кожної п’ятої з другої та третьої груп із невеликою тенденцією зниження частоти при середньому й тяжкому перебігу.
Проведення проби з жовчогінним сніданком дозволило виявити в 45 (42,8 %) із 109 дітей, які мали скарги, зниження скорочувальної функції жовчного міхура, що було розцінене як дисфункція за гіпомоторним типом. У 12 (11 %) дітей зазначали підвищення скоротливої функції жовчного міхура, що було розцінене як дисфункція за гіпермоторним типом.
За даними ехографії відзначали ознаки халазії, дуоденогастрального і/або шлунково-стравохідного рефлюксів, що визначалося при візуалізації руху вмісту в протиприродному напрямку.
Збільшення розмірів печінки (до 10 %) без зміни ехоструктури та ехогенності спостерігали в 26 (23,8 ± 0,8 %) дітей з АД. Реактивні зміни печінки у вигляді зниження ехогенності паренхіми печінки й посилення судинного рисунка з ущільненням стінок судин печінки й жовчних проток візуалізувалися в 3,6 ± 0,1 % дітей. Збільшені лімфатичні вузли в воротах печінки правильної овальної форми, однорідної структури й нормальної ехогенності зареєстровані в 4,7 ± 0,3 % обстежених.
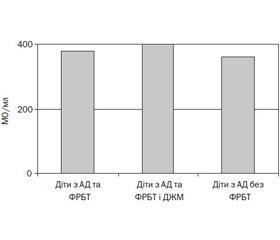
Підвищений рівень IgE відзначали в 52,3 % дітей. Середній рівень IgE в обстежених становив 371,3 ± 44,1 МО/мл. У пацієнтів із IgE-залежним АД середній рівень IgE становив 791,7 ± 88,3 МО/мл,
у підгрупі з IgE-незалежним АД — відповідно 35,86 ± 6,3 МО/мл. У дітей з АД та функціональними розладами біліарного тракту спостерігалася тенденція до підвищення рівня IgE, особливо в дітей із наявністю деформації жовчного міхура, однак вірогідно вищої концентрації не встановлено (p > 0,05; рис. 2).
Отже, отримані дані свідчать про взаємозв’язок двох патологічних станів: функціональних порушень біліарного тракту та АД. Наявність клінічних ознак порушення функції біліарного тракту в дітей з АД може бути оцінена як реакція на надходження алергенів, які викликають запалення або функціональні розлади моторики жовчовивідних шляхів. З іншого боку, порушення функції біліарного тракту можуть призводити до накопичення нерозщеплених макромолекул у просвіті кишечника, що може призводити до сенсибілізації організму дитини.
Висновки
З огляду на високу частоту функціональних порушень біліарного тракту дітям з АД доцільно проводити ультразвукове дослідження органів гепатобіліарної системи. На основі отриманих даних проводити відповідну корекцію виявлених порушень у комплексному лікуванні АД.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Simon D., Wollenberg A., Renz H., Simon H.U. Atopic Dermatitis: Collegium Internationale Allergologicum (CIA) Update 2019 // Int. Arch. Allergy Immunol. — 2019 Feb. — 8. — Р. 1-12. doi: 10.1159/000497383.
2. Ellis C., Luger T., Abeck D. et al. International Consensus Conference on Atopic Dermatitis II (ICCAD II): clinical update and current treatment strategies // Brit. J. Dermatol. — 2003. — 148, Suppl. 63. — Р. 3-10. PMID: 12694268.
3. Ellwood P., Asher M., Beasley R. et al. The International Study of Asthma and Allergies in Childhood (ISAAC): Phase Three rationale and methods // Int. J. Tuberc. Lung Dis. — 2005. — 9(1). — Р. 10-6.
4. Bridgman A.C., Eshtiaghi P., Cresswell-Melville А. et al. The Burden of Moderate to Severe Atopic Dermatitis in Canadian Children: A Cross-Sectional Survey // Cutan. J. Med. Surg. — 2018 Jul/Aug. — 22(4). — Р. 443-444. doi: 10.1177/1203475418761859.
5.Охотникова Е.Н. Атопический дерматит: взгляд педиатра // Клиническая иммунология. Аллергология. Инфектология. Спецвыпуск. — 2010. — № 1. — С. 65-73.
6. Kryuchko T.O., Holovanova I.A., Tkachenko O.Y. et al. Prevalence of risk factors of allergic diseases among children aged 8–9 years in Poltava region (the results of the first stage of the research) // Wiad. Lek. — 2018. — 71(3 pt 2). — Р. 699-704.
7. Yang E.J., Beck K.M., Sekhon S. et al. The impact of pediatric atopic dermatitis on families: A review // Pediatr. Dermatol. — 2019 Jan. — 36(1). — Р. 66-71. doi: 10.1111/pde.13727.
8. Barbarot S., Auziere S., Gadkari A. et al. Epidemiology of atopic dermatitis in adults: results from an international survey // Allergy. — 2018 Jun. — 73(6). — Р. 1284-93. doi: 10.1111/all.13401.
9. Kunsleben N., Rüdrich U., Gehring M. et al. IL-31 Induces Chemotaxis, Calcium Mobilization, Release of Reactive Oxygen Species, and CCL26 in Eosinophils: Which Are Capable to Release IL-31 // J. Invest. Dermatol. — 2015 Jul. — 135(7). — Р. 1908-11.doi: 10.1038/jid.2015.106. Epub 2015 Mar 19.
10. Ramirez F.D., Chen S., Langan S.M. et al. Association of Atopic Dermatitis with Sleep Quality in Children // JAMA Pediatr. — 2019 Mar. — 4. — e190025. doi: 10.1001/jamapediatrics.2019.0025.
11. Schmitt J., Chen C.M., Apfelbacher C. et al. LISA-plus Study Group. Infant eczema, infant sleeping problems, and mental health at 10 years of age: the prospective birth cohort study LISAplus // Allergy. — 2011 Mar. — 66(3). — Р. 404-11. doi: 10.1111/j.1398-9995.2010.02487.
12. Weidinger S., Novak N. Atopic dermatitis // Lancet. — 2016. — 387. — Р. 1109.doi: 10.1016/S0140-6736(15)00149-X.
13. Sicherer S.H. Clinical Aspects of Gastrointestinal Food Allergy in Childhood // Pediatrics. — 2003. — Vol. 111, № 6. — Р. 1609-1616.
14. Кобец Т.В., Гостищева Е.В. Анализ сочетанной патологии: атопический дерматит и функциональные нарушения билиарной системы у детей // Вестн. физиотерап. и курортол. — 2011. — (3). — С. 66-67.
15. Охотникова Е.Н. Гастроинтестинальная пищевая аллергия у детей // Клиническая иммунология. Аллергология. Инфектология. — 2013. — № 2. — С. 5-13.
16. Охотнікова О.М., Бондаренко Л.В., Іванова Т.П. та ін. Гастроінтестинальні порушення у дітей з атопічним дерматитом // Современная педиатрия. — 2014. — № 8 (64). — С. 104-109. doi: 10.15574/SP.2014.64.
17. Yaghmaie P., Koudelka C.W., Simpson E.L. Mental health comorbidity in patients with atopic dermatitis // J. Allergy Clin. Immunol. — 2013 Feb. — 131 (2). — Р. 428-33. doi: 10.1016/j.jaci.2012.10.041.
18. Halling-Overgaard A.S., Zachariae C., Thyssen J.P. Management of Atopic Hand Dermatitis // Dermatol. Clin. — 2017 Jul. — 35 (3). — Р. 365-372. doi: 10.1016/j.det.2017.02.010.
19. Hanifin J.M., Rajka G. Diagnostic features of atopic dermatitis // Acta Derm. Venereol. Suppl (Stockh). — 1980. — 92. — Р. 44-47. doi: 10.2340/00015555924447.
20. Hanifin J.M., Thurston M., Omoto M. et al. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis. EASI Evaluator Group // Exp. Dermatol. — 2001. — Vol. 10 (1). — Р. 11-18. doi: 10.1034/j.1600-0625.2001.100102.x.

/9-1.jpg)
/10-1.jpg)
/10-2.jpg)
/11-1.jpg)
/11-2.jpg)