Журнал «Здоровье ребенка» Том 14, №3, 2019
Вернуться к номеру
Ротавирусная инфекция: профилактика и лечение
Авторы: Крамарев С.А., Закордонец Л.В.
Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Діареї залишаються основною причиною смерті дітей у всьому світі, що становить 1,31 мільйона випадків на рік. В етіологічній структурі діарей ротавіруси посідають провідні позиції. У статті розглядаються питання етіології, епідеміології, патогенезу, лікування та профілактики ротавірусної інфекції. Одним із перспективних напрямків комплексного лікування ротавірусної інфекції може бути використання препарату Ергоферон, що має виражений противірусний та імуномодулюючий ефект, який прискорює одужання пацієнтів і елімінацію збудника.
Диареи остаются основной причиной смерти детей в мире, что составляет 1,31 миллиона случаев в год. В этиологической структуре диарей ротавирусы занимают лидирующие позиции. В статье рассмотрены вопросы этиологии, эпидемиологии, патогенеза, лечения и профилактики ротавирусной инфекции. Одним из перспективных направлений комплексного лечения ротавирусной инфекции может быть использование препарата Эргоферон, который имеет выраженный противовирусный и иммуномодулирующий эффект, что способствует скорейшему выздоровлению пациентов и элиминации возбудителя.
Diarrhea remains the leading cause of death in children in the world (1.31 million cases per year). Rotavirus is the main etiological agent of diarrhea in children. The article deals with the etiology, epidemiology, pathogenesis, treatment and prevention of rotavirus infection. One of the promising areas of comprehensive treatment of rotavirus infection may be the use of Ergoferon that has a pronounced antiviral and immunomodulatory effect, which contributes to the rapid recovery of patients and elimination of the pathogen.
ротавірусна інфекція; ротавірус; гастроентерит; Ергоферон
ротавирусная инфекция; ротавирус; гастроэнтерит; Эргоферон
rotavirus infection; rotavirus; gastroenteritis; Ergoferon
Ежегодно в мире регистрируется около 2,39 биллиона случаев диарейных заболеваний (ДЗ), из которых 957,5 миллиона случаев приходится на детей первых 5 лет жизни [1]. ДЗ остаются основной причиной смерти у детей всех возрастов в мире, что составляет 1,31 миллиона случаев в год [1]. Основными агентами летальных исходов диареи в мире являются ротавирус (199 000 случаев), Shigella spp. (164 300) и Salmonella spp. (90 300). Ежегодно в мире от острой диареи умирает около 499 000 детей младше 5 лет, в этиологической структуре у них лидируют ротавирус, Cryptosporidium spp. и Shigella spp. [1].
В Украине, по данным МЗ, в 2017–2018 годах зарегистрировано 104 500–120 587 случаев ДЗ. В этиологической структуре преобладали ротавирус (17 517–18 142 случая) и сальмонеллы (7391–7713 случаев). Украина входит в координируемую ВОЗ Глобальную сеть эпиднадзора за ротавирусной инфекцией (ГСЭР), которая включает группу дозорных стационаров и лабораторий, проводящих обследование детей в возрасте до 5 лет, госпитализированных с диареей, в целях определения, является ли ротавирус причиной заболевания. Согласно данным ГСЭР, в Украине среди детей в возрасте до 5 лет, госпитализированных с острой диареей в стационар, ротавирус в фекалиях с помощью метода иммуноферментного анализа выявляли в 34 % случаев [2].
Этиология и эпидемиология ротавирусной инфекции
Ротавирусы относятся к семейству Reoviridae. Вирусная частица содержит геном, состоящий из 11 сегментов двунитчатой ДНК, каждый сегмент которой кодирует 6 структурных вирусных белков (VP), из которых строится вирусная частица, и 5–6 неструктурных белков (NVP). NVP синтезируются в инфицированной клетке и участвуют в репликации вируса, а также играют важную роль в патогенезе инфекции и иммунном ответе на нее.
Ротавирусы подразделяют на группы (или виды) на основе антигенных характеристик и аминокислотной последовательности капсидного белка VP6 [3]. Всего описано 5 групп ротавирусов (А–Е) [3]. Ротавирусы, принадлежащие к одной группе, способны обмениваться фрагментами генома при коинфекции, что обеспечивает их эволюцию и появление новых вирусов. В процессе репликации в коинфицированных клетках хозяина может иметь место рекомбинация 11 сегментов. С формированием рекомбинантов частично связано широкое разнообразие штаммов ротавируса, выделенных в природе; были выявлены даже рекомбинанты штаммов человеческого/животного происхождения. Внешняя оболочка вируса содержит вирусные протеины VP7 и VP4, которые вызывают выработку нейтрализующих антител и, следовательно, являются важным элементом в формировании защитного иммунитета.
Одновременно на одной территории может циркулировать несколько типов ротавирусов. Тип ротавируса обычно не связан с тяжестью заболевания. В течение первого эпизода ротавирусной инфекции инфицированный человек выделяет вирусы в очень большой концентрации (> 1012 вирусных частиц/грамм) на протяжении нескольких дней со стулом и рвотными массами. Передача вируса происходит преимущественно фекально-оральным путем непосредственно от человека человеку или через загрязненные предметы [3, 4].
Мониторинг 200 мексиканских детей в период от рождения до двухлетнего возраста путем проведения еженедельных посещений на дому выявил на основе выделения вируса в испражнениях или с помощью серологической реакции 316 эпизодов ротавирусной инфекции, при этом 52 % случаев были первичными, а 48 % — повторными случаями инфекции. Дети, перенесшие 1, 2 или 3 эпизода инфекции, имеют прогрессивно меньший риск последующего заражения ротавирусами (установленный относительный риск 0,62; 0,40 и 0,34 соответственно) или развития диареи (установленный относительный риск 0,23; 0,17 и 0,08), чем дети, которые ранее не были заражены. Последующие эпизоды ротавирусной инфекции были значительно менее тяжелыми, чем первые (р = 0,02), и вторые эпизоды были, наиболее вероятно, вызваны другим типом — G (р = 0,05) [5]. Однако риск возникновения тяжелого заболевания сохраняется и после нескольких эпизодов реинфекции [3].
Переменная изменчивость защиты от ротавирусной инфекции полностью не установлена, но иммунный ответ на протеины VP4 и VP7 рассматривается в качестве одного из основных механизмов защиты от ротавирусной инфекции [3].
Профилактика ротавирусной инфекции
Сегодня для профилактики ротавирусной инфекции активно используют вакцинацию. На международном рынке имеются две оральные ротавирусные вакцины: моновалентная вакцина (RV1) Rotarix® (Glaxo Smith Kline Biologicals, Rixensart, Бельгия) и пентавалентная вакцина (RV5) Rota Teq® (Merck&Co. Inc., West Point, PA, США). Обе вакцины считаются весьма эффективными в предотвращении тяжелых желудочно-кишечных заболеваний. В странах с низким уровнем доходов действенность вакцины может быть ниже, чем в промышленно развитых, аналогично другим живым оральным вакцинам [3].
Вакцина RV1 — живая, оральная, получена на основе штамма G1P [8], выделенного у ребенка с гастроэнтеритом. Две дозы вакцины вводятся с интервалом по крайней мере в 4 недели. Согласно рекомендации производителя, 1-я доза должна вводиться ребенку в возрасте 6 недель и старше, а 2-я доза — до достижения им 24-недельного возраста [3].
Вакцина RV5 — оральная и содержит 5 рекомбинантов ротавирусов, полученных из человеческого и бычьего (WC3) родительских штаммов вируса. Рекомендуемый производителем календарь прививок предусматривает введение 3 доз вакцины детям в возрасте 2, 4 и 6 месяцев [3].
Вакцины RV1 и RV5 имеют одинаковую действенность против тяжелого ротавирусного гастроэнтерита в странах с многообразием одновременно циркулирующих штаммов, что предполагает важную роль гетеротипического защитного иммунитета. Однако опосредованные данные говорят о том, что гомотипический иммунитет также играет важную роль в защите против последующей ротавирусной инфекции [6].
Патогенез ротавирусной инфекции
Вирус повреждает ворсинки эпителиальных клеток в тонком кишечнике, что приводит к нарушению всасывания и транспорта воды и электролитов с развитием осмотической диареи. Кроме того, при ротавирусной диарее имеет место и секреторный механизм ее развития, который вызывает неструктурный белок NSP4, активирующий хлоридные каналы, что сопровождается повышением секреции ионов хлора и воды [10]. Его считают первым (и пока единственным известным) вирусным энтеротоксином [10]. В патогенезе диареи также имеют значение активация локальной нервной системы и усиление перистальтики кишечника [10].
Иммунный ответ при ротавирусной инфекции
Защита от ротавирусной инфекции обеспечивается гуморальным и клеточным звеном иммунной системы. Ведущую роль в защите от ротавирусной инфекции приписывают выработке секреторных антител (sIgA) в кишечнике. Большинство интестинальных IgA направлены против внутреннего белка ротавирусов VP6 и не являются нейтрализующими [11]. Интересно, что многие ротавирус-специфические В-лимфоциты, циркулирующие в крови, несут на своей поверхности особые рецепторы, которые обеспечивают их прицельную миграцию в лимфоидные ткани кишечника (специфический хоуминг-рецептор a4b7) [12]. Здесь они превращаются в антитело-продуцирующие клетки, а также клетки памяти. Именно В-лимфоциты обеспечивают защиту от повторных инфекций. Значимость этого механизма удалось подтвердить путем определения уровня IgA в кале и демонстрации прямой корреляции их высокого уровня с невосприимчивостью к ротавирусной инфекции [12]. Интересно, что пассивный иммунитет за счет материнских антител, передающихся через плаценту и содержащихся в молоке, дает лишь слабую устойчивость к ротавирусу в первые месяцы жизни [6, 12].
Серологический ответ на первичное инфицирование направлен в основном против специфического вирусного серотипа (т.е. гомотипический ответ), тогда как более широкий гетеротипический ответ антителами вызывается последующим или последующими эпизодами ротавирусной инфекции [6].
Кроме гуморального механизма в защите от ротавирусной инфекции принимает участие и клеточное звено иммунитета. Однако в начале заболевания у детей с ротавирусным энтеритом число участвующих в противовирусном ответе Т-клеток, включая CD4+, достоверно снижается, что приводит к дисбалансу Т-хелперного ответа и, соответственно, нарушению выработки цитокинов [13].
Также у пациентов с ротавирусным энтеритом выявляется дисбаланс клеток Th17/Treg, которые относятся к CD4+ Т-лимфоцитам, что может быть одной из основных причин возникновения ротавирусной инфекции [13]. По данным H. Dong (2015), процент Treg-клеток в периферической крови детей с ротавирусным энтеритом был значительно снижен по сравнению с контрольной группой (здоровые дети) на фоне увеличения количества Th17-клеток. Клетки Treg представляют собой субпопуляцию Т-клеток с иммуносупрессивными эффектами, которые обеспечивают активный и эффективный контроль над функциями других иммунных клеток. Treg-клетки главным образом секретируют интерлейкины (ИЛ) 10 и TGF-бета [13]. Thl7 представляют собой субпопуляцию Т-клеток, отличающуюся от подтипов Th1 и Th2, которые секретируют ИЛ-17, ИЛ-6 и другие цитокины. ИЛ-17 является провоспалительным цитокином, который может вызывать повышенную регуляцию хемокинов и инвазию воспалительных клеток в ткани [13]. ИЛ-6 — это цитокин, который функционирует в различных типах клеток и регулирует ряд механизмов врожденного и адаптивного иммунитета [13]. У детей с ротавирусной инфекцией уровни синтеза ИЛ-17 и IL-6 в периферической крови были значительно повышены по сравнению с контрольной группой.
Также установлено, что ИЛ-6 и ИЛ-17 способствуют персистенции вируса посредством ингибирования апоптоза и синергетической функции цитотоксических Т-клеток [14].
S.M. Chen (2012) обнаружил, что определение уровня ИЛ-10 в сыворотке крови имело большое значение для клинической диагностики ротавирусной инфекции [15].
Даже к 7-му дню от начала лечения у детей с ротавирусным энтеритом сохранялись достоверно сниженные сывороточные уровни ИЛ-2, ИЛ-6, ИЛ-12 и TNF-a [16].
Таким образом, нарушения на уровне Т-клеточного звена иммунитета способствуют возникновению и прогрессированию ротавирусной инфекции. Это объясняет эффективность использования в комплексе лечебных мероприятий при инфекции, кроме диеты и регидратации, препарата Эргоферон.
Подходы к лечению
Основными направлениями в лечении ротавирусного гастроэнтерита являются диетотерапия, регидратационная терапия, этиотропное лечение, вспомогательная терапия (энтеросорбенты, пробиотики) [17]. Важным моментом, влияющим на продолжительность ротавирусной диареи, является исключение по возможности из рациона дисахаридов. В остром периоде вирусной диареи у грудных детей обычные адаптированные смеси рекомендуется заменять на низколактозные. Продолжительность низколактозной диеты индивидуальна и зависит от состояния ребенка. Обычно она назначается на острый период заболевания и отменяется сразу после начала формирования стула [17]. В остром периоде гастроэнтерита рекомендуется уменьшать суточный объем пищи на 1/2–1/3, в остром периоде колита — на 1/2–1/4.
Раннее применение адекватной регидратационной терапии является главным условием быстрого и успешного лечения заболевания. При проведении регидратационной терапии преимущество отдают оральной регидратации.
Специфической противовирусной терапии, направленной против ротавирусов, пока не разработано. Одним из перспективных направлений комплексного лечения ротавирусной инфекции может быть использование препарата Эргоферон. В состав препарата входит комбинация антител к CD4 (АТ CD4), к интерферону-g (АТ ИФН-g) и к гистамину (АТ Гис). Благодаря своему составу Эргоферон обладает тройным механизмом действия, усиленным противовирусным, противовоспалительным и антигистаминным эффектом.
Эргоферон влияет на функциональную активность взаимодействия ИФН-гамма, гистамина и CD4 с их рецепторами, оказывает регулирующее действие на молекулы мишени (ИФН-гамма, ИФН-альфа, Т-хелперы, макрофаги, рецепторы к ИФН-гамма, рецепторы к гистамину, CD4-корецептор). Именно эта способность препарата обеспечивает комбинированный противовирусный, противовоспалительный и антигистаминный лечебный эффект. Эргоферон влияет и на продукцию, и на рецепцию ИФН, что повышает эффективность работы системы ИФН. Стоит заметить, что регулирующее действие антител к CD4 приводит к повышению функциональной активности CD4-лимфоцитов и нормализации иммунорегуляторного индекса CD4/CD8, что также значимо с учетом данных об иммунопатогенезе ротавирусной инфекции у детей.
Влияние на систему ИФН в сочетании с активацией процессов распознавания вирусов системой CD4-клеток обеспечивает синергию в реализации их противовирусных эффектов и развитие полноценного противовирусного состояния в клетке. Помимо повышения вирус-индуцированной продукции ИФН-g и ИФН-a/b и сопряженных с ними интерлейкинов (ИЛ-2, ИЛ-4, ИЛ-10 и др.), улучшения взаимодействия ИФН с его рецептором, важным преимуществом Эргоферона при ротавирусной инфекции, достигаемым благодаря входящим в его состав антителам к ИФН-g, представляется наличие способности восстанавливать баланс Th1/Th2-активностей иммунного ответа, а также повышение продукции защитных антител — IgG и IgA, в т.ч. секреторного sIgА, который усиливает местный, мукозальный, иммунитет.
Противовирусная активность АТ ИФН-g с профилактической и лечебной целью была доказана в условиях экспериментального заражения животных различными вирусами (вирусом гриппа, герпесвирусами, ротавирусами). Противовирусная активность препарата в отношении вируса гриппа и герпесвирусов (ветряная оспа, инфекционный мононуклеоз, генитальный герпес) была подтверждена и в клинических исследованиях. Кроме того, в клинических исследованиях была показана эффективность АТ ИФН-g при ротавирусной, коронавирусной, калицивирусной, аденовирусной, респираторно-синцитиальной инфекции [4].
При изучении противовирусной активности Эргоферона на экспериментальной модели ротавирусной инфекции клеток линии М А-104 in vitro было выявлено снижение титра ротавируса в инфицированных клетках под действием Эргоферона на 83 % по сравнению с группой растворителя, используемого для приготовления препарата (р < 0,05), и на 90 % по сравнению с дистиллированной водой (р < 0,05), что указывает на наличие выраженного противовирусного действия у препарата в отношении ротавирусной инфекции [18].
Установлено, что применение Эргоферона у детей с острой вирусной инфекцией сопровождалось увеличением синтеза ИФН-a, ИФН-g и секреторного IgA, преимущественно у детей с низкими исходными уровнями этих показателей, что подчеркивает иммуномодулирующий эффект препарата. При этом сокращалась продолжительность заболевания [19].
В рандомизированных исследованиях у детей раннего возраста с ротавирусной инфекцией на фоне приема Эргоферона наблюдалось достоверное уменьшение выраженности и сроков сохранения симптомов заболевания (лихорадки, частоты стула, рвоты). Эргоферон устраняет диспептические расстройства и симптомы интоксикации при ротавирусной инфекции после 3 дней лечения (рис. 1) [20, 21]. При этом выявлена хорошая переносимость препарата, не наблюдались побочные реакции при его применении.
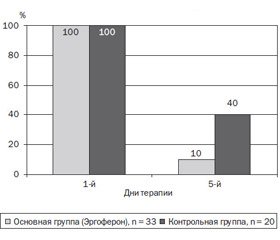
Авторами отмечено, что достигнутые клинические эффекты во многом связаны с элиминацией ротавируса из желудочно-кишечного тракта (ЖКТ) — у 90 % детей на 5-е сутки лечения прекращалось вирусовыделение, тогда как в копрофильтрате пациентов, получавших плацебо, антиген ротавируса определялся у 40 % (рис. 2) [20].
Помимо противовирусного действия, Эргоферон обладает дополнительной лечебной активностью: оказывает противовоспалительное и антигистаминное действие. Противовоспалительная активность Эргоферона обеспечивается влиянием антител к гистамину на гистаминзависимые реакции, являющиеся компонентом воспалительного процесса, и антител к CD4 — на цитокиновую сеть и регуляцией баланса продукции про- и противовоспалительных цитокинов [22].
Поэтому трехкомпонентный состав Эргоферона позволяет воздействовать на различные механизмы инфекционно-воспалительного процесса и формировать адекватный противовирусный ответ широкого спектра, включая ротавирусную инфекцию. Стоит отметить, что особенности фармакологического действия Эргоферона обусловливают единую лечебную схему, не зависящую от возраста пациента. Таким образом, данные экспериментальных и клинических исследований указывают на выраженный противовирусный эффект препарата, его иммуномодулирующее действие, что способствует скорейшему выздоровлению пациентов. Это позволяет рекомендовать использовать препарат Эргоферон в комплексной терапии ротавирусной инфекции у детей и взрослых.
1. Estimates of global, regional, and national morbidity, mortality, and aetiologies of diarrhoeal diseases: a systematic analysis for the Global Burden of Disease Study 2015. GBD Diarrhoeal Diseases Collaborators // Lancet Infect. Dis. — 2017. — Vol. 17 (9). — P. 909-948.
2. Эпидемиологическая справка ВОЗ. — 2018. — 1. — 1-18.http://www.euro.who.int/__data/assets/pdf_file/0004/371434/epibrief-1-2018-rus.pdf?ua = 1
3. Еженедельный эпидемиологический бюллетень. — 2013. — № 5. — С. 49-64. https://www.who.int/immunization/documents/WHO_PP_rotavirus_2013_RU.pdf
4. Малышев Н.А., Сафонова О.А. Ротавирусная инфекция у детей: особенности иммунного ответа и опыт применения нового релиз-активного препарата // Медицинский совет. — 2016. — № 7. — С. 70-76.
5. Velazquez F.R., Matson D.O., Calva J.J. et al. Rotavirus infection in infants as protection against subsequent infections // New England Journal of Medicine. — 1996. — Vol. 335. — P. 1022-1028.
6. Angel J. et al. Rotavirus immune responses and correlates of protection // Current Opinion in Virology. — 2012. — Р. 419-424.
7. Soares-Weiser K. Vaccines for preventing rotavirus diarrhoea: vaccines in use / K. Soares-Weiser, H. Bergman, N. Henschke et al. // Cochrane. — 2019. — Vol. 3. — P. 008521.
8. Soares-Weiser K. et al. Vaccines for preventing rotavirus diarrhoea: vaccines in use // Cochrane Database Systematic Review. — 2012. — Vol. 11. — P. 008521.
9. https://www.who.int/vaccine_safety Database Syst Rev. 2019
10. Seheri M. Update of rotavirus strains circulating in Africa from 2007 through 2011 / M. Seheri, L. Nemarude, I. Peenze et al. // Pediatr. Infect. Dis. J. — 2014. — Vol. 33 (Suppl. 1). — P. 76-84.
11. Desselberger U., Huppertz H.I. Immune responses to rotavirus infection and vaccination and associated correlates of protection // J. Infect. Dis. — 2011. — Vol. 203. — P. 188-195.
12. Маянский Н.А., Маянский А.Н., Куличенко Т.В. Ротавирусная инфекция: эпидемиология, патология, вакцинопрофилактика // Вестник РАМН. — 2015. — № 1. — С. 47-55.
13. Dong H. Changes in the cytokine expression of peripheral Treg and Th17 cells in children with rotavirus enteritis / H. Dong, S. Qu, X. Chen et al. // Exp. Ther. Med. — 2015. — № 10 (2). — P. 679-682.
14. Hou W. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibiting cellular apoptosis and cytotoxic T cell function / W. Hou, Y.H. Jin, H.S. Kang et al. // J. Virol. — 2014. — Vol. 88 (15). — P. 8479-8489.
15. Chen S.M., Ku M.S., Lee M.Y., Tsai J.D., Sheu J.N. Diagnostic performance of serum interleukin-6 and interleukin-10 levels and clinical predictors in children with rotavirus and norovirus gastroenteritis // Cytokine. — 2012. — Vol. 59 (2). — P. 299-304.
16. Hong J. Effect of adjuvant oral immunoglobulin therapy on the illness of children with rotavirus enteritiss // Journal of Hainan Medical University. — 2018. — Vol. 24 (5). — P. 40-43.
17. Інфекційні хвороби в дітей: підручник / С.О. Крамарьова, О.Б. Надрага, Л.В. Пипа та ін. / За ред. проф. С.О. Крамарьова, О.Б. Надраги. — К.: Медицина, 2010. — 392 с.
18. Емельянова А.Г., Шиловский И.П., Сундукова М.С., Хаитов М.Р., Эпштейн О.И. Противовирусная активность эргоферона в отношении ротавируса группы А // Бюллетень экспериментальной биологии и медицины. — 2016. — № 6. — С. 764-766.
19. Крамарьов С.О., Закордонець Л.В. Досвід застосування препарату Ергоферон у дітей з гострими респіраторними вірусними інфекціями // Современная педиатрия. — 2015. — № 1 (65).
20. Тхакушинова Н.Х., Соболева Н.Г. Современные возможности эффективного лечения ротавирусной инфекции у детей раннего возраста (результаты двойного слепого плацебо-контролируемого исследования лечебной эффективности анаферона детского) // Педиатрия. — 2012. — № 91 (1). — С. 63-67.
21. Мартынова Г.П., Соловьева И.А., Кузнецова Н.Ф., Дорошенко Л.Г., Комарова Б.Л., Щеголева Ю.Е. и др. Ротавирусная инфекция: клинико-эпидемиологические особенности, опыт применения препарата Анаферон детский в комплексной терапии детей первого года жизни // Практическая медицина. — 2015. — № 7 (92). — С. 138-144.
22. Павлова Е.Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата // Internal Medicine. Clinical Sleep Medicine (Доктор.Ру). — 2014. — 9 (97). — 20-24.

/52-1.jpg)
/53-1.jpg)