Журнал «Здоровье ребенка» Том 14, №3, 2019
Вернуться к номеру
Безпечність застосування нейроадаптогенів Когівіс і Сілента в педіатричній практиці
Авторы: Хайтович М.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
За останню декаду суттєво зросла поширеність психовегетативних розладів у дітей. Тривожність, інсомнія порушують вегетативну регуляцію, спричиняють часті головні болі, коливання артеріального тиску, погіршення уваги, пам’яті, знижують якість життя дитини та сім’ї. Розглянуто дані доказової медицини в аспекті безпеки застосування агоністів рецепторів гамма-аміномасляної кислоти (бензодіазепінів, препаратів Z-групи), мелатоніну; препаратів, що використовуються для лікування дітей із синдромом дефіциту уваги з гіперактивністю (стимулюючих і нестимулюючих) тощо. Застосування даних лікарських засобів часто супроводжується побічними ефектами, що унеможливлює їх рутинне використання. Альтернативою є використання комбінованих лікарських засобів із синергічною дією, що дозволяє мінімізувати їх побічні ефекти. Обґрунтовано доцільність застосування комплексних препаратів Когівіс і Сілента для нейроадаптації дітей.
За последнюю декаду существенно возросла распространенность психовегетативных расстройств у детей. Тревожность, инсомния нарушают вегетативную регуляцию, вызывают частые головные боли, колебания артериального давления, ухудшение внимания, памяти, снижают качество жизни ребенка и семьи. Рассмотрены данные доказательной медицины в аспекте безопасности применения агонистов рецепторов гамма-аминомасляной кислоты (бензодиазепинов, препаратов Z-группы), мелатонина; препаратов, используемых для лечения детей с синдромом дефицита внимания с гиперактивностью (стимулирующих и нестимулирующих) и др. Использование данных лекарственных средств часто сопровождается побочными эффектами, что делает невозможным их рутинное применение. Альтернативой является использование комбинированных лекарственных средств с синергическим действием, что позволяет минимизировать их побочные эффекты. Обоснована целесообразность применения комплексных препаратов Когивис и Силента для нейроадаптации детей.
Over the last decade, the prevalence of autonomic dysfunction in children has significantly increased. Anxiety, insomnia violate the vegetative regulation, cause frequent headaches, blood pressure variability, deterioration of attention, memory, reduce the quality of life of the child and family. We have evaluated the data of evidence-based medicine in the aspect of safe usage of GABA receptor agonists (benzodiazepines, Z-drugs), melatonin and drugs used to treat children with attention deficit hyperactivity disorder (stimulating and non-stimulating), etc. The application of these drugs is often accompanied by side effects, which make it impossible to use them routinely. The alternative is to use combination drugs with synergistic action that minimizes the side effects. The expediency of using Cogivis and Silenta combination drugs for neuroadaptation of children was substantiated.
діти; лікування; побічні ефекти лікарських засобів; Сілента; Когівіс
дети; лечение; побочные эффекты лекарственных средств; Силента; Когивис
children; treatment; side effects; Silenta; Cogivis
За останні роки рівень психоемоційного напруження в дітей і молоді суттєво зріс. Це призвело до поширення так званих психосоматичних захворювань (соматоформної вегетативної дисфункції, артеріальної гіпо- або гіпертензії, дискінезії жовчовивідних шляхів, гіпервентиляційного синдрому, синдрому іритованого кишечника, первинного головного болю тощо). В основі даної патології лежить підвищена тривожність і соматизована депресія. Найбільш характерним симптомом при цьому є порушення сну (інсомнія). Дані популяційних досліджень свідчать, що від інсомнії страждає 13–27 % дітей і підлітків [1–3], причому з 2002 по 2012 роки поширеність інсомнії серед молоді збільшилась на 30,9 % [4]. У свою чергу тривожність через інсомнію підвищує ризик розвитку депресії в підлітків [5]. Унаслідок хронічного порушення сну в дітей погіршуються функції центральної нервової системи (ЦНС) у денний час, а також знижується якість життя сім’ї [6]. Результати наших досліджень показали: якщо інсомнія в підлітка відмічається 2 і більше разів на тиждень, це суттєво погіршує якість його життя. При цьому вірогідно знижуються такі показники якості життя (згідно з SF-36), як рольове фізичне функціонування (61,00 ± 4,89 бала проти 86,11 ± 3,65 бала); загальне здоров’я (61,64 ± 3,64 бала проти 78,33 ± 2,71 бала); життєздатність (46,72 ± 3,64 бала проти 71,22 ± 2,71 бала); психологічне здоров’я (60,48 ± 3,23 бала проти 74,75 ± 2,41 бала) [1]. Найнижчі показники якості життя відмічались у підлітків із інтрасомнічним типом інсомнії, а також при комбінації пре- та постсомнічних, а також пре- та інтрасомнічних розладів. У підлітків, у яких інсомнія відмічалась рідше від 1 разу на тиждень, також спостерігалась тенденція до зниження показників якості життя, але зміни були невірогідними. Від порушень сну в дитини суттєво страждають когнітивні функції (пам’ять, концентрація уваги тощо), збільшується частота й інтенсивність головного болю [2].
Тому корекція сну, зменшення підвищеної тривожності є важливим аспектом підтримки здоров’я, ліквідації вегетативних порушень і підвищення якості життя дитини та її сім’ї [7], покращення когнітивних функцій, а отже, і соціального функціонування.
При визначенні тактики лікування інсомнії в дорослої людини лікар може спиратись на дані доказової медицини. Ряд авторитетних лікарських асоціацій видали настанови щодо застосування снодійних лікарських засобів у дорослих [8–10]. Погляди на лікування інсомнії в дітей у дослідників суттєво різняться. Крім звичайних гіпнотиків, вивчається вплив на функцію сну різних груп лікарських засобів, у тому числі вітаміну D і препаратів заліза [11].
У даній статті ми розглядаємо такий важливий аспект лікування, як безпека застосування лікарських засобів, які призначаються для покращення сну, зниження тривожності й депресії, посилення когнітивних функцій, оскільки відомо, що їх вживання часто поєднується з розвитком побічних реакцій [12,13].
Побічна реакція на лікарський засіб (Adverse Drug Reaction), за визначенням ВООЗ, — це будь-яка ненавмисна й шкідлива для організму людини реакція, що виникає при використанні лікарського засобу в звичайних дозах з метою профілактики, лікування й діагностики [14]. Побічні (небажані, несприятливі) реакції на лікарські засоби — одна з найважливіших проблем громадської охорони здоров’я, оскільки вони є основною причиною госпіталізації й смертності людей у розвинутих країнах [15].
У наш час виділяють побічні реакції типу А (augmented — доповнені, поширені) — дозозалежні й передбачувані (прогнозовані) реакції; типу В (bizarre — дивні, несподівані) — реакції непередбачувані (непрогнозовані), незалежні від дози (алергічні, псевдоалергічні, ідіосинкразія); типу С (continuing — тривати) — реакції, що виникають при тривалому застосуванні лікарських засобів; типу D (delayed — затриманий) — реакції, що з’являються через певний час (канцерогенні, тератогенні тощо); типу Е (end-of-use — відміна) — реакції відміни. Залежно від тяжкості виділяють побічні реакції легкі, помірні й тяжкі, а з урахуванням наслідків для пацієнта — серйозні й несерйозні.
Як показують результати епідеміологічних досліджень, серед 1082 дітей, госпіталізованих у відділення педіатрії, у 54 пацієнтів було ідентифіковано 64 побічні реакції на лікарські засоби (захворюваність становила 4,99 %) [16].
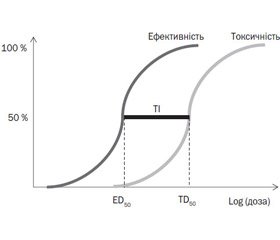
Для характеристики безпеки лікарського засобу користуються таким параметром, як терапевтичний індекс (рис. 1), що є відношенням токсичної дози у 50 % популяції до ефективної дози в 50 % популяції. Саме малий терапевтичний індекс обмежує застосування більшості психотропних лікарських засобів у клінічній діяльності, у тому числі в педіатрії.
Препаратами першої лінії при лікуванні тривожних розладів та інсомнії є агоністи рецепторів гамма-аміномасляної кислоти (ГАМК): бензодіазепіни й препарати Z-групи (золпідем, зопіклон, залеплон).
Бензодіазепіни високоафінні до ГАМК-рецепторів типу А, потенціюють ефекти ГАМК і тому широко призначаються при тривожності, безсонні, епілептичних нападах і як протисудомні засоби. Тривале застосування бензодіазепінів обмежене такими несприятливими ефектами, як толерантність, залежність, абстиненція й порушення когнітивних функцій [17]. Доведено, що вживання бензодіазепінів асоціюється з порушенням міжособистісного функціонування й визначення емоцій за виразом обличчя [18].
Сильнодіючі бензодіазепіни не рекомендується призначати через ризик побічних реакцій [19]. Так, при використанні мідазоламу в дітей часто відмічається парадоксальна стимуляція центральної нервової системи (ЦНС) — кошмари, галюцинації й гіпоманіакальна поведінка, поява міоклонічних рухів [20].
Результати контрольованих досліджень з оцінки ефективності й безпечності застосування золпідему чи зопіклону в дітей із синдромом дефіциту уваги показали відсутність покращення сну, тоді як побічні ефекти відмічались частіше, ніж у групі плацебо [21].
Переважно при синдромі дефіциту уваги з гіперактивністю (СДУГ) призначають cтимулятори (метилфенідат, амфетаміни) і нестимулятори ЦНС (атомоксетин, клонідин і гуанфацин) [22]. Доведено, що метилфенідат, клонідин, гуанфацин, дезипрамін і атомоксетин зменшують прояви СДУГ у дітей із тиками, хоча рівень доказовості низький або дуже низький [23].
Нещодавно було опубліковано результати систематичного огляду й метааналізу рандомізованх контрольованих досліджень (≥ 3 тижні спостереження) щодо застосування різних лікарських засобів для лікування порушень сну, уваги й пам’яті при СДУГ. Усього розглянуто 190 рандомізованих досліджень (52 інтервенції, згруповані в 32 терапевтичні класи), які включали 26 114 учасників із СДУГ. Відмічено, що в більшості випадків ефективність фармакологічних методів лікування була пов’язана з несприятливими побічними реакціями (найбільш часто відмічались анорексія, втрата маси тіла й посилення інсомнії) [24].
Прийом ліздексамфетаміну асоціювався зі зниженням апетиту й маси тіла, головним болем, безсонням і дратівливістю [25]. Високі дози декстроамфетаміну посилювали тики. Відмічено пригнічення апетиту і/або втрату маси в пацієнтів, які вживали метилфенідат, декстроамфетамін, атомоксетин і дезипрамін. Спостерігались безсоння, пов’язане з метилфенідатом і декстроамфетаміном [23], і седативна дія клонідину [22, 23].
Серед підлітків (13–17 років) із СДУГ застосування метилфенідату асоціюється з побічними ефектами у ≥ 5 % учасників, удвічі частіше, ніж у групі плацебо, відмічаються: зниження апетиту й маси тіла, безсоння, сухість у роті й назофарингіт, дратівливість і запаморочення, а також підвищена частота серцевих скорочень [26–28]. Несерйозні побічні ефекти відмічаються в 51,2 % пацієнтів, які вживали метилфенідат [29]. Інсомнія і/або погіршення апетиту зустрічаються частіше, ніж у 10 % пацієнтів, які приймали даний лікарський засіб [30]. За даними інших дослідників, труднощі із засинанням відмічались у 17,9 %, головний біль — у 14,4 %, біль у животі — у 10,7 %, зниження апетиту — у 31,1 % підлітків, які приймали метилфенідат [29]. Було відмічено, що метилфенідат викликає низку серйозних побічних ефектів: збільшує ризик розвитку психотичного розладу й аритмії [31].
За результатами одного невеликого рандомізованого дослідження встановлено, що через 1 тиждень застосування дифенгідраміну відмічено зменшення на 10 хвилин тривалості засинання [21]. Однак велика кількість побічних ефектів дифенгідраміну (сухість у роті, нудота, блювання, запор, діарея, абдомінальний біль, порушення координації, загальна слабість, сонливість, запаморочення, головний біль), вплив на ферменти метаболізму, а також досить тривалий (2–8 годин) період напіввиведення обмежують рутинне застосування його як снодійного засобу в дітей.
За результатами 19 рандомізованих контрольованих досліджень встановлено, що мелатонін у середньому на 28 хвилин скорочував час засинання, на 33 хвилини подовжував тривалість сну, але не впливав на кількість пробуджень за ніч. Препарат у цілому непогано переносився [21], але покращення сну було найбільшим у дітей з аутизмом [1, 32, 33] або іншими порушеннями розвитку нервової системи, тоді як у дітей і підлітків із хронічною пресомнією ефект був незначний.
Встановлено, що дулоксетин, пароксетин, венлафаксин, барбітурати і метилфенідат можуть викликати бруксизм уві сні [34].
Низка дослідників рекомендують застосовувати як препарат другої лінії при лікуванні інсомнії в пацієнтів із тривожністю й порушенням харчової поведінки атиповий нейролептик кветіапін [35]. Відомо, що нейролептики можуть спричиняти метаболічні зміни, такі як гіперглікемія й цукровий діабет. Описано розвиток цукрового діабету 1-го типу в 16-річного підлітка з аутизмом на фоні застосування протягом 4 міс. оланзапіну, кломіпраміну, вальпроєвої кислоти й літію [36].
Суворексант — перший подвійний агоніст орексинових рецепторів, що став використовуватись для лікування інсомнії. Його застосовували в 30 підлітків (8 хлопчиків, 22 дівчинки) віком 15,7 ± 2,4 року. Двоє пацієнтів припинили лікування внаслідок патологічних сновидінь, двоє — внаслідок відсутності ефекту, 17 пацієнтів продовжили прийом препарату, однак якість сну у них була гіршою, ніж у тих, хто припинив лікування [37].
Отже, у більшості випадків фармакологічні засоби, які впливають на ГАМК, серотонінові, гістамінові, дофамінові й орексинові рецептори, якщо і покращують сон та емоційний і вегетативний стан дітей, то досить часто викликають побічні ефекти, що унеможливлює їх рутинне застосування.
Для нейроадаптації останнім часом рекомендується використовувати комплексні препарати Когівіс і Сілента, що містять синергічні за дією компоненти.
Когівіс містить у 5 мл сиропу 35 мг аспарагіну моногідрату, 32,5 мг N-ацетил-L-глутаміну, 35 мг DL-фосфосерину та 0,75 мг вітаміну В6. У цілому даний препарат за рахунок стабілізації нервових процесів (аспарагін), введення в організм джерела утворення нейротрансмітерів (L-глутамін) і регулятора обміну речовин, у тому числі амінокислот (піридоксин), зниження вироблення стресового гормону кортизолу (DL-фосфосерин) забезпечує розвиток мозку, синтез білків, нуклеотидів, нейротрансмітерів, зменшує низькоінтенсивне запалення в центральній нервовій системі, зокрема в гіпокампі. Усе це створює умови для протидії інтенсивному й тривалому стресу та забезпечує оптимальне функціонування нейроцитів, покращує когнітивні функції в дітей.
Сілента містить у 5 мл такі активні речовини: 278,2 мг цитрату магнію (у тому числі 30 мг магнію); 50 мг L-триптофану; 80 мг сухого екстракту квіток ромашки аптечної (Matricaria chamomilla L.); 50 мг сухого екстракту листя меліси лікарської (Melissa officinalis L.) і 20 мг сухого екстракту суцвіть липи широколистої (Tilia platyphyllos Scop.). Згідно з фармакодинамічними особливостями компонентів Сілента знижує тривожність, психоемоційне напруження та зменшує інсомнію в дітей.
Відомо, що одна з важливих ролей у реалізації синаптичної пластичності й вищих інтеграційних функцій мозку, включаючи процеси навчання й пам’яті, належить глутаматергічній системі. Тому вона інтенсивно досліджується як мішень для фармакологічного впливу. Магній, один із компонентів препарату Сілента, здійснює нейропротекторну дію через антагоністичний вплив на глутаматні рецептори, оскільки блокує надходження іонів кальцію в клітину [38]. Триптофан є незамінною амінокислотою й джерелом утворення нікотинамідних коферментів, а також мелатоніну. Останній потенціює снодійний ефект магнію. Екстракти седативних фітозасобів також сприяють гіпнотичним ефектам Сіленти.
Встановлено, що після курсу застосування Сіленти частота інсомнії в молодших школярів зменшилась із 77 до 17 %, а після застосування Когівісу — з 17 до 7 % [39]. При цьому в більшості пацієнтів зменшилась частота й інтенсивність скарг астеноневротичного характеру, цефалгії [39]. Не відмічено побічних ефектів.
Медикаментозній терапії в дітей повинні передувати поведінкові втручання. Необхідно дотримуватись регулярності в часі засинання та прокидання; забезпечити достатньо часу для сну (7–9 годин для підлітків) у тихому й темному спальному приміщенні; уникати примусового засинання й можливості спостерігати за годинником; видалити зі спальні потенційні руйнівники сну (телевізор, телефон, планшет тощо); уникати прийому перед сном психоактивних речовин; фізичні вправи здійснювати регулярно, але не перед сном; вирішити до відходу до сну стресові ситуації й перед сном розслабитися; уникати денної дрімоти. Важливо забезпечити протягом дня достатню фізичну активність.
Отже, препарати першої лінії лікування депресії, тривожності й інсомнії в дорослих — антидепресанти, бензодіазепіни та лікарські засоби Z-групи — повинні застосовуватись у дітей лише при тяжких психоемоційних розладах короткими курсами. Важливо врахувати період напіввиведення й наявність активних метаболітів, обговорити з пацієнтом ще до початку лікування ризик виникнення несприятливих побічних реакцій і питання про припинення терапії.
Комбінація лікарських засобів із синергічною дією дозволяє зменшити дозу, а отже, мінімізувати побічні ефекти лікарських засобів. Прикладом таких комбінацій є препарати Когівіс і Сілента.
Сілента, завдяки поєднанню антиглутаматної дії магнію, снодійного ефекту мелатоніну, що утворюється з триптофану, і седативного впливу екстрактів меліси, ромашки й липи, показана при гострій інсомнії, психовегетативних розладах із переважанням тривожності. Препарат досить швидко нормалізує сон у більшості дітей, не викликаючи побічних ефектів.
Когівіс потенціює ефекти Сіленти в дітей, а при тривалому застосуванні забезпечує стабільність нервової системи в умовах інтенсивного емоційного стресу й перенапруження, у результаті покращує стресостійкість, апетит і когнітивні функції, зменшує вираженість астенічного синдрому (слабості, підвищеної втомлюваності, зниженої працездатності).
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Хайтович М.В., Очеретко В.В., Місюра O.M. Частота і характер інсомнії у підлітків та її вплив на якість життя // Матеріали XI Конгресу педіатрів України (7–9.10.2015, м. Kиїв). — К., 2015. — С. 102-103.
2. Хайтович М.В., Потаскалова В.С., Місюра О.М. Стиль життя і первинний головний біль у школярів // Соціальна педіатрія і реабілітологія. — 2017. — 3. — 19-24.
3. Grau K., Plener P.L. Pharmacotherapy for children and adolescents with sleep disorders: an overview // Z. Kinder Jugendpsychiatr. Psychother. — 2018 Sep. — 46(5). — 393-402. doi: 10.1024/1422-4917/a000562. Epub 2017 Dec 14.
4. Ford E.S., Cunningham J., Giles W.H., Croft J.B. Trends in insomnia and excessive daytime sleepiness among U.S. adults from 2002 to 2012 // Sleep Med. — 2015. — 16(3). — 372-378.
5. Li Y., Starr L.R., Wray-Lake L. Insomnia mediates the longitudinal relationship between anxiety and depressive symptoms in a nationally representative sample of adolescents // Depress. Anxiety. — 2018 Jun. — 35(6). — 583-591. doi: 10.1002/da.22764.
6. Owens J.A., Moore M. Insomnia in Infants and Young Children // Pediatr. Ann. — 2017 Sep 1. — 46(9). — e321-e326. doi: 10.3928/19382359-20170816-02.
7. Anand S., Tong H., Besag F.M.C., Chan E.W., Cortese S., Wong I.C.K. Safety, Tolerability and Efficacy of Drugs for Treating Behavioural Insomnia in Children with Attention-Deficit/Hyperactivity Disorder: A Systematic Review with Methodological Quality Assessment // Paediatr. Drugs. — 2017 Jun. — 19(3). — 235-250. doi: 10.1007/s40272-017-0224-6.
8. Matheson E., Hainer B.L. Insomnia: Pharmacologic Therapy // Am. Fam. Physician. — 2017 Jul 1. — 96(1). — 29-35. https://www.ncbi.nlm.nih.gov/pubmed/28671376.
9. Riemann D., Baglioni C., Bassetti C. et al. European guideline for the diagnosis and treatment of insomnia // J. Sleep Res. — 2017 Dec. — 26(6). — 675-700. doi: 10.1111/jsr.12594. Epub 2017 Sep 5.
10. Sateia M.J., Buysse D.J., Krystal A.D., Neubauer D.N., Heald J.L. Clinical practice guideline for the pharmacologic treatment of chronic insomnia in adults: an American Academy of Sleep Medicine clinical practice guideline // J. Clin. Sleep Med. — 2017. — 13(2). — 307-349.
11. Bruni O., Angriman M. Pediatric insomnia: New insights in clinical assessment and treatment options // Arch. Ital. Biol. — 2015 Jun-Sep. — 153(2-3). — 144-156.
12. Штрыголь С.Ю., Кортунова Т.В., Штрыголь Д.В. Побочные эффекты ноотропных средств // Провизор. — 2003. — № 11. — http://www.provisor.com.ua/archive/2003/N11/art_31.php
13. Напрєєнко О.К., Хайтович М.В. Клінічна психофармакологія: Навчальний посібник для студентів медичних (фармацевтичних) ВНЗ. — 2016. — 136 с.
14. WHO Adverse Reaction Terminology // International Monitoring of Adverse reactions to Drug. — December, 2004. — Mode of access: https://www.nlm.nih.gov/research/umls/sourcereleasedocs/current/WHO.
15. Angamo M.T., Chalmers L., Curtain C.M., Bereznicki L.R. Adverse-Drug-Reaction-Related Hospitalisations in Developed and Developing Countries: A Review of Prevalence and Contributing Factors // Drug Saf. — 2016. — [Epub ahead of print]. — Mode of access: http://www.ncbi.nlm.nih.gov/pubmed/27449638.
16. Kurian J., Mathew J., Sowjanya K., Chaitanya K.R., Ramesh M., Sebastian J., Narayanappa D. Adverse Drug Reactions in Hospitalized Pediatric Patients: A Prospective Observational Study // Indian J. Pediatr. — 2016. — Vol. 83, № 5. — P. 414-419.
17. Furukawa T., Shimoyama S., Miki Y. et al. Chronic diazepam administration increases the expression of Lcn2 in the CNS // Pharmacol. Res Perspect. — 2017 Jan 31. — 5(1). — e00283. doi: 10.1002/prp2.283. eCollection 2017 Feb.
18. Żurowska N., Kałwa A., Rymarczyk K., Habrat B. Recognition of emotional facial expressions in benzodiazepinedependence and detoxification // Cogn. Neuropsychiatry. — 2018 Mar. — 23(2). — 74-87. doi: 10.1080/13546805.2018.1426448. Epub 2018 Jan 21.
19. Revet A., Yrondi A., Montastruc F. Good practices in prescribing benzodiazepines // Presse Med. — 2018 Oct. — 47(10). — 872-877. doi: 10.1016/j.lpm.2018.10.008. Epub 2018 Oct 29.
20. Gupta M.K., Mondkar J.A., Hegde D. Paradoxical Reaction to Midazolam in Preterm Neonates: A Case Series // Indian J. Crit. Care Med. — 2018 Apr. — 22(4). — 300-302. doi: 10.4103/ijccm.IJCCM_36_17.
21. McDonagh M.S., Holmes R., Hsu F. Pharmacologic Treatments for Sleep Disorders in Children: A Systematic Review // J. Child Neurol. — 2019 Jan 23. — 883073818821030. doi: 10.1177/0883073818821030.
22. Clavenna A., Bonati M. Pediatric pharmacoepidemiology — safety and effectiveness of medicines for ADHD // Expert Opin. Drug Saf. — 2017 Dec. — 16(12). — 1335-1345. doi: 10.1080/14740338.2017.1389894. Epub 2017 Oct 12.
23. Osland S.T., Steeves T.D., Pringsheim T. Pharmacological treatment for attention deficit hyperactivity disorder (ADHD) in children with comorbid tic disorders // Cochrane Database Syst. Rev. — 2018 Jun 26. — 6. — CD007990. doi: 10.1002/14651858.CD007990.pub3.
24. Catalá-López F., Hutton B., Núñez-Beltrán A. et al. The pharmacological and non-pharmacological treatment of attention deficit hyperactivity disorder in children and adolescents: A systematic review with network meta-analyses of randomised trials // PLoS One. — 2017 Jul 12. — 12(7). — e0180355. doi: 10.1371/journal.pone.0180355. eCollection 2017.
25. Frampton J.E. Lisdexamfetamine Dimesylate: A Review in Paediatric ADHD // Drugs. — 2018 Jul. — 78(10). — 1025-1036. doi: 10.1007/s40265-018-0936-0.
26. Newcorn J.H., Nagy P., Childress A.C., Frick G., Yan B., Pliszka S. Randomized, Double-Blind, Placebo-Controlled Acute Comparator Trials of Lisdexamfetamine and Extended-Release Methylphenidate in Adolescents With Attention-Deficit/Hyperactivity Disorder // CNS Drugs. — 2017 Nov. — 31(11). — 999-1014. doi: 10.1007/s40263-017-0468-2.
27. Brams M., Childress A.C., Greenbaum M., Yu M., Yan B., Jaffee M., Robertson B. SHP465 Mixed Amphetamine Salts in the Treatment of Attention-Deficit/Hyperactivity Disorder in Children and Adolescents: Results of a Randomized, Double-Blind Placebo-Controlled Study // J. Child Adolesc. Psychopharmacol. — 2018 Feb. — 28(1). — 19-28. doi: 10.1089/cap.2017.0053. Epub 2017 Aug 17.
28. Wigal S.B., Childress A., Berry S.A. et al. Efficacy and Safety of a Chewable Methylphenidate Extended-Release Tablet in Children with Attention-Deficit/Hyperactivity Disorder // J. Child Adolesc. Psychopharmacol. — 2017 Oct. — 27(8). — 690-699. doi: 10.1089/cap.2016.0177. Epub 2017 May 30.
29. Storebø O.J., Pedersen N., Ramstad E. et al. Methylphenidate for attention deficit hyperactivity disorder (ADHD) in children and adolescents — assessment of adverse events in non-randomised studies // Cochrane Database Syst. Rev. — 2018 May 9. — 5. — CD012069. doi: 10.1002/14651858.CD012069.pub2.
30. Pliszka S.R., Wilens T.E., Bostrom S. et al. Efficacy and Safety of HLD200, Delayed-Release and Extended-Release Methylphenidate, in Children with Attention-Deficit/Hyperactivity Disorder // J. Child Adolesc. Psychopharmacol. — 2017 Aug. — 27(6). — 474-482. doi: 10.1089/cap.2017.0084. Epub 2017 Jul 21.
31. Childress A.C., Wigal S.B., Brams M.N., Turnbow J.M., Pincus Y., Belden H.W., Berry S.A. Efficacy and Safety of Amphetamine Extended-Release Oral Suspension in Children with Attention-Deficit/Hyperactivity Disorder // J. Child Adolesc. Psychopharmacol. — 2018 Jun. — 28(5). — 306-313. doi: 10.1089/cap.2017.0095. Epub 2017 Dec 6.
32. Maras A., Schroder C.M., Malow B.A. et al. Long-Term Efficacy and Safety of Pediatric Prolonged-Release Melatonin for Insomnia in Children with Autism Spectrum Disorder // J. Child Adolesc. Psychopharmacol. — 2018 Oct 11. doi: 10.1089/cap.2018.0020.
33. Gringras P., Nir T., Breddy J., Frydman-Marom A., Findling R.L. Efficacy and Safety of Pediatric Prolonged-Release Melatonin for Insomnia in Children With Autism Spectrum Disorder // J. Am. Acad. Child Adolesc Psychiatry. — 2017 Nov. — 56(11). — 948-957.e4. doi: 10.1016/j.jaac.2017.09.414. Epub 2017 Sep 19.
34. Melo G., Dutra K.L., Filho R. et al. Association between psychotropic medications and presence of sleep bruxism: A systematic review // J. Oral. Rehabil. — 2018 Jul. — 45(7). — 545-554. doi: 10.1111/joor.12633. Epub 2018 May 3.
35. Chow E.S., Zangeneh-Kazemi A., Akintan O., Chow-Tung E., Eppel A., Boylan K. Prescribing Practices of Quetiapine for Insomnia at a Tertiary Care Inpatient Child and Adolescent Psychiatry Unit: A Continuous Quality Improvement Project // J. Can. Acad. Child. Adolesc. Psychiatry. — 2017 Jul. — 26(2). — 98-103. Epub 2017 Jul 1.
36. Ripoli C., Pinna A.P., Podda F., Zanni R., Tronci M.G., Nurchi A.M. Second-generation antipsychotic and diabetes mellitus in children and adolescents // Pediatr. Med. Chir. — 2017 Dec 13. — 39(4). — 149. doi: 10.4081/pmc.2017.149.
37. Kawabe K., Horiuchi F., Ochi M., Nishimoto K., Ueno S.I., Oka Y. Suvorexant for the Treatment of Insomnia in Adolescents // J. Child. Adolesc. Psychopharmacol. — 2017 Nov. — 27(9). — 792-795. doi: 10.1089/cap.2016.0206. Epub 2017 May 18.
38. Хайтович M.В. Фармакологічна корекція стрес-індукованих вегетативних порушень та інсомнії в дітей // Міжнародний неврологічний журнал. — 2018. — 102(8). — 38-43.
39. Квашніна Л.В., Майдан І.С., Ігнатова Т.Б. Можливості комплексної корекції проявів шкільної дезадаптації у дітей молодшого шкільного віку // Здоров’я дитини. — 2019. — 14(2). — 2-7.

/59-1.jpg)