Журнал «Здоровье ребенка» Том 14, №3, 2019
Вернуться к номеру
Лекарственные средства, ингибирующие кворум-сенсинг бактерий Staphylococcus aureus
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГНУЗ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У науковому огляді наведено дані щодо функціонування систем кворум-сенсингу Agr і RAP/TRAP бактерій Staphylococcus aureus. Подана характеристика препаратів, що пригнічують експорт AIP з бактеріальної клітини, активність гістидинкінази AgrC, експресію і функціональну активність AgrA, експресію транскрипта RNAIII бактерій Staphylococcus aureus. Припущено, що препарати, які будуть розроблені для придушення активності механізмів кворум-сенсингу бактерій Staphylococcus aureus, займуть гідне місце в антистафілококовій терапії.
В научном обзоре представлены данные о функционировании систем кворум-сенсинга Agr и RAP/TRAP бактерий Staphylococcus aureus. Дана характеристика препаратов, которые ингибируют экспорт AIP из бактериальной клетки, активность гистидинкиназы AgrC, экспрессию и функциональную активность AgrA, экспрессию транскрипта RNAIII бактерий Staphylococcus aureus. Предположено, что препараты, которые будут разработаны для подавления активности механизмов кворум-сенсинга бактерий Staphylococcus aureus, займут достойное место в антистафилококковой терапии.
The scientific review presents data on the functioning of the quorum-sensing systems Agr and RAP/TRAP of Staphylococcus aureus bacteria. The paper gives the characteristics of medications inhibiting the export of AIP from a bacterial cell, the activity of histidine kinase AgrC, the expression and functional activity of AgrA, the expression of the RNAIII transcript of Staphylococcus aureus bacteria. It is suggested that the drugs developed to inhibit the activity of the mechanisms of the quorum sensing of Staphylococcus aureus bacteria will take a worthy place in anti-staphylococcal therapy.
кворум-сенсинг; Staphylococcus aureus; інгібітори кворум-сенсингу; огляд
кворум-сенсинг; Staphylococcus aureus; ингибиторы кворум-сенсинга; обзор
quorum sensing; Staphylococcus aureus; inhibitors of quorum sensing; review
Введение
В этиологической структуре инфекционных заболеваний грамположительные бактерии Staphylococcus aureus входят в топ-пятерку патогенных агентов. Микроорганизмы Staphylococcus aureus не случайно получили характеристику «двуликого Януса» [5], так как, представляя собой оппортунистические патогены, могут вызвать инфекционный процесс с тяжелым инвазивным течением. Так, открытые в 1961 году штаммы бактерий Staphylococcus aureus, резистентные к действию метициллина (methicillin-resistant Staphylococcus aureus — MRSA) [15], являются ведущей причиной тяжелых нозокомиальных инфекций в странах всего мира [18]. Особенно высокий риск развития MRSA-ассоциированных инфекций отмечается у недоношенных и новорожденных детей с очень низкой массой тела [43], для которых характерен низкий уровень экспрессии образраспознающих рецепторов [1]. Медикаментозное лечение инфекций, вызванных MRSA, является чрезвычайной проблемой современной медицины [11, 22]. Одним из важнейших механизмов, опосредующих развитие антибиотикорезистентности, считают формирование бактериальных биопленок [10, 27, 36], в связи с чем лекарственные средства, ингибирующие механизмы кворум-сенсинга (quorum sensing — QS), представляют собой класс медикаментов, которые, по мнению многих ученых, в недалеком будущем позволят решить терапевтическую задачу лечения больных с инфекционными процессами, вызванными высокопатогенными бактериями MRSA.
Механизмы формирования биопленки бактериями Staphylococcus aureus
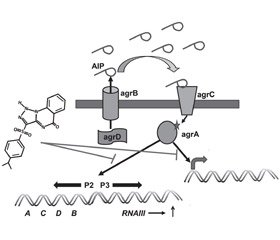
Стафилококковые бактерии при формировании биопленки используют систему регулятора аксессуарного гена (accessory gene regulator — Agr), двухкомпонентную систему RAP/TRAP и, вероятно, систему LuxS [24]. Система Agr бактерий Staphylococcus aureus контролирует экспрессию генов факторов вирулентности (гемолизинов, лейкоцидинов, адгезинов, экзоферментов) и генов, участвующих в формировании биопленки. Локус Agr (3,5 кб) состоит из двух транскрипционных единиц — RNAII и RNAIII — c промоторами P2 и P3 соответственно. Транскрипционная единица RNAII содержит четыре гена: AgrB, AgrD, AgrC и AgrA. Ген AgrD кодирует пептид, который является предшественником эффекторного внеклеточного сигнала Agr-системы кворум-сенсинга, получившего название аутоиндукторного пептида (autoinducing peptide — AIP). Молекула AIP состоит из 7–9 аминокислотных остатков и 5-членного тиолактонного кольца. Пептид AgrB, который представляет собой трансмембранную пептидазу с молекулярной массой тела 22 кДа, расположенный в цитоплазматической мембране, протеолизирует пептид AgrD до AIP, который и экспортирует из бактерии. Окончательное созревание пептида AIP во внеклеточной среде связано с действием пептидазы типа SspB. Бактерии Staphylococcus aureus могут продуцировать четыре аллельных варианта AIP: вариант I характеризуется аминокислотной последовательностью YSTCDFIM; вариант II — GVNACSSLF, вариант III — INCDFLL и вариант IV — YSTCYFIM. Каждый вариант AIP транскрибируется из собственного Agr-оперона и связывается со своей соответствующей киназой AgrC (рис. 1) [41].
Гены agrC и agrA кодируют двухкомпонентную сигнальную систему трансдукции, включающую сенсорную гистидинкиназу AgrC и регулятор ответа — пептид agrA. Сенсор AgrC является трансмембранным протеином, принадлежащим к семейству рецепторных гистидинпротеинкиназ. При помощи N-терминального мембранно-интегрированного сенсорного модуля гистидинкиназа AgrC обнаруживает и связывает AIP. После того как AIP связывается с сенсорным модулем протеина AgrC, происходит изменение конформации эндодомена молекулы AgrC, обусловливающее аутофосфорилирование и активацию киназы AgrC. Активированная гистидинкиназа AgrC фосфорилирует гомодимер AgrA, который связывается с промоторной областью P2, индуцируя генерацию транскрипта RNAII, и с промоторной областью P3, вызывая генерацию транскрипта RNAIII, которые способствуют продукции определенных QS-ассоциированных продуктов (рис. 2) [19, 32, 41].
Транскрипция RNAIII также зависит от активности двухкомпонентной QS-системы — RAP/TRAP. Протеин RAP (RNAIII activating protein) представляет собой секретируемую бактериями молекулу, которая, достигая критического уровня концентрации, участвует в активации протеина TRAP, известного как мишень RAP (target of RAP — TRAP). Высококонсервативный, конститутивно экспрессируемый, мембраносвязанный протеин TRAP после RAP-опосредованного фосфорилирования индуцирует экспрессию транскрипта RNAIII [2].
Система Agr является глобальным регулятором активности генов стафилококков [27]. Данная QS-система бактерий Staphylococcus aureus контролирует экспрессию более 100 факторов вирулентности [19]. Система Agr индуцирует экспрессию нескольких генов вирулентности, фенолсолютабных модулинов, токсинов, вызывающих шок (toxic shock syndrome toxins — TSST), и др. Представляет интерес то, что антисмысловой транскрипт RNAIII индуцирует продукцию a-гемолизина и других токсинов, протеаз, протеинов капсулы и в то же время подавляет продукцию поверхностного протеина A, который позволяет Staphylococcus aureus уклоняться от опсонизации, и адгезинов [27].
Система Agr активно участвует в формировании Staphylococcus aureus-ассоциированной биопленки. В экспериментальных условиях установлено, что добавление AIP в стафилококковую колонию способствует организации биопленки [28].
Система QS бактерий Staphylococcus aureus способствует инвазии при остром течении заболевания, а QS-зависимое формирование биопленки обусловливает рецидивирующее и хроническое течение инфекционного процесса [7, 19].
Обращает на себя внимание то, что в течение стафилококковой инфекции in vitro наблюдается появление мутантных бактериальных клонов, обладающих резко сниженной QS-активностью. Данные клоны, по-видимому, являются социальными бактериальными читерами, которые эксплуатируют кооперативные межбактериальные связи, не привнося свой вклад в пул факторов вирулентности, то есть тяжесть инфекционного процесса обратно пропорциональна доле читеров в популяции патогена. Учитывая, что соотношение между представительством кооперативных бактерий и читеров предопределяет вероятность летального исхода заболеваний, наличие бактериальных читеров может являться своеобразным микробиологическим признаком благоприятного исхода. Медикаментозное усиление генерации читеров может стать одним из направлений лечения, предупреждающих тяжелое течение заболевания [25].
Лекарственные средства, подавляющие развитие биопленки у бактерий Staphylococcus aureus
Среди ингибиторов QS бактерий Staphylococcus aureus различают несколько групп соединений, отличающихся по механизму действия (табл. 1).
Подавление экспорта AIP из бактериальной клетки
Результаты исследования, проведенного Daniel A. Todd и соавторами [33], свидетельствуют о том, что амбуиновая кислота (ambuic acid), представляющая собой высокофункциональный циклогексенон, выделенный из эндофитных грибов Pestalotiopsis spp. и Monochaetia sp., обладает мощным ингибирующим эффектом на биосинтез трансмембранной пептидазы AgrB. Подавление активности AgrB сопровождается снижением уровня высвобождения AIP во внеклеточное пространство и подавлением активности экспрессии нескольких генов, контролируемых Agr-системой бактерий Staphylococcus aureus (рис. 3) [34].
Блокада гистидинкиназы AgrC
В последнее время активно разрабатываются соединения, предупреждающие формирование биопленки бактериями Staphylococcus aureus за счет блокирования гистидинкиназы AgrC.
Наиболее многочисленной и изученной группой антибиопленочных средств являются соединения, структурно имитирующие AIP [35]. Так, идентифицированы четыре нефункциональных пептидных аналога AIP, которые предупреждают активацию гистидинкиназы AgrC [37]. Согласно мнению Yftah Tal-Gan и соавторов [30], наиболее эффективными синтетическими ингибиторами AgrC QS-системы бактерий Staphylococcus aureus являются AIP III D4A, tAIP III D2A, AIP III N2A/D4A и AIP III I1A/N2A/D4A.
Циклический пептид авелланин C, полученный из грибов Hamigera ingelheimensis, является выраженным конкурентом с AIP в процессе связывания с рецептором AgrC и блокирует активацию сигнального каскада, способствующего продукции факторов вирулентности и компонентов биопленки [14].
Показано, что нерибосомальный депсипептид солонамид B (solonamide B), синтезируемый морскими бактериями Photobacterium halotolerance spp. strain S2753, и его аналоги подавляют экспрессию a-гемолизина и фенолсолютабных модулинов бактерий Staphylococcus aureus. Однако солонамиды оказывает незначительное влияние на формирование биопленки. Солонамид B и его аналоги конкурентно ингибируют активность Agr-системы, препятствуя связыванию AIP с киназой AgrC [4, 12].
На основании скрининга 1000 соединений культуральных экстрактов актиномицетов Said E. Desouky и соавторы [9] установили, что три циклодепсипептида: WS9326A, WS9326B и кохинмицин II/III — обладают способностью подавлять активность Agr-системы бактерий Staphylococcus aureus. Соединения WS9326A и WS9326B ингибируют гемолиз, индуцированный бактериями Staphylococcus aureus.
Jingru Li и соавторы [21] определили, что пробиотические бактерии Lactobacillus reuteri RC-14 продуцируют малые сигнальные молекулы — циклические дипептиды: cyclo(L-Phe-L-Pro) и cyclo(L-Tyr-L-Pro), которые способны влиять на функционирование стафилококковой QS-системы и подавлять активность системы TSST-1 менструального штамма MN8 Staphylococcus aureus. Данные циклические дипептиды ингибируют транскрипцию всех генов локуса Agr бактерий Staphylococcus aureus и генов-регуляторов факторов вирулентности sarA и saeRS.
Ewan J. Murray и соавторы [23] показали, что 3-оксо-C12-HSL-1 бактерий Pseudomonas aeruginosa подавляет активность Agr-системы бактерий Staphylococcus aureus (рис. 4). Авторами разработана серия аналогов 3-оксо-C12-HSL, тетраминовой и тетрановой кислот, ингибирующих формирование биопленки бактерий Staphylococcus aureus. Вещество 3-оксо-C12-HSL также является модулятором иммунного и воспалительного ответа, активности эпителиального барьера.
Ингибирование экспрессии и функциональной активности AgrA
Активность экспрессии AgrA может быть успешно ингибирована антисмысловым олигонуклеотидом PLNA34, нарингенином и малой молекулой савирином.
Fei Da и коллеги [8] синтезировали антисмысловой олигонуклеотид PLNA34, ингибирующий экспрессию agrA и эффекторной молекулы RNAIII штамма USA300 LAC бактерий Staphylococcus aureus. Также PLNA34 ингибирует экспрессию таких Agr-ассоциированных вирулентных генов, как Hla, Psma, Psmb и Pvl. Бактериальные стафилококковые колонии после инкубации с олигонуклеотидом PLNA34 теряют свою гемолитическую активность и способность лизировать и рекрутировать нейтрофилы. Применение антисмыслового олигонуклеотида PLNA34 способствует выздоровлению мышей с экспериментальной кожной инфекцией, вызванной MRSA.
Антиоксидант нарингенин (naringenin) — 4',5,7-тригидроксилаванон — представляет собой флавоноид, в частности, гликозилированный флаванон, и представляет собой агликон нарингенина (нарингенин-7-рамноглюкозид), который обладает противовирусной и антибактериальной активностью [13, 42]. Ингаляционное введение нарингенина в концентрации 16 мкг/мл мышам с пневмонией, вызванной бактериями Staphylococcus aureus, способствует выраженному подавлению экспрессии a-токсина микроорганизмами и снижению активности воспалительного процесса в ткани легкого у экспериментальных животных. Авторы считают, что нарингенин является перспективным терапевтическим средством для лечения стафилококковых инфекций.
Идентифицировано соединение, ингибирующее AgrA, из категории малых молекул, которое получило название «савирин» (S. aureus virulence inhibitor — savirin) [29]. Савирин блокирует связывание AgrA с его сайтами связывания на промоторных регионах, что предотвращает активацию экспрессии генов AgrA и AgrC, транскрипта RNAIII и, как следствие, продукцию многочисленных секретируемых факторов вирулентности (рис. 5).
Ингибирование экспрессии транскрипта RNAIII
Первым ингибитором транскрипта RNAIII был идентифицирован гептапептид — YSPWTNF — RNAIII-ингибирующий пептид (RNAIII inhibiting peptide — RIP), способный подавлять активность инфекционного стафилококкового процесса. Пептид RIP ингибирует фосфорилирование протеина TRAP, который создает аутоиндуцирующую петлю синтеза RNAIII [2].
Для улучшения эффективности и стабильности действующей молекулы проведены различные модификации пептида RIP.
Согласно результатам сканирования пептида RIP было установлено, что основной действующей аминокислотной последовательностью является YSPWT, которая более активно подавляет жизнедеятельность бактерий Staphylococcus aureus, чем полная форма — YSPWTNF — пептида RIP [3].
Oriana Simonetti и коллеги [26] синтезировали аналоги RIP — FS (1–11), из которых наибольшей антибиопленочной антистафилококковой активностью обладали соединения FS3, FS8 и FS10. Примечательно, что тетрапептид FS10, представляющий последовательность H-Ser-Pro-Trp-Thr-NH2, содержит пролиновый остаток в Р2 и треониновый остаток в Р4 положениях. Данная композиция аминокислотных остатков является ключевым молекулярным фактором, который структурно ассоциирован с ингибированием жизнедеятельности стафилококковых бактерий.
Другой аналог RIP — 16P-AC (CH3CO-YKPVTNF-ST-YKPVTNF-CONH2) — достоверно подавляет формирование биопленки и адгезию бактерий MRSA. Применение пептида 16P-AC в дозе 10 мг/кг сопровождается достоверным снижением уровня бактериурии, количества КОЕ в тканях почек, мочевого пузыря у инфицированных крыс. Авторы полагают, что 16P-AC является молекулой, которая заслуживает дальнейшего исследования ее антибиопленочных возможностей [45].
В коре кустарникового ореха (Hamamelis virginiana) идентифицирован натуральный полифенол, принадлежащий семье танинов, непептидный аналог RIP — 2,5-ди-O-галоил (хамамелитанин — hamamelitannin), достоверно ингибирующий активность экспрессии транскрипта RNAIII бактерий Staphylococcus aureus. Хамамелитанин ингибирует фосфорилирование протеина TRAP, что приводит к снижению вирулентности и подавлению процесса формирования биопленки [38]. В настоящее время синтезировано несколько аналогов хамамелитанина и установлено, что они достоверно потенцируют активность ванкомицина при проведении лечения инфекционных заболеваний, вызванных MRSA [39].
Другие соединения, обладающие способностью ингибировать активность Agr-системы бактерий Staphylococcus aureus
В настоящее время идентифицировано несколько химических соединений, блокирующих экспрессию определенных факторов вирулентности бактерий Staphylococcus aureus. В частности, показано, что нестероидный противовоспалительный препарат дифлунизал (diflunisalum), одобренный Федеральным управлением по лекарственным средствам, ингибирует продукцию a-гемолизина и a-токсина дозозависимым образом без ингибирования роста бактерий [17]. J. Matthias Walz и соавторы [40] считают, что дифлунизал может быть использован при лечении инфекций, вызванных бактериями Staphylococcus aureus.
Продемонстрировано, что за счет содержания производного терпеноидов цис-неролидола эфирные масла черного перца, кананги и мирта ингибируют формирование биопленки бактерий Staphylococcus aureus. Применение эфирных масел черного перца приводит к подавлению активности экспрессии генов a-токсина (hla), нуклеазы и регуляторных генов QS-систем [20].
Выводы
Одной из чрезвычайных проблем современной инфектологии является лечение заболеваний, вызванных антибиотикорезистентными штаммами бактерий Staphylococcus aureus, способных формировать устойчивые к внешним воздействиям биопленки. Заболевания, ассоциированные с бактериями MRSA, характеризуется неблагоприятным течением и высоким риском летального исхода. Организация стафилококковых биопленок связана с функционированием таких QS-систем, как Agr и RAP/TRAP. Кроме участия в формировании биопленок эти системы регулируют экспрессию генов токсинов, фенолсолютабных модулинов, протеаз, протеинов капсулы бактерий. Основными направлениями, которые считают перспективными для разработки антибиопленочных препаратов, являются: подавление экспорта AIP из бактериальной клетки; ингибирование активности гистидинкиназы AgrC, экспрессии и функциональной активности AgrA, экспрессии транскрипта RNAIII. Не вызывает сомнения то, что препараты, которые будут разработаны для подавления активности QS-механизмов бактерий Staphylococcus aureus, займут достойное место в антистафилококковой терапии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Роль Toll-подобных рецепторов в рекогниции патоген-ассоциированных молекулярных структур инфекционных патогенных агентов в развитии воспаления. Часть 1. Семейство TLR // Здоровье ребенка. — 2012. — № 5(40). — С. 116-121.
2. Balaban N. Treatment of Staphylococcus aureus biofilm infection by the quorum-sensing inhibitor RIP / N. Balaban, O. Cirioni, A. Giacometti et al. // Antimicrob. Agents Chemother. — 2007 Jun. — 51(6). — Р. 2226-9. doi: 10.1128/AAC.01097-06.
3. Baldassarre L. Discovery of novel RIP derivatives by alanine scanning for the treatment of S. aureus infections / L. Baldassarre, E. Fornasari, C. Cornacchia et al. // Med. Chem. Comm. — 2013. — 4. — Р. 1114-1117. https://doi.org/10.1039/C3md00122a.
4. Baldry M. The agr Inhibitors Solonamide B and Analogues Alter Immune Responses to Staphylococccus aureus but Do Not Exhibit Adverse Effects on Immune Cell Functions / M. Baldry, B. Kitir, H. Frøkiær et al. // PLoS One. — 2016 Jan 5. — 11(1). — Р. e0145618. doi: 10.1371/journal.pone.0145618.
5. Bröker B.M., Holtfreter S., Bekeredjian-Ding I. Immune control of Staphylococcus aureus — regulation and counter-regulation of the adaptive immune response // Int. J. Med. Microbiol. — 2014 Mar. — 304(2). — Р. 204-14. doi: 10.1016/j.ijmm.2013.11.008.
6. Cassandra L. Quave, Alexander R. Horswill Flipping the switch: tools for detecting small molecule inhibitors of staphylococcal virulence // Front Microbiol. — 2014. — 5. — Р. 706. Prepublished online 2014 Oct 29. Published online 2014 Dec 12. doi: 10.3389/fmicb.2014.00706.
7. Cullen L., McClean S. Bacterial Adaptation during Chronic Respiratory Infections // Pathogens. — 2015 Mar 2. — 4(1). — Р. 66-89. doi: 10.3390/pathogens4010066.
8. Da F. Antisense locked nucleic acids targeting agrA inhibit quorum sensing and pathogenesis of community-associated methicillin-resistant Staphylococcus aureus / F. Da, L. Yao, Z. Su et al. // J. Appl. Microbiol. — 2017 Jan. — 122(1). — Р. 257-267. doi: 10.1111/jam.13321.
9. Desouky S.E. Cyclodepsipeptides produced by actinomycetes inhibit cyclic-peptide-mediated quorum sensing in Gram-positive bacteria / S.E. Desouky, A. Shojima, R.P. Singh et al. // FEMS Microbiol. Lett. — 2015 Jul. — 362(14). — Рii: fnv109. doi: 10.1093/femsle/fnv109.
10. Doulgeraki A.I. Methicillin-resistant food-related Staphylococcus aureus: a review of current knowledge and biofilm formation for future studies and applications / A.I. Doulgeraki, P. Di Ciccio, A. Ianieri, G.E. Nychas // Res. Microbiol. — 2017 Jan. — 168(1). — Р. 1-15. doi: 10.1016/j.resmic.2016.08.001.
11. Habboush Y., Guzman N. Antibiotic Resistance // StatPearls [Internet]. — Treasure Island (FL): StatPearls Publishing, 2018 Jan — 2018 Jun 6.
12. Hansen A.M. Lactam hybrid analogues of solonamide B and autoinducing peptides as potent S. aureus AgrC antagonists / A.M. Hansen, P. Peng, M. Baldry et al. // Eur. J. Med. Chem. — 2018 May 25. — 152. — Р. 370-376. doi: 10.1016/j.ejmech.2018.04.053.
13. Hernández-Aquino E., Muriel P. Beneficial effects of naringenin in liver diseases: Molecular mechanisms // World J. Gastroenterol. — 2018 Apr 28. — 24(16). — Р. 1679-1707. doi: 10.3748/wjg.v24.i16.1679.
14. Igarashi Y. Avellanin C, an inhibitor of quorum-sensing signaling in Staphylococcus aureus, from Hamigera ingelheimensis / Y. Igarashi, F. Gohda, T. Kadoshima et al. // J. Antibiot. (Tokyo). — 2015 Nov. — 68(11). — Р. 707-10. doi: 10.1038/ja.2015.50.
15. Junie L.M. Molecular epidemiology of the community-associated methicillin-resistant staphylococcus aureus clones: a synthetic review / L.M. Junie, I.I. Jeican, L. Matroş, S.L. Pandrea // Clujul. Med. — 2018 — 91(1). — Р. 7-11. doi: 10.15386/cjmed-807.
16. Karathanasi G. Linear peptidomimetics as potent antagonists of Staphylococcus aureus agr quorum sensing / G. Karathanasi, M.S. Bojer, M. Baldry et al. // Sci. Rep. — 2018 Feb 23. — 8(1). — Р. 3562. doi: 10.1038/s41598-018-21951-4.
17. Khodaverdian V. Discovery of antivirulence agents against methicillin-resistant Staphylococcus aureus / V. Khodaverdian, M. Pesho, B. Truitt et al. // Antimicrob. Agents Chemother. — 2013 Aug. — 57(8). — Р. 3645-52. doi: 10.1128/AAC.00269-13.
18. Kumburu H.H. Hospital Epidemiology of Methicillin-Resistant Staphylococcus aureus in a Tertiary Care Hospital in Moshi, Tanzania, as Determined by Whole Genome Sequencing / H.H. Kumburu, T. Sonda, P. Leekitcharoenphon et al. // Biomed. Res. Int. — 2018 Jan 2. — 2018. — 2087693. doi: 10.1155/2018/2087693.
19. Le K.Y., Otto M. Quorum-sensing regulation in staphylococci-an overview // Front. Microbiol. — 2015 Oct 27. — 6. — 1174. doi: 10.3389/fmicb.2015.01174.
20. Lee K. Anti-biofilm, anti-hemolysis, and anti-virulence activities of black pepper, cananga, myrrh oils, and nerolidol against Staphylococcus aureus / K. Lee, J.H. Lee, S.I. Kim et al. // Appl. Microbiol. Biotechnol. — 2014 Nov. — 98(22). — Р. 9447-57. doi: 10.1007/s00253-014-5903-4.
21. Li J. Lactobacillus reuteri-produced cyclic dipeptides quench agr-mediated expression of toxic shock syndrome toxin-1 in staphylococci / J. Li, W. Wang, S.X. Xu et al. // Proc. Natl. Acad. Sci. USA. — 2011 Feb 22. — 108(8). — Р. 3360-5. doi: 10.1073/pnas.1017431108.
22. Madden G.R., Sifri C.D. Antimicrobial Resistance to Agents Used for Staphylococcus aureus Decolonization: Is There a Reason for Concern? // Curr. Infect. Dis. Rep. — 2018 Jun 7. — 20(8). — 26. doi: 10.1007/s11908-018-0630-0.
23. Murray E.J. Targeting Staphylococcus aureus quorum sensing with nonpeptidic small molecule inhibitors / E.J. Murray, R.C. Crowley, A. Truman et al. // J. Med. Chem. — 2014 Mar 27. — 57(6). — Р. 2813-9. doi: 10.1021/jm500215s.
24. Novick R.P., Geisinger E. Quorum sensing in staphylococci // Annu. Rev. Genet. — 2008. — 42. — Р. 541-64. doi: 10.1146/annurev.genet.42.110807.091640.
25. Pollitt E.J. Cooperation, quorum sensing, and evolution of virulence in Staphylococcus aureus / Pollitt E.J., West S.A., Crusz S.A. et al. // Infect. Immun. — 2014 Mar. — 82(3). — Р. 1045-51. doi: 10.1128/IAI.01216-13.
26. Simonetti O. Efficacy of the Quorum Sensing Inhibitor FS10 Alone and in Combination with Tigecycline in an Animal Model of Staphylococcal Infected Wound / O. Simonetti, O. Cirioni, I. Cacciatore et al. // PLoS One. — 2016 Jun 2. — 11(6). — Р. e0151956. doi: 10.1371/journal.pone.0151956.
27. Singh R., Ray P. Quorum sensing-mediated regulation of staphylococcal virulence and antibiotic resistance // Future Microbiol. — 2014. — 9(5). — Р. 669-81. doi: 10.2217/fmb.14.31.
28. Solano C., Echeverz M., Lasa I. Biofilm dispersion and quorum sensing // Curr. Opin. Microbiol. — 2014 Apr. — 18. — Р. 96-104. doi: 10.1016/j.mib.2014.02.008.
29. Sully E.K. Selective chemical inhibition of agr quorum sensing in Staphylococcus aureus promotes host defense with minimal impact on resistance / E.K. Sully, N. Malachowa, B.O. Elmore et al. // PLoS Pathog. — 2014 Jun 12. — 10(6). — Р. e1004174. doi: 10.1371/journal.ppat.1004174.
30. Tal-Gan Y. Highly potent inhibitors of quorum sensing in Staphylococcus aureus revealed through a systematic synthetic study of the group-III autoinducing peptide / Y. Tal-Gan, D.M. Stacy, M.K. Foegen et al. // J. Am. Chem. Soc. — 2013 May 29. — 135(21). — Р. 7869-82. doi: 10.1021/ja3112115.
31. Tal-Gan Y., Stacy D.M., Blackwell H.E. N-Methyl and peptoid scans of an autoinducing peptide reveal new structural features required for inhibition and activation of AgrC quorum sensing receptors in Staphylococcus aureus // Chem. Commun. (Camb.). — 2014 Mar 21. — 50(23). — Р. 3000-3. doi: 10.1039/c4cc00117f.
32. Tan L. Therapeutic Targeting of the Staphylococcus aureus Accessory Gene Regulator (agr) System / L. Tan, S.R. Li, B. Jiang, X.M. Hu, S. Li // Front. Microbiol. — 2018 Jan 25. — 9. — 55. doi: 10.3389/fmicb.2018.00055.
33. Todd D.A. Hybrid Quadrupole-Orbitrap mass spectrometry for quantitative measurement of quorum sensing inhibition / D.A. Todd, D.B. Zich, K.A. Ettefagh et al. // J. Microbiol. Methods. — 2016 Aug. — 127. — Р. 89-94. doi: 10.1016/j.mimet.2016.05.024.
34. Todd D.A. Signal Biosynthesis Inhibition with Ambuic Acid as a Strategy To Target Antibiotic-Resistant Infections / D.A. Todd, C.P. Parlet, H.A. Crosby et al. // Antimicrob. Agents Chemother. — 2017 Jul 25. — 61(8). — Р. e00263-17. doi: 10.1128/AAC.00263-17.
35. Tsuchikama K., Shimamoto Y., Anami Y. Truncated Autoinducing Peptide Conjugates Selectively Recognize and Kill Staphylococcus aureus // ACS Infect. Dis. — 2017 Jun 9. — 3(6). — Р. 406-410. doi: 10.1021/acsinfecdis.7b00013.
36. Turkey A.M. Molecular assessment of accessory gene regulator (agr) quorum sensing system in biofilm forming Staphylococcus aureus and study of the effect of silver nanoparticles on agr system / A.M. Turkey, K.K. Barzani, A.A.J. Suleiman, J.J. Abed // Iran. J. Microbiol. — 2018 Feb. — 10(1). — Р. 14-21. PMID: 29922414.
37. Vasquez J.K. Simplified AIP-II Peptidomimetics Are Potent Inhibitors of Staphylococcus aureus AgrC Quorum Sensing Receptors / J.K. Vasquez, Y. Tal-Gan, G. Cornilescu et al. // Chembiochem. — 2017 Feb 16. — 18(4). — Р. 413-423. doi: 10.1002/cbic.201600516.
38. Vermote A. Hamamelitannin Analogues that Modulate Quorum Sensing as Potentiators of Antibiotics against Staphylococcus aureus / Vermote A., Brackman G., Risseeuw M.D. et al. // Angew. Chem. Int. Ed. Engl. — 2016 May 23. — 55(22). — Р. 6551-5. doi: 10.1002/anie.201601973.
39. Vermote A. Novel hamamelitannin analogues for the treatment of biofilm related MRSA infections-A scaffold hopping approach / A. Vermote, G. Brackman, M.D. Risseeuw et al. // Eur. J. Med. Chem. — 2017 Feb 15. — 127. — Р. 757-770. doi: 10.1016/j.ejmech.2016.10.056.
40. Walz J.M. Anti-infective external coating of central venous catheters: a randomized, noninferiority trial comparing 5-fluorouracil with chlorhexidine/silver sulfadiazine in preventing catheter colonization / J.M. Walz, R.L. Avelar, K.J. Longtine et al. // Crit. Care Med. — 2010 Nov. — 38(11). — Р. 2095-102. doi: 10.1097/CCM.0b013e3181f265ba.
41. Wang B., Muir T.W. Regulation of Virulence in Staphylococcus aureus: Molecular Mechanisms and Remaining Puzzles // Cell. Chem. Biol. — 2016 Feb 18. — 23(2). — Р. 214-24. doi: 10.1016/j.chembiol.2016.01.004.
42. Wang L.H. Modification of membrane properties and fatty acids biosynthesis-related genes in Escherichia coli and Staphylococcus aureus: Implications for the antibacterial mechanism of naringenin / L.H. Wang, X.A. Zeng, M.S. Wang et al. // Biochim. Biophys. Acta. — 2018 Feb. — 1860(2). — Р. 481-490. doi: 10.1016/j.bbamem.2017.11.007.
43. Washam M. Risk factors for methicillin-resistant Staphylococcus aureus colonization in the neonatal intensive care unit: A systematic review and meta-analysis / M. Washam, J. Woltmann, B. Haberman et al. // Am. J. Infect. Control. — 2017 Dec 1. — 45(12). — Р. 1388-1393. doi: 10.1016/j.ajic.2017.06.021.
44. Zhang Y. Inhibition of a-toxin production by subinhibitory concentrations of naringenin controls Staphylococcus aureus pneumonia / Y. Zhang, J.F. Wang, J. Dong et al. // Fitoterapia. — 2013 Apr. — 86. — Р. 92-9. doi: 10.1016/j.fitote.2013.02.001.
45. Zhou Y. Oligomerization of RNAIII-Inhibiting Peptide Inhibits Adherence and Biofilm Formation of Methicillin-Resistant Staphylococcus aureus In Vitro and In Vivo / Y. Zhou, R. Zhao, B. Ma et al. // Microb. Drug. Resist. — 2016 Apr. — 22(3). — Р. 193-201. doi: 10.1089/mdr.2015.0170.

/70-1.jpg)
/71-1.jpg)
/72-1.jpg)
/73-1.jpg)
/74-1.jpg)