Вступ
Нейродегенеративні хвороби залишаються актуальною й остаточно не вирішеною проблемою сучасної неврології. Однією з найпоширеніших у людській популяції форм нейродегенерації є так званий скроневий медіанний склероз (СМС; temporal mesial sclerosis), який все ще залишається недостатньо діагностованим феноменом у клінічній практиці неврологів і психіатрів. Цим терміном позначають випадки повільно прогресуючої нейродегенерації в серединних відділах скроневих часток півкуль великого мозку зі специфічною клінічною, патоморфологічною й нейровізуалізаційною картиною [3]. Хоча на сьогодні встановлено багато етіологічних чинників СМС у людей, герпесвірусні інфекції, особливо віруси герпесу 6-го і 7-го типів (HHV-6 і HHV-7), вважаються основною причиною розвитку зазначеної патології. З’ясування етіологічної ролі герпесвірусів у розвитку СМС відкриває багатообіцяючі перспективи досягнення контролю над нейродегенеративним процесом за рахунок адекватного противірусного лікування, і результати першого контрольованого дослідження з апробації противірусних ліків при СМС, асоційованому з герпесвірусними інфекціями [7], підтверджують перспективність окресленого напрямку.
Характеристика нейродегенерації
Як відомо, СМС — прогресуючий нейродегенеративний розлад, в основі якого лежить поступова втрата нейронів, перебудова міжнейронних зв’язків і прогредієнтний реактивний астрогліоз у серединних структурах скроневих часток півкуль великого мозку, що належать до лімбічної системи центральної нервової системи (ЦНС) [10]. Спочатку вражаються майже виключно гіпокампи, мигдалеподібні тіла, острівці й парагіпокампальні звивини, однак згодом нейродегенерація поширюється й на інші структури мозку через втрату аферентних і еферентних зв’язків. Основою клінічної картини цієї нейродегенерації є чотири синдроми: ней-ропсихіатричні розлади (тривога, депресія, інсомнія і/або шизофреноподібні прояви тощо), вегетативна дисфункція (включно з панічними атаками), когнітивне зниження особистості й епілептичний синдром за типом скроневої медіанної епілепсії [6]. При СМС не формуються рухові або координаторні порушення, а переважають розлади в психічній сфері, тому пацієнти нерідко звертаються по допомогу до психіатрів, а не до неврологів. Кінцевими наслідками СМС є рефрактерна скронева епілепсія, асоційована зі скроневим медіанним склерозом (temporal lobe epilepsy associated with mesial temporal sclerosis, TLE-MTS) [61], або скронева медіанна епілепсія з гіпокамапальним склерозом (mesial temporal lobe epilepsy with hippocampal sclerosis, MTLE-HS) [44], що нерідко потребує нейрохірургічних втручань, і/або скронева деменція, яка може нагадувати за клініко-інструментальними даними хворобу Альц-геймера з формуванням недієздатності пацієнта.
Стадії СМС
Клінічний перебіг СМС має принаймні три послідовні етапи: латентний, доепілептичний/додементний і власне епілептичний/дементний. Латентний період триває з моменту проникнення герпесвірусу в сере-динні структури скроневих часток півкуль великого мозку до появи перших клінічних симптомів СМС — від кількох місяців до кількох років. Існування цього періоду пов’язано зі здатністю мозку функціонально компенсувати втрату нейронів на початкових проявах нейродегенерації за рахунок реалізації процесів нейропластичності. Протягом латентного періоду деякі пацієнти страждають від клінічних проявів, що нагадують синдром хронічної втоми [19]. Ці загальні симптоми зазвичай зумовлені вірусемією, сформованою причинним вірусом, тому інформативною в діагностиці в таких випадках є полімеразна ланцюгова реакція (ПЛР) крові з видоспецифічними праймерами інфекційного агента [21]. Проте інші пацієнти можуть почувати себе задовільно протягом усього латентного періоду, вважати себе здоровими особами й не звертатися по медичну допомогу з приводу цієї проблеми. Момент проникнення вірусу до ЦНС може бути безсимптомним, проте в дітей при первинному інфікуванні HHV-6 або HHV-7 іноді розвиваються так звані фебрильні судоми, що в деяких випадках можуть бути точкою відліку початку нейродегенерації [60]. Якщо СМС розвинувся після лімбічного герпесвірусного енцефаліту, латентний період зазвичай відсутній (рис. 1) [11].
/9.jpg)
Доепілептичний/додементний період характеризується поступовим наростанням нейропсихіатричних, вегетативних і когнітивних розладів із різним темпом прогресування у різноманітних комбінаціях. Перебіг хвороби доволі варіабельний: деякі пацієнти при повільному прогресуванні нейродегенерації ніколи не досягають епілептичної/дементної стадії, а в інших перші епілептичні напади розвиваються вже в дитячому віці.
Епілептична/дементна стадія СМС характеризується проявами скроневої медіанної епілепсії з переважанням парціальних епілептичних нападів над генералізованими і/або розвитком скроневої деменції з грубими порушеннями у семантичній сфері [39]. У більшості пацієнтів прояви епілепсії передують розвитку деменції, проте є й такі, які страждають від деменції без епілептичних нападів.
Етіологічна роль гепесвірусів при СМС
Як відомо, СМС може розвиватися спонтанно, тобто без епізоду перенесеного напередодні лімбічного енцефаліту, або мати постенцефалітне походження. Уперше про зв’язок між герпесвірусами й СМС стало відомо після опису цієї нейродегенерації в пацієнтів, які перенесли скроневий частковий некротично-геморагічний енцефаліт, зумовлений вірусами простого герпесу 1-го і 2-го типів [53]. Однак основний поштовх до розвитку вчення про етіологічну роль герпесвірусів при СМС отримало після відкриття вірусів герпесу 6-го і 7-го типів, що є провідними чинниками прогресування нейродегенерації при СМС. Доказова база причетності герпесвірусів до розвитку СМС ґрунтується на таких пунктах: закономірний розвиток СМС після скроневого й лімбічного енцефалітів герпесвірусної природи [11, 53], наявність ДНК, РНК і білків вірусу в зоні нейродегенерації [22, 25], відкриття низки механізмів вірус-індукованої нейродегенерації й епілептогенезу [26, 35], виявлення кореляції між експресією вірусних білків і процесами глутаматергічної ексайтотоксичності в зоні ураження [26], відтворення СМС у піддослідних тварин при інфікуванні герпесвірусами [65], з’ясування механізму трансольфакторної міграції герпесвірусів із верхніх дихальних шляхів до нейронів гіпокампів і мигдалеподібних тіл (рис. 2) [30].
/10.jpg)
Клінічна картина СМС
Увесь комплекс клінічних проявів при СМС у доепілептичний/додементий період об’єднали під терміном «зміна особистості» (change personality). Ураження різних структур лімбічної системи скроневих часток при СМС призводить до появи різних клінічних симптомів. Так, склероз гіпокампів і парагіпокампальних звивин відповідальний за когнітивне зниження особистості з порушенням функції короткочасної пам’яті й збереженням функції довготривалої пам’яті. Натомість склероз мигдалеподібних тіл призводить до порушень в емоційній сфері й розладів поведінки. Ураження острівців відповідальні за вегетативну дисфункцію, включно з панічними атаками, гіпервентиляційним синдромом і синдромом подразненої товстої кишки.
Тотальне ураження. При найтяжчих ураженнях зміна особистості при СМС полягає або в так званому особистісному синдромі (personality syndrome) при однобічному ураженні, або в синдромі Клювера — Бюсі (Kluver-Bucy syndrome) при білатеральному залученні структур лімбічної системи ЦНС. P.C. Trevisol-Bittencourt, A.R. Troiano описали особистісний синдром при ураженні недомінантної скроневої частки, що полягав в індукції гіпосексуальності, гіперрелігійності, зниженні розуміння гумору й гіперфагії [62]. Натомість глибока двобічна атрофія гіпокампів у випадку тяжкого СМС може призводити до розвитку синдрому Клювера — Бюсі, який включає гіперсексуальність, розлади емоційної поведінки, включаючи ексгібіціонізм, а також гіпероралізм і візуальну агнозію [12].
Соціальна інтерференція. У разі м’якших форм ней-родегенерації при СМС, які зустрічаються частіше, можуть відзначатися прогресуючі емоційні розлади й порушення функції соціальної інтерференції, як показали М. Cohn зі співавт. Зокрема, виявили, що атрофія лівого гіпокампа призводить до загальної дисфункції соціальної адаптації особистості, тоді як атрофія лівого переднього неокортексу опосередковує розвиток проявів патологічного сарказму [18].
Тривога. Розлади психіки при СМС доволі різноманітні. Тривога може бути першим клінічним проявом СМС у людей. Як показали H.M. Munger Clary зі співавт. у спеціально спланованому клінічному дослідженні, СМС незалежно асоційований із тривожним розладом особистості (OR = 2,12; 95% CI = 1,11–4,04, p = 0,023) [42]. Крім тривоги, у таких пацієнтів найчастіше розвиваються велика депресія, епізоди психозів, шизофреноподібні прояви і, рідше, біполярний розлад й обсесивно-компульсивний синдром.
Депресія і психоз. Згідно з результатами дослідження D. San-Juan зі співавт., при склерозі гіпокампів має місце велика депресія в 50 %, психотичні епізоди — в 16 %, а ознаки деменції — ще у 8 % випадків [51].
G.N. de Oliveira зі співавт. у спеціально спланованому дослідженні за участю 73 пацієнтів діагностували ознаки розладу настрою в 49,3 %, депресії — в 27,4 %, біполярного розладу — в 9,6 %, тривоги — в 42,5 % (у тому числі генералізованого тривожного розладу — в 21,9 %), обсесивно-компульсивного розладу — в 11,0 %, психотичних епізодів — у 5,5 % випадків. Автори відзначають, що зазначені психічні порушення частіше розвивалися при лівобічному СМС, ніж при правобічному [20]. Р. Puppala зі співавт. повідомили про тяжкий психоз як прояв СМС у пацієнта, який раніше страждав від темпоральної медіанної епілепсії [48]. L. Gayubo Moreo
зі співавт. повідомили про розвиток епізодів психотичної депресії при СМС, яку описували раніше в асоціації з часторецидивною HSV-1-інфекцією у вигляді орофаціального герпесу [28]. А. Quiske зі співавт. за допомогою мультиваріативного аналізу показали, що депресія в пацієнтів із СМС, пов’язаним зі скроневою медіанною епілепсією, обумовлена саме СМС, а не є реакцією пацієнта на хворобу або наслідком впливу антиконвульсивних медикаментів. Відзначено, що прояви депресії частіше розвиваються при переважному лівобічному ураженні медіанних відділів скроневих часток півкуль великого мозку [49].
Шизофреноподібні розлади. D.C. Taylor зі співавт. у дослідженні за участю 255 пацієнтів показав зв’язок СМС із шизофреноподібними проявами з дисоціативними розладами мислення, галюцинаціями, параноєю зі збереженням критики до свого стану, особливо часто в лівшів [59]. Відповідно до цього R.K. Singh зі співавт. описали комплексні візуальні й слухові галюцинації, а також зміну півкульної домінантності при СМС у дитини [56].
Емоційні й поведінкові порушення. Розлади емоцій, волі й поведінки при СМС відрізняються в чоловіків і жінок, що дозволяє говорити про модулюючий вплив статевих гормонів. Якщо в чоловіків частіше відзначаються прояви агресивності й експлозивні психотичні напади, то в жінок нерідко реєструють істериформну симптоматику, безпосередньо зумовлену ураженням мигдалеподібних тіл. Так, S.R. Benbadis зі співавт. описали серію випадків психогенних демонстративних неепілептичних нападів, що імітували прояви скроневої медіанної епілепсії, у пацієнтів із СМС [13].
A.E.R. Furlan зі співавт. у нещодавньому ретроспективному когортному дослідженні встановили, що психогенні неепілептичні напади комбінувалися з істинними епілептичними нападами у 29,7 % випадків і були єдиною формою нападів в 9,8 % випадків серед пацієнтів із TLE-MTS [27]. Натомість L.T. van Elst зі співавт. у контрольованому випробуванні показали тісну асоціацію афективної агресивності з атрофією мигдалеподібних тіл і оточуючих церебральних структур у пацієнтів із СМС. Напади агресивності поєднувалася із лівобічним ураженням мигдалеподібних тіл, двобічними патологічними змінами на електроенцефалограмі (ЕЕГ) і магнітно-резонансній томограмі (МРТ) головного мозку, характерними для СМС, низьким рівнем IQ, депресією й тривожністю [63]. Відповідно до цього А. Jacob зі співавт. у контрольованому клінічному дослідженні встановили зв’язок контралатерального емоційного лицьового парезу і СМС у людей [32].
Цефалгія. При СМС може розвиватися рефрактерний цефалгічний синдром. J.C. Nunes зі співавт. у дослідженні за участю 100 пацієнтів з СМС і пов’язаним із цим епілептичним синдромом показали тісний зв’язок цієї нейродегенерації з рецидивним іпсилатеральним цефалгічним синдромом. У 51,9 % випадків епізодичний головний біль за фенотипом відповідав критеріям мігрені й лише в 39,1 % — головного болю напруження. Напади целфалгій були частими, тяжкими й зі схильністю до латералізації [45].
Когнітивне зниження. Розлади когнітивної сфери при СМС широко варіюють — від мінімальної пізнавальної дисфункції до деменції. Вважають, що СМС є причиною щонайменше 16 % усіх випадків деменції в людей. У випадку постенцефалітичного СМС розвиваються грубі когнітивні розлади, зокрема, були випадки антеро- і ретроградної амнезії, аналогічні до тих, що часто відзначаються після травм мозку. При СМС відомі клінічні прояви, що нагадують транзиторну глобальну амнезію, здебільшого після перенесеного скроневого часткового енцефаліту, викликаного вірусом простого герпесу 1-го типу [38]. D. Pacagnella зі співавт. у секційному перехресному дослідженні встановили, що порушення пам’яті не пов’язані з частотою й тяжкістю епілептичних нападів у пацієнтів зі скроневою медіанною епілепсією, а є прямим незалежним проявом СМС [47]. Відповідно до цього A.R. Giovagnoli, G. Avanzini зі співавт. в іншому контрольованому дослідженні за участю 131 пацієнта показали зв’язок СМС з порушенням пам’яті й здатності до навчання [29]. L.H. Castro зі співавт. встановили, що вибіркове порушення вербальної пам’яті при СМС відзначається в 25,6 % випадків при ураженні лівого гіпокампа, а невербальної пам’яті — в 26,2 % випадків у разі залучення правої гіпокампальної ділянки. Глобальне ураження функції пам’яті має місце лише в 13,8 % випадків [17]. Натомість S. Oddo зі співавт. встановили, що порушення пам’яті відзначалися щонайменше в 66 % випадків серед 71 пацієнта з СМС. У 21 особи виявлені розлади вербальної пам’яті, у 17 — візуальної, тоді як поєднане порушення діагностовано лише у 8 випадках. Відзначалася кореляція між магнітно-резонансними даними у вигляді гіперінтенсивності сигналу гіпокампів на Т2-зважених знімках і глибиною когнітивних розладів, які відзначалися при клінічному дослідженні пацієнта. Функція мовлення була порушеною в 46 %, а виконавчі функції — в 25 % випадків СМС [46]. B.P. Hermann зі співавт. у контрольованому клінічному дослідженні за участю 107 пацієнтів продемонстрували асоціацію СМС зі зниженням інтелігентності, рівня академічних знань, порушенням мовлення й візуальної пізнавальної діяльності [31].
Семантична деменція. Розлади семантичної сфери психічної діяльності типові для СМС, однак діагностуються зрідка, оскільки випадають з поля зору клініцистів. C.S. Messas зі співавт. у спеціально спланованому контрольованому клінічному дослідженні виявили порушення семантичної пам’яті в пацієнтів із СМС, зокрема визначення слів і називання об’єктів [39]. За даними Р. Rzezak зі співавт., при СМС має місце порушення негайної й відстроченої епізодичної пам’яті, візуальної епізодичної пам’яті, утруднення вербального й візуального навчання, зниження результатів тестування семантичних навиків, називання предметів, визначення слів і повторення речень [50].
Вегетативна дисфункція. Вегетативні розлади, пов’язані зі СМС, можуть бути перманентними або пароксизмальними. Тахікардія або тахіаритмія є раннім проявом епілептичного нападу або вегетативної дисфункції при СМС, особливо при правобічному ураженні лімбічної системи, згідно з результатами К. Kato зі співавт. [33]. М. Sazgar зі співавт. повідомили про серію панічних атак (вегетативних кризів), зумовлених СМС, які спочатку помилково інтерпретували як вегетативні епілептичні напади [52]. Ураження домінантного (лівобічного — у правшів) острівця зумовлює формування так званих симпатоадреналових кризів із тахікардією, артеріальною гіпертензією, страхом і тремором м’язів, а недомінантного острівця — вагоінсулярних нападів із брадикардією, артеріальною гіпотензією, пітливістю і гіпермоторикою кишечника. Найчастіше СМС є білатеральним, і тому одночасно уражаються обидві інсулярні зони. У зв’язку з цим у клінічній практиці при СМС здебільшого реєструються змішані вегетативні напади з переважанням симпатичних або парасимпатичних впливів у різних системах.
Скронева медіанна епілепсія з переважанням простих і складних парціальних епілептичних нападів над генералізованими тоніко-клонічними судомними пароксизмами є типовим проявом у пацієнтів з СМС, що зазвичай формується на пізній стадії хвороби, при прогресуванні процесу нейродегенерації. Нами запропонована оригінальна концепція вірус-індукованої трансформації синаптичної передачі збудження як моделі розвитку епілептичного синдрому при СМС [9].
Зазвичай при СМС реєструються сенсорні, рухові, сенсомоторні, психічні й вегетативні епілептичні напади без пригнічення свідомості або з її потьмаренням, глибина якого може широко варіювати — від дереалізації й деперсоналізації до трансу, психотичного нападу й делірію. L.A. Suemitsu зі співавт. у перехресному секційному лонгітудинальному дослідженні за допомогою Т2-релаксометрії продемонстрували тісний зв’язок між дебютом епілептичного синдрому й глибиною склерозу гіпокампів у пацієнтів зі скроневою медіанною епілепсією. У багатьох родичів цих осіб відзначалися початкові асимптомні нейровізуалізаційні прояви СМС [57]. S.M. Mirsattari зі співавт. доповіли про 6 випадків психічних епілептичних нападів, які сплутали з проявами психіатричної патології. У трьох із них епілептичний пароксизм мав перебіг панічної атаки, ще у двох — психозу, а в одному — шизофренії [41]. G.H. Dove зі співавт. доповіли про піломоторні епілептичні напади з феноменом гусячої шкіри при СМС у людей [23]. Сироваткова концентрація фактора некрозу пухлини альфа може бути біомаркером тяжкості стану й прогнозування подальшого перебігу хвороби при скроневій медіанній епілепсії в пацієнтів зі СМС [37].
ЕЕГ дозволяє виявити характерні зміни біоелектричної активності в іктальний та інтеріктальний період при СМС (рис. 3). ЕЕГ важлива для розрізнення істеричних і справжніх епілептичних нападів, а також вегетативних парціальних епілептичних приступів і панічних атак у пацієнтів із СМС.
Діагностика СМС, асоційованого з герпесвірусною інфекцією
Діагноз СМС, асоційованого з герпесвірусною інфекцією, має мати принаймні три компоненти: а) ідентифікацію власне феномену СМС за клініко-радіологічними даними; б) виявлення ознак герпесвірусної інфекції, що є рушійною силою нейродегенерації; в) діагностику первинного або вторинного імунодефіциту, що підтримує реактивацію герпесвірусної інфекції з латентного стану.
Про СМС як про нейродегенерацію, асоційовану з епілептичним синдромом, стало відомо з 60-х років минулого сторіччя завдяки патоморфологічним дослідженням біоптатів головного мозку, отриманих при нейрохірургічних втручаннях з приводу рефрактерної скроневої медіанної епілепсії (рис. 4). Для СМС характерний специфічний патерн зниження нейрональної щільності з картиною кінців пелюсток (endfolium pattern) і феноменом проростання замшілих волокон (mossy fibers sprouting), при якому гранульозні клітини формують два типи синапсів: з клітинами-корзинами, які є інгібіторними інтернейронами, і дендритами гранульози або пірамідних нейронів, що є збуджуючими клітинами [54]. За даними патоморфологічного дослідження I. Blümcke зі співавт., більшість пірамідних і мультиполярних нейронів у зоні склерозу демонструють інтенсивні розгалуження дендритів і періодичні зони вузлового набряку дендритичних валів. Електрон-на мікроскопія підтверджує порушення морфології нейронів з акумуляцією філаментів цитоскелету й збільшенням кількості мітохондрій [14].
/13.jpg)
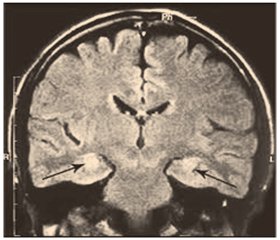
На сьогодні біопсію головного мозку для діагностики СМС виконують зрідка у зв’язку з досягненнями неінвазивної нейровізуалізації. МРТ головного мозку без контрасту на томографі з величиною магнітної індукції 1,5 Тл дозволяє виявити характерну неоднорідну, затухаючу до периферії гіперінтенсивність сигналу в Т2-зваженому режимі й режимі FLAIR із нечіткими межами в зоні гіпокампів, мигдалеподібних тіл, острівців і парагіпокампальних звивин в одного або двох боків [4] (рис. 5). Однак при ранніх проявах СМС може знадобитися томограф із величиною магнітної індукції 3, 4 або навіть 7 Тл для коректної нейровізуалізації. Це стадія СМС без атрофії. При прогресуванні нейродегенерації з’являються ознаки атрофії гіпокампів, мигдалеподібних тіл і острівців, яку можна ідентифікувати в скринінговому режимі за рахунок виявлення локального розширення анатомічних борозен, а точніше, оцінити на підставі даних воксельної морфометрії мозку. На сьогодні апробоване, валідоване й доступне на ринку комерційне програмне забезпечення з автоматизованої сегментації об’єму гіпокампів для магнітно-резонансних томографів, що дозволяє виявляти й оцінювати тяжкість СМС на атрофічній стадії патологічного процесу [40].
Дифузійно-зважені МРТ-знімки й режим гіпокампальної Т2-релаксометрії допомагають правильно оцінити локальний набряк у гіпокампах і мигдалеподібних тілах і залучення оточуючої білої речовини півкуль великого мозку при СМС у людей [10]. Як показали M.R. Nazem-Zadeh зі співавт., при проведенні МРТ головного мозку в дифузійно-зваженому режимі при наявності склерозу гіпокампів відзначається підвищення обсягу основної дифузності в іпсилатеральному гіпокампі й редукція функціональної анізотропії в задньонижньому субрегіоні іпсилательної поясної звивини й ніжки склепіння [43].
R.P. Carne зі співавт. описали серію випадків МРТ-негативного, однак позитивного при проведенні позитронної емісійної томографії СМС, що зумовлював генерацію епілептичних нападів [16]. Як повідомляють R.K. Singh зі співавт., позитронна емісійна томографія з флюородеоксиглюкозою (FDG PET) демонструє гіпометаболізм у серединних темпоральних структурах, уражених склерозом, тоді як однофотонна емісійна комп’ютерна томографія здатна виявити гіперперфузію в передньоскроневій ділянці в таких випадках [56]. Протонна магнітно-резонансна спектроскопія демонструє зниження індексу NAA/Cho в зоні СМС [55].
ПЛР ліквору здебільшого неінформативна при діагностиці герпесвірусної інфекції при СМС, оскільки має місце не енцефаліт, а вірус-індукований нейродегенеративний процес [25]. ДНК, РНК і білки вірусу можна ідентифікувати в біоптатах мозку, отриманих із зон склерозу [22]. Неінвазивна діагностика може включати вивчення феномену інтратекального синтезу специфічних противірусних антитіл за допомогою ELISA, яка доволі інформативна при вірусній інфекції, що використовує трансольфакторний шлях міграції до нейронів гіпокампів (вірус простого герпесу 1-го і 2-го типів, вірус герпесу 6-го типу і, найбільш ймовірно, вірус герпесу 7-го типу) [8]. Як показують результати спеціально спланованого дослідження, результати ПЛР крові можуть корелювати з даними серологічного дослідження ліквору при СМС, асоційованому з герпесвірусною інфекцію, при реактивації лімфотропних герпесвірусів (EBV, CMV. HHV-6, HHV-7) [36]. Тому дані ПЛР крові можна використовувати при моніторингу ефективності лікування реактивованої гепесвірусної інфекції в пацієнтів із СМС.
Проведено кілька клінічних досліджень з оцінки імунного статусу в пацієнтів із СМС, асоційованим із герпесвірусною інфекцією. Встановлено, що первинні імунодефіцити при зазначеній нейродегенерації зустрічаються щонайменше в 27 %, а вторинна імунна супресія — в 73 % випадків [1, 2, 5]. Вторинний імунодефіцит при СМС, асоційованому з герпесвірусною інфекцією, має складний механізм розвитку й включає принаймні три компоненти: а) постіктальну імуносупресію, що може бути тяжкою в пацієнтів із частими епілептичними нападами; б) імуносупресивний вплив реактивованих герпесвірусів, який відіграє провідну роль при мікст-інфекціях із високим вірусним навантаженням; в) пригнічення імунітету антиконвульсантами, особливо значиме при комбінованому застосуванні кількох протисудомних хіміопрепаратів у великих дозах [5].
Диференціальна діагностика
J. Sureka, R.K. Jakkani провели аналіз причин феномену темпоральної білатеральної гіперінтенсивності на МРТ-знімках у 65 випадках, виявивши енцефаліт, викликаний вірусом простого герпесу 1-го типу, вроджену цитомегаловірусну інфекцію, сімейну скроневу медіанну епілепсію, хворобу Альцгеймера, фронтотемпоральну деменцію, міотонічну дистрофію 1-го типу, гліоматоз мозку, мітохондріальну енцефалопатію, хворобу Вільсона, епізоди лактат-ацидозу й гіперамоніємії, мегаленцефалітичну енцефалопатію із субкортикальними цистами, паранеопластичні лімбічні енцефаліти, а також автосомно-домінантну артеріопатію із субкортикальними інфарктами й лейкодистрофією [68], що слід враховувати в клінічній практиці при проведенні диференціальної діагностики. Слід зазначити, що СМС може бути наслідком автоімунного або паранеопластичного лімбічного енцефаліту, про що свідчать описи клінічних випадків [34]. Однак результати нещодавнього клінічного дослідження A.W. Nóbrega Jr зі співавт. за типом «випадок — контроль» за участю 100 пацієнтів вказують на нечасте виявлення антинейрональних автоантитіл в осіб із MTLE-HS (переважно проти GAD65) [44]. Результати нещодавнього дослідження М. Falip зі співавт. показують, що гіпометаболізм в зоні острівців при проведенні FDG PET є специфічною ознакою СМС, асоційованого з автоантитілами до GAD65, порівняно з аналогічним феноменом після корового енцефаліту або рецидивних фебрильних судом (рис. 6) [24].
У більшості випадків при ідентифікації феномену гіперінтенсивності від скроневих медіанних відділів при вивченні результатів МРТ-знімків головного мозку має місце саме СМС, асоційований із герпесвірусною інфекцією.
Висновки
СМС, асоційований з герпесвірусною інфекцією, — поширений у популяції інвалідизуючий нейродегенеративний феномен, що потребує своєчасної діагностики й комплексного, мультидисциплінарного підходу до ведення пацієнта із залученням невролога, психіатра, інфекціоніста й клінічного імунолога. На сьогодні як клініцисти, так і радіологи недостатньо поінформовані з приводу цієї проблеми, що зумовлює обмежену діагностику зазначеної патології в Україні. Даний огляд є ще одним щаблем на шляху до впровадження в клінічну практику неврологів і психіатрів дієвого алгоритму з раннього виявлення СМС, асоційованого з герпесвірусною інфекцією, і своєчасного призначення адекватного противірусного лікування для пригнічення репродуктивної активності герпесвірусу й адресної імунотерапії для компенсації імунної дисфункції й покращання імунного нагляду над вірусним агентом. Такий підхід може сповільнити або навіть зупинити вірус-індукований нейродегенеративний процес, оптимізувавши контроль над наявними когнітивними, нейропсихіатричними й вегетативними розладами й запобігши розвитку рефрактерної скроневої медіанної епілепсії і/або темпоральної деменції в багатьох пацієнтів із несприятливим прогнозом хвороби. З огляду на останні відкриття в царині вірусології й нейроімунології існує нагальна потреба в проведенні подальших клінічних досліджень з ефективності й безпечності противірусного лікування й імунотерапії при СМС, асоційованому з герпесвірусною інфекцією, у людей.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Казмирчук В.Е., Мальцев Д.В. Диагностика первичных и вторичных иммунодефицитов у пациентов с герпесвирусной нейроинфекцией, ассоциированой с височной медианной эпилепсией // Аллергология и иммунология (Российская Федерация). — 2012. — Т. 13, № 2. — С. 149-164.
2. Казмірчук В.Є., Мальцев Д.В. Діагностика первинних імунодефіцитів у хворих з верифікованою герпесвірусною нейроінфекцією, ускладненою судомним синдромом // Український неврологічний журнал. — 2010. — № 4. — С. 42-59.
3. Казмірчук В.Є., Мальцев Д.В. та ін. Імунологічні та аспекти етіології та патогенезу епілепсії: невикористані терапевтичні можливості // Український неврологічний журнал. — 2009. — № 4. — С.11-25.
4. Казмірчук В.Є., Мальцев Д.В., Зільберблат Г.М. та ін. МРТ у діагностиці герпесвірусної нейроінфекції, асоційованої з епілептичним синдромом // Український неврологічний журнал. — 2010. — № 3. — С. 5-22.
5. Мальцев Д.В. Діагностика вторинних імунодефіцитів у хворих на герпесвірусну нейроінфекцію, ускладнену епілептичним синдромом // Імунологія та алергологія. — 2010. — № 2. — С. 76-90.
6. Мальцев Д.В., Казмірчук В.Є. Герпесвірусна нейроінфекція і скронева медіанна епілепсія — К.: Фенікс, 2011. — 242 c.
7. Мальцев Д.В., Казмірчук В.Є. Ефективність противірусного лікування при герпесвірусній нейроінфекції зі скроневою епілепсією // Міжнародний неврологічний журнал. — 2011. — № 4(42). — С. 21-28.
8. Мальцев Д.В., Казмірчук В.Є. Модифікована методика порівняльних серологічних досліджень для діагностики перистуючої герпесвірусної нейроінфекції // Лабораторна діагностика. — 2011. — № 3(57). — С. 24-30.
9. Мальцев Д.В., Казмірчук В.Є., Ковальчук Л.І. Концепція вірус-індукованої трансформації синаптичної передачі збудження, як моделі розвитку скроневої епілепсії у людей // Науковий вісник НМУ ім. О.О. Богомольця. — 2009. — № 4(26). — С. 154-170.
10. Мальцев Д.В., Недопако Я.Я., Грицик В.Ф та ін. Скроневий медіанний склероз // Український неврологічний журнал. — 2015. — № 4. — С. 7-20
11. Aburakawa Y., Katayama T., Saito T. et al. Limbic Encephalitis Associated with Human Herpesvirus-7 (HHV-7) in an Immunocompetent Adult: The First Reported Case in Japan // Intern. Med. — Vol. 56(14). — P. 1919-1923.
12. Begum H., Nayek K., Khuntdar B.K. Kluver-Bucy syndrome — a rare complication of herpes simplex encephalitis // J. Indian. Med. Assoc. — 2006. — Vol. 104(11). — P. 637-638.
13. Benbadis S.R., Tatum W.O. 4th, Murtagh F.R., Vale F.L. MRI evidence of mesial temporal sclerosis in patients with psychogenic nonepileptic seizures // Neurology. — 2000. — Vol. 55(7). — P. 1061-1062.
14. Blümcke I., Zuschratter W., Schewe J.C. et al. Cellular pathology of hilar neurons in Ammon’s horn sclerosis // J. Comp Neurol. — 1999. — Vol. 414(4). — P. 437-453.
15. Buchwald D., Cheney P.R., Peterson D.L. et al. A chronic illness characterized by fatigue, neurologic and immunologic disorders, and active human herpesvirus type 6 infection // Ann. Intern Med. — 1992. — Vol. 116(2). — P. 103-113.
16. Carne R.P., O’Brien T.J., Kilpatrick C.J. et al. “MRI-negative PET-positive” temporal lobe epilepsy (TLE) and mesial TLE differ with quantitative MRI and PET: a case control study // BMC Neurol. — 2007. — Vol. 7. — P. 16.
17. Castro L.H., Silva L.C., Adda C.C. et al. Low prevalence but high specificity of material-specific memory impairment in epilepsy associated with hippocampal sclerosis // Epilepsia. — 2013. — Vol. 54(10). — P. 1735-1742.
18. Cohn M., St-Laurent M., Barnett A., McAndrews M.P. Social inference deficits in temporal lobe epilepsy and lobectomy: risk factors and neural substrates // Soc. Cogn. Affect Neurosci. — 2015. — Vol. 10(5). — P. 636-644.
19. Daugherty S.A., Henry B.E., Peterson D.L. et al. Chronic fatigue syndrome in northern Nevada // Rev. Infect. Dis. — 1991. — Vol. 13(1). — S39-44.
20. de Oliveira G.N., Kummer A., Salgado J.V. et al. Psychiatric disorders in temporal lobe epilepsy: an overview from a tertiary service in Brazil // Seizure. — 2010. — Vol. 19(8). — P. 479-484.
21. Di Luca D., Zorzenon M., Mirandola P. et al. Human herpesvirus 6 and human herpesvirus 7 in chronic fatigue syndrome // J. Clin. Microbiol. — 1995. — Vol. 33(6). — P. 1660-1661.
22. Donati D., Akhyani N., Fogdell-Hahn A. et al. Detection of human herpesvirus-6 in mesial temporal lobe epilepsy surgical brain resections // Neurology. — 2003. — Vol. 61(10). — P. 1405-1411.
23. Dove G.H., Buchhalter J.R., Cascino G.D. Acute repetitive pilomotor seizures (goose bumps) in a patient with right mesial temporal sclerosis // Clin. Neurophysiol. — 2004. — Vol. 115(11). — P. 2511-2513.
24. Falip M., Rodriguez-Bel L., Castañer S. et al. Hippocampus and Insula Are Targets in Epileptic Patients With Glutamic Acid Decarboxylase Antibodies // Front Neurol. — 2019. — Vol. 9. — P. 1143.
25. Fotheringham J., Akhyani N., Vortmeyer A. et al. Detection of active human herpesvirus-6 infection in the brain: correlation with polymerase chain reaction detection in cerebrospinal fluid // J. Infect. Dis. — 2007. — Vol. 195(3). — P. 450-454.
26. Fotheringham J., Williams E.L., Akhyani N., Jacobson S. Human herpesvirus 6 (HHV-6) induces dysregulation of glutamate uptake and transporter expression in astrocytes // J. Neuroimmune Pharmacol. — 2008. — Vol. 3(2). — P. 105-116.
27. Furlan A.E.R., da Silva S.C. Junior, Marques L.H.N., de Araujo Filho G.M. Are psychogenic nonepileptic seizures risk factors for a worse outcome in patients with refractory mesial temporal epilepsy submitted to surgery? Results of a retrospective cohort study // Epilepsy Behav. — 2019. — Vol. 93. — P. 12-15.
28. Gayubo Moreo L., Martínez Pastor C.J., García Recio A. Mesial temporal sclerosis and psychiatric symptoms: a case report // Int. J. Psychiatry Med. — 2004. — Vol. 34(3). — P. 271-275.
29. Giovagnoli A.R., Avanzini G. Learning and memory impairment in patients with temporal lobe epilepsy: relation to the pre-sence, type, and location of brain lesion // Epilepsia. — 1999. — Vol. 40(7). — P. 904-911.
30. Harberts E., Yao K., Wohler J.E. et al. Human herpesvirus-6 entry into the central nervous system through the olfactory pathway // Proc. Natl. Acad. Sci. USA. — 2011. — Vol. 108(33). — P. 13734-1379.
31. Hermann B.P., Seidenberg M., Schoenfeld J., Davies K. et al. Neuropsychological characteristics of the syndrome of mesial temporal lobe epilepsy // Arch. Neurol. — 1997. — Vol. 54(4). — P. 369-376.
32. Jacob A., Cherian P.J., Radhakrishnan K., Sarma P.S. Emotional facial paresis in temporal lobe epilepsy: its prevalence and lateralizing value // Seizure. — 2003. — Vol. 12(1). — P. 60-64.
33. Kato K., Jin K., Itabashi H. et al. Earlier tachycardia onset in right than left mesial temporal lobe seizures // Neurology. — 2014. — Vol. 83(15). — P. 1332-1336.
34. Kotsenas A.L., Watson R.E., Pittock S.J. et al. MRI findings in autoimmune voltage-gated potassium channel complex encephalitis with seizures: one potential etiology for mesial temporal sclerosis // AJNR Am. J. Neuroradiol. — 2014. — Vol. 35(1). — P. 84-89.
35. Li J.M., Lei D., Peng F. et al. Detection of human herpes virus 6B in patients with mesial temporal lobe epilepsy in West China and the possible association with elevated NF-κB expression // Epilepsy Res. — 2011. — Vol. 94(1–2). — P. 1-9.
36. Maltsev D.V. Kazmirchuk V.E. Diagnosis of Herpesvirus Neiroinfeсtions in Patients with Temporal Mesial Epilepsy // Allergy, Astma & Immunophysiology: From Basic Science to Clinical Aррlication. — MEDIMOND s.r.l., 2012. — P. 231-234.
37. Maltsev Dmitriy V., Kazmirchuk Vera E., Grytsyk Vladimir F., Nedopaco Yaroslav Ya. The Possibility of Using Serum Concetracions of the Tumor Necrosis Factor-Alpfa As a Biomarker in Mesial Temporal Lobe Epilepsy Associated With the Human herpes Virus Neiroinfections // International Journal of Вiomedicine. — 2012. — Vol. 2(1). — P. 16-25.
38. McCorry D.J., Crowley P. Transient global amnesia secondary to herpes simplex viral encephalitis // QJM. — 2005. — Vol. 98(2). — P. 154-155.
39. Messas C.S., Mansur L.L., Castro L.H. Semantic memory impairment in temporal lobe epilepsy associated with hippocampal sclerosis // Epilepsy Behav. — 2008. — Vol. 12(2). — P. 311-316.
40. Mettenburg J.M., Branstetter B.F., Wiley C.A. et al. Improved Detection of Subtle Mesial Temporal Sclerosis: Validation of a Commercially Available Software for Automated Segmentation of Hippocampal Volume // AJNR Am. J. Neuroradiol. — 2019. — Feb 7. [Epub ahead of print].
41. Mirsattari S.M., Gofton T.E., Chong D.J. Misdiagnosis of epileptic seizures as manifestations of psychiatric illnesses // Can. J. Neurol. Sci. — 2011. — Vol. 38(3). — P. 487-493.
41. Munger Clary H.M., Snively B.M., Hamberger M.J. Anxiety is common and independently associated with clinical features of epilepsy // Epilepsy Behav. — 2018. — Vol. 85. — P. 64-71.
43. Nazem-Zadeh M.R., Schwalb J.M., Elisevich K.V. et al. Lateralization of temporal lobe epilepsy using a novel uncertainty analysis of MR diffusion in hippocampus, cingulum, and fornix, and hippocampal volume and FLAIR intensity // J. Neurol. Sci. — 2014. — Vol. 342 (1–2). — P.152-161.
44. Nóbrega-Jr A.W., Gregory C.P., Schlindwein-Zanini R. et al. Mesial temporal lobe epilepsy with hippocampal sclerosis is infrequently associated with neuronal autoantibodies // Epilepsia. — 2018. — Vol. 59(9). — e152-e156.
45. Nunes J.C., Zakon D.B., Claudino L.S. et al. Hippocampal sclerosis and ipsilateral headache among mesial temporal lobe epilepsy patients // Seizure. — 2011 — Vol. 20(6). — P. 480-484.
46. Oddo S., Solís P., Consalvo D. et al. Mesial temporal lobe epilepsy and hippocampal sclerosis: cognitive function assessment in Hispanic patients // Epilepsy Behav. — 2003. — Vol. 4(6). — P. 717-722.
47. Pacagnella D., Lopes T.M., Morita M.E. et al. Memory impairment is not necessaryly related to seizure frequency in mesial temporal lobe epilepsy with hippocampal sclerosis // Epilepsia. — 2014. — Vol. 55(8). — P. 1197-1204.
48. Puppala P., Thakore H., Edelman M.J. Case report of mesial temporal sclerosis with seizures and psychosis: an interface between psychiatry and neurology // Prim. Care Companion J. Clin. Psychiatry. — 2009. — Vol. 11(1). — P. 37-38.
49. Quiske A., Helmstaedter C., Lux S., Elger C.E. Depression in patients with temporal lobe epilepsy is related to mesial temporal sclerosis // Epilepsy Res. — 2000. — Vol. 39(2). — P. 121-125.
50. Rzezak P., Guimarães C., Fuentes D. et al. Episodic and semantic memory in children with mesial temporal sclerosis // Epilepsy Behav. — 2011. — Vol. 21(3). — P. 242-247.
51. San-Juan D., Mayorga A.P., Calcáneo Jde D. et al. Periodic epileptiform discharges in mesial temporal lobe epilepsy with hippocampal sclerosis // Seizure. — 2013. — Vol. 22(9). — P. 735-742.
52. Sazgar M., Carlen P.L., Wennberg R. et al. Panic attack semiology in right temporal lobe epilepsy // Epileptic. Disord. — 2003. — Vol. 5(2). — P. 93-100.
53. Schlitt M., Bucher A.P., Quindlen E.A. et al. Nonfulminant herpes simplex encephalitis as a cause for mesial temporal sclerosis // Med. Hypotheses. — 1990. — Vol. 33(3). — P. 177-179.
54. Serrano-Castro P., Sánchez-Alvarez J.C., García-Gómez T. Mesial temporal sclerosis (I): histological data, physiopathological hypothesis and etiological factors // Rev. Neurol. — 1997. — Vol. 25(140). — P. 584-589.
55. Shih J.J., Weisend M.P., Sanders J.A., Lee R.R. Magnetoencephalographic and magnetic resonance spectroscopy evidence of regional functional abnormality inmesial temporal lobe epilepsy // Brain Topogr. — 2011. — Vol. 23(4). — P. 368-374.
56. Singh R.K., Glynn S.M., Garton H.J. et al. Hallucinations and reversed cerebral dominance in mesial temporal sclerosis // Pediatr. Neurol. — 2011. — Vol. 45(2). — P. 121-124.
57. Suemitsu L.A., Yasuda C.L., Morita M.E. et al. Longitudinal analysis of hippocampal T2 relaxometry in FMTLE // Epilepsy Behav. — 2014. — Vol. 36. — P. 154-158.
58. Sureka J., Jakkani R.K. Clinico-radiological spectrum of bilateral temporal lobe hyperintensity: a retrospective review // Br. J. Radiol. — 2012. — Vol. 85(1017). — e782-792.
59. Taylor D.C. Factors influencing the occurrence of schizophrenia-like psychosis in patients with temporal lobe epilepsy // Psychol. Med. — 1975. — Vol. 5(3). — P. 249-254.
60. Theodore W.H. Prolonged Febrile Convulsions Produce More Severe Mesial Temporal Sclerosis // Epilepsy Curr. — 2002. — Vol. 2(3). — P. 78.
61. Tong F., Jewells V., Trembath D.G. et al. Triple pathological findings in a surgically amenable patient with mesial temporal lobe epilepsy // Epilepsy Behav. Case Rep. — 2015. — Vol. 4. — P. 52-55.
62. Trevisol-Bittencourt P.C., Troiano A.R. Interictal personality syndrome in non-dominant temporal lobe epilepsy: case report // Arq. Neuropsiquiatr. — 2000. — Vol. 58(2B). — P. 548-555.
63. van Elst L.T., Woermann F.G., Lemieux L. et al. Affective aggression in patients with temporal lobe epilepsy: a quantitative MRI study of the amygdale // Brain. — 2000. — Vol. 123(Pt 2). — P. 234-243.
64. Wichova H., Shew M., Alvi S., Lin J. A Case of Mesial Temporal Lobe Sclerosis Following Temporal Bone Encephalocele Repair for Medically Refractory Seizures // Cureus. — 2018. — Vol. 10(11). — e3623.
65. Wu H.M., Huang C.C., Chen S.H. et al. Herpes simplex virus type 1 inoculation enhances hippocampal excitability and seizure susceptibility in mice // Eur. J. Neurosci. — 2003. — Vol. 18(12). — P. 3294-3304.
/12.jpg)

/9.jpg)
/10.jpg)
/13.jpg)
/14.jpg)