Введение
Роль нарушений холинергической (ХЭ) регуляции в формировании неврологической патологии обусловлена распространенностью холинергических синапсов в структурах нервной системы с образованием массивных нейрональных сетей и целого комплекса разноуровневых проводящих путей. Нарушение комплексности работы этих систем и возникновение дисбаланса между заинтересованными структурами на любом уровне приводит к возникновению неврологической симптоматики различной степени выраженности, с тенденцией к прогрессированию и глобализации возникающих нарушений. Высокая представленность ХЭ-нейронов в структурах головного мозга, играющих ключевую роль в формировании когнитивных функций, включая неокортекс, обусловливает критическую важность холинергической передачи для временной и декларативной памяти, обучения и внимания. С учетом биохимии головного мозга, в которой ацетилхолин имеет широкую представленность, есть также основания полагать, что этот медиатор обеспечивает сложные двигательные функции — инициацию движения, двигательные стереотипы. Кроме того, ХЭ-система обеспечивает спонтанную активность, эмоциональное поведение, память и волевые акты. В недавних исследованиях обнаружено, что холинергические нейроны, локализованные в базальных отделах переднего мозга, моносинаптически проецируются на кору, обеспечивая баланс между реакциями торможения и активации, что является невероятно важным для понимания основ формирования сознания и патогенетических механизмов его нарушений.
Анатомо-физиологические особенности холинергической системы
По своей сути ХЭ-система представляет собой совокупность нейронов, секретирующих ацетилхолин в качестве трансмиттера, расположенных в базальных отделах переднего мозга и диффузно проецирующих свои аксоны по всей коре головного мозга с наибольшим представительством в лимбической и окололимбической областях. Холинергические волокна направляются во все слои коры головного мозга. Самая высокая плотность холинергических волокон — в первом и втором слоях коры, а также в верхней части третьего слоя. Существует восемь групп холинергических клеток, от которых начинаются проводящие пути в различные структуры центральной нервной системы, включая базальное ядро Мейнерта, медиальное ядро перегородки, вертикальное ядро диагонального пучка, гиппокамп, поясную извилину, обонятельную луковицу, гипоталамус, миндалевидные ядра. Вся холинергическая иннервация коры головного мозга и таламуса человека исходит из этих холинергических образований. Понимание значения и функции ХЭ-системы в основном стало доступно благодаря экспериментальным исследованиям. Установлено, что электрическая стимуляция базального ядра Мейнерта приводит к высвобождению ацетилхолина (АХ) в коре мозга крысы [51]. Таким образом, базальное крупноклеточное ядро Мейнерта, расположенное в области внутренней капсулы, ниже медиального сегмента бледного шара, является основным источником холинергической иннервации коры головного мозга [50]. Его холинергические проекции модулируют активность медиальных отделов височной доли и орбито-фронтальной коры [62]. Основные холинергические афферентные пути берут начало в лимбической системе, направляясь к базальным ядрам, что в сочетании с их обширной представленностью в коре лимбической и паралимбической зон предопределяет функцию этой структуры — установление соответствия эмоционального ответа характеру раздражителя, модуляцию воздействия эмоционально релевантной информации на корковые функции; ведь, как известно, лимбическая система играет главную роль в деятельности мозга, связанной с эмоциями [25].
Другая группа холинергических нейронов сконцентрирована в области покрышки среднего мозга и представлена педункулопонтинным ядром и смежными ядрами ствола мозга. Образуя многочисленные связи с гипоталамусом, гиппокампальной извилиной, миндалиной и префронтальной корой, данная холинергическая субсистема участвует в формировании циркадных ритмов и инициирует фазу быстрого сна (рис. 1).
/69.jpg)
Ее активность максимальна в период бодрствования и уменьшается во время медленноволнового сна [63]. Уровень возбуждения холинергических нейронов переднего мозга, связанных с бодрствованием, меняется параллельно с поведенческой активностью животного. Частота их спайковых разрядов увеличивается во время бодрствования, и особенно во время движения, а также в парадоксальном сне [5]. В медленном сне их активность уменьшается. Концепция холинергических нейронов как источника кортикальной активации, поддерживающего бодрствование, должна быть дополнена представлением о существовании специального холинергического механизма, обеспечивающего дополнительное высвобождение АХ в локальных участках коры, которые реагируют на стимулы, связанные с подкреплением. Показано, что значительная часть нейронов базальных отделов переднего мозга реагирует активацией на условные раздражители, связанные с наградой, и не реагирует на условные сигналы наказания [59]. Это механизм избирательного внимания к значимым стимулам, который обеспечивает их обработку в соответствующих областях коры [60]. Опыты с фармакологическим отключением базального переднего мозга у животных показали нарушение поведения. Животные не могут использовать приобретенные ими навыки, включая прохождение различных лабиринтов, заученное пассивное и активное избегание [28]. Создавая локальную активацию в коре, холинергические нейроны взаимодействуют с таламокортикальной неспецифической системой. Предполагают, что, параллельно влияя на кору и таламус, они могут модулировать, в том числе усиливать реакции активации, определяемые механизмом таламокортикальной неспецифической системы. Холинергические активирующие влияния из базальных отделов переднего мозга распространяются также на лимбическую систему, в частности на гиппокамп, вызывая гиппокампальный тета-ритм — признак активации гиппокампа.
В базальных отделах переднего мозга функция регуляции активации сосуществует с функцией управления сном. Активирующая холинергическая система этих структур находится под тормозным контролем гипногенного механизма. Кроме того, медиальная преоптическая область и передний гипоталамус, которые часто рассматриваются как часть вентральной гипногенной системы переднего мозга, контролируя сон, действуют на холинергическую систему через тормозные синапсы.
Для комплексного понимания функционального значения холинореактивных систем необходимо помнить об их эволюционной приспособленности работать в противодействии адренергическим системам и способности защитить нейроны от избыточных и разрушительных действий катехоламинов, то есть трофогенных, преимущественно саногенетических свойствах. Кроме того, холинергические факторы дифференцировки нейронов осуществляют роль нейропоэтинов для нервных клеток головного мозга и способны выполнять модулирующую роль, постсинаптические рецепторы нейронов холинергических систем оказывают метаболическое воздействие [34].
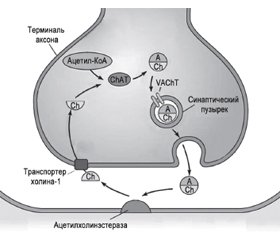
Ацетилхолин является основным нейротрансмиттером, регулирующим активность базальной холинергической системы; он синтезируется в цитоплазме аксонов из активной формы ацетата (ацетил-коэнзим А) и холина при помощи фермента холинацетилтрансферазы (рис. 2).
/70.jpg)
Холинергические нейроны вырабатывают холин-ацетилтрансферазу, которая транспортируется в проекционные зоны, где служит катализатором синтеза ацетилхолина. Ацетилхолин хранится в синаптических везикулах. Их диаметр 80 нм в холинергических синапсах, и содержат они около 40 тысяч молекул нейромедиатора. Его высвобождение при возбуждении происходит путем полного опорожнения каждой везикулы. Перенос ацетилхолина, содержащегося в цитозоле нейрона, в синаптический пузырек осуществляется под действием везикулярного транспортера ацетилхолина. Слияние мембраны везикул с пресинаптической мембраной обеспечивается увеличением концентрации ионов Са2+ внутри клетки, в результате чего происходит выброс нейромедиатора в синаптическую щель. Необходимо 4 иона Са2+ для выхода содержимого из одной везикулы. В синаптической щели ацетилхолин взаимодействует с рецептором, входящим в состав постсинаптической мембраны. Проницаемость постсинаптической мембраны изменяется: пропускная способность для ионов Nа+ резко увеличивается. Так запускается ряд реакций, обеспечивающих выполнение специфических функций. Избыток молекул нейромедиатора расщепляется ферментом ацетилхолинэстеразой (АХЭС), являющейся одним из самых быстрых известных науке ферментов. В результате гидролиза ацетилхолина образуются холин и уксусная кислота, абсорбирующиеся пресинаптической мембраной назад в пресинаптическую терминаль, где они повторно используются для синтеза ацетилхолина [34].
В синаптической щели АХ может взаимодействовать с двумя основными типами рецепторов — мускариновыми (М-холинорецепторы) и никотиновыми (Н-холинорецепторы) [61]. Методом клонирования кДНК обнаружено пять подтипов М-холинорецепторов (М1-М5), четыре из них были идентифицированы функционально и фармакологически (Amenta F., Tayebati). М1-рецепторы локализуются в области коры головного мозга и гиппокампальной извилины. Они являются основными постсинаптическими холинорецепторами, регулирующими когнитивные функции. М2-рецепторы обнаруживаются преимущественно в стволе мозга и мозжечке. При их активации ингибируется дальнейшее выделение ацетилхолина [57]. В настоящее время идентифицированы 9 α- (1–9) и 4 (1–4) β-субъединицы. α1 и β1 локализуются в нервно-мышечных синапсах, α2–9 и β2–4 — в различных структурах центральной нервной системы [58]. Среди большого разнообразия подтипов Н-холинорецепторов в головном мозге наиболее важны два: 4α2β и α7. 4α2β-рецепторы регулируют выброс дофамина в прилежащем ядре и играют важную роль в регуляции психического статуса [53]. Основная функция α7-рецепторов связана с регуляцией различных когнитивных функций [3].
Наличие двух различных типов АХ-рецепторов обусловливает разнонаправленное сбалансированное влияние АХ-системы на функционирование головного мозга. Так, мускариновые рецепторы обеспечивают активирующее действие, растормаживание пирамидного слоя коры и усиливают передачу информации между слоями коры. Никотиновые рецепторы, наоборот, оказывают тормозное влияние на нейроны коры.
Роль холинергической системы в патологии центральной нервной системы
Основная психофизиологическая роль АХ связана с обеспечением запоминания новой информации. Дефицит ацетилхолина нарушает процесс перевода кратковременной памяти в долговременную за счет ингибирующего действия интеркуррентных стимулов. В нормальных условиях поступающий новый значимый стимул проходит цикл обработки, во время которого нейроны гиппокампальной извилины остаются рефрактерными к другим стимулам. После обработки возникает тета-ритм, синхронизированный с активностью нейронов неокортекса. При нарушении холинергической иннервации нейрональные популяции гипоталамуса становятся чрезвычайно реактивными и неустойчивыми к любым незначительным стимулам, что вызывает нарушение консолидации полученной информации [24]. Таким образом, базальная холинергическая система обеспечивает запоминание поступающей информации путем стабилизации функциональной активности структур гиппокампа. Ацетилхолин играет ключевую роль в обеспечении устойчивости внимания за счет активирующего влияния на кору головного мозга [39]. Дисфункция базальной холинергической системы приводит к повышенной отвлекаемости, сниженной концентрации внимания и, как следствие, к быстрой утрате приобретенной информации [23].
Дисфункция базальной холинергической системы приводит к формированию когнитивных нарушений, которые наиболее полно изучены при болезни Альцгеймера (БА) [35], при которой возникает атрофия базальных ядер переднего мозга, что приводит к недостаточности всей холинергической системы.
Исследования нейрохимической организации памяти, проведенные в 1970-е годы, показали, что медиатором, участвующим в запоминании как вербальных, так и зрительных образов, является ацетилхолин [22]. Дальнейшие исследования позволили выявить в головном мозге ацетилхолинергические пути, обеспечивающие необходимый уровень сознания и активного внимания (ретикулярная формация, медиобазальное ядро Мейнерта, структуры гиппокампова круга), способствующие адекватному запоминанию информации, а также оказывающие влияние на работу первичных и вторичных сенсорных корковых зон (височные, теменные и затылочные отделы коры больших полушарий головного мозга).
Еще в 1982 году Bartus с соавторами [18] установили, что при нейродегенеративных заболеваниях, проявляющихся деменцией, в центральной нервной системе пациентов снижается количество медиатора ацетилхолина. В результате этого возникает нарушение именно механизма избирательной активации, опосредующее дефицит когнитивных функций [22, 33].
Позже было показано, что нейродегенеративный процесс при БА тесто связан именно с ацетилхолинергическими структурами: наиболее ранние и, как правило, самые грубые изменения при этом заболевании отмечаются в структурах гиппокампова круга и медиобазальной лобной коре [30]. Согласно холинергической гипотезе болезни Альцгеймера, основной причиной дисфункции и гибели холинергических нейронов переднего мозга является широкое распространение пресинаптической холинергической денервации в результате нейрофибриллярной дегенерации. Откладывающийся β-амилоид взаимодействует с α7-АХ-рецепторами, приводя к уменьшению их численности, особенно в лобных и височных областях коры головного мозга [58].
Дальнейшее изучение патогенеза БА показало ряд интересных особенностей. Так, ацетилхолин сам по себе является веществом, активно осаждающим амилоидный белок, что объясняет отложение последнего именно в структурах, богатых ацетилхолином. Ферменты, влияющие на метаболизм ацетилхолина, воздействуют на амилоидогенез различными способами. Проведенные исследования показали, что наибольшим отрицательным влиянием на амилоидогенез обладает левовращающий изомер бутирилхолинэстеразы [56].
Таким образом, нейродегенеративный процесс при БА тесно связан именно с ацетилхолинергическими структурами: наиболее ранние и, как правило, грубые изменения при этом заболевании отмечаются в структурах гиппокампова круга и медиобазальной лобной коре [37]. Холинергический дефицит при болезни Альцгеймера взаимодействует с другими аспектами патофизиологии заболевания [38].
По мере прогрессирования болезни Альцгеймера патологический процесс, начавшийся с медиальных отделов височной доли, постепенно распространяется на новые области головного мозга, обусловливая характерную динамику клинических проявлений заболевания [46]. Считается, что морфологическим маркером заболевания является численность нейрофибриллярных клубочков (НФК) в том или ином отделе мозга. Выявлена корреляция между количеством НФК в базальном ядре Мейнерта и успешностью выполнения тестов, оценивающих память. Кроме того, определена зависимость между степенью когнитивных нарушений и численностью синапсов в височно-теменных и лобных отделах коры больших полушарий [35].
Дисфункция базальной холинергической системы рассматривается как важный патогенетический механизм развития когнитивных нарушений при сосудистой деменции [19]. Поражение белого вещества головного мозга по типу субкортикального или перивентрикулярного лейкоареоза приводит к повреждению холинергических проекций от базального ядра Мейнерта к коре головного мозга. Нарушение холинергической иннервации префронтальных отделов коры обусловливает раннее развитие регуляторных когнитивных и поведенческих расстройств, включая депрессию и апатико-абулический синдром. Холинергическая иннервация медиальных отделов височных долей при сосудистых когнитивных нарушениях, по-видимому, страдает в меньшей степени, чем при болезни Альцгеймера. По данным L. Pantoni et al. (2007) [48], определена прямая зависимость между выраженностью лейкоареоза и тяжестью когнитивных нарушений.
В основе поведенческих и когнитивных нарушений при деменции с тельцами Леви лежит прогрессирующий холинергический дефицит, вызванный дегенерацией холинергических нейронов в базальном ядре Мейнерта. Установлено, что дисфункция базальной холинергической системы при деменции с тельцами Леви выражена в большей степени, чем при болезни Альцгеймера. Это подтверждается более низким уровнем посмертно определяемой активности холинацетилтрансферазы в лобной коре, а также более выраженным уменьшением количества крупных холинергических нейронов в ядре Мейнерта [39].
Кроме того, центральная холинергическая недостаточность наблюдается при болезни Паркинсона и выражена в наибольшей степени при сочетании болезни Паркинсона с деменцией. В настоящее время получены данные о влиянии дисфункции базальной холинергической системы на состояние когнитивных функций у больных миастенией [45]. В исследовании D. Joshi с соавторами [40] представлены данные о высокой распространенности когнитивных расстройств среди пациентов с миастенией. Проведенное нейропсихологическое обследование (mini mental state examination, comprehensive neuropsychological battery in hindi) 40 больных выявило наличие нарушений памяти различной степени выраженности у 75 % и интеллектуальных нарушений у 68 % испытуемых в сравнении с показателями контрольной группы. Известно, что в гипоталамусе, гиппокампальной извилине, среднем мозге, коре головного мозга имеются ацетилхолиновые рецепторы, структурно и генетически сходные с рецепторами на постсинаптической мембране нервно-мышечного синапса. Перекрестное взаимодействие антител между данными рецепторами может вызывать формирование когнитивных нарушений при миастении [41]. Таким образом, вне зависимости от преобладания первичного нейродегенеративного процесса или сосудистого поражения головного мозга общим патогенетическим механизмом в развитии когнитивных нарушений и деменции является дефицит ацетилхолина в структурах, отвечающих за когнитивные функции.
Рассеянный склероз (РС) представляет собой воспалительное и нейродегенеративное заболевание центральной нервной системы (ЦНС), характеризующееся инфильтрацией лейкоцитов, демиелинизацией, дегенерацией аксонов и гибелью нейронов. Серьезные изменения, влияющие на нервную систему, способствуют двигательной и когнитивной инвалидности и в значительной степени зависят от тяжелых воспалительных процессов, действующих как в центральной нервной системе, так и в иммунной системе. Ацетилхолин, по-видимому, участвует в модуляции центрального и периферического воспаления. Иммунные клетки, а также астроциты и микроглия реагируют на стимулы АХ активацией холинергических рецепторов. Мускариновые и никотиновые рецепторы по-разному способствуют модуляции иммунологических и воспалительных процессов, стимулируя соответственно про- и противовоспалительные цитокины. Роль, которую играет АХ в патогенезе рассеянного склероза, до конца не изучена, однако многие данные указывают на его участие в патогенезе, по механизму сходное с таковым при болезни Альцгеймера и шизофрении. Выявлены корреляции между воспалением, вызывающим дисфункцию нервной системы при рассеянном склерозе, и изменениями холинергической системы. Эксперименты, выполненные на моделях животных с РС и анализы биологических жидкостей от пациентов с РС, таких как кровь, сыворотка и спинномозговая жидкость, позволяют предположить, что холинергические изменения могут способствовать нарушению воспалительных процессов при РС. Многие современные терапевтические подходы при РС основаны на противовоспалительных препаратах. Мы также обсуждаем, как использование ингибиторов холинэстеразы или миметиков AХ может представлять новый интересный терапевтический подход при РС [29].
Также установлено, что критические состояния, даже не ассоциированные с внутричерепной патологией, часто являются причиной развития нарушений функционирования ЦНС [47]. У пациентов, перенесших критическое состояние, часто отмечается снижение активности мыслительных функций различной выраженности и продолжительности. Степень выраженности этих нарушений может варьировать от легкого когнитивного снижения до делирия или комы [2]. В многоцентровом проспективном когортном исследовании BRAIN-ICU было выявлено, что каждый четвертый пациент спустя 12 месяцев после перенесенного критического состояния имел снижение когнитивных функций, по степени тяжести сопоставимое с легкой формой болезни Альцгеймера. Когнитивный дефицит во многом был связан с холинергической дисфункцией [17].
Когнитивные нарушения, обусловленные критическими состояниями, представляют собой, с одной стороны, значительную проблему для анестезиологии и интенсивной терапии, поскольку могут усугублять течение острого периода, а с другой стороны, изменения состояния когнитивных функций могут помочь в раннем выявлении отрицательной динамики в течении критического состояния. Поскольку когнитивные нарушения при критических состояниях развиваются вследствие нарушения нормального функционирования ЦНС, вполне оправданно будет считать их проявлением острой церебральной недостаточности [32].
Одной из форм острой дисфункции головного мозга, которая может быть обусловлена критическим состоянием и ассоциируется с повышенным уровнем смертности, является делирий [64].
Установлено, что одним из ведущих патогенетических механизмов, лежащих в основе формирования делирия, является холинергическая недостаточность. Острая церебральная недостаточность приводит к резкому снижению уровня ацетилхолина, а также к дисбалансу между холинергическим и другими нейротрансмиттерными путями. Кроме того, существуют генетические, ферментативные и иммунологические оверлэп-механизмы, сходные для делирия и деменции и опосредованные холинергической недостаточностью. Дальнейшие исследования позволят оценить генетический вклад и определить биомаркеры особенностей реакции на холинергические препараты при делирии. Понимание взаимосвязи нарушений холинергический системы с формированием делирия может дать инновационные подходы в диагностике, профилактике и лечении этого сложного патологического состояния.
Процесс старения является необратимым континуумом, переживаемым всеми людьми. С возрастом в сердечно-сосудистой системе происходит ряд физиологических преобразований [10]. Эти изменения приводят к увеличению риска развития сердечно-сосудистых заболеваний, многие из которых часто встречаются в гериатрической популяции. Хотя механизмы кардиальной дисфункции, связанной с возрастом, точно не установлены, имеется множество данных о роли холинергической дисфункции в этих процессах [15, 16].
М. Dakroub с соавторами [26] установили, что фармакологическая активация холинергической передачи способствует предотвращению возрастной кардиальной дисфункции. Кроме того, холинергическая передача сигналов во время острого церебрального повреждения также важна для сохранения сердечной функции после травмы.
Возможности фармакологической коррекции холинергических нарушений
Воздействие на холинергическую систему всегда представлялось важной терапевтической задачей. Расширение спектра неврологической патологии, в основе которой лежит холинергическая дисфункция, дополнительно подчеркивает актуальность поиска возможных путей ее коррекции.
Средствами, обладающими доказанной эффективностью в отношении холинергических нарушений, обусловливающих когнитивные расстройства, считаются ингибиторы ацетилхолинэстеразы [20]. Экспериментальные исследования показали, что со снижением активности ацетилхолинэстеразы коррелирует уменьшение выраженности когнитивных расстройств [22]. Для восполнения дефицита церебрального ацетилхолина в комбинации с АХЭС могут быть использованы препараты холина альфосцерата [11]. Эти препараты в течение длительного времени изучались в международных рандомизированных плацебо-контролируемых исследованиях, в которых отмечена их эффективность в отношении восстановления когнитивных функций при нейродегенеративных и сосудистых заболеваниях, а также относительная безопасность применения [51].
Холина альфосцерат (Цереглиа) — соединение, содержащее в своем составе 40 % защищенного холина, обладающего электрической нейтральностью. Препарат свободно проходит через гематоэнцефалический барьер (ГЭБ) и служит прямым донором нейротрансмиттера ацетилхолина в пресинаптических мембранах холинергических нейронов. При попадании в организм под действием ферментов происходит его расщепление на холин и глицерофосфат. Получившийся холин благодаря электрической нейтральности проникает через гематоэнцефалический барьер и попадает в головной мозг, где служит основой для образования ацетилхолина. Кроме того, глицерофосфат (Цереглиа), являясь предшественником фосфолипидов мембраны нейронов, стимулирует образование фосфатидилхолина, который восстанавливает фосфолипидный состав мембран нейронов и улучшает их пластичность, положительно влияет на функциональное состояние микроструктур клеток, улучшая цитоскелет нейронов, увеличивая массу митохондрий и рибосом. Кроме того, он нормализует передачу нервных импульсов, потенцирует анаболические процессы в нейронах, ответственных за мембранный фосфолипидный и глицеролипидный синтез, улучшая состояние когнитивных и поведенческих функций [52]. Его важным преимуществом, по сравнению с другими пресинаптическими холинотропными средствами, является прямое сохранение, возможно, увеличение и депонирование эндогенного пула ацетилхолина, миелинов и фосфолипидов, что объясняет слабое влияние препарата на чувствительность синапса (не снижает ее). Значительная терапевтическая широта препарата Цереглиа дает возможность назначать его при необходимости длительно и в больших дозах, при острой церебральной патологии (инсультах, травмах головы), различных экстрапирамидных нарушениях, энцефалопатиях с выраженными интеллектуально-мнестическими, психоорганическими, эмоционально-поведенческими и двигательными нарушениями, при постнаркозной энцефалопатии, прогрессирующей деменции, нейродегенеративных заболеваниях, малой мозговой дисфункции у детей, глубоких нарушениях сознания и необходимости скорейшего его восстановления.
В экспериментальных исследованиях выявлено улучшение межполушарного проведения нервных импульсов, коррекция нарушения обучения и координации под воздействием холина альфосцерата (Цереглиа). Кроме того, препарат улучшает все виды памяти [55]. В открытых исследованиях выявлены возможности фармакотерапии пациентов с задержкой общего и речевого развития, дислексией, дисграфией, диспраксией и трудностями обучения. В действии холина альфосцерата присутствует сосудистый компонент. Остается открытым вопрос, в какой мере вазотропные свойства являются первичными (непосредственное влияние на метаболические процессы в стенке мозговых сосудов), а в какой — вторичными в результате нормализующего воздействия на нейроны сосудодвигательных центров головного мозга. В острый период черепно-мозговой травмы у больных с сохраненными механизмами регуляции мозгового кровотока холина альфосцерат вызывает увеличение линейной скорости кровотока на стороне поражения, способствует нормализации биоэлектрической активности мозга, регрессу неврологической симптоматики и восстановлению сознания. Активируя ретикулярную формацию, он существенно повышает функциональную активность головного мозга [21].
В мультицентровом двойном слепом рандомизированном плацебо-контролируемом исследовании, выполненном De Jesus Moreno Moreno, оценивалась эффективность холина альфосцерата (400 мг 3 раза в сутки на протяжении 180 суток) и плацебо. Состояние когнитивных функций оценивалось при помощи комплекса нейропсихологических шкал, включающего шкалу оценки состояния пациента с болезнью Альцгеймера (Alzheimer’s Disease Assessment Scale; ADAS), позволяющую оценить состояние когнитивных функций (ADAS-Cog), поведения (ADAS-Behav), краткую шкалу оценки когнитивных функций (Mini-Mental State Examination; MMSE), клиническую шкалу общего впечатления (Clinical Global Impression; CGI). Всего в исследование был включен 261 больной с легкой или умеренной степенью деменции альцгеймеровского типа (132 получали холина альфосцерат, 129 — плацебо) в возрасте 60–80 лет (в среднем 72,2 ± 7,5 года в группе ХА и 71,7 ± 7,4 года — в группе плацебо). Оценка состояния пациентов проводилась в начале исследования, а также через 90 и 180 дней от начала исследования. В результате проведенного исследования было показано, что через 90 и 180 дней лечения в группе больных, принимавших ХА, отмечалось улучшение когнитивных функций по различным показателям нейропсихологического статуса, в группе плацебо — отсутствие изменений или ухудшение состояния. Констатирована хорошая переносимость препарата и малая частота нежелательных побочных эффектов проводимого лечения [27].
L. Parnetti и соавт. [49] в обзоре 13 клинических исследований приводят данные об эффективности холина альфосцерата у 1570 больных с деменцией альцгеймеровского и сосудистого типа (при этом у 854 пациентов использовали плацебо-контроль). Установлена эффективность и безопасность применения холина альфосцерата (Цереглиа) у больных с деменцией. В одном из недавних экспериментальных исследований на крысах линии Wistar изучалась эффективность комбинированной терапии холином альфосцератом и ривастигмином. В результате исследования было установлено, что использование комбинированной терапии сопровождалось достоверным дозозависимым увеличением концентрации ацетилхолина и маркера связывания ацетилхолина ([(3)H] hemicholinium-3) в нейронах гиппокампа крыс [11, 12].
Имеются данные об эффективности холина альфосцерата при БА, сочетающейся с цереброваскулярным заболеванием. В двойном слепом многоцентровом исследовании ASCOMALVA (Effect of association between a ChE-I and choline alphoscerate on cognitive deficits in Alzheimer’s disease associated with cerebrovascular injury — «Влияние комбинации ингибиторов ацетилхолинэстеразы и холина альфосцерата на когнитивные расстройства при БА, сочетающейся с цереброваскулярным заболеванием») проведен анализ результатов лечения 300 пациентов в течение 12 месяцев. Пациенты были рандомизированы в группу лечения комбинацией донепезила и холина альфосцерата или одного донепезила с оценкой состояния через 3, 6, 9 и 12 мес. лечения. Были оценены когнитивные функции, повседневная деятельность пациента и наличие поведенческих симптомов при помощи нейропсихологических шкал и опросников. Установлено, что использование комбинации донепезила и холина альфосцерата имеет преимущества перед приемом только донепезила [13].
Кроме того, препараты холина альфосцерата (Цереглиа) обладают рядом неоспоримых преимуществ: метаболиты ацетилхолина входят в состав клеточных мембран и обеспечивают их матричные функции; холинергические средства не изменяют системной гемодинамики, усиливают перистальтику и способны повышать кислородную емкость крови.
Терапевтический эффект лекарственных препаратов, повышающих концентрацию церебрального ацетилхолина, дозозависим [31, 43]. Лечение следует начинать с высоких доз лекарственных препаратов; раннее назначение высоких доз является фактором, максимально влияющим на прогрессирование болезни. Соответственно, назначение небольших доз лекарственных препаратов или доз, не являющихся максимальными, существенно снизит эффективность лечения и позволит врачу ошибочно считать данный вариант терапии БА неэффективным.
Показана хорошая переносимость холина альфосцерата (Цереглиа) [44]. Неблагоприятные побочные реакции отмечены только у 2 % больных в виде тошноты (главным образом как следствие допаминергической активации), бессонницы и головных болей. Элиминация происходит главным образом через легкие в виде двуокиси углерода. Лишь 15 % препарата выводится почками и через кишечник. Не влияет на репродуктивный цикл, не обладает тератогенным и мутагенным действием. Противопоказаниями являются индивидуальная гиперчувствительность к препарату, период беременности и кормления грудью. В случае возникновения тошноты или других побочных явлений рекомендовано временное снижение дозы препарата. Клинически значимого лекарственного взаимодействия холина альфосцерата с другими лекарствами не выявлено. В официальной аннотации нет противопоказаний к применению холина альфосцерата (Цереглиа) при эпилепсии; анализ литературы также не выявил публикаций о действии препарата на усиление эпилептической активности. Таким образом, важной клинической характеристикой холина альфосцерата (Цереглиа) является безопасность. Препарат Цереглиа показан при острой церебральной патологии (инсультах, травмах головы), различных экстрапирамидных нарушениях, энцефалопатиях с выраженными интеллектуально-мнестическими, психоорганическими, эмоционально-поведенческими и двигательными нарушениями, при постнаркозной энцефалопатии, прогрессирующих когнитивных нарушениях, нейродегенеративных заболеваниях в дозе 400 мг 3 раза в день, длительностью до 3–6 месяцев.
Конфликт интересов. Не заявлен.
Список литературы
1. Бачинская Н.Ю., Копчак О.О. Холинергическая стратегия в терапии когнитивных нарушений у пациентов пожилого и старческого возраста // Международный неврологический журнал. — 2014. — № 2 (64). — С. 84-92.
2. Криштафор А.А. Когнитивные нарушения, обусловленные критическими состояниями, как проявление церебральной недостаточности // Медицина неотложных состояний. — 2015. — 2 (65).
3. Макотрова Т.А. Роль α7 никотиновых ацетилхолиновых рецепторов в фармакотерапии нейродегенеративных заболеваний // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. — 2012. — Т. 112, № 10. — С. 57-59.
4. Одинак М.М., Вознюк И.А., Пирадов М.А., Румянцева С.А. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте // Клиническая неврология. — 2010. — 4 (1). — 20-7.
5. Никонов В.В., Савицкая И.Б. Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии // Медицина неотложных состояний. — 2011. — № 1-2. — С. 101-106.
6. Никонов В.В., Савицкая И.Б., Белецкий А.В. Холина альфосцерат в терапии острого ишемического инсульта // Мед. неотл. сост. — 2013. — № 1. — С. 94-98.
7. Расулова Х.А. Особенности холинергической нейромедиации при ишемических инсультах в зависимости от их патогенетической гетерогенности // Міжнар. неврол. журн. — 2011. — № 3. — С. 55-59.
8. Черний Т.В., Андронова И.А., Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме // Международный неврологический журнал. — 2011. — № 2. — С. 40.
9. Черний Т.В., Андронова И.А., Черний В.И. и др. Принципы коррекции холинергической недостаточности, развивающейся в восстановительном периоде лечения травматической болезни головного мозга и мозгового инсульта // Міжнар. неврол. журн. — 2012. — № 3. — С. 108-116.
10. Abramochkin, Denis V., Anastasia A. Borodinova, Leonid V. Rosenshtraukh, Eugen E. Nikolsky. Both Neuronal and Non-Neuronal Acetylcholine Take Part in Non-Quantal Acetylcholine Release in the Rat Atrium // Life Sciences. — 2012. — 91 (21-22). — 1023-26.
11. Amenta F., Tayebati S.K., Vitali D., Di Tullio M.A. Association with the cholinergic precursor choline alphoscerate and the cholinesterase inhibitor rivastigmine: an approach for enhancing cholinergic neurotransmission // Mech. Ageing. Dev. — 2006. — 127. — 173-179.
12. Amenta F., Carotenuto A., Fasanaro A.M., Lanari A., Previdi P., Rea R. Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta // G. Gerontol. — 2010. — V. 58. — P. 64-68.
13. Amenta F. et al. The ASCOMALVA trial: association between the cholinesterase inhibitor donepezil and the cholinergic precursor choline alphoscerate in Alzheimer’s disease with cerebrovascular injury: interim results // J. Neurol. Sci. — 2012. — 322 (1-2). — 96-101.
14. Amenta F., Carotenuto A., Fasanaro A.M. et al. Исследование ASCOMALVA. Эффективность комбинированного применения ингибитора холинэстеразы и холина альфосцерата в отношении когнитивных расстройств при болезни Альцгеймера в сочетании с цереброваскулярным поражением головного мозга // Международный неврологический журнал. — 2014. — № 5 (67). — С. 50-58.
15. Araujo Joseph A., Christa M. Studzinski, Norton W. Milgram. Further Evidence for the Cholinergic Hypothesis of Aging and Dementia from the Canine Model of Aging. Progress in Neuro-Psychopharmaco-logy and Biological Psychiatry, Canine Model оf Cognitive Aging: Further Developments аnd Practical Applications. — 2005. — 29 (3). — 411-22.
16. Aspinall Richard. Aging of the Organs and Systems // Springer Science & Business Media. — 2013.
17. Audrey Miang Ying Tan. Postoperative cognitive dysfunction after cardiac surgery / Audrey Miang Ying Tan, Derek Amoako // Contin. Educ. Anaesth. Crit. Care Pain. — 2013. — Vol. 13, Iss. 6. — P. 218-223.
18. Bartus R.T., Dean R.L., Beer B., Lippa A. The cholinergic hypothesis of geriatric memory dysfunction // Science. — 1982. — 217 (4558). — P. 408-414.
19. Behl P. et al. Strategic subcortical hyperintensities in cholinergic pathways and executive function decline in treated Alzheimer patients // Archives of Neurology. — 2007. — Vol. 64, № 2. — P. 266-272.
20. Bond M. et al. The effectiveness and cost-effectiveness of donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer's disease (review of Technology Appraisal № 111): a systematic review and economic model // Health technology assessment (Winchester, England). — 2012. — Vol. 16, № 21. — P. 1-470.
21. Bowler J.V. Vascular Cognitive Impairment // Stroke. — 2004. — 35. — 386-388.
22. Bullock R. New drugs for Alzheimer’s disease and other dementias // Br. J. Psychiatry. — 2002. — 180. — 135-139.
23. Bunce J.G., Sabolek H.R., Chrobak J.J. Intraseptal infusion of the cholinergic agonist carbachol impairs delayed-non-match-to-sample radial arm maze performance in the rat // Hippocampus. — 2004. — Vol. 14, № 4. — P. 450-459.
24. Cuello A.C. Basal Forebrain Cholinergic Neurons // Encyclopedia of Psychopharmacology — Springer, Berlin-Heidelberg. — 2010. — P. 201-201.
25. Cummings J. Cholinesterase Inhibitors: A New Class of Psychotropic Compounds // The American Journal of Psychiatry. — 2000. — Vol. 157 (1). — Р. 4-15.
26. Dakroub Mouhamed. Cardioprotective Role of the Choli-nergic System // Electronic Thesis and Dissertation Repository. — 2015. — 3425.
27. De Jesus Moreno Moreno M. Cognitive improvement in mild to moderate Alzheimer’s dementia after treatment with the acetylcholine precursor choline alfoscerate: a multicenter, double-blind, randomized, placebo-controlled trial // Clin. Ther. — 2003. — 25, 1. — 178-193.
28. Dekker A.J., Connor D.J., Thal L.J. The role of cholinergic projections from the nucleus basalis in memory // Neurosci Biobehav. Rev. — 1991. — 15 (2). — 299-317.
29. Di Bari M., Di Pinto G., Reale M., Mengod G., Tata A.M. Cholinergic System and Neuroinflammation: Implication in Multiple Sclerosis // Cent. Nerv. Syst. Agents. Med. Chem. — 2017. — 17 (2). — 109-115.
30. Doggrell S.A., Evans S. Treatment of dementia with neurotransmission modulation // Expert Opin. Investig. Drugs. — 2003. — 12. — 1633-54.
31. Dubois B., Albert M.L. Amnestic MCI or prodromal Alzheimer’s disease // Lancet Neurology. — 2004. — 3. — 246-8.
32. Ehlenbach W.J. Association between Acute Care and Critical Illness Hospitalization and Cognitive Function in Older Adults / Ehlenbach W.J., Hough C.L., Crane P.K. et al. // JAMA. — 2010. — Vol. 303 (8). — P. 763-770.
33. Galasko D. New approaches to diagnose and treat Alzheimer’s disease: a glimpse of the future // Clin. Geriatr. Med. — 2001. — 17 (2). — 393-410.
34. Giboureau N. et al. PET radioligands for the vesicular acetylcholine transporter (VAChT) // Current topics in medicinal chemistry. — 2010. — Vol. 10, № 15. — P. 1569-1583.
35. Grothe M., Heinsen H., Teipel S.J. Atrophy of the cholinergic basal forebrain over the adult age range and in early stages of Alzheimer's disease // Biological psychiatry. — 2012. — Vol. 71, № 9. — P. 805-813.
36. Fodale V., Santaria L.B., Schifilliti D., Mandel P.K. Anesthe-tics and postoperative cognitive dysfunction: a pathological mechanism mimicking Alzheimer’s disease // Anesthesia. — 2010. — V. 65 (4). — P. 388-395.
37. Francis P. T., Ramirez M.J., Lai M.K. Neurochemical basis for symptomatic treatment of Alzheimer's disease // Neuropharmacology. — 2010. — Vol. 59. — P. 221-229.
38. Harald J. Hampel, M-Marsel Mesulam, Augusto Claudio Cuell, Zaven Khachaturian. The cholinergic system in the pathophysiology and treatment of Alzheimer's disease // Brain. — 2018. — 141 (7).
39. Hasselmo M.E. The role of acetylcholine in learning and me-mory // Current opinion in neurobiology. — 2006. — Vol. 16, № 6. — P. 710-715.
40. Joshi D., Bhatia M., Gupta S. et al. Cognitive evaluation in myasthenia gravis: A P300 and neuropsychological study // Neurology Asia. — 2006. — Vol. 11. — P. 97-102.
41. Kaltsatou A. et al. Cognitive impairment as a central choli-nergic deficit in patients with Myasthenia Gravis // BBA clinical. — 2015. — Vol. 3. — P. 299-303.
42. Klein J.C. et al. Neurotransmitter changes in dementia with Lewy bodies and Parkinson disease dementia in vivo // Neurology. — 2010. — Vol. 74, № 11. — P. 885-892.
43. Lulu Xie et al. Sleep drives metabolite clearance from the adult brain // Science. — 2013. — 342. — 373.
44. Maniega S.M., Cvoro V., Armitage P.A. Choline and Creatine Are Not Reliable Denominators for Calculating Metabolite Ratios in Acute Ischemic // Stroke. — 2008.
45. Mao Z. et al. Association between myasthenia gravis and cognitive function: A systematic review and meta-analysis // Annals of Indian Academy of Neurology. — 2015. — Vol. 18, № 2. — P. 131.
46. Pákáski M., Kálmán J. Interactions between the amyloid and cholinergic mechanisms in Alzheimer's disease // Neurochemistry international. — 2008. — Vol. 53, № 5. — P. 103-111.
47. Pandharipande P.P. Long-Term Cognitive Impairment after Clinical Illness / P.P. Panharipande, T.D. Girard, J.C. Jackson et al. // N. Engl. J. Med. — 2013. — № 369. — C. 1306-1316.
48. Pantoni L., Poggesi A., Inzitari D. The relation between white-matter lesions and cognition // Current opinion in neurology. — 2007. — Vol. 20, № 4. — P. 390-397.
49. Parnetti L., Amenta F., Gallai V. Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mech. Ageing. Dev. — 2001. — 122. — 2041-55.
50. Ranganath C., Rainer G. Neural mechanisms for detecting and remembering novel events // Nature Reviews Neuroscience. — 2003. — Vol. 4, № 3. — P. 193-202.
51. Sato N., Sakamori M., Haga K., Takehara S., Setoguchi M. Antagonistic activity of Y-25130 on 5-HT3 receptors // Jpn. J. Pharmacol. — 1992. — 59 (4). — 443-8.
52. Scapicchio P.L. // Int. J. Neurosci. — 2013. — 123 (7). — 444.
53. Söderman A. et al. Activation of nicotinic α 7 acetylcholine receptor enhances long term potentation in wild type mice but not in APP swe/ PS1ΔE9 mice // Neuroscience letters. — 2011. — Vol. 487, № 3. — P. 325-329.
54. Szymusiak R. Magnocellular nuclei of the basal forebrain: substrates of sleep and arousal regulation // Sleep. — 1995. — 18 (6). — 478-500.
55. Tayebati S.K., Tomassoni D., Di Stefano A. et al. Effect of choline-containing phospholipids on brain cholinergic transporters in the rat // J. Neurol. Sci. — 2011. — V. 302. — P. 49-57.
56. Vellas B., Messina J., Hartman R. et al. Multi-dimensionality of treatment benefits in Alzheimer’s disease: investigating the correlation between activities of daily living and cognition in patients treated with rivastigmine. Research and practice in Alzheimer’s disease. — Paris: Serdi Publishing; NY: Springer Publishing Company, 2001. — 193-204.
57. Wess J., Eglen R.M., Gautam D. Muscarinic acetylcholine receptors: mutant mice provide new insights for drug development // Nature reviews Drug discovery. — 2007. — Vol. 6, № 9. — P. 721-733.
58. Wessler I., Kirkpatrick C.J. Acetylcholine beyond neurons: the non-neuronal cholinergic system in humans // British journal of pharmacology. — 2008. — Vol. 154, № 8. — P. 1558-1571.
59. Whalen P.J., Rauch S.L., Etcoff N.L., McInerney S.C., Lee M.B., Jenike M.A. Masked presentations of emotional facial expressions modulate amygdala activity without explicit knowledge // J. Neurosci. — 1998. — 18. — 411-418.
60. Wilson F.A., Rolls E.T. Neuronal responses related to the novelty and familiarity of visual stimuli in the substantia innominata, diagonal band of Broca and periventricular region of the basal forebrain // Exp. Brain Res. — 1990. — 80. — 104-20.
61. Wonnacott S., Barik J. Nicotinic ACh receptors // Tocris. Rev. — 2007. — Vol. 28. — P. 1-20.
62. Woolf N.J., Butcher L.L. Cholinergic systems mediate action from movement to higher consciousness // Behavioural brain research. — 2011. — Vol. 221, № 2. — P. 488-498.
63. Xu M. et al. Basal forebrain circuit for sleepwake control // Nature neuroscience. — 2015. — Vol. 18, № 11. — P. 1641-1647.
64. Zaal I.J. Delirium in critically ill patients: epidemiology, pathophysiology, diagnosis and management / I.J. Zaal, A.J. Slooter // Drugs. — 2012. — № 72 (11). — P. 1457-1471.
/69.jpg)
/70.jpg)