Введение
Остеоартрит (ОА) является лидирующей причиной патологии опорно-двигательного аппарата в всем мире, поражающей 10–15 % взрослых, с риском возникновения в течение жизни до 50 % [1]. ОА страдает более 30 миллионов человек в США [2] и 302 миллиона во всем мире [3]. Распространенность ОА растет и, как ожидается, затронет 78 миллионов взрослых в США к 2040 году [4]. В настоящее время ОА занимает 12-е место в мире среди всех причин инвалидизации населения [5]. Несмотря на успехи в понимании роли воспаления, биомеханического стресса и клеточных реакций в патофизиологии ОА, одобренная фармакологическая тактика ОА по-прежнему ограничена применением препаратов только лишь для облегчения симптомов, при отсутствии доступной и высокодоказательной базы лечения для предотвращения возникновения или прогрессирования ОА.
Подагра и подагрический артрит, в свою очередь, являются наиболее распространенным воспалительным артритом, поражающим 3,9 % взрослого населения США (8,3 млн человек) [6]. Облигатной причиной подагры является гиперурикемия, которая физиологически определяется как содержание сывороточной мочевой кислоты (сМК) > 6,8 мг/дл, причем точка растворимости моноурата натрия (МУН) — pH 7,4. Бессимптомная гиперурикемия определяется как гипер-урикемия у лиц без клинических проявлений подагры. Гиперурикемия встречается гораздо чаще, чем подагра, распространенность ее в США составляет 21,4 % [6]; считается, что приблизительно каждый четвертый житель планеты имеет гиперурикемию. Усовершенствованные методы визуализации показали, что примерно у 25 % людей бессимптомная гиперурикемия сопровождается осаждением кристаллов МУН в тканях без клиники подагрического артрита [7]. Бессимптомная гиперурикемия может рассматриваться как биохимическое/метаболическое состояние, прогрессирующее у некоторых индивидуумов до воспалительного заболевания (подагра) в ответ на отложение кристаллов МУН, включая образование сложных, биологически активных структур, отражающих хронические воспалительные гранулематозные и фиброзные реакции в ответ на депозицию кристаллов МУН [8].
Хотя клинический опыт показывает, что подагра и ОА часто встречаются у одного и того же пациента, существует ли патофизиологическая связь между ОА и подагрой/гиперурикемией, до сих пор неясно. Если предположить, что гиперурикемия/подагра способствует развитию или прогрессированию ОА, это может иметь терапевтические преимущества, учитывая, что, в отличие от ОА, для подагры и гиперурикемии существуют эффективные методы профилактики и лечения.
Подагра и остеоартрит: клинико-эпидемиологические ассоциации
Эпидемиологически подагра и ОА имеют ряд общих факторов риска, включая пожилой возраст, ожирение и сахарный диабет 2-го типа [9, 10]. Предшествующее повреждение (травма) сустава в анамнезе или механическая перегрузка являются доказанными факторами риска ОА, одновременно острое повреждение сустава выступает безусловным триггером острой подагрической атаки [11]. Подагра и ОА также связаны с отложением кристаллов пирофосфата кальция [12]. Напротив, существует несколько противоречивых факторов риска, включая пол (у мужчин чаще развивается подагра, у женщин — ОА) и почечную недостаточность (фактор риска при подагре, но не при ОА).
На оба заболевания влияет генетическая предрасположенность, однако генетические ассоциации различаются: при ОА выявлена связь с биологией хряща и индексом массы тела (ИМТ), а генетическая предрасположенность подагры в основном ассоциирована с метаболизмом мочевой кислоты и ее почечной экскрецией. Кроме того, выявлена связь возникновения ОА с генами семейства интерлейкина-1 (IL-1) [13], потенциально релевантными для подагры, поскольку IL-1 является центральным медиатором подагрического воспалительного ответа [14].
ОА и подагра имеют общую склонность к некоторым специфическим локализациям патологического процесса в суставах, включая суставы кистей (например, дистальные межфаланговые суставы), суставы ног (особенно первые плюснефаланговые суставы) и коленные суставы. Так, у пациентов с узелковой формой дистального межфалангового ОА (узелки Гебердена) подагрический артрит не является редкостью и ассоциирован с приемом диуретиков и почечной недостаточностью, предположительно из-за их потенцирующего влияния на гиперурикемию [15]. Локализация в других суставах для ОА и подагры различается: для ОА характерно частое поражение тазобедренного сустава, а для подагры — вовлечение лучезапястного (за исключением пациентов, которые имели травму запястья в анамнезе) и голеностопного суставов. При ОА эти локализации являются проявлением вторичного поражения. В нескольких исследованиях изучали локализацию пораженных суставов при ОА и подагре. В исследовании Е. Roddy et al. (2007) у 164 пациентов с подагрой шансы на появление ОА в суставах, которые были поражены подагрическим артритом, были в 7–8 раз выше по сравнению с интактными [14]. В другом исследовании N. Dalbeth et al. (2015) сообщили, что в суставах, в которых было идентифицировано осаждение кристаллов МУН при помощи двухэнергетической компьютерной томографии, в 5–10 раз чаще выявлялись признаки рентгенологического ОА, включая остеофиты, субхондральный склероз и сужение суставной щели — признаки, которые не являются типичными для подагры как таковой [15]. Аналогично посмертное исследование голеностопного сустава, обычно не вовлекающегося в патологический процесс при первичном ОА, продемонстрировало, что отложение МУН было ассоциировано с повреждением хряща, типичным для ОА [16]. Таким образом, ОА в определенных суставах, по-видимому, связан как с наличием клинически активной подагры, так и с бессимптомной депозицией кристаллов МУН. Однако такие наблюдения не доказывают четкой причинно-следственной связи ОА и гиперурикемии и/или подагры. Возможно, что оба состояния возникают из-за общих факторов риска, таких как ожирение, возраст и пол.
Клинически подагра характеризуется эпизодическими обострениями интенсивного воспалительного артрита. Напротив, болезненные обострения при ОА менее интенсивны и более вариабельны, включая потенциальную роль участия поражений костного мозга и синовита [17]. Хотя ранее ОА традиционно считали невоспалительным заболеванием, при нем синовит и выпот часто обнаруживаются в полости сустава при визуализации (МРТ и УЗИ), клинически они представлены в виде отека и припухлости сустава. Синовит при ОА коленного сустава ассоциирован с концентрацией воспалительных цитокинов, а также с тяжестью и прогрессированием ОА [18]. Считается, что синовиальная оболочка и синовиоциты реагируют на фрагменты хряща и другие осколки, продуцируя медиаторы воспаления и активируя их посредством запуска врожденной иммунной системы [19]. Другие данные свидетельствуют о том, что кристаллы кальция, образование и отложение которых часто происходит у пациентов с ОА, могут способствовать воспалительным реакциям ОА [20].
Дистресс- и патоген-ассоциированные молекулярные паттерны (ДАМП, ПАМП), которые активируются при повреждении суставного хряща, запускают иммунную систему и вызывают воспалительный ответ при ОА посредством взаимодействия с рецепторами распознавания частиц, такими как Toll-подобные и NOD-подобные рецепторы. МУН является одним из таких ДАМП, приводящих к «сборке» инфламмасом и последующей активации воспалительных путей [21]. Являются ли эти эффекты МУН релевантными в патологии OA, полностью не установлено, предполагают, что появление болевого синдрома при ОА может быть связано с отложением кристаллов уратов. Исследования, посвященные вопросу, может ли подагра предрасполагать к ОА или ОА к подагре, достаточно редки.
В британском исследовании «случай — контроль», в котором участвовали 39 111 пациентов с подагрой и равное количество пациентов в группе контроля [22], медицинские записи были проверены на предмет развития сопутствующих заболеваний в течение 10 лет после индексной даты и за тот же период времени до индексной даты для оценки существующих ранее сопутствующих заболеваний. По сравнению с контрольной группой риск возникновения ОА был выше у субъектов с подагрой (отношение шансов (ОШ) 1,45 (95% ДИ 1,35–1,54)). Пациенты с подагрой, в свою очередь, чаще имели предшествующий диагноз ОА (ОШ 1,27) по сравнению с контрольной группой. ИМТ не был полностью учтен, и, следовательно, остаточное искажение не может быть исключено в качестве объяснения этой наблюдаемой ассоциации. Тем не менее эти исследования дают возможность предположить, что подагра и ОА могут быть кофакторами риска друг друга.
Связь между гиперурикемией как таковой и ОА лучше всего изучать у пациентов с бессимптомной гипер-урикемией, поскольку почти невозможно различить уратный и воспалительный эффекты у пациентов с установленной подагрой. Кросc-секционное исследование более 4000 участников продемонстрировало, что повышенные уровни сМК и стойкая гиперурикемия были в значительной степени ассоциированы с остео-фитозом коленного сустава — отличительной чертой ОА — у пациентов женского пола, даже с коррекцией по ИМТ и наличию диабета [31].
Для установления взаимообусловленности ОА и подагры R.G. Howard et al. (2015) провели исследование среди 75 мужчин старшего возраста, разделив их на три группы: с нормоурикемией, бессимптомной гипер-урикемией и подагрой (по 25 в каждой группе) [24]. Используя клинические или клинико-рентгенографические классификационные критерии Американской коллегии ревматологов (ACR) для ОА коленного сустава, отметили, что у пациентов с подагрой было более чем двукратное увеличение распространенности ОА коленного сустава по сравнению с контролем (68 против 28 %). У пациентов с бессимптомной гиперурикемией частота возникновения ОА коленного сустава была промежуточной между нормоурикемической и подагрической группами (52 %), что указывает на потенциальный концентрация-зависимый эффект гиперурикемии и процесса прогрессирования подагры на риск развития ОА. Кроме того, было отмечено, что бессимптомная гиперурикемия отражалась на тяжести течения ОА коленного сустава, оцененного при помощи Kellgren-Lawrence рентгенографических критериев, а подагра ассоциировалась с более тяжелым течением ОА коленного сустава, что также указывает на концентрация-зависимый эффект сМК [24]. Связь ОА с бессимптомной гиперурикемией не наблюдалась в подгруппе пациентов с ожирением, что позволяет предположить, что ожирение является весомым фактором риска ОА, подавляя специфические эффекты гиперурикемии. Аналогичные результаты были обнаружены G.G. Teng et al. (2017), которые отметили, что худые женщины с подагрой чаще подвергались артропластике коленного сустава при тяжелом ОА, чем худые женщины без подагры, но такая связь отсутствовала у женщин с ИМТ > 25 кг/м2 [25].
Для дальнейшего изучения связи между гиперурикемией и тяжестью ОА коленного сустава было проведено исследование коленных и первых плюснефаланговых суставов (1ПФС) на предмет наличия такого УЗИ-симптома, как «двойной контур» (свидетельствующего об осаждении кристаллов МУН на поверхности хряща) и наличие тофусов [26]. Было обнаружено, что осаждение кристаллов МУН связано с более высокой распространенностью ОА коленного сустава (60 % против 27 % распространенности ОА, P = 0,04). Интересно, что именно депозиция уратов в 1ПФС, а не в коленном, была связана с более высокой распространенностью ОА коленного сустава (для осаждения кристаллов МУН в 1ПФС — 62,5 % против 29 % распространенности ОА коленного сустава, P = 0,03; для осаждения кристаллов МУН в коленном суставе — соответственно 50 % против 38,6 %, P = 0,6) [24]. Эти данные свидетельствуют, что осаждение кристаллов МУН в различных суставах может служить маркером тяжести поражения суставов, характерного для ОА.
Ураты и остеоартрит: патогенетическая конвергенция
Эпидемиологическая связь между гиперурикемией/подагрой и ОА вызывает следующий вопрос: существует ли биологическая связь между этими двумя нозологиями?
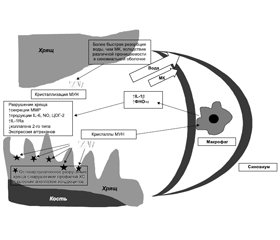
Четыре важных факта заслуживают рассмотрения:
— связь между гиперурикемией и ОА обусловлена общими факторами риска (например, ожирением, сахарным диабетом), а не какими-либо прямыми отношениями;
— остеоартритический процесс в суставе может способствовать локальной кристаллизации уратов; этот процесс может усугубляться в условиях стойкой гипер-урикемии и способен привести к подагре;
— отложение кристаллов МУН на/в хряще может создать местное механическое и/или воспалительное повреждение, способствующее развитию ОА;
— ураты могут образоваться в процессе развития и/или прогрессирования ОА [27]. Эти механизмы схематически представлены на рис. 1.
ОА как провоцирующий фактор отложений депозитов МУН
В ряде исследований рассматривался вопрос о том, могут ли остеоартритические изменения в суставах предрасполагать к формированию депозитов МУН в тканях сустава. Многие исследования подчеркивают тот факт, что для кристаллизации требуется поверхность зародышеобразования — ядро депозита и что именно хрящ при ОА имеет предрасположенность к этому. Е. Pascual et al. (2015) указали, что осаждение кристаллов МУН на хряще происходит параллельно поверхностным волокнам, и предполагают, что нерегулярная структура коллагена при ОА может обес-печить каркас, на котором могут легко осаждаться ураты [28].
Другие исследователи сфокусировались на роли хондроитина сульфата (ХС) в процессе отложений кристаллов МУН. Среди множества форм ХС наибольший интерес был связан с отношениями ХС-4 и ХС-6: ХС-4 способствует осаждению уратов, тогда как ХС-6 может замедлять его. Разрушение суставного гиалинового хряща приводит к дисперсии ХС-6, обнаруживаемого в основном на поверхности, и выделению ХС-4, обнаруженного в более глубоких слоях, что приводит к увеличению отношения ХС4/ХС6 и большей вероятности осаждения уратов [29]. Эти процессы, по-видимому, будут усугубляться при наличии гиперурикемии, так как синовиальная жидкость в значительной степени является гиперфильтратом сыворотки крови. Следует отметить, однако, что ХС может также ослаблять активацию макрофагов [30] и, следовательно, уменьшать воспалительный ответ на кристаллы МУН, даже если они способствуют кристаллизации уратов.
Кроме того, по крайней мере одно исследование предполагает, что синовиальная оболочка при ОА может способствовать повышению уровня уратов в полости сустава, поскольку синовиум при ОА является более проницаемым для воды, чем для уратов. В этой модели резорбция воды из суставной жидкости в кровь происходит быстрее, чем резорбция уратов в иммобилизированном суставе (например, ночью), таким образом достигается относительное локальное повышение концентрации уратов [23]. Исследователи предполагают, что это преходящее ночное увеличение содержания уратов в синовиальной жидкости может быть одной из причин, по которым приступы подагры обычно происходят ночью [23].
Когда-то считавшийся заболеванием «износа» и маркером старения, ОА сегодня определяется не только как механически обусловленное, но и как биохимически и клеточно прогрессирующее заболевание всего сустава, при котором экспрессия медиаторов воспаления является центральной и определяющей чертой [18]. В ответ на механический и клеточный стресс хондроциты претерпевают фенотипические изменения, вырабатывая не свойственные здоровому хрящу медиаторы воспаления, в том числе IL-1, фактор некроза опухоли a (ФНО-a), простагландин Е2 (PGE2), оксид азота и другие [32]. Важность IL-1 может быть подчеркнута тем фактом, что полиморфизм гена-антагониста рецептора IL-1 связан с тяжестью ОА [32]. Кроме того, хондроциты при OA секретируют матриксные металлопротеиназы (MMPs), такие как MMP-3 и -13, наряду с аггреканазами, такими как ADAMTS-4 и ADAMTS-5, эффективно переключаясь с анаболического на катаболический фенотип [33]. Эти механизмы ассоциированы с параллельными ответами синовиоцитов, приводящими к низкоуровневому воспалению синовиальной оболочки (субклинический/клинический синовит), которое является маркером тяжести ОА [34], и к костным изменениям, включая субхондральный склероз, формирование остеофитов и поражения костного мозга, диагностируемые с помощью МРТ [35]. Все вышеперечисленные воспалительные изменения будут способствовать поддержанию воспалительного процесса при подагрическом артрите или инициировать его.
Ураты как провоцирующий фактор ОА
В свою очередь, ураты и их депозиты могут способствовать развитию ОА. Поскольку повреждение хряща почти любого типа может способствовать прогрессированию ОА, представляется вероятным, что механическое повреждение и/или воспалительные реакции в ответ на отложение МУН и образование тофусов могут способствовать развитию и прогрессированию ОА.
К сожалению, ни одно исследование формально не оценило влияние МУН/подагрического или воспалительно-медиаторного повреждения на прогрессирование ОА. Но следует предположить, что ураты могут играть потенциальную биохимическую роль в патофизиологии ОА.
В последнее десятилетие сМК и МУН привлекают все большее внимание к своим ключевым ролям, запускающим воспалительные каскады. Воспалительная природа ОА сегодня имеет цельную доказательную базу, включая повышенные уровни IL-1Ra и PGE2 в плазме и повышенные профили экспрессии цитокинов в периферических лейкоцитах, которые ассоци-ированы со значительной прогрессией ОА [36]. Исследования in vitro продемонстрировали сходные ответы хондроцитов на МУН: R. Liu et al. (2004) сообщили, что воздействие уратов на хондроциты приводило к повышению уровня IL-1 [37], что согласуется с тем, что МУН активирует и стимулирует NLRP3 инфламмасому — ферментативный активатор IL-1β и IL-18 [21]. IL-1β считается основным провоспалительным интерлейкином и обладает плейотропным эффектом во многих тканях, включая ткани сустава. При ОА IL-1β способствует дегенерации хряща, стимулируя секрецию ММРs хондроцитами, подавляя экспрессию коллагена II типа и аггреканов и индуцируя выработку IL-6 и других катаболических цитокинов и хемокинов [38]. IL-1β также участвует в индукции провоспалительных генов, таких как циклооксигеназа-2 (ЦОГ-2), ФНО-α и NO-синтетаза. В дополнение генерация NO может подавлять эндогенный нейтрализатор IL-1β — антагонист рецепторов IL-1 (IL-1Ra), потенциально позволяя IL-1β повышать его собственную эффективность [37] (рис. 2).
/10.jpg)
Потенциальная роль IL-1β как посредника между подагрой и ОА подтверждается клиническими исследованиями, изучающими взаимосвязи между МК и воспалительными цитокинами в синовиальной жидкости и тяжестью OA [39]. В исследовании OA коленного сустава, проведенном А.Е. Denoble et al. (2011), уровни МК в синовиальной жидкости непосредственно коррелировали с уровнями в ней IL-18 и IL-1β, что согласуется с возможностью того, что ураты в суставе активировали воспаление, опосредованное через NLRP3-инфламмасому, и что концентрации этих интерлейкинов коррелируют с показателями тяжести ОА коленного сустава при рентгенографии (оценка остеофитов и сужение суставного пространства) [40].
Суммируя эти наблюдения, А.Е. Denoble et al. предложили циклическую модель, в которой гибель хондроцитов приводит к перицеллюлярному увеличению концентрации МК и способствует микроскопическому осаждению МУН, вызывая увеличение воспаления и гибель соседних хондроцитов. Возможно, наложение фактической подагры/гиперурикемии или даже просто транзиторное повышение концентрации МК в синовиальной жидкости может ускорить или усугубить эти процессы [40].
Следует также добавить, что R. Liu et al. (2004) в своих исследованиях продемонстрировали, что in vitro кристаллы МУН индуцируют высвобождение ММР-3 и оксида азота (NO) из хондроцитов [37]. ММР-3, как известно, разрушает неспиральные, неколлагеновые домены нескольких хрящевых матриксных белков [41]. NO ингибирует синтез протеогликанов хондроцитов, снижая жизнеспособность хондроцитов и усиливая катаболическую активность ММР [42]. Высвобождение как MMP-3, так и NO способствует повреждению хряща. Другие авторы показали, что кристаллы МУН могут непосредственно снижать жизнеспособность и функцию хондроцитов человека и вызывать их гибель [43]. Е. Charlier et al. (2016) документировали подобные результаты и дополнительно сообщили, что МУН провоцируют хондроциты к увеличению экспрессии ADAMTS-5 и снижению выработки коллагена, а также способствуют гибели хондроцитов неапоптотическим путем, в отличие от ожидаемого процесса апоптоза при ОА [44]. Это наблюдение подтверждено и расширено исследованиями H.S. Huang et al. (2015), которые сообщили, что уратиндуцированная смерть хондроцитов обусловлена не апоптозом или некрозом, а аутофагией [42]. Эксперименты Y. Shi et al. (2003) впервые установили тот факт, что ураты генерируются умирающими клетками как сигнал опасности для оповещения иммунной системы [45]. Это позволяет предположить, что гибель хондроцитов в ответ на воздействие микрокристаллических уратов может, в свою очередь, привести к образованию дополнительных уратов в петле амплификации с прямой связью.
Важно отметить, что эти реакции возникали только при высоких концентрациях МУН, что согласуется с вероятностью образования микрокристаллов МУН. Однако не все воздействия уратов могут быть пагубными для хондроцитов. J.H. Lai et al. (2017) сообщили, что более низкие концентрации уратов (т.е. ниже 6,8 мг/дл) оказывают протективное воздействие на хондроциты и предотвращают развитие остеоартритического фенотипа хондроцитов, включая подавление экспрессии хондроцитов ЦОГ, MMP-13 и iNOS и стимулирование секреции коллагена [46]. Таким образом, ураты могут играть амбивалентную и даже парадоксальную роль для хрящевой ткани, снижая риск развития и усугубления ОА в низких концентрациях и повышая при более высоких. В соответствии с этой гипотезой ряд исследований продемонстрировали возможность того, что ураты могут обладать антиоксидантными/прооксидантными свойствами в зависимости от среды и концентрации [47].
Поскольку уровень сМК сыворотки крови является основным фактором, определяющим концентрацию уратов в синовиальной жидкости, было проведено исследование потенциальной возможности МК в прогнозировании прогрессирования OA коленного сустава. Используя данные 88 участников когорты с анамнезом ОА коленного сустава и исключенным диагнозом подагры, исследователи наблюдали, что уровень МК был предиктором прогрессирования сужения медиального суставного пространства [48]. Более высокие уровни МК были связаны с более быстрым сужением суставного пространства, с пороговым эффектом концентрации МК 6,8 мг/дл. При МРТ коленного сустава у этих пациентов была отмечена линейная связь между уровнем МК и объемом синовиальной жидкости, что согласуется с возможным влиянием уратов на синовит в условиях ОА [48].
Синовиальная и сывороточная МК: коммуникация и закономерности
В отличие от исследования уровня МК в синовиальной жидкости, сМК является легкодоступным маркером и, следовательно, имеет большую потенциальную полезность для клиницистов. Поэтому важным является установление потенциальной связи между концентрацией сМК и развитием/прогрессированием ОА. В некоторых исследованиях сообщается о противоречивых ассоциациях МК и OA в зависимости от того, исследуется ли МК сыворотки или синовиальной жидкости, что ставит вопрос о том, существует ли надежная корреляция между уровнями МК сыворотки и синовиальной жидкости при различных артритах.
В нескольких крупных ретроспективных исследованиях изучалась взаимосвязь между сМК и OA как на уровне населения, так и на индивидуальном уровне, но результаты оказались двойственными. Так, в исследовании Y. Sun et al. (2000) обнаружена положительная корреляция между сМК и генерализованным ОА среди пациентов с ОА тазобедренного сустава, но не среди пациентов с ОА коленного сустава [49]. Аналогичный результат был получен в исследовании Ulm Osteoarthritis с участием 420 пациентов с ОА тазобедренного сустава и 398 пациентов с ОА коленного сустава [50]. Однако в исследовании C.A. Ma et al. (2017) не было отмечено убедительной причинно-следственной связи между мочевой кислотой, подагрой и ОА [51].
A.E. Denoble et al. (2011) отметили, что в группе пациентов с ОА коленного сустава, но без подагры в анамнезе, сывороточные концентрации МК были значительно выше, чем в синовиальной жидкости, у 85 % больных [40]. Они также продемонстрировали, что именно уровень МК синовиальной жидкости, а не сМК, значительно коррелирует с тяжестью ОА, даже несмотря на то, что синовиальная жидкость считается ультрафильтратом плазмы [40]. Тем не менее другие исследования сообщают о прямой взаимосвязи между сывороточной и синовиальной МК. S. Wangkaew et al. (2014) провели сравнительное исследование уровней МК в сыворотке крови и синовиальной жидкости у пациентов с подагрой и другими артритами, включая ОА, пирофосфатную артропатию, ревматоидный артрит, септический артрит и анкилозирующий спондилит. При каждой нозологии авторы сообщили о положительной корреляции между уровнями уратов в сыворотке и синовиальной жидкости; для ОА, в частности, коэффициент корреляции был весьма значительным (0,81). Интересно, что у пациентов с ОА была вторая по величине концентрация сМК (6,1 мг/дл) и уровень МК в синовиальной жидкости (5,9 мг/дл) после подагры (6,7 и 7,1 мг/дл соответственно) [52].
Моделирование взаимодействия между уратами и ОА
Хотя приведенные выше наблюдения требуют подтверждения, они предлагают модель, в которой традиционные факторы риска (возраст, генетика, ожирение, предшествующая травма, сахарный диабет и т.д.) приводят к инициации хрящевого повреждения. В этот момент протеазы, высвобождаемые хондроцитами, способствуют деградации хряща, и одновременно выделяются воспалительные медиаторы, которые способствуют воспалению, в том числе в синовиальной оболочке. В то же время гибель хондроцитов ведет к образованию уратов, и, если их концентрации достаточно высоки, это может способствовать отложению кристаллов на хряще на макроскопическом уровне, что потенциально может привести к вторичному механическому повреждению и/или воспалительным процессам, реакциям на кристаллизованные ураты, которые способствуют дополнительному прогрессированию ОА.
Формированию кристаллов внутри суставов при ОА способствуют молекулярные продукты ОА (т.е. воздействие коллагена и ХС изнутри хряща). Кристаллизация уратов на микроскопическом уровне, предположительно вокруг умирающих хондроцитов, может дополнительно активировать соседние хондроциты для стимуляции большего количества протеаз и производства цитокинов и способствовать дополнительной их гибели, действуя в качестве сигнала ДАМП.
Результатом будет порочный цикл, в котором прогрессирование ОА приводит к образованию уратов, а образование уратов способствует дальнейшей прогрессии ОА. В условиях гиперурикемии синовиальная жидкость при ОА будет иметь более высокие фоновые уровни уратов, что может напрямую влиять на местные урат-опосредованные процессы ОА, увеличивая вероятность кристаллизации. У пациентов с выраженной подагрой повышается риск макроскопического осаждения кристаллов МУН в суставе (например, в виде отложения МУН в суставах и/или тофусах), при этом острое и хроническое воспаление, связанное с уратом/ тофусами, усугубляет воспалительные процессы, уже установленные в суставах с ОА, в дополнение к потенциально неблагоприятным механическим воздействиям кристаллического осаждения МУН. По крайней мере, такая модель предоставляет многократные гипотезы и предлагает ряд возможных точек вмешательства с доступными в настоящее время лекарствами.
С признанием депозиции кристаллов МУН при усовершенствованных визуализационных методах исследованиях среди людей с бессимптомной гиперурикемией необходимы продольные исследования, чтобы определить, является ли такое осаждение фактором риска развития ОА, в дополнение к изучению долговременных эффектов гиперурикемии независимо от бессимптомного осаждения кристаллов МУН.
Возможные механизмы взаимосвязи подагры/ги-перурикемии и остеоартрита, а также формирование порочного круга представлены на рис. 3.
Терапевтические вмешательства
Несмотря на высокую распространенность и влияние ОА на заболеваемость во всем мире, ни один из болезнь-модифицирующих антиостеоартритных препаратов (DMOAD) не получил одобрения организацией Управления по контролю за продуктами и лекарствами (FDA). Предлагаемые современные методы лечения в основном являются паллиативными и направлены на адекватное обезболивание с последующей заменой сустава. Наше растущее понимание роли воспаления при ОА и наше зарождающееся, но развивающееся понимание потенциальной роли влияния МК на хрящ при ОА повышает вероятность того, что нацеливание на уровни сМК или воспаление, индуцированное кристаллами МУН, заслуживает рассмотрения в исследованиях по лечению ОА. Более того, даже если было показано, что сМК отражает только тяжесть и/или прогрессирование ОА, не обязательно играющие инициальную роль, установление сМК в качестве легкодоступного биомаркера для выявления пациентов группы риска развития ОА может значительно облегчить перспективные испытания потенциально оправданных лекарственных средств при ОА.
В нескольких небольших исследованиях изучалась потенциальная роль колхицина, стандартного противовоспалительного средства в лечении подагры, в лечении ОА. Было показано, что колхицин подавляет МУН-индуцированное высвобождение IL-1β под воздействием NLRP3 инфламмасом [53], что указывает на возможный механизм воздействия колхицина на патофизиологию ОА. S.K. Das et al. (2002) провели рандомизированное контролируемое исследование эффективности колхицина у 39 пациентов с ОА коленных суставов [54]. Все пациенты первоначально получали ежедневно пироксикам; если симптомы ОА сохранялись, несмотря на 2-недельный прием НПВС, пациенты дополнительно получали внутрисуставную инъекцию стероидов. В дальнейшем они были рандомизированы для получения колхицина или плацебо в течение 5 месяцев. Добавление колхицина по сравнению с плацебо приводило к более длительному облегчению симптомов ОА. Кроме того, значительно большее число пациентов группы контроля отметили боль в ранее не пораженных суставных зонах как значительную новую проблему по сравнению с группой, получавшей колхицин, что указывает на возможную роль колхицина не только в лечении, но и в профилактике симптоматического ОА у уже предрасположенных к нему людей. Еще одно исследование, проведенное S. Aran et al. (2011), подтвердило выше-указанные результаты: пациентки в постменопаузе с ОА коленного сустава (61) были рандомизированы на получавших колхицин или плацебо [55]. Обе группы дополнительно получали обычные методы лечения ОА, такие как ацетаминофен для анальгезии. Уменьшение боли в конце 3-х месяцев было значительно больше выражено в группе колхицина по оценке как пациентов, так и врачей. Более того, доза ацетаминофена была значительно ниже в группе женщин, принимавщих колхицин.
Сбор первичных данных для более крупного РКИ с участием 120 пациентов с ОА коленного сустава — «Эффективность колхицина в модификации симптомов и воспаления при остеоартрите коленного сустава» (COLKOA) был завершен в сентябре 2015 года. В этом исследовании 120 пациентов с ОА коленного сустава были рандомизированы на ежедневный прием колхицина или плацебо в дополнение к их базовому режиму обезболивания. Результаты оценивались по клиническому ответу, а также по уровням воспалительных маркеров через 16 недель [56]. В противовес предыдущим результатам настоящее исследование показало, что колхицин не был эффективен в облегчении симптомов ОА в течение 16-недельного периода по сравнению с плацебо. Оценка была основана на данных шкалы WOMAC ≥ 30 %: исследователи наблюдали более высокий уровень ответа в группе плацебо. Следует отметить, что у пациентов в группе колхицина наблюдалось значительное снижение среднего уровня СРБ в сыворотке крови. Однако изменение hs-CRP не коррелировало с изменениями других провоспалительных биомаркеров синовиальной жидкости или изменениями симптомов.
Интригующей является идея о том, что прямое воздействие на уровень уратов может снизить риск или бремя ОА, которая еще не была всесторонне оценена в клинических исследованиях. На модели мышей Р. Gasse et al. (2009) продемонстрировали, что уратснижающая терапия может снижать продукцию IL-1β. Полученные результаты позволяют предположить, что уратснижающая терапия может предотвращать патогенетические процессы, имеющие значение для ОА [57].
На основании растущего понимания метаболического синдрома как фактора риска ОА Z. Aibibula et al. (2016) использовали модель на мышах с метаболическим синдромом и продемонстрировали, что мыши, которые получали рацион с высоким содержанием жиров, имели повышенную распространенность и тяжесть ОА, а также высокую активность ксантиноксидазы [58]. Назначение ингибитора ксантиноксидазы фебуксостата уменьшало гистологические и рентгенологические изменения ОА коленного сустава даже при продолжающейся диете с высоким содержанием жиров [58], а уровни IL-1β, сопряженные с ОА, увеличивались в ответ на диету с высоким содержанием жира и уменьшались в ответ на использование фебуксостата.
Выводы
Старая догма о том, что ОА является болезнью пассивной дегенерации, неизбежно приводила к терапевтическому нигилизму, предполагая только симптоматическую обезболивающую терапию и хирургические решения. Растущее понимание того, что ОА является активным, мультимодальным, сложным процессом, затрагивающим все ткани суставов, привело к мнению, что биологические вмешательства смогут предотвратить или замедлить катаболический и воспалительный процессы. Связь между ОА и подагрой и, в частности, между ОА и гиперурикемией, не случайна. Понятие взаимообусловленности ОА и гиперурикемии расширилось за последнее десятилетие, прояснилось, что по крайней мере некоторые механизмы являются общими для обоих заболеваний, что предполагает возможность взаимоотношений, в которых каждое состояние может усугубить другое. Принимая во внимание, что структурное заболевание, которым является ОА, в настоящее время не поддается лечению, в то время как для лечения гиперурикемии и подагрического воспаления доступно несколько лекарственных препаратов, эффективность уратснижающей терапии при ОА становится более вероятной гипотезой. Учитывая растущее во всем мире бремя ОА и отсутствие доступных и эффективных DMOADs в настоящее время, есть хорошее обоснование для будущих исследований, чтобы сосредоточиться на понимании взаимосвязи между МК и OA и обосновании перепрофилирования лекарственных препаратов для лечения подагры в качестве DMOADs. Независимо от результатов таких испытаний исследование ОА и его взаимодействия с гиперурикемией и подагрой уже дало важные знания о биологии и пересечении обоих состояний.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Информация о вкладе каждого участника. Головач И.Ю. —концепция и дизайн работы, обзор литературы по проблеме, написание текста, коррекция текста; Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати.
Список литературы
1. Murphy L., Schwartz T.A., Helmick C.G. et al. Lifetime risk of symptomatic knee osteoarthritis. Arthritis Rheum. 2008. Vol. 59. P. 1207-13.
2. Ma V.Y. Incidence, prevalence, costs, and impact on disability of common conditions requiring rehabilitation in the United States: stroke, spinal cord injury, traumatic brain injury, multiple sclerosis, osteoarthritis, rheumatoid arthritis, limb loss, and back pain. Arch. Phys. Med. Rehabil. 2014. Vol. 95. P. 986-95.
3. GBD 2015 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016. Vol. 388. P. 1545-602.
4. Hootman J.M., Helmick C.G., Barbour K.E. et al. Updated projected prevalence of self-reported doctor-diagnosed arthritis and arthritis-attributable activity limitation among US adults, 2015–2040. Arthritis Rheumatol. 2016. Vol. 68. P. 1582-7.
5. GBD 2016 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2017. Vol. 390. P. 1211-59.
6. Zhu Y. Prevalence of gout and hyperuricemia in the US General population: National Health and Nutrition Examination Survey 2007–2008. Choi Arthritis Rheum. 2011. Vol. 63. P. 3136-41.
7. Perez-Ruiz F. A review of crystal deposition disease, and gout. Adv. Ther. 2015. Vol. 32. P. 31-41.
8. Chhana A. The gouty tophus: a review. Curr. Rheumatol. Rep. 2015. Vol. 17. P. 19.
9. Головач И.Ю. Метаболический фенотип остеоартрита: двойная роль ожирения. Травма. 2017. 18 (5). С. 87-93.
10. Roddy E. Epidemiology of gout. Rheum. Dis. Clin. North Am. 2014. Vol. 40 (2). P. 155-175.
11. Головач И.Ю. Посттравматический остеоартрит: современные представления о развитии, прогрессировании и терапевтических подходах. Политравма. 2019. № 1. С. 82-91.
12. Frallonardo P., Ramonda R., Peruzzo L. et al. Basic calcium phosphate and pyrophosphate crystals in early and late osteoarthritis: relationship with clinical indices and inflammation. Clin. Rheumatol. 2018. Vol. 37 (10). P. 2847-2853.
13. Zengini E., Hatzikotoulas K., Tachmazidou I. et al. Genome-wide analysis using UK Biobank data provide insights into the osteoarthritis. Nat. Genet. 2018. Vol. 50. P. 549- 558.
14. Roddy E. Are joints affected by gout also affected by osteoarthritis? Ann. Rheum. Dis. 2007. Vol. 66. P. 1374-7.
15. Dalbeth N., Aati O., Kalluru R. et al. Relationship between structural joint damage and urate deposition in gout: a plain radiography and dual-energy CT study. Ann. Rheum. Dis. 2015. Vol. 74. P. 1030-6.
16. Muehleman C., Li J., Aigner T. et al. Association between crystals and cartilage degeneration in the ankle. J. Rheumatol. 2008. Vol. 35. P. 1108-17.
17. Felson D.T. Developments in the clinical understanding of osteoarthritis. Arthritis Res. Ther. 2009. Vol. 11. P. 203.
18. Головач И.Ю. Остеоартрит: фундаментальные и прикладные аспекты этиопатогенеза заболевания. Ничего не стоит на месте. Український ревматологічний журнал. 2014. № 2 (56). C. 4-11.
19. Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthritis Cartilage. 2013. Vol. 21. P. 16-21.
20. Ea H.K., Chobaz V., Nguyen C. et al. Pathogenic role of basic calcium phosphate crystals in destructive arthropathies. PLoS One. 2013. Vol. 8. P. 57352
21. Martinon F., Pétrilli V., Mayor A., Tardivel A., Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature. 2006. Vol. 440 (7081). P. 237-41.
22. Kuo C.F., Grainge M.J., Mallen C. et al.Comorbidities in patients with gout prior to and the following diagnosis: case-control study. Ann. Rheum. Dis. 2016. Vol. 75. P. 210-7.
23. Ding X., Zeng C., Wei J. et al. The associations of serum uric acid level and hyperuricemia with knee osteoarthritis. Rheumatol. Int. 2016. Vol. 36. P. 567-73.
24. Howard R.G., Samuels J., Gyftopoulos S. et al. Presence of gout is associated with increased prevalence and severity of knee osteoarthritis among older men:results of a pilot study. J. Clin. Rheumatol. 2015. Vol. 21. P. 63-71.
25. Teng G.G., Leung Y.Y., Ang L.W. et al. Gout and risk of knee replacement for severe knee osteoarthritis in the Singapore Chinese Health Study. Osteoarthritis Cartilage. 2017. Vol. 25. P. 1962-8.
26. Thiele R.G. Diagnosis of ultrasound gout. Schlesinger Rheumatology (Oxford). 2007. Vol. 46. P. 1116-21.
27. Roddy E. Gout and osteoarthritis: a pathogenetic link? Joint Bone Spine. 2012. Vol. 79. P. 425-7.
28. Pascual E., Addadi L., Andres M., Sivera F. Mechanisms of crystal formation in gout-a structural approach. Nat. Rev. Rheumatol. 2015. Vol. 11. P. 725-30.
29. Yokose C., Chen M., Berhanu A. et al. Gout and osteoarthritis: associations, pathophysiology, and therapeutic implications. Curr. Rheumatol. Rep. 2016. Vol. 18. P. 65.
30. Orlowsky E.W., Stabler T.V., Montell E. et al. Monosodium urate crystal-induced macrophage inflammation is attenuated by chondroitin sulphate: pre-clinical model for gout prophylaxis? BMC Musculoskelet Disord. 2014. Vol. 15. P. 318.
31. Ding X., Zeng C., Wei J. et al. Uric acid level and associations hyperuricemia with knee osteoarthritis. Rheumatol. Int. 2016. Vol. 36. P. 567-73.
32. Attur M., Al-Mussawir H.E., Patel J. et al. Prostaglandin E2 exerts catabolic effects in osteoarthritis cartilage: evidence for signaling via the EP4 receptor. J. Immunol. 2008. Vol. 181. P. 5082-8.
33. Verma P. ADAMTS-4 and ADAMTS-5: key enzymes in osteoarthritis. J. Cell. Biochem. 2011. Vol. 112. P. 3507-14.
34. Loeser R.F. Aging and osteoarthritis: the role of chondrocyte senescence and aging changes in the cartilage matrix. Osteoarthritis Cartilage. 2009. Vol. 17. P. 971-9.
35. Felson D.T., McLaughlin S., Goggins J. et al. Bone marrow edema and its relation to progression of knee osteoarthritis. Ann. Intern. Med. 2003. Vol. 139. P. 330-6.
36. Attur M., Statnikov A., Samuels J. et al. Plasma levels of interleukin-1 receptor antagonist (IL1Ra) predict radiographic progression of symptomatic knee osteoarthritis. Osteoarthritis Cartilage. 2015. Vol. 23. P. 1915-24.
37. Liu R., Liote F., Rose D.M. et al. Proline-rich tyrosine kinase 2 and Src kinase signaling transduce monosodium urate of crystal-induced nitric oxide production and matrix metalloproteinase 3 expression in chondrocytes. Arthritis rheum. 2004. Vol. 50. P. 247-58.
38. Pretzel D., Pohlers D., Weinert S., Kinne R.W. In vitromodel for the analysis of synovial fibroblastmediated degradation of intact cartilage. Arthritis Res. Ther. 2009. Vol. 11 (1). P. 25.
39. Siebuhr A.S., Bay-Jensen A.C., Jordan J.M. et al. Inflammation (or synovitis)-driven osteoarthritis: an opportunity for personalizing prognosis and treatment? Scand. J. Rheumatol. 2016. Vol. 45 (2). P. 87-98.
40. Denoble A.E., Huffman K.M., Stabler T.V. et al. Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation. Proc. Natl. Acad. Sci USA. 2011. Vol. 108 (5). P. 2088-93.
41. Goldring M.B. The role of the chondrocyte in osteoarthritis. Arthritis Rheum. 2000. Vol. 43 (9). P. 1916-26.
42. Hwang H.S., Yang C.M., Park S.J., Kim H.A. Monosodium urate crystal-induced chondrocyte death via autophagic process. Int. Jmol. Sci. 2015. Vol. 16 (12). P. 29265-77.
43. Chhana A., Callon K.E., Pool B. et al. The effects of monosodium urate monohydrate crystals on chondrocyte viability and function: implications for development of cartilage damage in gout. J. Rheumatol. 2013. Vol. 40 (12). P. 2067-74.
44. Charlier E., Relic B., Deroyer C. et al. Insights on the molecular mechanisms of chondrocytes death in osteoarthritis. Int. J. Mol. Sci. 2016. Vol. 17. P. 23-34.
45. Shi Y. Molecular identification of a signal the immune system to dying cells. 2003. Vol. 425. P. 516-21.
46. Lai J.H., Luo S.F., Hung L.F. et al. Physiological concentrations of soluble uric acid are chondroprotective and anti-inflammatory. Sci Rep. 2017. Vol. 7. P. 2359.
47. Neogi T., George J., Rekhraj S. et al. Are either or both hyperuricemia and xanthine oxidase directly toxic to the vasculature? A critical appraisal. Arthritis rheum. 2012. Vol. 64. P. 327-38.
48. Krasnokutsky S., Oshinsky C., Attur M. et al. Serum urate levels predict joint space narrowing in non-gout patients with medial knee osteoarthritis. Arthritis Rheumatol. 2017. Vol. 69. P. 1213-20.
49. Sun Y., Brenne H., Sauerland S. et al. Serum uric acid and patterns of radiographic osteoarthritis — the Ulm Osteoarthritis Study. Scand. J. Rheumatol. 2000. Vol. 29 (6). P. 380-6.
50. Gunther K.P., Puhl W., Brenner H., Stürmer T. Clinical epidemiology of hip and knee joint arthroses: an overview of the results of the BUlm Osteoarthrosis Study. Rheumatol. Z. 2002. Vol. 61 (3). P. 244-9.
51. Ma C.A. Exploring the Link between Uric Acid and Osteoarthritis. Leung Front Med. (Lausanne). 2017. Vol. 4. P. 225.
52. Wangkaew S., Kasitanon N., Hongsongkiat S. et al. A comparative study of serum and synovial fluid levels of uric acid between patients with gout and other arthritides. J. Med. Assoc. Thai. 2014. Vol. 97 (7). P. 679-85.
53. Slobodnick A., Shah B., Pillinger M.H., Krasnokutsky S. Colchicine: old and new. Am. J. Med. 2015. Vol. 128 (5). P. 461-70.
54. Das S.K., Mishra K., Ramakrishnan S. et al. A randomi-zed controlled trial to evaluate the slowacting symptom modifying effects of a regimen containing colchicine in a subset of patients with osteoarthritis of the knee. Osteoarthr. Cartil. 2002. Vol. 10 (4). P. 247-52.
55. Aran S. A double-blind randomized controlled trial appraising the symptom-modifying effects of colchicine on osteoarthritis of the knee. Seifirad. Clin. Exp. Rheumatol. 2011. Vol. 29 (3). P. 513-8.
56. Leung Y.Y., Thumboo J., Wong B.S. et al. Colchicine effectiveness in symptom and inflammation modification in knee osteoarthritis (COLKOA): study protocol for a randomized controlled trial. Trials. 2015. Vol. 16. P. 200.
57. Gasse P., Riteau N., Charron S. et al. Uric acid is a danger signal activating NALP3 inflammasome in lung injury inflammation and fibrosis. Am. J. Respir. Crit. Care Med. 2009. Vol. 179 (10). P. 903-13.
58. Aibibula Z., Ailixiding M., Iwata M. et al. Xanthine oxidoreductase activation is implicated in the onset of metabolic arthritis. Biochem. Biophys. Res. Commun. 2016. Vol. 472 (1). P. 26-32.

/8.jpg)
/10.jpg)
/12.jpg)