Журнал «Здоровье ребенка» Том 14, №4, 2019
Вернуться к номеру
Вплив саплементації вітаміну D3 на перебіг гострого обструктивного бронхіту в дітей раннього віку
Авторы: Больбот Ю.К., Годяцька К.К.
Державний заклад «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Гострий обструктивний бронхіт (ГОБ) посідає друге рангове місце серед захворювань органів дихання у дітей. Останніми роками результати клінічних досліджень вказують на кореляцію між низькою забезпеченістю організму вітаміном D (VD) та ризиком рекурентних респіраторних інфекцій у дорослих і дітей. При цьому вплив недостатності/дефіциту VD та своєчасної компенсації цих порушень на частоту й тяжкість бронхообструктивного синдрому (БОС) у дітей перших років життя залишається маловивченим. Мета дослідження: вивчення особливостей забезпеченості VD дітей раннього віку з рекурентним БОС та впливу дотації вітаміну D3 на частоту й тяжкість епізодів захворювання. Матеріали та методи. Обстежено 120 пацієнтів з ГОБ. I група — 60 пацієнтів з епізодичним БОС (до 3 епізодів на рік), II група — 60 дітей з рекурентним БОС (3 епізоди і більше на рік). Групу контролю становили 30 здорових дітей відповідного віку. Хворим проводили оцінку тяжкості БОС та визначення вмісту 25-гідроксивітаміну D (25(OH)D) в сироватці крові електрохемілюмінесцентним методом. Надалі група дітей з рекурентним БОС була розподілена на дві підгрупи: IIа підгрупа — 30 дітей, які щоденно отримували 1000 МО вітаміну D3 упродовж року, IIб підгрупа — 30 пацієнтів, яким не проводилась саплементація VD. Ефективність саплементації вітаміну D3 визначали за динамікою вмісту 25(OH)D в крові, частоти й тяжкості епізодів БОС. При статистичному аналізі даних використовували непараметричні методи. Для всіх видів аналізу критичне значення рівня значущості (p) приймалося < 0,05. Результати. Аналіз клінічних особливостей епізоду БОС показав, що в групі дітей з рекурентним БОС порівняно з пацієнтами з епізодичним БОС захворювання характеризувалось тяжчим перебігом (23,3 проти 10,0 % відповідно, р = 0,034). Встановлено, що середній показник забезпеченості VD у дітей з рекурентним БОС становив 13,68 (7,96; 19,51) нг/мл, а у дітей з епізодичним БОС — 33,0 (28,19; 41,97) нг/мл (p < 0,001). Показник саплементації VD в групі з рекурентним БОС був статистично значуще нижчим, ніж у дітей, які хворіли епізодично (5 проти 60 %, р < 0,001). Показано вірогідне зростання ризику виникнення тяжкого (відношення шансів (ВШ) 3,06; 95% довірчий інтервал (ДІ) 1,19–7,84; р = 0,019) та рекурентного БОС (ВШ 4,35; 95% ДІ 2,75–6,86; р < 0,001) за наявності рівня 25(OH)D в сироватці крові менше 20 нг/мл. Доведено вірогідний позитивний вплив річного курсу дотації вітаміну D3 на стан забезпеченості VD (25,11 (12,14; 42,47) нг/мл проти 14,48 (10,58; 23,47) нг/мл, р = 0,012) та середню частоту епізодів БОС (1,0 (0,0; 2,0) у IIа підгрупі проти 2,0 (1,0; 3,0) у IIб підгрупі, р < 0,001). На тлі прийому вітаміну D3 тяжкий перебіг БОС не реєструвався, на відміну від пацієнтів, які його не отримували (0 проти 20 % відповідно, р = 0,031). Висновки. При рекурентному БОС дефіцит VD має місце в 75 % дітей. Рівень 25(OH)D в сироватці крові нижче за 20 нг/мл асоціюється з підвищеним ризиком розвитку рекурентних і тяжких епізодів БОС. Саплементація вітаміну D3 у дозі 1000 МО/добу дозволяє підвищити вміст 25(OH)D в сироватці крові, зменшити частоту й тяжкість БОС.
Актуальность. Острый обструктивный бронхит (ООБ) занимает второе ранговое место среди заболеваний органов дыхания у детей. За последние годы результаты клинических исследований указывают на корреляцию между низкой обеспеченностью организма витамином D (VD) и риском рекуррентных респираторных инфекций у взрослых и детей. При этом влияниие недостаточности/дефицита VD и своевременной компенсации этих нарушений на частоту и тяжесть бронхообструктивного синдрома (БОС) у детей первых лет жизни остается малоизученным. Цель исследования: изучение особенностей обеспеченности VD детей раннего возраста с рекуррентным БОС и влияния дотации витамина D3 на частоту и тяжесть заболевания. Материалы и методы. Обследовано 120 пациентов с ООБ. I группа — 60 пациентов с эпизодическим БОС (до 3 эпизодов в год), II группа — 60 детей с рекуррентным БОС (3 эпизода и более в год). Группу контроля составляли 30 здоровых детей соответствующего возраста. Больным проводили оценку тяжести БОС и определение содержания 25-гидроксивитамина D (25(OH)D) в сыворотке крови электрохемилюминесцентным методом. В дальнейшем группа детей с рекуррентным БОС была разделена на две подгруппы: IIа подгруппа — 30 детей, которые ежедневно получали 1000 МЕ витамина D3 в течение года, IIб подгруппа — 30 пациентов, которым не проводилась саплементация VD. Эффективность саплементации витамина D3 определяли по динамике содержания 25(OH)D в крови, частоты и тяжести эпизодов БОС. При статистическом анализе данных использовали непараметрические методы. Для всех видов анализа критическое значение уровня значимости (p) принималось < 0,05. Результаты. Анализ клинических особенностей эпизода БОС показал, что в группе детей с рекуррентным БОС по сравнению с пациентами с эпизодическим БОС заболевание характеризовалось более тяжелым течением (23,3 против 10,0 % соответственно, р = 0,034). Установлено, что средний показатель обеспеченности VD у детей с рекуррентным БОС составлял 13,68 (7,96; 19,51) нг/мл, а у детей с эпизодическим БОС — 33,0 (28,19; 41,97) нг/мл (p < 0,001). Показатель саплементации VD в группе с рекуррентным БОС был статистически значимо ниже, чем у детей, которые болели эпизодически (5 против 60 %, р < 0,001). Показано наличие риска развития тяжелого (отношение шансов (ОШ) 3,06; 95% доверитедьный интервал (ДИ) 1,19–7,84; р = 0,019) и рекуррентного БОС (ОШ 4,35; 95% ДИ 2,75–6,86; р < 0,001) при наличии уровня 25(OH)D в сыворотке крови менее 20 нг/мл.
Доказан достоверный положительный эффект годового курса дотации витамина D3 на статус обеспеченности VD (25,11 (12,14; 42,47) нг/мл против 14,48 (10,58; 23,47) нг/мл, р = 0,012) и среднюю частоту эпизодов БОС (1,0 (0,0; 2,0) во IIа подгруппе против 2,0 (1,0; 3,0) во IIб подгруппе, р < 0,001). На фоне приема витамина D3 тяжелое течение БОС не регистрировалось, в отличие от пациентов, которые его не получали (0 против 20 % соответственно, р = 0,031). Выводы. При рекуррентном БОС дефицит VD имеет место в 75 % детей. Уровень 25(OH)D в сыворотке крови ниже 20 нг/мл ассоциируется с повышенным риском развития рекуррентных и тяжелых эпизодов БОС. Саплементация витамина D3 в дозе 1000 МЕ/сутки позволяет повысить содержание 25(OH)D в сыворотке крови, уменьшить частоту и тяжесть БОС.
Background. Acute obstructive bronchitis (AOB) ranks second among the respiratory diseases in children. In recent years, the results of clinical studies demonstrate a correlation between the low level of vitamin D (VD) and the risk of recurrent respiratory infections in adults and children. At the same time, the impact of VD insufficiency/deficiency and timely compensation of these changes on the frequency and severity of broncho-obstructive syndrome (BOS) in young children remains poorly understood. Thus, the purpose of the research was to study the features of VD level in young children with recurrent BOS and the efficacy of vitamin D3 supplementation on incidence and severity of the disease. Materials and methods. We examined 120 children with acute obstructive bronchitis. Group I included 60 patients with episodic BOS (up to 3 episodes per year), group II consisted of 60 children with recurrent BOS (3 or more episodes per year). The control group represented 30 healthy children of the corresponding age. We evaluated the severity of BOS and determined the serum level of 25-hydroxyvitamin D (25(OH)D) using an electrochemiluminescence method. Subsequently, the group of children with recurrent BOS was divided into two subgroups: IIa subgroup included 30 children who received vitamin D3 1000 IU daily throughout the year, IIb included 30 patients who were not supplemented with VD. The effectiveness of vitamin D3 supplementation was determined by the changes in the blood level of 25(OH)D, frequency and severity of BOS episodes. We used non-parametric methods for statistical analysis of data. For all types of analysis, the critical value of the significance level (p) was taken to be < 0.05. Results. The analysis of the clinical features of BOS episode showed that in the group of children with recurrent BOS compared to patients with episodic BOS the disease was characterized by a more severe course (23.3 % vs. 10.0 %, respectively; p = 0.034). We found that the mean VD level in children with recurrent BOS was 13.68 (7.96; 19.51) ng/ml and in children with episodic BOS 33.0 (28.19, 41.97) ng/ml (p < 0.001). The VD supplementation in the group with recurrent BOS was significantly lower than in children who were ill episodically (5 % vs. 60 %; p < 0.001). We showed that the risk of severe episode (OR = 3.06; 95% CI: 1.19–7.84; p = 0.019) and recurrent BOS (OR = 4.35; 95% CI: 2.75–6.86; p < 0.001) is higher in case of 25(OH)D level in serum less than 20 ng/ml. According to our data, VD supplementation in children for one year improves VD level (25.11 (12.14, 42.47) ng/ml vs. 14.48 (10.58, 23.47) ng/ml; p = 0.012) and reduces frequency of BOS episodes (1.0 (0.0; 2.0) in IIa subgroup vs. 2.0 (1.0; 3.0) in IIb subgroup; p < 0.001). On the background of vitamin D3 intake the severe course of BOS was not noticed, unlike the patients who did not receive it (0 % vs. 20 %, respectively; p = 0.031). Conclusions. VD deficiency occurs in 75 % of children with recurrent BOS. Moreover, the serum level of 25(OH)D below 20 ng/ml is associated with an increased risk of recurrent and severe episodes of BOS. Thus, supplementation with vitamin D3 1000 IU per day helps to increase the content of 25(OH)D in serum, to reduce the frequency and severity of BOS.
діти раннього віку; бронхообструктивний синдром; вітамін D; саплементація
дети раннего возраста; бронхообструктивный синдром; витамин D; саплементация
young children; bronchoobstructive syndrome; vitamin D; supplementation
Вступ
Проблема гострих захворювань органів дихання, зокрема гострого обструктивного бронхіту (ГОБ), залишається актуальною у педіатричній практиці в зв’язку зі значною поширеністю та медико-соціальною значущістю. Особливий інтерес фахівців до цієї проблеми обумовлений високою частотою формування рекурентного перебігу обструктивного бронхіту в ранньому дитячому віці. ГОБ вважається таким, що має рекурентний перебіг за наявності 3 або більше задокументованих окремих епізодів бронхообструктивного синдрому (БОС) на рік, які частіше спричинені вірусною інфекцією, за відсутності симптомів в інтеркурентному періоді [1]. У сучасній науковій літературі для визначення рекурентного обструктивного бронхіту також використовується поняття «синдром рецидивного свистячого дихання» [2].
За результатами попередніх досліджень відомо, що розвитку повторних епізодів БОС сприяють такі фактори, як обтяжений сімейний або індивідуальний алергологічний анамнез [3, 4], несприятливий перебіг анте- і перинатального періодів [5], рекурентні респіраторні інфекції [6], пасивне тютюнопаління [7]. На практиці зазначені фактори присутні не у всіх пацієнтів, що актуалізує пошук нових прогностично значущих чинників, які сприяють формуванню рекурентного БОС на тлі вірусної інфекції серед дітей раннього віку.
У сучасній літературі широко обговорюється роль вітаміну D (VD), а також значення його дефіциту в формуванні схильності дорослих та дітей до частих респіраторних захворювань [8, 9]. Встановлення нещодавно факту активної участі VD в регуляції системи протиінфекційного імунітету та в забезпеченні ним функціонального балансу між Т-лімфоцитами-хелперами (Th) 1-го типу і Th 2-го типу [10]; можливості розвитку дисбалансу Th1/Th2 імунної відповіді в бік останніх за умов дефіциту VD, а також наявності підвищеної продукції протизапальних Th2-асоційованих цитокінів [11] певною мірою може бути основою для розвитку БОС. Підтвердженням значущості VD в імунній регуляції є результати численних експериментальних і клінічних досліджень, що демонструють зв’язок між низькими рівнями транспортної форми VD — 25-гідроксивітаміну D (25(OH)D) в крові та підвищеною сприйнятливістю до різних інфекцій (вірусної, бактеріальної, грибкової етіології), а також до розвитку автоімунної й алергічної патології [12, 13]. Крім того, показано, що активність інфекційного процесу та кількість ускладнень негативно корелюють з рівнем VD в крові [14]. На сьогодні переконливо доведено, що підтримання значень 25(OH)D в сироватці крові в діапазоні 30–100 нг/мл дозволяє запобігати позаскелетним проявам дефіциту VD, зокрема зниження резистентності до інфекцій та розвиток бронхолегеневих захворювань [13].
Проведені сучасні наукові дослідження забезпеченості організму здорових дітей VD свідчать, що в нашій країні тільки у 9,4 % дітей від народження до 17 років спостерігається бажаний стан забезпеченості VD, водночас низький рівень забезпеченості VD у дітей віком від 1 місяця до 3 років реєструється у 78,6 % [15], а в дошкільному й шкільному віці цей показник взагалі досягає 90 %, що повністю збігається й з результатами закордонних вчених [16]. Основними факторами ризику формування гіповітамінозу D у дітей є зниження його синтезу в шкірі, обмеження в раціоні продуктів харчування, що містять VD, наявність супутньої патології, що впливає на метаболізм або всмоктування вітаміну. У сучасному світі суттєво зменшився прямий вплив сонячних променів завдяки як широкому застосуванню дитячих сонцезахисних кремів, так і проведенню більшої частини часу в приміщенні. Вважається, що запаси VD у дорослих визначаються продуктами харчування лише на 10–20 %, водночас у дітей цей показник може бути ще меншим [17]. В цьому аспекті одним із методів профілактики дефіциту VD серед населення в багатьох розвинутих країнах використовується збагачення (фортифікація) харчових продуктів VD. Найчастіше фортифікують молочні продукти (молоко, сир, йогурт), апельсиновий сік, хліб, маргарин, готові сніданки зі злакових [18]. Проте для України тема фортифікації досить нова і поки не має ні широкого застосування, ні системної підтримки на державному рівні.
З наведеного вище випливає, що найбільш оптимальним підходом до профілактики та корекції низької забезпеченості VD є адекватна саплементація раціону вітаміном у формі фармацевтичних препаратів (масляні, водні розчини, таблетовані форми). На сьогодні перевага надається препаратам вітаміну D3 (холекальциферол) з огляду на те, що він має більш тривалий період напіввиведення й ефективніше підвищує та підтримує вміст 25(ОН)D в сироватці крові, ніж вітамін D2 [14]. Питання щодо переважного застосування тієї чи іншої форми досі обговорюється. Водний розчин VD використовувавcя в педіатричній практиці в останні десятиліття досить широко через добре всмоктування у травному тракті, менше напруження ферментних систем кишечника при всмоктуванні, більш тривалий ефект порівняно з масляною формою (зберігається до 3 міс.), швидке настання клінічного ефекту (через 5–7 днів після початку застосування). Проте деякі науковці наголошують на призначенні масляних розчинів холекальциферолу дітям [19].
Профілактична доза VD для дітей раннього віку має становити 1000 МО на добу, що достатньо для досягнення концентрації 25(ОН)D в сироватці крові понад 30 нг/мл [20]. Для компенсації вже встановленого гіповітамінозу D використовують препарати VD у лікувальних дозах, що, за різними даними, коливаються від 1000 до 10 000 МО/добу залежно від віку пацієнта та маси тіла [14].
З огляду на доведений вплив VD на процеси запалення та протиінфекційний імунітет [21] перспективним є вивчення терапевтичних можливостей VD при вірусних захворюваннях дихальних шляхів у дітей. Отримані впродовж останніх років результати досліджень доводять те, що VD має певне значення в патогенезі різних клінічних форм гострих респіраторних захворювань, а призначення його препаратів має сприятливий ефект на їх перебіг у дітей і дорослих [13, 22]. Водночас вплив препаратів вітаміну D3 на частоту й тяжкість перебігу ГОБ у дітей раннього віку досі залишається маловивченим.
Метою нашого дослідження стало вивчення особливостей забезпеченості VD дітей раннього віку з рекурентним БОС та впливу дотації вітаміну D3 на частоту й тяжкість епізодів захворювання.
Матеріали та методи
Дослідження проводилось на базі інфекційного відділення для дітей раннього віку КЗ «Дніпровська міська дитяча клінічна лікарня № 6» ДМР з січня 2016 по квітень 2018 р., яке за своїм видом було «випадок — контроль», проспективним, відкритим. Проведення наукової роботи дозволено комісією з питань біомедичної етики Державного закладу «Дніпропетровська медична академія Міністерства охорони здоров’я України» та КЗ «Дніпровська МДКЛ № 6» ДМР.
Критерії включення дітей у дослідження: верифікований діагноз ГОБ; вік дитини від 6 місяців до 3 років; письмова інформована згода батьків (законних представників) дитини на участь у дослідженні. I групу дослідження становили 60 дітей з епізодичним БОС (менше 3 епізодів протягом року), II групу — 60 дітей з рекурентним БОС (3 епізоди і більше на рік). Верифікацію діагнозу ГОБ проводили на підставі наказу МОЗ України від 13.01.2005 р. № 18 «Про затвердження протоколів надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія» та клінічних рекомендацій Американської академії педіатрії «Бронхіоліт: діагностика, ведення пацієнта й профілактика» (2014 р.) [23]. З дослідження виключалися пацієнти з хронічними захворюваннями бронхолегеневої системи та лор-органів, первинними та вторинними імунодефіцитними станами, гастроезофагеальною рефлюкс–ною хворобою, синдромом мальабсорбції, хронічною нирковою недостатністю, діти, які народилися недоношеними та/або із затримкою внутрішньоутробного розвитку та приймали системні глюкокортикостероїди або антиконвульсанти в анамнезі.
Групи дослідження за віком та статтю вірогідно не відрізнялись між собою. Медіана віку пацієнтів I групи становила 17,5 (13,0; 22,0) місяця, II групи — 20,0 (15,0; 26,5) місяця (р > 0,05 за U-критерієм Манна — Уїтні).
Усім дітям на другу-третю добу від початку захворювання визначали ступінь тяжкості БОС за сукупністю клінічних симптомів згідно з 12-бальною шкалою (Respiratory Score, 2014) [23]: частота дихання; ретракція піддатливих місць грудної клітки; диспное; свистяче дихання при аускультації. Ступінь тяжкості БОС оцінювалась як легка при сумі в 1–3 бали, середньотяжка — 4–7 балів, тяжка — 8–12 балів.
Статус VD в обстежених дітей оцінювали за показником 25(ОН)D в сироватці крові, визначення якого проводили електрохемілюмінесцентним методом двічі: на 2-шу або 3-тю добу захворювання та через 12 місяців застосування препарату вітаміну D3 в зимово-весняний період року. Відповідно до рекомендацій з лікування та профілактики дефіциту вітаміну D для населення країн Центральної Європи (2013) оптимальним рівнем забезпеченості VD вважали показник 25(OH)D в сироватці крові 30 нг/мл і більше, недостатність VD — 20–29 нг/мл
та дефіцит — нижче за 20 нг/мл [24].
На другому етапі дослідження пацієнти з рекурентним БОС були розділені методом пар-копій на 2 рівні підгрупи, які були порівнянні за віком, статтю, частотою й тяжкістю БОС, вихідними показниками 25(OH)D
в сироватці крові. IIа підгрупу становили 30 пацієнтів, які отримували 1000 МО/добу вітаміну D3 протягом року згідно з методичними рекомендаціями з лікування та профілактики дефіциту вітаміну D для населення країн Центральної Європи (2013) [24], IIб підгрупу — 30 дітей, які не отримували дотацію VD. Здебільшого пацієнти приймали міцельовані (водорозчинні) розчини вітаміну D3. Ефективність саплементації оцінювали на підставі динаміки вмісту 25(OH)D в крові, частоти й тяжкості епізодів БОС.
Показники рівня забезпеченості VD (25(OH)D в сироватці крові) оцінювались порівняно з референтними значеннями, що отримано при дослідженні 30 практично здорових дітей, які були репрезентативні основній групі за віком та статтю.
Статистична обробка результатів дослідження проводилась за допомогою програмного забезпечення Statistica 6.1 (серійний номер AGAR909 E415822FA) та Microsoft Excel 2010 (Microsoft Office 2016 Professional Plus, Open License 67528927). Застосовували непараметричні методи статистики з огляду на те, що в нашому дослідженні переважна більшість кількісних даних характеризувалась типом розподілу, що відрізняється від нормального. Для визначення зв’язку між якісними показниками використовували відношення шансів (ВШ) з 95% довірчим інтервалом (ДІ) і p-значенням. Для всіх видів аналізу критичне значення рівня значущості (p) приймалося < 0,05.
Результати
Згідно з отриманими даними, в обох групах дослідження переважав середньотяжкий перебіг БОС, який відзначався у 30 (50 %) пацієнтів I групи та у 39 (65 %) пацієнтів II групи (c2 = 2,76, р = 0,097). Водночас тяжкий перебіг БОС вдвічі частіше реєструвався серед дітей II групи порівняно з I групою (23,3 і 10,0 % відповідно, c2 = 4,50, р = 0,034).
Проведене дослідження забезпеченості VD показало, що у пацієнтів I групи рівень 25(OH)D в сироватці крові коливався від 15,12 до 59,65 нг/мл та в II групі — від 4,72 до 31,21 нг/мл. Середні показники рівня концентрацій 25(OH)D в сироватці крові в обстежених дітей наведені в табл. 1.
Аналіз частотного розподілу показників забезпеченості VD виявив, що серед дітей з рекурентним перебігом БОС переважали пацієнти з дефіцитом VD (75 %), водночас в групі з епізодичним БОС — діти, які мали достатній рівень 25(ОН)D в крові (66,7 %), що вірогідно не відрізнявся від показника забезпеченості дітей в групі контролю (c2 = 0,102, р = 0,750). Недостатність 25(OH)D
в сироватці крові реєструвалася у 26,7 % пацієнтів I групи та у 23,3 % дітей в II групі (c2 = 0,18, р = 0,673).
За нашими даними, саплементацію VD на момент дослідження в рекомендованій дозі не менше
500 МО/добу отримували 5 % пацієнтів з рекурентним БОС та 60 % дітей з епізодичним БОС (c2 = 38,89, р < 0,001).
При вивченні взаємозв’язків між вмістом 25(OH)D
в сироватці крові та клінічними параметрами ГОБ встановлено, що за наявності у дитини сироваткової концентрації 25(ОН)D нижче за 20 нг/мл вірогідно підвищувався ризик розвитку рекурентних епізодів БОС (ВШ 4,35; 95% ДІ 2,75–6,86; р < 0,001) та тяжчого їх перебігу (ВШ 3,06; 95% ДІ 1,19–7,84; р = 0,019).
З огляду на те, що більшість дітей з рекурентним БОС мали недостатність/дефіцит VD, доцільним було призначення препаратів вітаміну D3 з метою компенсації виявлених порушень.
Дослідження змін статусу VD продемонструвало вірогідне зростання середньої концентрації 25(OH)D в крові після застосування вітаміну D3 порівняно з його рівнем, визначеним на початку дослідження (табл. 2).
При індивідуальному зіставленні сироваткового рівня 25(OH)D в динаміці встановлено, що після застосування холекальциферолу серед 22 пацієнтів зі встановленим дефіцитом VD на початку дослідження у 11 пацієнтів (50 %) показники 25(OH)D в сироватці крові підвищились до недостатнього рівня, у 3 пацієнтів (13,6 %) — до оптимального рівня та у 8 пацієнтів (36,4 %) рівень забезпеченості VD залишався в межах дефіциту. Серед 7 пацієнтів, які на початку дослідження мали недостатній рівень 25(OH)D в сироватці крові, у 6 дітей (85,7 %) відзначалась оптимальна забезпеченість VD та лише в 1 пацієнта (14,3 %) статус VD був незмінним після прийому вітаміну D3.
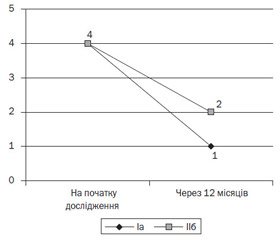
Катамнестичне спостереження показало, що у дітей з рекурентним перебігом захворювання на тлі прийому вітаміну D3 відмічалось статистично значуще зменшення середньої частоти епізодів БОС на рік порівняно з підгрупою дітей, які його не отримували (1,0 (0,0; 2,0) в IIа підгрупі проти 2,0 (1,0; 3,0) в IIб підгрупі, р < 0,001 за Т-критерієм Вілкоксона) (рис. 1).
Нами також встановлено, що кількість пацієнтів з легким перебігом БОС в IIа підгрупі вірогідно перевищувала таку в IIб підгрупі (60 проти 33,3 % відповідно, c2 = 4,28, р = 0,038). Тяжкий перебіг БОС серед дітей, які приймали вітамін D3, не реєструвався, на відміну від пацієнтів, які його не отримували (0 проти 20 % відповідно, c2 = 4,63, р = 0,031). Середньотяжкий перебіг захворювання реєструвався приблизно з однаковою частотою в обох підгрупах дослідження (40 % в IIа підгрупі проти 46,7 % в IIб підгрупі, c2 = 0,271, р = 0,602).
Обговорення
Результати проведеного дослідження показали, що дефіцит VD є вагомим фактором ризику розвитку рекурентного й тяжкого перебігу ГОБ у дітей в ранньому віці. Значущість цього чинника в формуванні схильності дітей перших років життя до повторних епізодів БОС на тлі вірусної інфекції також підкреслює A. Bener зі співавт. (2014) [25].
Встановлено, що 98,3 % дітей з рекурентним БОС мали низьку забезпеченість VD, із них у 75 % пацієнтів реєструвався дефіцит VD, що збігається з результатами подібного дослідження [26]. Проте дані щодо статусу VD у дітей раннього віку з рекурентним БОС є поодинокими та неоднозначними, що створює підґрунтя для проведення подальших наукових досліджень в цьому напрямку. За нашими спостереженнями, високу питому вагу дефіциту VD в обстежених дітей можна пояснити дуже низьким показником саплементації VD. У нещодавній роботі M.P. Brito та співавт. (2019) також показано, що більшість дітей перших років життя з рекурентним БОС не отримують дотацію VD [27]. Така тенденція, ймовірно, зумовлена недостатньою інформованістю батьків у питаннях гіповітамінозу D, що, у свою чергу, призводить до нерозуміння ними необхідності VD після року, адже його застосування традиційно пов’язують тільки з профілактикою рахіту. Неможливо заперечити й те, що часті або тяжкі епізоди БОС можуть обмежувати прийом препаратів VD на період проведення лікування.
Останніми роками продовжується активне вивчення ефективності дотації VD для профілактики захворювань верхніх і нижніх дихальних шляхів [28, 29]. Аналіз результатів дослідження показав, що у дітей з рекурентним БОС, які щоденно отримували 1000 МО вітаміну D3 протягом року, спостерігалось двократне підвищення середнього вмісту 25(OH)D в сироватці крові, що, однак, не досягав цільових значень (30–50 нг/мл). Привертає увагу те, що після проведеної корекції статусу VD рівень 25(OH)D в крові нормалізувався у більшої частини дітей з початковою недостатньою забезпеченістю. При цьому у дітей з вихідним дефіцитом на тлі саплементації вітаміну D3 хоч і спостерігались позитивні зрушення в статусі VD, але сироватковий рівень 25(OH)D здебільшого не підвищився до референтних значень. Ймовірно, це пов’язано з тим, що за наявності дефіциту VD 12 місяців застосування холекальциферолу не є достатнім для нормалізації D-вітамінної забезпеченості, а тим більше підтримання стабільного рівня 25(ОН)D в сироватці крові. Можливо, існує й необхідність у застосуванні дози, більшої ніж 1000 МО/добу, при рівні 25(ОН)D в крові менше за 20 нг/мл у дітей з рекурентним БОС. На сьогодні є дані, що рівень 25(ОН)D сироватки крові тісно корелює з дозою препаратів VD [30]. Водночас наявні клінічні дослідження щодо оцінки ефективності терапевтичних ефектів VD на розвиток та частоту ГРВІ є досі неоднозначними. У проведених дослідженнях діапазон дозування VD був широким, а тому оптимальна доза досі невизначена [31, 32].
За нашими даними, позитивний ефект застосування вітаміну D3 проявлявся не тільки в зменшенні частоти ГОБ, але й зниженні тяжкості наступних епізодів БОС. Доступні на сьогодні наукові роботи, в яких досліджували призначення препаратів вітаміну D3 для запобігання розвитку БОС, є вкрай нечисленними. Так, A. Hibbs зі співавт. (2018) показали, що щоденне споживання 400 МО VD дітьми грудного віку може знижувати ризик рекурентного БОС на першому році життя, при цьому підкреслена необхідність подальших досліджень для встановлення довгострокових ефектів дотації холекальциферолу на перебіг БОС в ранньому віці [33]. Проте в роботах деяких дослідників позитивний вплив дотації VD на частоту випадків інфекцій нижніх дихальних шляхів у дітей віком до п’яти років не виявлено [34].
Таким чином, результати проведеного дослідження вносять певний вклад у розуміння клінічного значення забезпеченості VD та актуалізують проблему профілактики його недостатності й дефіциту в дітей перших трьох років життя, у тому числі для попередження розвитку рекурентного та тяжкого перебігу ГОБ.
Висновки
1. Значущим фактором, що сприяє розвитку рекурентного та тяжкого бронхообструктивного синдрому в ранньому дитячому віці виступає дефіцит вітаміну D.
2. Застосування 1000 МО вітаміну D3 на добу протягом року підвищує забезпеченість вітаміном D дітей раннього віку з рекурентним обструктивним бронхітом, що клінічно проявляється зниженням частоти його епізодів та зменшенням частки пацієнтів з тяжким перебігом бронхообструктивного синдрому.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про внесок кожного автора: Больбот Ю.К. — дизайн дослідження; Годяцька К.К. — збір та обробка матеріалів, написання тексту.
1. Prevalence, severity, and treatment of recurrent wheezing during the first year of life: a cross-sectional study of 12,405 Latin American infants. J. Mallol, D. Solé, L. Garcia-Marcos [et al.]. Allergy Asthma Immunol. 2016. Vol. 8, № 1. Р. 22-31. doi: 10.4168/aair.2016.8.1.22.
2. Логвінова О.Л. Синдром рецидивного візингу дошкільного віку (update 2017). Современная педиатрия. 2018. Т. 89, № 1. С. 124-128. doi: 10.15574/SP.2018.89.124.
3. Chung Wai Ng M. Recurrent wheeze and cough in young children: is it asthma? Singapore Med. J. 2014. Vol. 55, № 5. Р. 236-241.
4. Prevalence and risk factors associated with wheezing in the first year of life. Olivia A.A. Costa Bessa, Álvaro J. Madeiro Leite, D. Solé [et al.]. Jornal de Pediatria. 2014. Vol. 90, № 2. Р. 190-196. doi: 10.1016/j.jped.2013.08.007.
5. Social inequalities in wheezing in children: findings from the UK Millennium Cohort Study. D.C. Taylor-Robinson, A. Pearce, M. Whitehead [et al.]. Eur. Respir. J. 2016. Vol. 47, № 3. Р. 818-828. doi: 10.1183/13993003.01117-2015.
6. Абатуров О.Є. Прогнозування індивідуального ризику розвитку бронхіальної обструкції при гострих бронхітах у дітей раннього віку. Здоровье ребенка. 2015. Т. 60, № 1. С. 55-60. Режим доступу: http://nbuv.gov.ua/UJRN/Zd_2015_1_11.
7. Prenatal and passive smoke exposure and incidence of asthma and wheeze: Systematic review and meta-analysis. H. Burke, J. Leonardi-Bee, A. Hashim [et al.]. Pediatrics. 2012. Vol. 129, № 4. Р. 735-744. doi: 10.1542/peds.2011-2196.
8. Del Fiol F.S. Vitamin D and respiratory infections. J. Infect. Dev. Ctries. 2015. Vol. 9, № 4. Р. 355-361. doi: 10.3855/jidc.5711.
9. Esposito S. Vitamin D and respiratory tract infections in childhood. BMC Infectious Diseases. 2015. Vol. 15. P. 487. doi: 10.1186/s12879-015-1196-1.
10. Vitamin D and 1,25(OH)2D Regulation of T cells. M.T. Cantorna, L. Snyder, Y.-D. Lin [et al.]. Nutrients. 2015. Vol. 7, № 4. Р. 3011-3021. doi: 10.3390/nu7043011.
11. Impact of vitamin D on immune function: lessons learned from genome-wide analysis. R.F. Chun, P.T. Liu, R.L. Modlin [et al.]. Front Physiol. 2014. Vol. 5. Р. 151. doi: 10.3389/fphys.2014.00151.
12. Vitamin D and respiratory tract infections: A systematic review and meta-analysis of randomized controlled trials. P. Bergman, Åsa U. Lindh, L. Björkhem-Bergman [et al.]. Plos One. 2013. Vol. 8, № 6. Р. 1-9. doi: 10.1371/journal.pone.0065835.
13. Vitamin D and airway infections: A European perspective. A. Zittermann, S. Pilz, H. Hoffmann [et al.]. European Journal of Medical Research. 2016. Vol. 21, № 4. Р. 2-10. doi: 10.1186/s40001-016-0208-y.
14. Дефіцит та недостатність вітаміну D: епідемологія, діагностика, профілактика та лікування. За ред. В.В. Поворознюка, П. Плудовські. Донецьк: Видавець Заславський О.Ю., 2014. 262 с.
15. Квашніна Л.В. D-вітамінна забезпеченість організму в різні вікові періоди дитинства. Актуальні проблеми педіатрії: матеріали XI Конгресу педіатрів України (м. Київ, 7–9 жовтня 2015 р.). Международный журнал педиатрии, акушерства и гинекологии. 2015. Т. 8, № 1. С. 40-41.
16. Discrepancy between the recommended and functional cut offs of vitamin D among under-five children: experiences from a pilot study. S. Surve, S. Begum, S. Chauhan [et al.]. Indian. J. Endocrinol. Metab. 2018. Vol. 22, № 4. P. 473-478. doi: 10.4103/ijem.IJEM_574_17.
17. Holick Michael F. Vitamin D: A D-Lightful Vitamin for Health. Endocrinol. Metab. 2012. Vol. 27, № 4. Р. 255-267. doi: 10.1177/0148607111430189.
18. Роль фортифікованих продуктів у корекції вітамін-D-дефіцитних станів (огляд літератури та результати перших досліджень). В.В. Поворознюк, Н.І. Балацька, В.Ф. Доценко [та ін.]. Боль. Суставы. Позвоночник. 2014. Т. 15, № 3. С. 24-31.
19. Павлишин Г.А. Вітамін D-статус у патогенезі розвитку захворювань дітей. Актуальні питання педіатрії, акушерства та гінекології. 2018. № 1. С. 25-31. doi: 10.11603/24116-4944.2018.1.8800.
20. Майданник В.Г. Современные подходы к профилактике и лечению витамин D-дефицитного рахита с позиции доказательной медицины. Международный журнал педиатрии, акушерства и гинекологии. 2015. Т. 8, № 1. С. 133-143.
21. Bivona G. Vitamin D and immunomodulation: is it time to change the reference values? Ann. Clin. Lab. Sci. 2017. Vol. 47, № 4. P. 508-510.
22. Vitamin D for prevention of respiratory tract infections: A systematic review and meta-analysis. J. Charan, J.P. Goyal, D. Saxena [et al.]. J. Pharmacol. Pharmacother. 2012. Vol. 3, № 4. Р. 300-303. doi: 10.4103/0976-500X.103685.
23. Clinical Practice Guideline: The Diagnosis, Management, and Prevention of Bronchiolitis. Shawn L. Ralston, Allan S. Lieberthal, H. Cody Meissner [et al.]. Pediatrics. 2014. Vol. 134, № 5. Р. 1474-1502. doi: 10.1542/peds.2014-2742.
24. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe — recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. P. Pludovski, E. Karczmarewicz, M. Bayer [et al.]. Endokrynologia Polska. 2013. Vol. 64, № 4. P. 319-327. doi: 10.5603/EP.2013.0012.
25. The impact of vitamin D deficiency on asthma, allergic rhinitis and wheezing in children: An emerging public health problem. A. Bener, M.S. Ehlayel, Z. Bener [et al.]. J. Family Community Med. 2014. Vol. 21, № 3. Р. 154-161. doi: 10.4103/2230-8229.142967.
26. Prasad S. A Hospital Based Study to Establish the Correlation between Recurrent Wheeze and Vitamin D Deficiency Among Children of Age Group Less than 3 Years in Indian Scenario. J. Clin. Diagn. Res. 2016. Vol. 10, № 2. Р. 18-21. doi: 10.7860/JCDR/2016/17318.7287.
27. Prevalence of vitamin D deficiency and its relationship with factors associated with recurrent wheezing. M.B. Peçanha, R.B. Freitas, T.R. Moreira [et al.]. J. Bras. Pneumol. 2019. Т. 45, № 1. Р. e20170431. doi: 10.1590/1806-3713/e20170431.
28. The impact of vitamin D supplementation in paediatric primary care on recurrent respiratory infections: A randomized controlled trial. A. Di Mauro, M.E. Baldassarre, M. Capozza [et al.]. EuroMediterranean Biomedical Journal. 2018. Vol. 13, № 44. Р. 194-199. doi: 10.3269/1970-5492.2018.13.44.
29. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. A.R. Martineau, D.A. Jolliffe, R.L. Hooper [et al.]. BMJ. 2017. Р. 356-369. doi: 10.1136/bmj.i6583.
30. Why vitamin D clinical trials should be based on 25-hydroxyvitamin D concentrations. W.B. Grant, B.J. Boucher, H.P. Bhattoa [et al.]. J. Steroid Biochem. Mol. Biol. 2018. Vol. 177. P. 266-269. doi: 10.1016/j.jsbmb.2017.08.009.
31. Effect of high-dose vs standard-dose wintertime vitamin D supplementation on viral upper respiratory tract infections in young healthy children. M. Aglipay, C.S. Birken, P.C. Parkin [et al.]. JAMA. 2017. Vol. 318, № 3. Р. 245-254. doi: 10.1001/jama.2017.8708.
32. Effect of higher vs standard dosage of vitamin D3 supplementation on bone strength and infection in healthy infants. J. Rosendah, S. Valkama, E. Holmlund-Suila [et al.]. JAMA Pediatrics. 2018. Vol. 172, № 7. Р. 646-654. doi: 10.1001/jamapediatrics.2018.0602.
33. Effect of vitamin D supplementation on recurrent wheezing in black infants who were born preterm: The D-wheeze randomized clinical trial. А. Hibbs, K. Ross, L. Kerns [et al.]. JAMA. 2018. Vol. 319, № 20. P. 2086-2094. doi: 10.1001/jama.2018.5729.
34. Vitamin D supplementation for preventing infections in children under five years of age. M.Y. Yakoob, R.A. Salam, F.R. Khan [et al.]. Cochrane Database of Systematic Reviews. 2016. № 11. doi: 10.1002/14651858.CD008824.pub2.

/40-1.jpg)
/40-2.jpg)