Журнал «Почки» Том 8, №3, 2019
Вернуться к номеру
Хронічна хвороба нирок і анемія: застосування хелату бісгліцинату заліза для корекції залізодефіциту в пацієнтів із хронічною хворобою нирок
Авторы: Іванов Д.Д.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Анемія, маючи еритропоетин- і залізодефіцитний характер, є складовою хронічної хвороби нирок. Настанови KDIGO 2012 визначають анемію як концентрацію гемоглобіну < 120 г/л у жінок і < 130 г/л у чоловіків. Дефіцит заліза зустрічається в понад 50 % пацієнтів із недіаліззалежною хронічною хворобою нирок і в більшої частини пацієнтів, які отримують діаліз. Для діагностики залізодефіциту використовують визначення сироваткового рівня феритину й насичення трансферином. Зниження будь-якого із цих показників є підставою для корекції рівня гемоглобіну сполуками заліза. Дефіцит заліза збільшується за наявності запалення, потреба у ньому зростає при лікуванні еритропоетином. Серед пероральних молекул кращий профіль для всмоктування мають двовалентні солі заліза або ті, що не гідролізуються, мають високу біодоступність і добре корегують дефіцит заліза. У статті розглянутий Текнофер як приклад сполуки, що має певні переваги в корекції залізодефіциту при анемії в пацієнтів із хронічною хворобою нирок.
Анемия, имеющая эритропоэтин- и железодефицитный характер, является составляющей хронической болезни почек. Рекомендации KDIGO 2012 определяют анемию как концентрацию гемоглобина < 120 г/л у женщин и < 130 г/л у мужчин. Дефицит железа встречается у более 50 % пациентов с недиализзависимой хронической болезнью почек и у большей части пациентов, получающих диализ. Для диагностики железодефицита используют определение сывороточного уровня ферритина и насыщения трансферрином. Снижение любого из этих показателей является основанием для коррекции гемоглобина соединениями железа. Дефицит железа увеличивается при имеющемся воспалении, потребность в нем возрастает при лечении эритропоэтином. Среди пероральных молекул лучший профиль для всасывания имеют двухвалентные соли железа или те, которые не гидролизуются, имеют высокую биодоступность и хорошо корригируют дефицит железа. В статье рассмотрен Текнофер в качестве примера соединения, имеющего определенные преимущества в коррекции железодефицита при анемии у пациентов с хронической болезнью почек.
Anemia is a component of chronic kidney disease, having erythropoietin- and iron deficiency nature. 2012 KDIGO guidelines determine anemia as a hemoglobin concentration < 120 g/l in women and < 130 g/l in men. An iron deficiency occurs in more than 50 % of patients with non-dialysis-dependent chronic kidney disease and in the majority of patients receiving dialysis. For the diagnosis of iron deficiency, the value of serum ferritin level and transferrin saturation are used. Reduction of any of these indicators is the basis for hemoglobin correction by iron compounds. Iron deficiency increases with existing inflammation, its need increases with erythropoietin treatment. Among oral molecules, bivalent iron salts or those that are not hydrolyzed have the best absorption profile, high bioavailability and well regulate iron deficiency. The article considers Tecnofer as an example of compounds with certain advantages for the iron deficiency correction in anemia in patients with chronic kidney disease.
анемія; хронічна хвороба нирок; залізодефіцит; Текнофер
анемия; хроническая болезнь почек; железодефицит; Текнофер
anemia; chronic kidney disease; iron deficiency; Tecnofer
Вступ
Всесвітня організація охорони здоров’я та настанови KDIGO 2012 визначають анемію як концентрацію гемоглобіну < 120 г/л у жінок і < 130 г/л у чоловіків [1]. Організм розпізнає гіпоксію через систему a,b-HIF білків, число яких збільшується при анемії. Нефролог повинен втручатись у процес лікування анемії при рівні гемоглобіну менше від 120 г/л.
При хронічній хворобі нирок (ХХН) анемія насамперед зумовлена дефіцитом еритропоетину, якій не рекомендовано визначати в крові рутинно через низьку інформативність, і дефіцитом заліза, який зустрічається в понад 50 % пацієнтів із недіаліззалежною ХХН і більшої частини пацієнтів, які отримують діаліз [2].
Для діагностики залізодефіциту використовують такі показники:
— сироватковий рівень феритину;
— сироваткове насичення трансферином (TSAT).
Залізодефіцитна анемія діагностується при TSAT, меншому за 20 %, або рівні феритину нижче від 100 мкг/л, або кількості гіпохромних еритроцитів (% HRC) > 6 %, або вмісті гемоглобіну в еритроцитах (CHR) < 29 пг (миттєва оцінка статусу заліза).
Отже, корекція залізодефіциту починається, якщо будь-який із цих показників є нижчим від указаних значень, а терапія еритропоетином — лише при скорегованому дефіциті заліза при рівні гемоглобіну менше від 100 г/л (у пацієнтів, які отримують діаліз, — менше від 90 г/л).
Крім абсолютного дефіциту заліза слід пам’ятати ще про два фактори, що обумовлюють його функціональний дефіцит. По-перше, наявність запалення збільшує концентрацію білка гепсидину, що блокує залізо, доступне для еритропоезу, тому може хибно збільшуватись рівень феритину. По-друге, при призначенні лікування еритропоетином виникає підвищена потреба в залізі для синтезу гемоглобіну, унаслідок чого може розвиватись функціональний дефіцит заліза.
Отже, загальна практика збільшення рівня гемоглобіну в осіб із ХХН починається з оцінки дефіциту залізу та його корекції. Як правило, корекцію вмісту заліза при рівні гемоглобіну понад 100 г/л проводять препаратами через рот, при гемоглобіні менше ніж 100 г/л — внутрішньовенними препаратами заліза (наприклад, заліза карбоксимальтозат (ferric carboxymaltosate)).
Якщо внутрішньовенні препарати заліза є лікарськими засобами, то корекція пероральними субстанціями може виконуватись як препаратами фармацевтичного походження, так і біологічно активними добавками. На сьогодні добавки застосовують досить часто, проте заслуговують на увагу лише окремі з них, саме ті, що мають доказові терапевтичні ефекти. Спробую поділитись своїм досвідом застосування хелату бісгліцинату заліза.
1. Якому залізу віддати перевагу? Двовалентному, що не гідролізується в шлунку, тому швидко всмоктується й має високу біодоступність.
Хелат бісгліцинату заліза — єдиний представник Fe++, що не гідролізується в шлунку, тому всмоктується в незміненому вигляді [3–5] і має біодоступність 91 % [3, 6].
Він складається з однієї молекули двовалентного заліза і двох молекул амінокислоти гліцину. Дві молекули гліцину зв’язують залізо й захищають його від гідролізу (рис. 1).
Завдяки цьому хелат бісгліцинату заліза транзитом проходить через шлунок і всмоктується слизовою оболонкою тонкої кишки в незміненому вигляді.
І тільки після всмоктування під впливом цитоплазматичних ферментів клітин кишечника відбувається вивільнення заліза й надходження його в кров. При цьому відсутні втрати заліза при проходженні через шлунково-кишковий тракт (ШКТ) із каловими масами (рис. 2).
Така висока біодоступність також пояснюється наявністю двох шляхів абсорбції, тобто зв’язуванням із двома типами рецепторів [5].
Перший тип рецепторів — DMT-1 — призначений для солей заліза, ці рецептори знаходяться в дванадцятипалій кишці. Другий тип — PEPT-1 — призначений для зв’язування пептидів. Наявність у складі продукту амінокислоти гліцину дозволяє хелату бісгліцинату заліза зв’язуватися і з цим типом рецепторів. Це істотно збільшує всмоктування препарату, особливо з огляду на той факт, що рецептори PEPT-1 розташовані по всій поверхні тонкої кишки (рис. 2).
Біодоступність традиційних солей препаратів заліза, наприклад сульфату, становить тільки 26 %, причинами цього є: 1) втрати в шлунково-кишковому тракті при гідролізі; 2) те, що всмоктування здійснюється тільки з використанням одного типу рецепторів (DMT-1) [5, 7].
2. Які сполуки заліза добре переносяться? Ті, що не гідролізуються в шлунку.
Для пацієнтів із ХХН, особливо в умовах уремії, дуже важлива добра переносимість препарату, відсутність побічних ефектів.
Традиційні препарати заліза, наприклад сульфат, переносяться погано: під дією pH шлункового соку піддаються гідролізу (дисоціації) в шлунку з утворенням вільного заліза. У свою чергу, вільне залізо подразнює слизову оболонку шлунково-кишкового тракту й викликає значні побічні ефекти: нудоту, біль у животі, діарею або запор, які й призводять до припинення прийому препарату [3, 5].
При застосуванні хелату бісгліцинату заліза контакт вільного заліза зі слизовою ШКТ відсутній, тому продукт має дуже добре переноситися.
3. Які сполуки заліза краще відновлюють його запаси? Ті, що мають високу біодоступність.
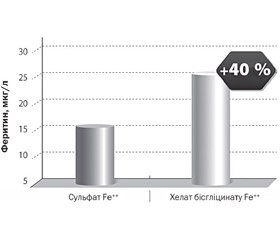
За рахунок високої біодоступності (91 %) хелат бісгліцинату заліза поповнює запаси заліза набагато краще, ніж сульфат [7] (рис. 3).
4. Які сполуки заліза можна між собою порівняти? Розглянемо табл. 1.
5. Про який продукт йдеться? Про Текнофер.
Його рекомендована доза становить 14–28 мг на добу (1–2 таблетки) [3, 5].
Висновки
Текнофер (хелат бісгліцинату заліза) — єдиний представник Fe++, який не гідролізується в шлунково-кишковому тракті й тому має високу біодоступність (91 %), дуже добре переноситься, що дозволяє рекомендувати його для збільшення добового споживання заліза. Завдяки цьому Текнофер сприяє корекції залізодефіциту й нормалізації рівня гемоглобіну в пацієнтів із ХХН.
Конфлікт інтересів. Автор представляв інтереси компанії «Ділео» у своїх публічних виступах.
1. Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter., Suppl. 2012. 2. 279-335.
2. Fishbane S., Spinowitz B. Update on Anemia in ESRD and Earlier Stages of CKD: Core Curriculum 2018. AJKD. March 2018. 71 (3). 423-435. DOI: https://doi.org/10.1053/j.ajkd.2017.09.026.
3. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and materials in Contact with Food on a request from the Commission related to: Ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA Journal. 2006.
4. DeWayne Ashmead Н. The absorption and metabolism of iron amino acid chelate. Archivos Latinoamericanos de Nutricion. 2001. 51.
5. Двухвалентное железо нового поколения для предотвращения анемии у беременных. Материалы круглого стола. Здоровье Украины, тематический номер. Гинекология. Декабрь 2018.
6. Pineda O., Ashmead H.D. Effectiveness of treatment of iron-deficiency anemia in infants and young children with ferrous bis-glycinate chelate. Nutrition. 2001 May. 17(5).
7. Szarfarc S.C. Relative effectiveness of iron bis-glycinate chelate and ferrous sulfate in the control of iron deficiency in pregnant woman. Arch. latinoam. Nutr. 2001. Mar. 51.

/43-11.jpg)
/43-2.jpg)
/44-2.jpg)
/44-1.jpg)