Журнал «Почки» Том 8, №3, 2019
Вернуться к номеру
Иммунобиологические препараты в терапии ревматических заболеваний
Авторы: Мельник А.А.
Специализированный медицинский центр «Оптима-фарм», г. Киев, Украина
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Ревматичні захворювання (РЗ) є одними з найпоширеніших хронічних захворювань опорно-рухової системи та сполучної тканини, що зустрічаються як у дорослих, так і в дітей. Причиною цих патологічних станів можуть бути зміни у функціонуванні імунної системи, запалення, інфекції та інші фактори. У деяких випадках вони призводять до інвалідності та значно впливають на якість і тривалість життя. Існують нефармакологічні і фармакологічні методи лікування РЗ. Перша лінія (нефармакологічна) лікування більшості РЗ полягає у зміні способу життя (фізичні вправи, правильне харчування, відмова від куріння). До фармакологічного стандартного лікування відносяться нестероїдні протизапальні препарати (НПЗП), глюкокортикоїди, протиревматичні препарати, що пригнічують реакцію гострої фази, сприяють зниженню рівня автоантитіл. На жаль, хоча НПЗП і допомагають контролювати симптоми РЗ, зменшуючи біль, набряк і запалення, проте не уповільнюють прогресування захворювання. Це відноситься і до глюкокортикоїдів, які є протизапальними гормонами, пов’язаними з кортизолом, стероїдом, що виробляється природним шляхом в організмі. Незважаючи на свої переваги, глюкокортикоїди мають значні побічні ефекти, включаючи діабет, остеопороз, гіпертонію, катаракту і схильність до інфекцій. За останні роки отримані нові дані про патогенез ревматичних захворювань, що сприяло можливості створення інноваційних імунобіологічних препаратів. Розробка таких лікарських засобів зробила революцію в терапевтичному підході при хронічних ревматичних захворюваннях, особливо в пацієнтів, стійких до стандартного лікування. Механізм дії цих імунобіологічних препаратів заснований на цілеспрямованому інгібуванні специфічних або молекулярних мішеней, безпосередньо залучених у патогенез захворювань. До них відносяться блокатори фактора некрозу пухлини, антагоністи інтерлейкінів-1, -6, -17А, блокатори CD20, CD80/CD86, інгібітор Т-клітинної костимуляції. Їх використання дозволяє поліпшити прогноз і досягти клінічної ремісії у значної кількості пацієнтів.
Ревматические заболевания (РЗ) являются одними из самых распространенных хронических заболеваний опорно-двигательного аппарата и соединительной ткани, которые встречаются как у взрослых, так и у детей. Причиной этих патологических состояний могут быть изменения в функционировании иммунной системы, воспаление, инфекции и другие факторы. В некоторых случаях они приводят к инвалидности и оказывают значительное влияние на качество и продолжительность жизни. Существуют нефармакологические и фармакологические методы лечения РЗ. Первая линия (нефармакологическая) лечения большинства РЗ состоит в изменении образа жизни (физические упражнения, правильное питание, отказ от курения). К фармакологическому стандартному лечению относятся нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды, противоревматические препараты, которые подавляют реакцию острой фазы, способствуют снижению уровня аутоантител. К сожалению, хотя НПВП и помогают контролировать симптомы РЗ, уменьшая боль, отек и воспаление, тем не менее они не замедляют прогрессирование заболевания. Это относится и к глюкокортикоидам, которые являются противовоспалительными гормонами, связанными с кортизолом — стероидом, вырабатываемым естественным путем в организме. Несмотря на свои преимущества, глюкокортикоиды дают значительные побочные эффекты, включающие диабет, остеопороз, гипертонию, катаракту и подверженность инфекциям. За последние годы получены новые данные о патогенезе ревматических заболеваний, что способствовало возможности создания инновационных иммунобиологических препаратов. Разработка таких лекарственных средств произвела революцию в терапевтическом подходе при хронических ревматических заболеваниях, особенно у пациентов, устойчивых к стандартному лечению. Механизм действия этих иммунобиологических препаратов основан на целенаправленном ингибировании специфических или молекулярных мишеней, непосредственно вовлеченных в патогенез заболевания. К ним относятся блокаторы фактора некроза опухоли, антагонисты интерлейкинов-1, -6, -17А, блокаторы CD20, CD80/CD86, ингибитор Т-клеточной костимуляции. Их использование позволяет улучшить прогноз и достичь клинической ремиссии у значительного количества пациентов.
Rheumatic diseases (RD) are among the most common chronic diseases of the musculoskeletal system and connective tissue which are found in both adults and children. The cause of these pathological conditions can be changes in the functioning of the immune system, inflammation, infections and other factors. In some cases, they lead to disability and have a significant impact on the quality of life and lifetime. There are non-pharmacological and pharmacological treatments for RD. The first line (non-pharmacological) treatment of most RDs consists in changing the lifestyle (exercises, correct diet, smoking cessation). Standard pharmacological treatment includes non-steroidal anti-inflammatory drugs, glucocorticoids, anti-inflammatory drugs that suppress acute phase response, help reduce the level of autoantibodies. Unfortunately, although non-steroidal anti-inflammatory drugs help control RD symptoms reducing pain, swelling and inflammation, they do not slow down the disease progression. This also refers to glucocorticoids which are anti-inflammatory hormones associated with cortisol, a steroid produced naturally in the body. Despite their advantages, glucocorticoids have significant side effects including diabetes, osteoporosis, hypertension, cataract and susceptibility to infections. In recent years, new data on the pathogenesis of rheumatic diseases has been obtained that has contributed to the possibility of creating innovative immunobiological drugs. The development of such drugs has revolutionized the therapeutic approach to chronic rheumatic diseases, especially in patients who are resistant to standard treatment. The mechanism of action of these immunobiological drugs is based on the inhibition of specific or molecular targets directly involved in the disease pathogenesis. They include tumor necrosis factor blockers, interleukin-1, -6, 17A receptor antagonists, CD20, CD80/CD86 blockers and T-cell costimulation blocker. Their use allows us to improve the prognosis and achieve clinical remission in a significant number of patients.
ревматичні захворювання; імунобіологічні препарати; блокатори фактора некрозу пухлини; антагоністи інтерлейкінів-1, -6, -17А; блокатори CD20, CD80/CD86; інгібітор Т-клітинної костимуляції; огляд
ревматические заболевания; иммунобиологические препараты; блокаторы фактора некроза опухоли; антагонисты интерлейкинов-1, -6, -17А; блокаторы CD20, CD80/CD86; ингибитор Т-клеточной костимуляции; обзор
rheumatic diseases; immunobiological drugs; tumor necrosis factor blockers; interleukin-1, -6, 17A receptor antagonists; CD20, CD80/CD86 blockers; T-cell соstimulation blocker; review
«Ревматическая болезнь» — это общий термин для обозначения состояний, при которых могут поражаться суставы, кости, хрящи, сухожилия, связки и мышцы, что вызывает хроническую, часто прерывистую боль.
Ревматология имеет тысячелетнюю богатую историю. Знаменитый древнегреческий врач Гиппократ (450–380 гг. до н.э.) был первым, кто обратил внимание на ревматические заболевания. Ученый внес вклад в диагностику подагры («артрит богатых») и описал эпизоды ревматической лихорадки. Об этом также свидетельствуют восемнадцать из его опубликованных афоризмов, которые (хотя и частично) относятся к заболеваниям суставов. Индийский аюрведический врач Charaka (около 300–200 гг. до н.э.) был подлинным пионером в области ревматологии. В трактате «Charaka Samhita» он охарактеризовал различные клинические фенотипы артрита и ревматоидного артрита (на санскрите — vishkantha). Древнеримский медик, грек по происхождению, Claudius Galenius (129–216 гг. н.э.) ввел термин «ревматизм» [1–3]. В I веке н.э. термин «ревма», или «текучая субстанция» (греческое ρεύμα, rheuma, river), предложен как показатель прохождения боли через суставы. Парижский врач Guilliaume de Baillou (1538–1616) в своем трактате «Liber de Rheumatismo et Pleuritide dorsali» представил первые современные описания ревматизма и артрита. Он красочно излагает данную патологию следующим образом: «…состояние, которое мы считаем ревматизмом, похоже на морскую болезнь сосудов (как рвота)» [4]. В 1949 году термин «ревматология» впервые введен в учебнике «Артрит и сопутствующие заболевания» под редакцией J.L. Hollander и B.I. Comroe [5]. В 50-х гг. XX века исследования по определению присутствия антител, направленных против аутоантигенов, таких как волчаночный антикоагулянт, и обнаружение антинуклеарных антител изменили представление о возможной этиологии ревматических заболеваний от инфекционной до аутоиммунной [6].
Ревматические заболевания являются одними из самых распространенных хронических заболеваний опорно-двигательного аппарата и соединительной ткани. Они встречаются во всех возрастных группах и в некоторых случаях вызывают инвалидность [7]. Ревматические заболевания наносят огромный социально-экономический урон из-за необходимости прекращать работу и рано выходить на пенсию [8]. Например, в США у 1 из 4 взрослых американцев диагностированы ревматические заболевания. Центр по контролю заболеваний (The Centers for Desease Control) прогнозирует, что это число будет расти и к 2040 году у 78 миллионов взрослых жителей США (26 % населения) будет диагностирован этот вид заболевания [9]. Статистика свидетельствует о том, что в Америке инвалидность, вызванная воспалительными ревматическими заболеваниями, связанными с артритом, выше по сравнению с заболеваниями сердца, раком или диабетом [10]. В Европе около 120 миллионов граждан (25 % от общей численности населения) страдают от ревматических и скелетно-мышечных заболеваний [11]. Из-за хронических болей и других функциональных нарушений качество жизни примерно 7,5 % европейского населения постоянно снижается.
За последние 50 лет ревматология как наука развивалась быстрыми темпами благодаря прогрессу в области иммунологии, молекулярной биологии, генетики и методов визуализации. Достижения в области молекулярной биологии помогли лучше понимать процесс болезни, а также осуществлять поиск новых лекарственных препаратов для лечения.
Эволюция лечения ревматических заболеваний от древности до наших дней
В древние времена использовались различные методы для лечения ревматических заболеваний. Древние египтяне и ассирийцы применяли экстракт ивы для уменьшения покраснения и боли в воспаленных суставах. Во времена Гиппократа в моде была диетотерапия. Так, Hippacrates, Syndenham и Galen от подагры предлагали ячменную воду и ячменный хлеб, а Antonius Musa успешно использовал диетотерапию для лечения ревматизма у императора Августа. Гиппократ также советовал слабительные средства для лечения подагры. Он использовал слабительные для трудноизлечимых случаев хронической подагры. Для лечения ревматических заболеваний с древних времен применяли СПА-терапию (баня с холодной и горячей водой), а также кровопускание. В VI веке византийский врач Alexander использовал колхицин, алкалоид, полученный из Colchicum autumnale, для лечения подагры. Однако из-за побочного действия колхицина на желудочно-кишечный тракт его использовали редко. В 1763 году колхицин был вновь открыт профессором A. Stoerk [12]. Противовоспалительные средства начали применять в XIX веке. В 1828 году Johann Andreas Buchner приготовил частично очищенный экстракт коры ивы — салицин, а Hammond Kolbe в 1859 году синтезировал салициловую кислоту [13]. Felix Hoffman в 1897 году синтезировал очищенную стабильную ацетилсалициловую кислоту, известную как аспирин [14]. С тех пор аспирин широко используется для лечения ревматоидного артрита и ревматизма.
Лечение ревматических заболеваний на современном этапе
1. Глюкокортикоиды
В 1948 году ревматолог из США Philip Showalter Hench успешно лечил пациентов глюкокортикоидами. Это стало важной вехой в ревматологии. Hench заметил, что при беременности и желтухе наблюдается ослабление ревматоидного артрита. Он объяснил это повышением уровня кортикостероидов при данных состояниях и применил глюкокортикоиды при ревматоидном артрите, за что был удостоен Нобелевской премии [15]. Аллопуринол был первым ингибитором ксантиноксидазы, который использовали для лечения подагры в 1963 году [16]. George Hitching и Gertrude Elion в 1988 году удостоены Нобелевской премии по медицине за разработку аллопуринола, азатиоприна и еще пяти лекарственных препаратов.
2. Метотрексат
Следующая веха в ревматологии приходится на 1968 год, когда A.N. Malaviya и его коллеги использовали метотрексат для лечения дерматомиозита [17]. Метотрексат — это химическое вещество, являющееся антагонистом фолиевой кислоты, разработанное Yellapragada Subbarao, ученым из Индии, работавшим в США. Низкодозовый метотрексат стал основным препаратом для лечения многих ревматических заболеваний вследствие его эффективности и малой токсичности. В 1988 году он был одобрен FDA (Food and Drug Administration, US FDA, Управление по контролю за качеством пищевых продуктов и лекарственных препаратов) для лечения ревматоидного артрита [18].
3. Аспирин
Механизм действия аспирина как блокатора синтеза простагландинов был расшифрован J.R. Vane и его коллегами в 1970-х годах. Это дало толчок разработке других противовоспалительных препаратов [19].
4. Антималярийные препараты
F. Page в 1951 году [20] для лечения волчанки впервые использовал противомалярийный препарат хинакрин. Для лечения ревматических заболеваний А. Bagnall в 1957 году [21] применил хлорохин. Сегодня гидроксихлорохин широко используется для лечения многих ревматических заболеваний из-за его эффективности и лучшего профиля безопасности [22].
5. Иммунобиологические препараты
Применение иммунобиологических препаратов, первым из которых является инфликсимаб, стало главной вехой в лечении ревматических заболеваний. Ravider Maini и Marc Feldman в своей новаторской работе сообщили о присутствии большого количества фактора некроза опухоли альфа (ФНО-a, англ. TNF, Tumor Necrosis Factor) в крови и ткани пациентов с ревматоидным артритом. Они продемонстрировали, что TNF-блокатор оказывал мощное действие на животных моделях с ревматоидным артритом. В 1993 году Ravider Maini [23] представил первые замечательные результаты действия TNF-блокаторов, которые появились на рынке в 1999 году.
Иммунобиологические лекарственные препараты в лечении ревматических заболеваний
Разработка иммунобиологических лекарственных препаратов произвела революцию в терапевтическом подходе при хронических ревматических заболеваниях, особенно у пациентов, устойчивых к стандартному лечению. Эти лекарственные препараты характеризуются инновационным механизмом действия, основанным на целенаправленном ингибировании специфических молекулярных или клеточных мишеней, непосредственно вовлеченных в патогенез заболевания (табл. 1).
Использование этих препаратов действительно позволило улучшить прогноз при таких ревматических заболеваниях, как ревматоидный артрит (РА), псориатический артрит (ПсАР), анкилозирующий спондилит (АС), системная красная волчанка (СКВ), и получить клиническую ремиссию [24].
I. Антагонисты фактора некроза опухоли альфа
Фактор некроза опухоли открыт в 1975 году как индуцируемая эндотоксинами молекула, вызывающая некроз in vitro. Вскоре после этого, в 1984 году, TNF был очищен биохимическими методами и охарактеризован как цитокин, вовлеченный во многие воспалительные процессы [25]. TNF представляет собой трансмембранный белок с м.в. 26 кДа, экспрессируемый активированными моноцитами/макрофагами, NK- и Т-клетками, а также неиммунными клетками, такими как эндотелиальные клетки и фибробласты. Синтезируется как трансмембранный белок (mTNF) и расщепляется матриксной металлопротеиназой TNF-превращающим ферментом (TACE, ADAM 17) с высвобождением растворимого TNF (sTNF). Как растворимый (sTNF), так и мембранный TNF (mTNF) связываются с двумя молекулами трансмембранного рецептора: TNFR1 (p55/60) и TNFR2 (p75/80), экспрессированными на поверхности большинства клеток [26]. В многочисленных исследованиях показана ключевая роль TNF в патогенезе таких хронических воспалительных заболеваний, как РА, ПсАР, АС, при воспалительных заболеваниях кишечника и увеите. В конце 90-х годов прошлого века были разработаны пять разных целевых иммунобиологических лекарственных препаратов в качестве блокаторов TNF: инфликсимаб, адалимумаб, голимумаб, цертолизумаб и этанерцепт (рис. 1).
Инфликсимаб, адалимумаб и голимумаб являются полноразмерными, двухвалентными моноклональными антителами класса IgG1, однако только адалимумаб и голимумаб полностью человеческие. Адалимумаб непосредственно связывается с TNF и нейтрализует его биологическую функцию, блокируя взаимодействие с рецепторами TNFR1 и TNFR2. Голимумаб образует высокоаффинные комплексы с sTNF и mTNF, тем самым предотвращая их связывание с рецепторами. Инфликсимаб представляет собой химерный двухвалентный IgG1 человека и мыши, содержащий около 25 % мышиных аминокислот. Цертолизумаб является Fab1-фрагментом моноклональных антител IgG1 и не имеет эффекторных функций, потому что у него нет Fc-области. Этанерцепт — это генно-инженерный гибридный белок, состоящий из Fc-домена человеческого IgG1, связанный с димером внеклеточного лиганд-связывающего домена человеческого TNFR2/p75.
Все эти лекарственные препараты конкурентно ингибируют связывание TNF с его рецепторами. Тем не менее они отличаются как фармакокинетическими, так и фармакодинамическими свойствами, что приводит к значительным различиям в их клинической эффективности. Наблюдаемая неоднородность в реагировании на лечение может быть связана с генетическими факторами, а именно — c разными полиморфными вариантами гена TNF [27].
Основные характеристики анти-TNF лекарственных препаратов представлены в табл. 2.
Механизм действия антагонистов TNF
Механизм действия антагонистов TNF основан на их связывании с растворимой и мембранной TNF с высокой аффинностью и специфичностью для предотвращения их взаимодействия с рецепторами (рис. 2, А и В). Другим механизмом, который способствует биологической активности этих препаратов, является их способность связываться с мембранной TNF и индуцировать обратную передачу сигналов в мембранные TNF-экспрессирующие клетки (рис. 2С) [28, 29]. И наконец, лекарственный препарат этанерцепт, имеющий в своем составе нативный внеклеточный TNFR, связывает и нейтрализует лимфотоксин-альфа (LTa), а также LTa1b2 и LTa2b1 со взаимодействием с FcR или без такового (рис. 2D).
Побочные эффекты ингибиторов TNF
Проблемы безопасности являются наиболее важными для любого лекарственного препарата. В связи с довольно коротким временем присутствия на рынке данного вида препаратов, которые относятся к классу иммунобиологических, правительственные органы (FDA и ЕМА, Europe Medicines Agency) тщательно анализируют все сообщения, касающиеся ингибиторов TNF. Если медицинские исследования показывают, что препарат несет значительный риск или даже опасен для жизни, выдается предупреждение или «черный ящик». Так называется черная рамка, которая обычно окружает текст предупреждения на маркировке рецептурного препарата или в литературе.
Для ингибиторов TNF выдано три предупреждения:
1. Повышенный риск развития серьезных побочных инфекций (включая туберкулез, гистоплазмоз, листериоз, пневмоцистную пневмонию), которые могут привести к госпитализации или смерти (2008).
2. Повышенный риск развития лимфомы и других злокачественных новообразований, некоторые из которых смертельны для детей и подростков (2009).
3. Постмаркетинговые случаи фатального редкого типа Т-клеточной лимфомы (2011).
Инфекции
TNF играет решающую роль в защите от микробных агентов. Поэтому, когда его эффекты оказываются блокированными, пациенты могут оказаться в группе риска развития инфекций верхних, нижних дыхательных и мочевыводящих путей [30]. Наиболее важным является то, что блокирование TNF может способствовать развитию латентной формы туберкулеза. В связи с этим необходимо перед назначением данного вида препаратов произвести скрининг пациентов на наличие латентной туберкулезной инфекции с использованием квантиферонового теста и рентгенографии грудной клетки [31, 32]. Среди сообщений о нежелательных побочных явлениях были оппортунистические инфекции: кандидоз, листериоз, опоясывающий лишай [33]. Еще одна важная проблема касается гепатит-В-позитивных пациентов, у которых могут повышаться функциональные печеночные тесты, что приводит к печеночной недостаточности при лечении анти-TNF. Рекомендуется перед началом терапии провести скрининговые тесты на гепатит В [34].
Злокачественные новообразования
Некоторые исследования показали повышенный риск немеланомного рака кожи, связанный с использованием адалимумаба, этанерцепта и инфликсимаба. Систематический обзор 25 клинических исследований показал различные риски малигнизации у больных псориатическим артритом при лечении этанерцептом, инфликсимабом или адалимумабом [35]. Однако результаты двух других метаанализов, выполненных среди более 26 000 пациентов, не оказались статистически значимыми в отношении увеличения риска злокачественности [36]. Метаанализ 33 двойных слепых рандомизированных контролируемых исследований у взрослых пациентов с ревматоидным артритом, проведенный Moulis et al. [37, 38], не выявил увеличения риска злокачественных новообразований при лечении любым из пяти ингибиторов TNF в течение двух лет. Тем не менее обнаружена тенденция к увеличению скорости развития немеланомного рака кожи.
Аутоиммунные заболевания
TNF играет одну из важных ролей в патологии рассеянного склероза (РС). Это подтверждают данные исследований о повышенной концентрации TNF в спинномозговой жидкости и сыворотке пациентов с РС. Более того, было показано, что увеличение секреции TNF из моноцитов до обострения симптомов заболевания предполагает роль TNF в патомеханизме демиелинизирующих расстройств. На основании этих данных проведены исследования влияния ингибиторов TNF у пациентов с рассеянным склерозом. К сожалению, фаза II клинического исследования была остановлена из-за увеличения частоты приступов РС, которые отличались продолжительностью и тяжестью [39].
В некоторых исследованиях сообщается о небольшом проценте пациентов, получавших анти-TNF, у которых развились аутоиммунные состояния. Они варьировали от бессимптомных иммунологических изменений с образованием антиядерных антител и антител к двухцепочечной ДНК до опасных для жизни аутоиммунных заболеваний [40, 41]. Аутоиммунные заболевания, связанные с лечением анти-TNF, включают волчаночноподобный синдром, васкулиты и псориатические поражения кожи. Эти синдромы требуют прекращения приема препаратов.
Сердечно-сосудистые заболевания
Сердечно-сосудистые побочные эффекты при анти-TNF варьируют от неспецифических и бессимптомных аритмий до развития сердечной недостаточности. Анти-TNF терапия противопоказана пациентам с сердечной недостаточностью III и IV классов по NYHA. Если сердечная недостаточность развивается у пациентов с анти-TNF терапией, следует прекратить прием препарата.
Беременность
На сегодняшний день опубликовано только одно исследование относительно безопасности ингибиторов TNF во время беременности. Не обнаружено доказательств повышенного риска неблагоприятных исходов при использовании инфликсимаба для лечения болезни Крона и ревматоидного артрита во время беременности [42]. Анализ данных о нежелательных явлениях у беременных с ревматоидным артритом, получавших анти-TNF, был осуществлен British Society for Rheumatology Biologics Regist. Показана связь между самопроизвольным абортом и продолжительностью беременности. Воздействие анти-TNF терапии во время зачатия было связано с самым высоким уровнем спонтанного аборта [43]. При использовании препаратов анти-TNF во время беременности необходимо иметь в виду потенциальный риск неблагоприятного эффекта.
Реакции в месте инъекции
При подкожном введении анти-TNF у 40 % пациентов отмечаются реакции в месте инъекции, которые считаются незначительными. Реакции, в которых отмечается значительная боль, обычно происходят в течение первых нескольких месяцев терапии. Они могут длиться от 2 до 5 дней, но редко требуют прекращения терапии. Для снижения проявлений симптомов достаточно использования льда или антигистаминных препаратов. Инфузионные реакции с инфликсимабом могут вызывать как острую, так и отсроченную инфузионную реакцию [44, 45]. Иммуногенность приводит к серьезным клиническим последствиям, таким как снижение эффективности препарата и его инфузии. Показано, что химерные антитела более иммуногенны, чем гуманизированные или человеческие. В одном из исследований больных ревматоидным артритом обнаружили антиинфликсимабные антитела у более чем 40 % пациентов [46].
II. Анти-В-клеточная терапия
1. Ритуксимаб (Rituxan/MabThera)
В мазке крови В- и Т-клетки невозможно отличить друг от друга, хотя их фенотипы различны. Технология развития моноклональных антител привела к идентификации кластера дифференцировки (CD) — молекул на клеточной поверхности. Так, Т-клетки экспрессируют CD2 и CD3, тогда как В-клетки экспрессируют CD19 и CD20. В-клетки играют существенную роль в патогенезе В-лимфом и хронического лимфолейкоза, а также принимают участие в развитии многочисленных аутоиммунных заболеваний, что является актуальным для ревматологии. CD20 — это мембранный высокоспецифичный белок, экспрессируемый на всех стадиях развития В-клеток, за исключением самых ранних (про-С-клетки) и последней стадии (плазматические клетки), стимуляция которого приводит к дифференцировке В-клеток. Функция CD20 остается до конца не ясной, хотя предполагается, что он может играть роль в передаче сигналов и в мобилизации кальция. Ритуксимаб был первым моноклональным антителом против CD20, одобренным FDA для лечения В-клеточных опухолей, а позже для аутоиммунных заболеваний.
Механизм действия ритуксимаба
Ритуксимаб представляет собой химерные (мышь — человек) моноклональные антитела, которые связываются с CD20, экспрессируются на В-клетках и опосредуют зависимый от комплемента лизис клеток в присутствии комплемента человека (комплемент-зависимая цитотоксичность), антителозависимую клеточную цитотоксичность, апоптоз (рис. 3).
В настоящее время ритуксимаб является лекарственным препаратом, который хорошо зарекомендовал себя как средство для лечения некоторых ревматических заболеваний.
Ритуксимаб при ревматоидном артрите
В 2004 году первое рандомизированное двойное слепое плацебо-контролируемое исследование среди пациентов с длительным, активным ревматоидным артритом показало, что один курс двух инфузий ритуксимаба отдельно или в сочетании с циклофосфамидом или метотрексатом обеспечивает значительное улучшение клинического ответа на 24-й и 48-й неделе [47]. Эффективность и безопасность различных доз ритуксимаба с метотрексатом и глюкокортикоидами или без них у пациентов с активным РА, которые не реагировали на антиревматические препараты, были изучены в исследовании GANGER [48]. Исследование MIRROR показало, что увеличение дозы ритуксимаба от двух доз по 500 мг до двух доз по 1000 мг не улучшало клинический ответ [49]. Дальнейшие исследования на пациентах с РА с неадекватным ответом на терапию анти-TNF показало, что единственный курс ритуксимаба с метотрексатом обеспечивал значительное улучшение состояния пациентов [50]. Устойчивая клиническая эффективность сохранялась после двух курсов ритуксимаба с интервалом в 6 месяцев. В 2011 году открытое проспективное исследование IIIb фазы (RESET) подтвердило, что ритуксимаб является эффективным вариантом лечения для пациентов, которые не ответили на ингибиторы TNF [51]. Исследование MIRRОR указывает на то, что переход на ритуксимаб является наиболее успешным вариантом лечения у пациентов по сравнению с антагонистами TNF [52]. Применение ритуксимаба (2 ´ 1000 мг) в сочетании с метотрексатом является эффективным методом лечения пациентов с РА, приводящим к устойчивому улучшению рентгенографических, клинических и функциональных результатов в течение 2 лет [53].
Ритуксимаб при системной красной волчанке
За последние 10 лет для пациентов с СКВ предложена целевая В-клеточная терапия, поскольку В-клетки играют существенную роль при данном заболевании [54]. Терапия ослабления антигенпрезентирующей функции В-клеток до сих пор не утверждена для СКВ, тем не менее она используется для лечения на ранних стадиях и при рефрактерности болезни. Ритуксимаб не разрабатывался как лекарственный препарат для пациентов с СКВ, но во многих неконтролируемых исследованиях подтверждена его полезность для пациентов с СКВ, которые не поддаются обычному лечению [55]. Ритуксимаб используется у пациентов с СКВ, осложненной тромбоцитопенией и гемолитической анемией, в меньшей степени — при кожном и мышечно-скелетном поражении при СКВ [56, 57]. Ритуксимаб также рекомендуется как эффективная терапия при антифосфолипидном синдроме, вторичном по отношению к СКВ, в профилактике рецидивирующих тромботических заболеваний [58]. В европейских странах ритуксимаб по-разному используется при СКВ, в том числе и по экономическим причинам [59].
Ритуксимаб при системном склерозе
В-клетки играют центральную роль в патогенезе системного склероза (СС). Увеличение количества доказательств дает основание использовать ритуксимаб у пациентов с СС [60]. В неконтролируемых исследованиях сообщается об эффективности ритуксимаба у пациентов с СС в отношении функции легких, фиброза кожи, реже — артрита и кальциноза [61, 62]. Сейчас в литературе недостаточно данных для назначения ритуксимаба пациентам с СС, которые не отвечают на традиционную терапию. Между тем ритуксимаб может рассматриваться как приемлемый вариант для тех пациентов, которые не переносят традиционную терапию или имеют противопоказания к ней (например, к циклофосфамиду), или для тех больных, у которых традиционная терапия потерпела неудачу. Применение ритуксимаба представляется перспективным при поражении легких, кожи, суставов, являющемся вторичным по отношению к системному склерозу.
Ритуксимаб и синдром Шегрена
Терапия синдрома Шегрена (СШ) в основном носит симптоматический и поддерживающий характер. Поскольку В-клетки играют ключевую роль в патогенезе СШ, предполагается, что ритуксимаб может быть потенциально полезным при этом заболевании [63]. Согласно недавно опубликованным рекомендациям по лечению синдрома Шегрена, ритуксимаб следует использовать у отдельных пациентов, которые не отвечают на обычные методы лечения [64].
Ритуксимаб во время беременности
Воздействие ритуксимаба до зачатия или во время беременности не вызывает истощения В-клеток у новорожденных, тогда как на поздней стадии беременности (второй и третий триместр) ритуксимаб способен снижать уровень В-клеток, который обычно нормализуется через 3–6 месяцев. У матерей и новорожденных, подвергшихся действию ритуксимаба, необходимо провести мониторинг на предмет обнаружения инфекций [65, 66]. Несмотря на то, что у беременных в течение первого триместра не было зарегистрировано никаких повреждений плода, эту терапию, согласно рекомендациям EULAP (European League Against Rheumatism), следует рассматривать только тогда, когда нет другого терапевтического варианта.
2. Белимумаб (Benlysta®)
Белимумаб представляет собой полностью человеческие рекомбинантные IgG1l моноклональные антитела, направленные против фактора В-клеточной активации (BAFF, B cell activation factor), который утвержден EMA в июле 2011 года для лечения системной красной волчанки [67, 68]. Белимумаб ингибирует биологическую активность BAFF, т.е. связывание BAFF с его рецептором, а также сигнализирующие и материнские В-клетки, что приводит к снижению патологии, связанной с СКВ (рис. 4). Белимумаб может блокировать секрецию INF-g и IL-2. Этот уникальный механизм сделал белимумаб многообещающим терапевтическим препаратом для пациентов с СКВ [70].
Утвержденный режим дозировки белимумаба составляет до 10 мг/кг (внутривенно) с интервалом в 2 недели для первых трех доз и с интервалом в 4 недели позже.
3. Офатумумаб (HuMax-CD20)
Офатумумаб — полностью человеческие IgG1k моноклональные антитела, которые специфически связываются с CD20 (эпитоп CD20 отличается от того, который распознается ритуксимабом) и приводит к В-клеточному лизису. Один курс двух инфузий по 700 мг был эффективным и безопасным у пациентов с активным ревматоидным артритом на фоне метотрексата. Офатумумаб не вызывает иммуногенности [71].
4. Окрелизумаб (Ocrevus)
Окрелизумаб — гуманизированные анти-CD20 моноклональные антитела, называемые «ритуксан следующего поколения» или «сын ритуксана». Эти моноклональные антитела вошли в III фазу исследования ревматоидного артрита и системной красной волчанки. Эффективность и безопасность окрелизумаба при ревматоидном артрите была оценена в фазе III клинических испытаний у большого количества пациентов [72].
5. Табамумаб
Табамумаб является полностью человеческими моноклональными антителами IgG4, которые связывают и нейтрализуют растворимый и мембраносвязанный BAFF [73]. В фазе II клинических исследований продемонстрировано доказательство биологической и клинической эффективности у пациентов с активным ревматоидным артритом, которые не отвечали на лечение метотрексатом [74]. На этапе III клинических исследований табамумаб не продемонстрировал клинической эффективности у пациентов с ревматоидным артритом в разных режимах дозирования, несмотря на доказательства биологической активности [75].
6. Атацицепт (anti-Blys)
Атацицепт является растворимым, полностью человеческим рекомбинантным белком, содержащим внеклеточную часть рецептора TACI и часть человеческого IgG [76]. Атацицепт нейтрализует фактор В-лимфоцитов (BLys) и APRIL — лиганд, вызывающий пролиферацию. Уровни BLys и APRIL повышены у пациентов с ревматоидным артритом. В отличие от ритуксимаба и белимумаба не показал существенной клинической пользы у пациентов с ревматоидным артритом [77, 78].
III. Ингибитор Т-клеточной костимуляции
Абатацепт
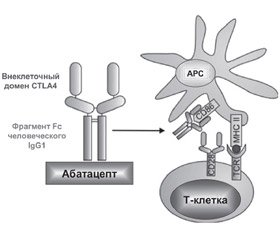
Абатацепт (Orencia®, Bristol Myers Squibb, USA) представляет собой генетический рекомбинантный растворимый белок, состоящий из внеклеточного домена CTLA4 (Cytotoxic T-lymphocyte antigen4, цитотоксический Т-лимфоцитарный антиген 4) и фрагмента Fc человеческого IgG1 (шарнир и домены СН2, СН3).
Механизм действия
Для активации Т-клеток требуется два разных сигнала. Первым сигналом является взаимодействие рецептора Т-клеток с главным комплексом гистосовместимости (МНС), пептидным комплексом на поверхности антиген-презентирующей клетки (АРС). Второй сигнал связывает костимулирующий рецептор на Т-клетках с лигандом на АРС, который способствует взаимодействию CD28 на Т-клетках с лигандом CD80 или CD86. Если реализуются оба сигнала, то Т-клетка достигает оптимальной активации и будет пролиферировать и продуцировать цитокины, которые могут активировать другие воспалительные клетки, такие как макрофаги. Если выполняется только один из двух сигналов, то это может привести к гибели клеток. Оптимальная активация Т-клеток связана с CTLA4, экспрессируемым на поверхности клеток. Связывание CTLA4 с CD80 и CD86 предотвращает взаимодействие между CD28 и CD80/CD86, так как аффинность CTLA4 к CD80/CD86 в 500–2500 раз превышает сродство CD28 к CD80/CD86.
Абатацепт имитирует эндогенный CTLA4 и конкурирует с CD28 за связывание с CD80 и CD86. При блокировании CD28, CTLA4 предотвращает второй костимулирующий сигнал, который необходим для оптимальной активации Т-клеток (рис. 5) [79].
Абатацепт и ревматоидный артрит
Абатацепт в сочетании с метотрексатом показан для лечения умеренного или тяжелого активного ревматоидного артрита у взрослых пациентов, у которых был недостаточный ответ или непереносимость других антиревматических препаратов. Данный препарат также показан для уменьшения признаков или симптомов у детей в возрасте от 6 лет и старше с умеренно-тяжелым активным многосуставным ювенильным идиопатическим артритом.
Абатацепт обладает эффективностью и безопасностью у пациентов с ревматоидным артритом при внутривенном введении и подкожной инъекции. Применение препарата приводит к улучшению качества жизни, которое проявляется в снижении боли и активизации физических функций.
Абатацепт следует вводить в течение 30 минут внутривенной инфузией в дозе, которая зависит от веса пациента (< 60 кг — 500 мг, от ≥ 60 до 100 кг — 750 мг, > 100 кг — 1000 мг). После первой инфузии назначается повторно через 2 и 4 недели, затем каждые 4 недели.
IV. Антагонисты интерлейкина-1
1. Анакинра (KineretТМ)
Интерлейкин-1 (IL-1) является провоспалительным цитокином, имеющим два разных лиганда (IL-1a и IL-b), которые связываются с рецептором IL-1 типа 1 (IL-1R1), что индуцирует множество медиаторов воспаления, включая простагландины, цитокины и хемокины. IL-1a присутствует в эндотелиальных и эпителиальных клетках, в то время как IL-b индуцируется в миелоидных клетках и высвобождается после расщепления каспазой-1. За последние 30 лет интерлейкин-1-
опосредованное воспаление было установлено при широком спектре заболеваний, начиная с редких аутоиммунных заболеваний и заканчивая такими распространенными, как подагра, ревматоидный артрит, диабет 2-го типа, атеросклероз и др. [80]. Интерлейкин-1 играет центральную роль в патофизиологии ревматоидного артрита [81].
Анакинра (KineretТМ, производитель — биотехнологическая компания Amgen Inc.) является рекомбинантной, негликозилированной формой антагониста рецептора интерлейкина-1 (IL-1Ra) человека. Состоит из 153 аминокислот и имеет м.в. 17,3 кДа. Механизм его действия состоит в блокировании биологической активности IL-1 путем конкурентного ингибирования при связывании IL-1 c рецептором IL-1Ra (рис. 6).
Анакинра показан для пациентов с умеренным или тяжелым ревматоидным артритом в возрасте 18 лет и старше, у которых не удалось достичь улучшения клинического состояния при использовании других противоревматических лекарственных препаратов. Рекомендованная доза анакинра составляет 100 мг один раз в день в виде подкожной инъекции.
2. Канакинумаб (ILARIS®)
Интерлейкин-1b является хорошо известным провоспалительным цитокином, который высвобождается различными клетками, такими как макрофаги, кератиноциты, фибробласты, эндотелиальными и нейрональными клетками [82]. IL-1b проявляет свое действие после связывания с его рецептором (IL-1bR). Нарушение регуляции активности IL-1b характерно для ревматоидного артрита и происходит либо от избытка продукции IL-1b, что приводит к увеличению концентрации цитокина, либо из-за качественного или количественного дефицита IL-1bR.
Канакинумаб (ILARIS®, компания-производитель Novartis) является гуманизированными моноклональными антителами IgGk против IL-1b [83]. Кроме того, что канакинумаб нейтрализует действие IL-1b, данный лекарственный препарат проявляет внутриклеточные эффекты, которые могут оказывать отрицательные обратные эффекты на продуцирование IL-1b и приводят его концентрацию к нормальной, характерной для здоровых пациентов.
В мае 2013 года FDA одобрило канакинумаб для лечения активного системного ювенильного идиопатического артрита у пациентов в возрасте от 2 лет и старше. Препарат вводится в виде подкожной инъекции один раз в месяц.
V. Антагонисты интерлейкина-6
Интерлейкин-6 представляет собой гликопептид с м.в. 26 кДа, который в основном вырабатывается моноцитами и нейтрофилами при активации Toll-подобных рецепторов. Обладает провоспалительной активностью, регулирует врожденную и приобретенную иммунную систему [84]. Известно, что IL-6 продуцируется в больших количествах в синовиальной жидкости пациентов с ревматоидным артритом.
Тоцилизумаб (ACTEMRA®, компания-производитель Hoffman-La Roche) является первыми рекомбинантными гуманизированными моноклональными антителами IgG1 c H2L2 полипептидной структурой, ингибирующими рецептор IL-6. Механизм действия тоцилизумаба заключается в связывании как с растворимыми (sIL-6R), так и с мембранными (mIL-6R) рецепторами и ингибировании опосредованных сигналов через эти рецепторы (рис. 7).
Показаниями к использованию в клинической практике тоцилизумаба являются:
— ревматоидный артрит у взрослых пациентов с активностью процесса от умеренного до тяжелого в сочетании с метотрексатом;
— полиартикулярный ювенильный идиопатический артрит у пациентов в возрасте от 2 лет и старше;
— системный ювенильный идиопатический артрит у пациентов в возрасте от 2 лет и старше, которые не отреагировали на предыдущую терапию одним или несколькими нестероидными противовоспалительными препаратами и системными кортикостероидами.
Рекомендуемая стартовая доза тоцилизумаба (внутривенная инфузия) для взрослых пациентов составляет 4 мг/кг веса с увеличением до 8 мг/кг в зависимости от ответа организма на препарат. Введение препарата 1 раз в четыре недели.
Подкожная инъекция для взрослых пациентов составляет 162 мг один раз в неделю с последующим увеличением дозы в зависимости от клинического ответа.
VI. Антагонисты интерлейкина-17А
Интерлейкин-17А (IL-17A) — провоспалительный цитокин, секретируемый исключительно Т-клетками, который участвует в патогенезе ревматоидного артрита, в развитии остеокластогенеза, разрушении хряща и эрозии кости.
1. Секукинумаб (Cosentyx)
Секукинумаб содержит высокоаффинные, полностью человеческие IgG1 моноклональные антитела, которые избирательно связывают и нейтрализуют IL-17A. Секукинумаб одобрен для лечения псориаза средней и тяжелой степени, псориатического артрита и анкилозирующего спондилита [85].
2. Иксекизумаб (Taltz®)
Представляет собой гуманизированные IgG4 моноклональные антитела, которые нейтрализуют IL-17А. Результаты исследования C. Leonardi et al. [86] показывают, что иксекизумаб может быть эффективным при лечении хронического умеренно-тяжелого бляшечного псориаза.
3. Бродалумаб (SILIQТМ)
Бродалумаб представляет собой моноклональные антитела IgG2 и одобрен FDA для лечения бляшечного псориаза средней и тяжелой степени у взрослых [87, 88]. В отличие от других ингибиторов IL-17A, таких как секукинумаб и иксекизумаб, которые в основном действуют на IL-17A и связываются с самим белком, бродалумаб нацелен на рецептор IL-17RA. Блокируя рецептор IL-17RA, бродалумаб предотвращает высвобождение опосредованных IL-17 провоспалительных протеинкиназ и хемокинов. В исследовании K. Pavelka et al. [89] не найдено доказательств клинической эффективности лечения бродалумабом у пациентов с ревматоидным артритом, которые не реагировали на лечение метотрексатом.
Выводы
Иммунобиологические препараты произвели революцию в лечении пациентов с хроническими ревматическими заболеваниями, такими как ревматоидный артрит, анкилозирующий спондилит, системная красная волчанка и др. К ним относятся блокаторы фактора некроза опухоли альфа, антагонисты интерлейкинов-1, -6, -17А, блокаторы CD20, CD80/CD86, ингибитор Т-клеточной стимуляции. Они позволяют улучшить прогноз и достичь клинической ремиссии у значительного количества пациентов. К определенным ограничениям при использовании лекарственных препаратов на основе моноклональных антител можно отнести их высокую стоимость и возможное развитие побочных эффектов.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Рецензент: проф. Д.Д. Иванов.
1. Deshpande S. History of rheumatology. Med. J. DY Patil. Univ. 2014. 7. 119-23. doi: 10.4103/0975-2870.126307.
2. Entezami P., Fox D.A., Clapham P.J., Chung K.C. Historical perspective on the etiology of rheumatoid arthritis. Hand Clin. 2011 Feb. 27 (1). 1-10. doi.org/10.1016/j.hcl.2010.09.006.
3. Sakkas L.I., Tronzas P. The Greek (Hellenic) rheumatology over the years: from ancient to modern times. Rheumatol. Int. 2019. in press. doi:org/10.1007/s00296-019-04261-4.
4. Parish L.C. An historical approach to the nomenclature of rheumatoid arthritis. Arthritis Rheum. 1963. 6. 138-58.
5. Hollander J.L., Comroe B.I. Arthritis and allied conditions, 4th ed. Philadelphia, PA: Lea & Febiger, 1949.
6. Conley C.L., Hartmann R.C. A hemorrhagic disorder caused by circulating anticoagulant in patients with disseminated lupus erythematosus. J. Clin. Invest. 1952. 152. 621-2.
7. Pereira Da Silva J.A., Woolf A.D. (eds.). Rheumatology in Practice, Springer, London, 2010.
8. Branco J.C., Rodrigues A.M., Gouveia N. et al. Prevalence of rheumatic and musculoskeletal diseases and their impact on health-related quality of life, physical function and mental health in Portugal: results from EpiReumaPt — a national health survey. doi: 10.1136/rmdopen-2015-000166.
9. Barbour K.E., Helmick C.G., Boring M., Brady T.J. Vital Signs: Prevalence of Doctor-Diagnosed Arthritis and Arthritis-Attributable Activity Limitation — United States. 2013-2015. MMWR2017. 66. 246-253. doi:10.15585/mmwr.mm6609e1.
10. Andersson Gare B. Juvenile arthritis: who gets it, where and when? A review of current data on incidence and prevalence. Clin Exp Rheumatol. 1999. 17. 367-74.
11. Estimation based on European Science Foundation (2006): Rheumatic Diseases — a Major Challenge for European Research and Health Care; European Science Foundation Policy Briefing, June.
12. Stoerk A. An essay on the use and effects of the root of the colchicum autumnale, or Meadow Saffron, Translated from the Latin. London: T Becket and PA de Honet; 1764.
13. Beer J.J. The emergence of the German dye industry. Illinois: Illinois Studies in the Social Science, 1959.
14. 100 years of Aspirin. Leverkusen: Bayer AG Consumer Care Business Group, 1997.
15. Hench P.S., Kendall E.C., Slocumb C.H., Polley H.F. The effect of a hormone of the adrenal cortex (17-hydroxy-11-dehydrocorticosterone: Compound E) and of pituitary adrenocorticotropic hormone on rheumatoid arthritis. Proc. Staff. Meet. Mayo Clin. 1949. 24. 181-97.
16. Rundles R.W., Wyngaarden J.B., Hitchings G.H., Elion G.B., Silberman H.R. Effects of a xanthine oxidase inhibitor on thiopurine metabolism, hyperuricaemia and gout. Trans. Assoc. Am. Physicians. 1963. 76. 126-40.
17. Malavyia A.N., Many A., Schwartz R.S. Treatment of dermatomyositis with methotrexate. Lancet. 1968. 2. 485-8.
18. Kaltsonoudis E., Papagoras C., Drosos A.D. Current and Future Role of Methotrexate in the Therapeutic Armamentarium for Rheumatoid Arthritis. Int. J. Clin. Rheumatol. 2012. 7. 179-89.
19. Vane J.R. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat. New. Biol. 1971. 231. 232-5.
20. Page F. Treatment of lupus erythematosus with mepacrine. Lancet. 1951. 2. 755-8.
21. Bagnall A.W. The value of chloroquine in rheumatoid disease:A four-year study of continuous therapy. Can. Med. Assoc. J. 1957. 77. 182-94.
22. Kumar P., Banik S. Pharmacotherapy options in rheumatoid arthritis. Clin. Med. Insights Arthritis Musculoskelet Disord. 2013. 6. 35-43. doi:10.4137/CMAMD.S5558.
23. Elliott M.J., Maini R.N., Feldmann M., Long-Fox A., Charles P., Katsikis P. et al. Treatment of rheumatoid arthritis with chimeric monoclonal antibodies to tumor necrosis factor alpha. Arthritis Rheum. 1993. 36. 1681-90.
24. Conti F., Ceccarelli F., Massaro L., Cipriano E., Di Franco M., Alessandri C., Spinelli F.R., Scrivo R., Valesini G. Biological therapies in rheumatic diseases. Clin. Ter. 2013. 164 (5). e413-428. doi: 10.7417/CT.2013.1622.
25. Pennica D., Nedwin G.E., Hayflick J.S. et al. Human tumor necrosis factor: precursor structure, expression and homology to lymphotoxin. Nature. 1984. 312. 724-9.
26. Chan F.K.-M., Chun H.J., Zheng L. et al. A domain in TNF receptors that mediates ligand-independent receptor assembly and signaling. Science. 2000. 288. 2351-4.
27. Prajapati R., Plant D., Barton A. Genetic and genomic predictors of anti-TNF response. Pharmacogenomics. 2011. 12. 1571-85. doi:10.2217/pgs.11.114.
28. Mitoma H., Horiuchi T., Hatta N., Tsukamoto H., Harashima S., Kikuchi Y. et al. Infliximab induces potent anti-inflammatory responses by outside-to-inside signals through transmembrane TNF-a. Gastroenterology. 2005. 128. 376-92.
29. Ringheanu M., Daum F., Markowitz J., Levine J., Katz S., Lin X. et al. Effects of infliximab on apoptosis and reverse signaling of monocytes from healthy individuals and patients with Crohn’s disease. Inflamm. Bowel. Dis. 2004. 10. 801-10. doi:10.1097/00054725-200411000-00015.
30. Bachmann F., Nast A., Sterry W. et al. Safety and efficacy of the tumor necrosis factor antagonists. Semin. Cutan. Med. Surg. 2010. 1. 35-47. doi:10.1016/j.sder.2010.02.002.
31. Gardam M.A., Keystone E.C., Menzies R. et al. Anti-tumor necrosis factor agents and tuberculosis risk: mechanism of action and clinical management. Lancet Infect. Dis. 2003. 3. 148-55.
32. Scrivo R., Sauzullo I., Mengoni F. et al. Serial interferon-g release assays for screening and monitoring of tuberculosis infection during treatment with biologic agents. Clin. Rheumatol. 2012. 31. 1567-75. doi:10.1007/s10067-012-2049-6.
33. Strangfeld A., Listing J., Herzer P. et al. Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. JAMA. 2009. 301. 737-44. doi:10.1001/jama.2009.146.
34. Roux C.H., Brocq O., Breuil V. et al. Safety of anti-TNF-alpha therapy in rheumatoid arthritis and spondylarthropathies with concurrent B or C chronic hepatitis. Rheumatology (Oxford). 2006. 45. 1294-7. doi:10.1093/rheumatology/kel123.
35. Rodgers M., Epstein D., Bojke L. et al. Etanercept, infliximab and adalimumab for the treatment of psoriatic arthritis: a systematic review and economic evaluation. Health Technol. Assess. 2011. 15. 1-329. doi:10.3310/hta15100.
36. Askling J., Fahrbach K., Nordstrom B., Ross S., Schmid C.H., Symmons D. Cancer risk with tumor necrosis factor alpha (TNF) inhibitors: meta-analysis of randomized controlled trials of adalimumab, etanercept, and infliximab using patient level data. Pharmacoepidemiol. Drug Saf. 2011. 20. 119-30. doi:10.1002/pds.2046.
37. Moulis G., Sommet A., Bene J. et al. Cancer risk of anti-TNF at recommended doses in adult rheumatoid arthritis: a meta-analysis with intention to treat and per protocol analyses. PLOS One. 2012. 7. 1-7. doi:10.1371/journal.phone.0048991.
38. Moulis G., Sommet A., Lapeyre-Mestre M. Mortality rates among patients with rheumatoid arthritis treated with tumor necrosis factor inhibitors: comment on the article by Simard et al. Arthitis Rheum. 2013. 65. 1670-1. doi:10.1002/art.37931.
39. Arnason B.G. TNF neutralization in MS: results of a randomized placebo-controlled multicenter study. Neurology. 1999. 53. 457-65.
40. Ramos-Casals M., Brito-Zerуn P., Muсoz S. et al. Autoimmune diseases induced by TNF-targeted therapies: analysis of 233 cases. Medicine (Baltimore). 2007. 86. 242-251.
41. Stallmach A., Hagel S., Bruns T. Adverse effects of biologics used for treating IBD. Best Pract. Res. Clin. Gastroenterol. 2010. 24. 167-182. doi:10.1016/j.bpg.2010.01.002.
42. Katz J.A., Antoni C., Keenan G.F., Smith D.E., Jacobs S.J., Lichtenstein G.R. Outcome of pregnancy in women receiving infliximab for the treatment of Crohn’s disease and rheumatoid arthritis. Am. J. Gastroenterol. 2004. 99. 2385-92. doi:10.1111/i.1572-0241.2004.30186.x.
43. Verstappen S.M.M., King Y., Watson K.D., Symmons D.P.M., Hyrich K.L. Anti-TNF therapies and pregnancy: outcome of 130 pregnancies in the British Society for Rheumatology Biologics Register. Ann. Rheum. Dis. 2011. 70. 823-6. doi:10.1136/ard.2010.140822.
44. Cheifetz A., Mayer L. Monoclonal antibodies, immunogenicity, and associated infusion reactions. Mt. Sinai J. Med. 2005. 72. 250-256.
45. Cheifetz A., Smedley M., Martin S. et al. The incidence and management of infusion reactions to infliximab: a large center experience. Am. J. Gastroenterol. 2003. 98. 1315-1324. doi:10.1111/i.1572-0241.2003.07457.x.
46. Wolbink G.J., Vis M., Lems W. et al. Development of antiinfliximab antibodies and relationship to clinical response in patients with rheumatoid arthritis. Arthritis Rheum. 2006. 54. 711-5. doi:10.1002/art.21671.
47. Edwards J.C., Szczepanski L., Szechinski J. et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N. Engl. J. Med. 2004. 350 (25). 2572-2581. doi:10.1056/NEJMoa032534.
48. Emery P., Fleischmann R., Filipowicz-Sosnowska A. et al. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment: results of a phase IIB randomized, double-blind, placebo-controlled, dose-ranging trial. Arthritis Rheum. 2006. 54 (5). 1390-1400. doi:10.1002/art.21778.
49. Rubbert-Roth A., Tak P.P., Zerbini C. et al. Efficacy and safety of various repeat treatment dosing regimens of rituximab in patients with active rheumatoid arthritis: results of a phase III randomized study (MIRROR). Rheumatology. 2010. 49 (9). 1683-1693. doi:10.1093/rheumatology/keq116.
50. Cohen S.B., Keystone E., Genovese M.C. et al. Continued inhibition of structural damage over 2 years in patients with rheumatoid arthritis treated with rituximab in combination with methotrexate. Ann. Rheum. Dis. 2010. 69 (6). 1158-1161. doi:10.1136/ard.2009.119222.
51. Haraoui B., Bokarewa M., Kallmeyer I., Bykerk V.P., Investigators R. Safety and effectiveness of rituximab in patients with rheumatoid arthritis following an inadequate response to 1 prior tumor necrosis factor inhibitor: the RESET Trial. J. Rheumatol. 2011. 38 (12). 2548-2556. doi:10.3899/jrheum.110444.
52. Gomez-Reino J.J., Maneiro J.R., Ruiz J. et al. Comparative effectiveness of switching to alternative tumour necrosis factor (TNF) antagonists versus switching to rituximab in patients with rheumatoid arthritis who failed previous TNF antagonists: the MIRAR Study. Ann. Rheum. Dis. 2012. 71 (11). 1861-1864. doi:10.1136/znnrheumdis-2012-201324.
53. Tak P.P., Rigby W., Rubbert-Roth A. et al. Sustained inhibition of progressive joint damage with rituximab plus methotrexate in early active rheumatoid arthritis: 2-year results from the randomised controlled trial IMAGE. Ann. Rheum. Dis. 2012. 71 (3). 351-357. doi:10.1136/annrheumdis-2011-200170.
54. Sanz I., Lee F.E. B cells as therapeutic targets in SLE. Nat. Rev. Rheumatol. 2010. 6 (6). 326-337. doi:10.1038/nrrheum.2010.68.
55. Lu T.Y., Ng K.P., Cambridge G. et al. A retrospective seven-year analysis of the use of B cell depletion therapy in systemic lupus erythematosus at University College London Hospital: the first fifty patients. Arthritis Rheum. 2009. 61 (4). 482-487. doi:10.1002/art.24341.
56. Albert D., Dunham J., Khan S. et al. Variability in the biological response to anti-CD20 B cell depletion in systemic lupus erythaematosus. Ann. Rheum. Dis. 2008. 67 (12). 1724-1731. doi:10.1136/ard.2007.083162.
57. Fernandez-Nebro A., de la Fuente J.L., Carreno L. et al. Multicenter longitudinal study of B-lymphocyte depletion in refractory systemic lupus erythematosus: the LESIMAB study. Lupus. 2012. 21 (10). 1063-1076. doi:10.1177/0961203312446627.
58. Wang C.R., Liu M.F. Rituximab usage in systemic lupus erythematosus-associated antiphospholipid syndrome: a single-center experience. Semin. Arthritis Rheum. 2016. 46 (1). 102-108. doi:10.1016/i.semarhrit.2016.02.002.
59. Ryden-Aulin M., Boumpas D., Bultink I. et al. Off-label use of rituximab for systemic lupus erythematosus in Europe. Lupus Sci Med. 2016. 3 (1). e000163. doi:10.1136/lupus-2016-000163.
60. Bosello S., De Luca G., Tolusso B. et al. B cells in systemic sclerosis: a possible target for therapy. Autoimmun. Rev. 2011. 10 (10). 624-630. doi:10.1016/i.autrev.2011.04.013.
61. McGonagle D., Tan A.L., Madden J. et al. Successful treatment of resistant scleroderma-associated interstitial lung disease with rituximab. Rheumatology. 2008. 47 (4). 552-553. doi:10.1093/rheumatology/kem357.
62. Lafyatis R., Kissin E., York M. et al. B cell depletion with rituximab in patients with diffuse cutaneous systemic sclerosis. Arthritis Rheum. 2009. 60 (2). 578-583. doi:10.1002/art.24249.
63. Cornec D., Devauchelle-Pensec V., Tobon G.J., Pers J.O., Jousse-Joulin S., Saraux A. B cells in Sjogren’s syndrome: from pathophysiology to diagnosis and treatment. J. Autoimmun. 2012. 39 (3). 161-167. doi:10.10116/i.iaut.2012.05.014.
64. Carsons S.E., Vivino F.B., Parke A. et al. Treatment guidelines for rheumatologic manifestations of Sjogren’s syndrome: use of biologic agents, management of fatigue, and inflammatory musculoskeletal pain. Arthritis Care Res. 2017. 69 (4). 517-527. doi:10.1002/act.22968.
65. Ostensen M., Forger F. How safe are anti-rheumatic drugs during pregnancy? Curr. Opin. Pharmacol. 2013. 13 (3). 470-475. doi:10.1016/i.coph.2013.03.004.
66. Klink D.T., van Elburg R.M., Schreurs M.W., van Well G.T. Rituximab administration in third trimester of pregnancy suppresses neonatal B-cell development. Clin. Dev. Immunol. 2008. 271363. doi:10/1155/2008/271363.
67. Dubey A.K., Handu S.S., Dubey S., Sharma P., Sharma K.K., Ahmed Q.M. Belimumab: First targeted biological treatment for systemic lupus erythematosus. J. Pharmacol. Pharmacother. 2011. 2. 317-319. doi:10.4103/0976-500X.85930.
68. Stohl W., Hilbert D.M. The discovery and development of belimumab: the anti-BLyS-lupus connection. Nat. Biotechnol. 2012. 30. 69-77. doi:10.1038/ndt.2076.
69. Kim S.S., Kirou K.A., Erkan D. Belimumab in systemic lupus erythematosus: an update for clinicians. Ther. Adv. Chronic. Dis. 2012. 3. 11-23. doi:10.1177/2040622311424806.
70. Dhaun N., Kluth D.C. Belimumab for systemic lupus erythematosus. Lancet. 2011. 377. 2079-2080.
71. Taylor P., Quattrocchi E., Maletti S., Kurrash R., Peterson J., Chang D. Ofatumumab, a fully human anti-CD20 monoclonal antibody, in biological-naive, rheumatoid arthritis patients with an inadequate response to methotrexate: a randomised, double-blind, placebo-controlled clinical trial. Ann. Rheum. Dis. 2011. 70. 2119-2125. doi:10.1136/ard.2011.151522.
72. Rigby W., Tony H.P., Oelke K., Combe B., Laster A. et al. Safety and efficacy of ocrelizumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: Results of a forty-eight-week randomized, doubleblind, placebo-controlled, parallel-group phase III trial. Arthritis Rheum. 2012. 64. 350-359. doi:10.1002/art.33317.
73. Manetta J., Bina H., Ryan P. et al. Generation and characterization of tabalumab, a human monoclonal antibody that neutralizes both soluble and membrane-bound B-cell activating factor. J. Inflamm. Res. 2014. 7. 121-31. doi:10.2147/JIR.S67751.
74. Genovese M.C., Bojin S., Biagini I.M. et al. Tabalumab in rheumatoid arthritis patients with an inadequate response to methotrexate and naive to biologic therapy: a phase II, randomized, placebo-controlled trial. Arthritis Rheum. 2013. 65. 880-9. doi:10.1002/art.37820.
75. Schiff M., Combe B., Dцrner T. et al. Efficacy and safety of tabalumab, an anti-BAFF monoclonal antibody, in patients with moderate-tosevere rheumatoid arthritis and inadequate response to TNF inhibitors: results of a randomised, doubleblind, placebo-controlled, phase 3 study. RMD Open. 2015. 1. e000037. doi:10.1136/rmdopen-2014-000037.
76. Munafo A., Priestley A., Nestorov I., Visich J., Rogge M. Safety, pharmacokinetics and pharmacodynamics of atacicept in healthy volunteers. Eur. J. Clin. Pharmacol. 2007. 63. 647-56.
77. Stohl W., Chatham W., Weisman M., Furie R., Weinstein A., Mishra N. et al. and the LBRA01 Study Group. Belimumab (BmAb), a novel fully human monoclonal antibody to B-lymphocyte stimulator (BLyS), selectively modulates B cell subpopulations and immunoglobulins in a heterogeneous rheumatoid arthritis population [abstract]. Arthritis Rheum. 2005. 52 Suppl. S444.
78. van Vollenboven R.F., Kinnman N., Vincent E., Wax S. and Bathon J. Atacicept in Patients With Rheumatoid Arthritis and an Inadequate Response to Methotrexate Results of a Phase II, Randomized, Placebo-Controlled Trial. Arthritis & Rheumatism. 2011. Vol. 63, № 7. Р. 1782-1792. doi: 10.1002/art.30372.
79. Korhonen R. and Moilanen E. Abatacept, a Novel CD80/86–CD28 T Cell Co-stimulation Modulator, in the Treatment of Rheumatoid Arthritis. Nordic Pharmacological Society. Basic & Clinical Pharmacology & Toxicology. 2009. 104. 276-284. doi: 10.1111/j.1742-7843.2009.00375.x.
80. Cavalli G. and Dinarello C.A. Anakinra Therapy for Non-cancer Inflammatory Diseases. Front. Pharmacol. 2018. 9. 1157. doi: 10.3389/fphar.2018.01157.
81. Dayer J.-M., Feige U., Edwards C.K., III, Burger D. Anti-interleukin-1 therapy in rheumatic diseases. Curr. Opin. Rheumatol. 2001. 13. 170-6.
82. Eder C. Mechanisms of interleukin-1beta release. Immunobiology. 2009. 214. 543-553. doi:10.10116/i.imbio.2008.11.007.
83. Dhimolea E. Canakinumab. MAbs 2010. 2. 3-13. doi:10.4161/mabs.2.1.10328.
84. Kishimoto T. IL-6: from laboratory to bedside. Clin. Rev. Allergy Immunol. 2005. 28 (3). 177-186.
85. Cosentyx (secukinumab) highlights of prescribing information. East Hanover (NJ): Novartis Pharmaceuticals Corporation; 2015. URL: https://www.pharma.us.novartis.com /product/pi/ pdf/ cosentyx.pdf.
86. Leonardi C., Matheson R., Zachariae C. et al. Anti-Interleukin-17 Monoclonal Antibody Ixekizumab in Chronic Plaque Psoriasis. N. Engl. J. Med. 2012. 366. 1190-9. doi:10.1056/NEJMoa1109997.
87. Beck K.M., Koo J. Brodalumab for the treatment of plaque psoriasis: up-to-date. Expert. Opin Biol. Ther. 2019 Apr. 19 (4). 287-292. doi:10.1080/14712598.2019.1579794.
88. Pinter A., Wilsmann-Theis D., Peitsch W.K., Mössner R. Interleukin-17 receptor A blockade with brodalumab in palmoplantar pustular psoriasis: Report on four cases. J. Dermatol. 2019 Feb. 20. doi:10.1111/1346-8138.14815.
89. Pavelka K., Chon Y., Newmark R., Lin S.L., Baumgarther S., Erondu. A study to evaluate the safety, tolerability, and efficacy of brodalumab in subjects with rheumatoid arthritis and an inadequate response to methotrexate. J. Rheumatol. 2015 Jun. 42 (6). 912-9. doi: 10.3899/jrheum.141271.

/67-1.jpg)
/68-1.jpg)
/69-1.jpg)
/71-1.jpg)
/72-1.jpg)
/73-1.jpg)
/74-1.jpg)
/74-2.jpg)