Журнал «Здоровье ребенка» Том 14, №5, 2019
Вернуться к номеру
Рівні оксиду азоту й ендотеліну-1 у крові при Helicobacter pylori-асоційованій виразковій хворобі в дітей
Авторы: Сорокман Т.В., Черней Н.Я.
ВДНЗ України «Буковинський державний медичний університет». м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Останнім часом багато вчених підкреслюють визначальну роль судинної стінки в регуляції агрегатного стану крові, а також значення її порушень у розвитку захворювань травної системи. Однак до сьогодні відсутні дані про роль Helicobacter pylori в розвитку ендотеліальної дисфункції. Мета: оцінити характер змін рівня оксиду азоту (NO) й ендотеліну-1 у крові дітей при ерозивно-виразкових ураженнях верхніх відділів шлунково-кишкового тракту. Матеріали та методи. Проведено комплексне клінічне та інструментально-лабораторне обстеження 120 дітей, хворих на хронічний ерозивний гастродуоденіт (79 осіб) та виразкову хворобу дванадцятипалої кишки (41 особа) віком 7–18 років (основна група) та 50 дітей відповідного віку без патології травної системи (група порівняння). Усім дітям здійснювалось ретельне клінічно-параклінічне дослідження за загальноприйнятими в клініці методиками. Концентрацію нітриту в плазмі крові визначали за методикою П.П. Голікова (2004). Дослідження рівня ендотеліну-1 в сироватці крові проводилося за допомогою методу імуноферментного аналізу з використанням наборів фірми Biomedicagruppe (Німеччина). Результати дослідження наведені кількістю спостережень у групі, відсотками або середнім та середньоквадратичним відхиленням, точним значенням р. Результати. Діти були розподілені за віком, статтю, місцем проживання та нозологічною формою патології. Рівень NО у плазмі крові дітей основної групи був вірогідно нижчим і становив 11,78 ± 1,10 мкмоль/л, р < 0,05. При внутрішньогруповому аналізі в обох групах обстежених дітей вірогідної різниці між вмістом NО у крові залежно від статі та віку не виявлено (р > 0,05). За відсутності Helicobacter pylori рівень NО у крові вірогідно вищий порівняно з групою хворих, в якої діагностовано Helicobacter pylori-асоційовану патологію (р < 0,05). Установлена різниця в рівнях NO у крові дітей залежно від періоду хвороби: його рівень вищий у період загострення як хронічного ерозивного гастродуоденіту, так і виразкової хвороби дванадцятипалої кишки. В середньому в дітей основної групи рівень ендотеліну-1 у крові був вірогідно нижчим від такого в дітей групи порівняння — 0,36 ± 0,02 фмоль/мл та 0,48 ± 0,02 фмоль/мл відповідно, p < 0,01. Рівень ендотеліну-1 у крові дітей також залежав від наявності Helicobacter pylori. Висновки. Рівні метаболітів NО й ендотеліну-1 вірогідно знижені в крові дітей, хворих на ерозивно-виразкову патологію верхніх відділів шлунково-кишкового тракту, залежать від періоду захворювання та наявності Helicobacter pylori і не залежать від віку та статі.
Актуальность. В последние годы многие ученые подчеркивают определяющую роль сосудистой стенки в регуляции агрегатного состояния крови, а также значение ее нарушений в развитии заболеваний пищеварительной системы. Однако до настоящего времени отсутствуют данные о роли Helicobacter pylori в развитии эндотелиальной дисфункции. Цель: оценить характер изменений уровня оксида азота (NO) и эндотелина-1 в крови детей при эрозивно-язвенных поражениях верхних отделов желудочно-кишечного тракта. Материалы и методы. Проведено комплексное клиническое и инструментально-лабораторное обследование 120 детей с хроническим эрозивным гастродуоденитом (79 человек) и язвенной болезнью двенадцатиперстной кишки (41 человек) в возрасте 7–18 лет (основная группа) и 50 детей соответствующего возраста без патологии пищеварительной системы (группа сравнения). Всем детям проводилось тщательное клинико-параклиническое исследование по общепринятым в клинике методикам. Концентрацию нитритов в плазме крови определяли по методике П.П. Голикова (2004). Исследование уровня эндотелина-1 в сыворотке крови проводилось с помощью метода иммуноферментного анализа с использованием наборов фирмы Biomedicagruppe (Германия). Результаты исследования представлены количеством наблюдений в группе, процентами или средним и среднеквадратичным отклонением, точным значением р. Результаты. Дети были распределены по возрасту, полу, месту жительства и нозологической форме патологии. Уровень NО в плазме крови детей основной группы был достоверно ниже и составлял 11,78 ± 1,10 мкмоль/л, р < 0,05. При внутригрупповом анализе в обеих группах обследованных детей достоверной разницы между содержанием NО в крови в зависимости от пола и возраста не выявлено (р > 0,05). При отсутствии Helicobacter pylori уровень NО в крови достоверно выше по сравнению с группой больных, в которой диагностирована Helicobacter pylori-ассоциированная патология (р < 0,05). Выявлена разница в уровнях NO в крови детей в зависимости от периода болезни: его уровень выше в период обострения как хронического эрозивного гастродуоденита, так и язвенной болезни двенадцатиперстной кишки. В среднем у детей основной группы уровень эндотелина-1 в крови был достоверно ниже такового у детей группы сравнения — 0,36 ± 0,02 фмоль/мл и 0,48 ± 0,02 фмоль/мл соответственно, p < 0,01. Уровень эндотелина-1 в крови детей также зависел от наличия Helicobacter pylori. Выводы. Уровни метаболитов NО и эндотелина-1 достоверно снижены в крови детей с эрозивно-язвенной патологией верхних отделов желудочно-кишечного тракта, зависят от периода заболевания и наличия Helicobacter pylori и не зависят от возраста и пола.
Background. In recent years, many scientists emphasize the decisive role of the vascular wall in regulating the aggregate state of the blood, as well as the importance of its disorders in the development of digestive diseases. However, there are currently no data on the role of Helicobacter pylori in the development of endothelial dysfunction. The purpose was to evaluate the nature of nitric oxide (NO) and endothelin-1 changes in the blood of children with erosive-ulcerative lesions of the upper gastrointestinal tract. Materials and methods. Comprehensive clinical and instrumental-laboratory examination was performed in 120 children aged 7–18 years, 79 with chronic erosive gastroduodenitis and 41 with duodenal ulcer, as study group, and 50 children of the corresponding age without digestive diseases (control group). All children underwent a thorough clinical and paraclinical study according to methods generally accepted in the clinic. Concentration of nitrite in the blood plasma was determined by P.P. Golikov (2004). The study of endothelin-1 serum level was carried out by enzyme-linked immunosorbent assay using Biomedica Gruppe (Germany) sets. The results of the study are represented by the number of observations in the group, the percentage or the mean and the mean square deviation, the exact value of p. Results. Children were divided by age, sex, place of residence and nosological form of pathology. The level of NO in the blood plasma of children in the study group was significantly lower — 11.78 ± 1.10 μmol/l (p < 0.05). The intragroup analysis in both groups of examined children showed no significant difference in the blood content of NO (p > 0.05) depending on gender and age. In the absence of Helicobacter pylori, the level of NO in the blood is significantly higher compared to the group of patients diagnosed with Helicobacter pylori (p < 0.05). There is a difference in the levels of NO in the blood of children depending on the period of the disease: they are higher during the exacerbation, both chronic erosive gastroduodenitis and duodenal ulcer. On average, blood endothelin-1 level in patients of the study group was significantly lower than that of children in the comparison group (0.36 ± 0.02 fmol/ml and 0.48 ± 0.02 fmol/ml, respectively, p < 0.01). The level of endothelin-1 in the blood of children also depended on the presence of Helicobacter pylori. Conclusions. The levels of NO and endothelin-1 metabolites are significantly reduced in the blood of children with erosive and ulcerative pathology of the upper gastrointestinal tract, depend on the period of the disease, the presence of Helicobacter pylori and do not depend on age and gender.
діти; ерозивно-виразкове ураження верхніх відділів шлунково-кишкового тракту; оксид азоту; ендотелін-1
дети; эрозивно-язвенные поражения верхних отделов желудочно-кишечного тракта; оксид азота; эндотелин-1
children; erosive-ulcerative pathology of the upper gastrointestinal tract; nitric oxide; endothelin-1
Вступ
Разом із неухильним зростанням хронічної патології верхніх відділів травного тракту в дітей спостерігається тенденція до обтяження перебігу кислотозалежних захворювань, збільшення питомої ваги ерозивних та виразкових форм гастродуоденальної патології [1]. Ці тенденції пов’язують із високою частотою хелікобактеріозу в дитячому віці як одного з етіологічних чинників формування хронічних захворювань гастродуоденальної ділянки. Сьогодні загальноприйняті теорії ульцерогенезу розглядаються у світлі персистування Helicobacter pylori і впливу кислотно-пептичного фактора, що підсилюють взаємну патогенну дію, при цьому Helicobacter pylori підтримує хронічний перебіг захворювання, створюючи загрозу рецидиву [2, 3]. Порівняно з дорослими діти мають відмінні риси інфекції Helicobacter pylori [4, 5]. Відмінності відбуваються через особливості клінічного перебігу захворювань, значно меншого прояву ознак, ніж у дорослих. Окрім того, у дітей є специфічні проблеми, пов’язані з особливостями проведення діагностичних тестів, що використовуються в дорослих, реакція одних і тих же діагностичних тестів у дітей і в дорослих може бути різною. Особливості дитячого організму підсумовані національними і міжнародними погоджувальними документами та рекомендаціями, насамперед European Society for Pediatric Gastroenterology and Nutrition. Одним із напрямків, що може мати відношення до пояснення відмінностей у розвитку певної Helicobacter pylori-асоційованої патології, є відповідь макроорганізму на Helicobacter pylori-індуковане запалення. Відомо, що властива активному запаленню дегрануляція нейтрофілів призводить до генерації реактивних форм кисню або азоту, які можуть викликати оксидативні ушкодження і прогнозувати каскад подальших подій, можливо, специфічних для окремих форм гастродуоденальної патології [6–8]. Уточнення особливостей відповіді дитячого організму на інфекцію Helicobacter pylori може мати і практичне значення. У популяції з високою поширеністю Helicobacter pylori, якою є українська популяція, важливим є уточнення форми асоційованої гастродуоденальної патології у зв’язку з наявним ризиком ерозивно-виразкових уражень. При обмеженнях ендоскопічних досліджень у дітей виявлення деяких метаболічних порушень в інфікованої Helicobacter pylori дитини, які дозволяють не тільки пояснити механізми того чи іншого варіанта перебігу Helicobacter pylori-асоційованого захворювання, а й оцінити їх з позиції можливого використання як діагностичних тестів, може мати певне практичне значення. У сучасних концепціях патогенезу ерозивно-виразкових уражень гастродуоденальної ділянки велике значення надається порушенням у нейроендокринній системі травного тракту. До початку цього століття з’явився напрям, що зосередив увагу клініцистів на новому об’єкті — ендотелії як органі-мішені, що першим піддається контакту з біологічно активними речовинами і найбільш рано пошкоджується при патологічних станах. Останнім часом багато вчених підкреслюють визначальну роль судинної стінки в регуляції агрегатного стану крові, а також значення її порушень у розвитку захворювань травної системи [9–13]. Однак, відступаючи на другий план порівняно з вираженістю кислотно-пептичної агресії при виразковій хворобі, стан функцій ендотелію залишається мало вивченим. До сьогодні відсутні дані про роль Helicobacter pylori в розвитку ендотеліальної дисфункції та можливості її корекції на тлі антихелікобактерної терапії. Цікавим є вивчення ролі ендотеліну-1 та синтази оксиду азоту у формуванні виразкової хвороби.
Мета: оцінити характер змін рівня оксиду азоту (NO) і ендотеліну-1 (Et-1) в крові дітей при ерозивно-виразкових ураженнях верхніх відділів шлунково-кишкового тракту.
Матеріали та методи
Дослідження виконане в рамках наукової теми «Рання діагностика, лікування і профілактика поєднаної патології шлунково-кишкового тракту та щитоподібної залози у дітей», шифр 0116U002937.
Проведено комплексне клінічне й інструментально-лабораторне обстеження 120 дітей, хворих на хронічний ерозивний гастродуоденіт (ХЕГД, 75 осіб) та виразкову хворобу дванадцятипалої кишки (ВХДПК, 45 осіб) віком 7–18 років (основна група) та 50 дітей відповідного віку без патології травної системи (група порівняння). Дослідження проводилося за допомогою методу простої рандомізації. Критерії включення в дослідження:
1) національність (етнічні українці);
2) місце народження та проживання (Чернівецька область);
3) вік (7–18 років);
4) стать (кількість хлопчиків та дівчаток);
5) однотипність клінічного діагнозу;
6) однотипний характер порушень функції шлунка;
7) єдина діагностична програма.
Критерії виключення з дослідження:
1) наявність декомпенсованої супутньої патології;
2) вік до 7 років;
3) обстеження в інших лікувально-профілактичних закладах;
4) народження та проживання за межами Чернівецької області;
5) вживання антибактеріальної терапії впродовж одного місяця;
6) відсутність інших запальних захворювань на момент дослідження;
7) куріння, наявність захворювань ротової порожнини та зубів;
8) відсутність згоди батьків дитини на участь у дослідженні.
Усім дітям, які були під спостереженням, проводилось ретельне параклінічне дослідження за загальноприйнятими в клініці методиками: загальний аналіз крові, біохімічні показники крові, аналіз крові на глюкозу, загальний аналіз сечі, аналіз калу на наявність яєць гельмінтів, копрограма, дослідження мікрофлори кишечника.
Для верифікації виразок слизової оболонки (СО), виявлення рефлюксів та супутньої патології використовувалися такі інструментальні методи обстеження: фіброезофагогастродуоденоскопія (ФЕГДС) за допомогою фіброгастродуоденоскопа Pentax FG-24P із визначенням ендоскопічних критеріїв Helicobacter pylori та проведення щиткової біопсії слизової оболонки шлунка (антрум і тіло шлунка) та дванадцятипалої кишки за загальноприйнятими правилами забору з наступним приготуванням мазка-відбитка, забарвленням та бактеріоскопією з метою діагностики Helicobacter pylori та визначення ступеня засівання (Аруин Л.И., 1995). Інфікування Helicobacter pylori підтверджували твердофазним імуноферментним тестом шляхом якісного та кількісного визначення IgG-антитіл до Helicobacter pylori в сироватці крові (UBI MAYIWELL™, США). Позитивним вважали рівень більше 40 Eu/мл. Одночасно з ФЕГДС проводили інтрагастральну рН-метрію з вивченням секреторної й олужнюючої функцій шлунка за різницею значень рН у тілі й антрумі апаратом «ІКШ-2» (Чернобровий В.М., 1990).
Концентрацію нітриту в плазмі крові визначали за допомогою стандарту. Як стандарт використовували нітрит натрію за методикою П.П. Голікова [14]. Відновлення нітрату в нітрит у пробах здійснювали за допомогою гранульованого кадмію (масова частка гранульованого кадмію > 99,96 %), аліквоти якого додавали до центрифугату, і проводили інкубування при кімнатній температурі протягом 15 год. Попередньо гранули кадмію промивали бідистильованою водою 0,1 N HCl та знову бідистильованою водою до нейтрального середовища. Параметри повноти відновлення гранулами кадмію, доданого в проби відновленого нітрату в нітрит, визначали за допомогою концентраційної залежності нітриту, верифікованого в реакції Грісса. Отриману суміш змішували з рівним об’ємом реактиву Грісса й інкубували 10 хв при кімнатній температурі. Вимірювання абсорбції розчину проводили на спектрофотометрі при довжині хвилі 546 нм. Отриманий результат порівнювали з калібровочною кривою для визначення рівня NO2–/NO3–, що є лінійною в діапазоні концентрацій від 2,1 до 300 мкмоль/л. Рівень NО визначали за формулою: С (NО) = 227, 273 ´ Е ´ К, де Е — дані, отримані згідно із зіставленням із калібровочною кривою, К — коефіцієнт, що становить 1,18. За референтне значення прийнято 15,84 ± 4,10 мкмоль/л. Дослідження рівня ендотеліну-1 в сироватці крові проводилося за допомогою методу імуноферментного аналізу з використанням наборів фірми Biomedicagruppe (Німеччина).
Надійність (ймовірність нульової гіпотези) вираховували згідно з методом та таблицею Стьюдента. Для твердження про вірогідність різниці враховувалася величина рівня ймовірності (р) — р < 0,05. Результати дослідження наведені кількістю спостережень у групі, відсотками або середнім та середньоквадратичним відхиленням, точним значенням р (Реброва О.Ю., 1996). Вірогідність різниці між відносними величинами визначалася за допомогою методу кутового перетворення Фішера Рj.
Дизайн дослідження передбачав дотримання принципів конфіденційності, концепцію інформованої згоди й урахування основних положень GCР ІCH та Гельсінської декларації з біомедичних досліджень, де людина виступає їх об’єктом, і наступних її переглядів (Сеул, 2008), Конвенції Ради Європи про права людини та біомедицину (2007) та позитивний висновок локальної комісії з біомедичної етики при Чернівецькій обласній дитячій лікарні.
Результати та обговорення
Дітей розподілили за віком, статтю, місцем проживання та нозологічною формою патології (табл. 1–3).
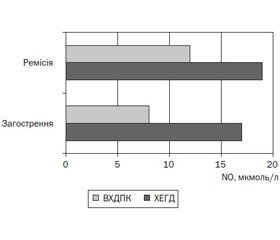
Рівень NО у плазмі крові дітей основної групи був вірогідно нижчим і становив 11,78 ± 1,10 мкмоль/л, р < 0,05. При внутрішньогруповому аналізі в обох групах обстежених дітей вірогідної різниці між вмістом NО у крові залежно від статі та віку не виявлено (р > 0,05). За даними літератури, NО здатний пригнічувати життєдіяльність Helicobacter pylori, незважаючи на те, що останній має цілу низку пристосувань для протидії цьому. Тому актуальним було визначення рівнів NО залежно від наявності даного мікроорганізму в організмі дитини. Результати наведені на рис. 1.
За відсутності Helicobacter pylori рівень NО у крові вірогідно вищий порівняно з групою хворих, в якої діагностовано Helicobacter pylori-асоційовану патологію (р < 0,05). Ця різниця посилюється залежно від ступеня засівання Helicobacter pylori слизової оболонки. Так, при низькому ступені засівання Helicobacter pylori рівень NО у плазмі крові дітей був у 1,7 раза вищим, ніж при високому ступені засівання, та в 1,2 раза вищим від середнього рівня NО при Helicobacter pylori-позитивній патології — відповідно 15,16 ± 1,05 мкмоль/л та 9,43 ± 1,10 мкмоль/л, p < 0,05. Така картина в показниках NO спостерігається як при ВХДПК, так і при ХЕГД, однак варто зауважити, що при ВХДПК рівень NO вірогідно нижчий. Установлена різниця в рівнях NO у крові дітей залежно від періоду хвороби — його рівень вищий у період загострення як ХЕГД, так і ВХДПК (рис. 2). Даний факт зумовлений тим, що в результаті поширеної деструкції слизової оболонки, очевидно, відбувається значне зменшення NО-синтазпродукуючих епітеліоцитів, що призводить до зниження рівня індукованої NО-синтази з наступним зменшенням концентрації NО. На нашу думку, потрібно також врахувати патогенність Helicobacter pylori, що, ймовірно, є більшою при значних виразкових дефектах слизової оболонки.
У середньому в дітей основної групи рівень ендотеліну-1 у крові був вірогідно нижчим, ніж у дітей групи порівняння (0,36 ± 0,02 фмоль/мл та 0,48 ± 0,02 фмоль/мл відповідно, p < 0,01). Виявлено тенденцію до підвищення рівня ендотеліну-1 в дітей із ВХДПК порівняно з його показниками в дітей із ХЕГД (0,34 ± 0,02 фмоль/мл та 0,37 ± 0,02 фмоль/мл, p > 0,05). Рівень ендотеліну-1 у крові дітей також залежав від наявності Helicobacter pylori (табл. 4).
Таким чином, проведене дослідження довело, що при хронічній запальній патології верхніх відділів травного тракту в дітей характер змін рівня ендотеліальних факторів, таких як оксид азоту й ендотелін-1, залежить не тільки від наявності фактора Helicobacter pylori-інфікованості, а й від клінічної форми та періоду хвороби.
Висновки
Рівні метаболітів оксиду азоту (NО) та ендотеліну-1 вірогідно знижені у крові дітей, хворих на ерозивно-виразкову патологію верхніх відділів шлунково-кишкового тракту, залежать від періоду захворювання та наявності Helicobacter pylori і не залежать від віку та статі.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Kotilea K., Bontems P., Touati E. Epidemiology, Diagnosis and Risk Factors of Helicobacter pylori Infection. Adv. Exp. Med. Biol. 2019 Apr 24. doi: 10.1007/5584_2019_357. [Epub ahead of print]
2. Burgard M., Kotilea K., Mekhael J. et al. Evolution of Helicobacter pylori associated with gastroduodenal ulcers or erosions in childrenover the past 23 years: Decline or steady state? Helicobacter. 2019 Jul 8:e12629. doi: 10.1111/hel.12629. [Epub ahead of print]
3. Okuda M., Lin Y., Kikuchi S. Helicobacter pylori Infection in Children and Adolescents. Adv. Exp. Med. Biol. 2019 Apr 30. doi: 10.1007/5584_2019_361. [Epub ahead of print]
4. Цветкова Л.Н., Горячева О.А., Цветков П.М. и др. Гастроэнтерологическая патология у детей: патоморфоз заболеваний и совершенствование методов диагностики на современном этапе. Мат-лы XVIII Конгресса детских гастроэнтерологов. Москва, 2011. С. 5-8.
5. Щербаков А.А., Корсунский А.А., Исаков В.А. Болезни органов пищеварения у детей при хеликобактериозе. Москва: Медицинское информационное агентство, 2011. 224 с.
6. Pacifico L., Anania C., Osborn J.F. et al. Consequences of Helicobacter pylori infection in children. World J. Gastroenterol. 2010. Vol. 16. № 41. Р. 5181-5194. doi:10.3748/wjg.v16.i41.5181.
7. Hagag A.A., Amin S.M., Emara M.H., Abo-Resha S.E. Gastric Mucosal Oxidative Stress Markers in Children with Helicobacter Pylori Infection. Infect Disord Drug Targets. 2018. 18(1). Р. 60-67. doi: 0.2174/1871526517666170502154350.
8. Szlachcic A., Krzysiek-Maczka G., Pajdo R. et al. The impact of asymmetric dimethylarginine (ADAMA), the endogenous nitric oxide (NO) synthase inhibitor, to the pathogenesis of gastric mucosal damage.Curr. Pharm. Des. 2013. 19(1). Р. 90-7.
9. Wang L., Zhou Y., Peng J. et al. Role of endogenous nitric oxide synthase inhibitor in gastric mucosal injury. Can. J. Physiol. Pharmacol. 2008 Mar. 86(3). Р. 97-104. doi: 10.1139/y08-003.
10. Zhang Z., Zou Y.Y., Li F.J., Hu C.P. Asymmetric dimethylarginine: a novel biomarker of gastric mucosal injury? World J Gastroenterol. 2011, May 7. 17(17). Р. 2178-80. doi: 10.3748/wjg.v17.i17.2178.
11. Munzel T., Sinning C., Post F. et al. Pathophysiology, diagnosis and prognostic implications of endothelial dysfunction. Ann. Med. 2008. Vol. 40. № 3. Р. 180-196.
12. Coskun S., Kasirga E., Yilmaz O. et al. Is Helicobacter pylori related to endothelial dysfunction during childhood? Pediatr. Int. 2008 Apr. 50(2). Р. 150-3. doi: 10.1111/j.1442-200X.2008.02542.x.
13. Ohara H., Isomoto H., Wen C.Y. et al. Expression of mucosal addressin cell adhesion molecule 1 on vascular endothelium of gastric mucosa in patients with nodular gastritis. World J. Gastroenterol. 2003 Dec. 9(12). Р. 2701-5. DOI: 10.3748/wjg.v9.i12.2701.
14. Голиков П.П. Роль оксида азота в клинике неотложных состояний. Москва: Медпрактика, 2004. С. 180.

/9-1.jpg)
/10-1.jpg)