Журнал «Здоровье ребенка» Том 14, №5, 2019
Вернуться к номеру
Комплексне лікування атопічного дерматиту в дітей грудного віку із супутньою лактазною недостатністю
Авторы: Шадрін О.Г., Ковальчук А.А., Дюкарева С.В., Фисун В.М.
ДУ «Інститут педіатрії, акушерства і гінекології ім. академіка О.М. Лук’янової НАМН України», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У статті наведені особливості перебігу, сучасні підходи до діагностики та лікування атопічного дерматиту в дітей грудного віку із супутньою лактазною недостатністю. Показана ефективність комплексної терапії із застосуванням ферменту лактази й антигістамінного препарату (диметиндену малеату). Отримана позитивна клініко-лабораторна динаміка вже через 2 тижні спостереження.
В статье представлены особенности течения, современные подходы к диагностике и лечению атопического дерматита у детей грудного возраста с сопутствующей лактазной недостаточностью. Показана эффективность комплексной терапии с применением фермента лактазы и антигистаминного препарата (диметиндена малеата). Получена положительная клинико-лабораторная динамика уже через 2 недели наблюдения.
The article presents the features of the manifestation, modern non-invasive methods of diagnosis and treatment of atopic dermatitis in infants with concomitant lactase deficiency. It is recommended to use the enzyme lactase and antihistamine medicine (dimetindenе maleate) in the comprehensive treatment of children being breastfed and those receiving mixed feeding. Positive clinical and laboratory dynamics has been obtained after 2 weeks of observation.
діти грудного віку; атопічний дерматит; лактазна недостатність; лікування
дети грудного возраста; атопический дерматит; лактазная недостаточность; лечение
infants; atopic dermatitis; lactase insufficiency; treatment
Вступ
Атопічний дерматит (АД) (МКХ-10: Х-L20) — хронічне, генетично детерміноване алергічне захворювання шкіри, в основі якого лежать імунні механізми, котре має вікові особливості, типову локалізацію й морфологію вогнищ запалення, характеризується шкірним свербежем й обумовлене гіперчутливістю як до алергенів, так і до неспецифічних подразників.
В 90 % випадків АД виникає у дітей до 5 років; його поширеність серед дитячого населення розвинених країн становить 12–37 %, при цьому збільшується кількість хворих із торпідним перебігом (36,7 % випадків) та із частим вторинним інфікуванням у ранньому віці (до 55,3 %) [19]. Протягом останніх десятирічь поширеність АД продовжує неухильно зростати. Як хронічне захворювання, АД суттєво погіршує якість життя дитини та її родини, призводить до порушення в емоційній сфері та соціальної дезадаптації [2, 23, 24].
Причини та тригерні фактори розвитку АД:
— генетичний фактор: якщо обидва батьки мають алергічне захворювання, ризик виникнення патологічних змін шкіри в дитини становить 60–80 %, якщо один із батьків — 40–50 %, за відсутності спадкової схильності — 13–15 %;
— харчові продукти (трофалергени): на даний час установлено понад 160 харчових алергенів, що обумовлюють IgE-залежні алергічні реакції в дітей. До так званої «великої вісімки» продуктів, що найчастіше викликають алергічні прояви, відносять: коров’яче молоко (2,5 %), куряче яйце (1,3 %), арахіс (0,8 %), сою (0,7 %), пшеницю (0,2 %), горіхи (0,2 %), рибу та морепродукти (0,1 %). До поширених алергенів відносять також какао, шоколад, мед, цитрусові, полуницю, суницю, телятину, куряче м’ясо. Установлено, що харчові алергени абсорбуються з кишечника матері, яка годує, дифундують у кров і за 1–6 годин проникають у грудне молоко, що в подальшому сприяє формуванню харчової толерантності. При анафілактичному, IgE-залежному механізмі достатньо мінімальної кількості алергенів для розвитку клінічних симптомів [2, 22–24].
Найбільш поширеним алергеном уважається коров’яче молоко (у тому числі й цільні молочні суміші). У його сироватковій фракції виявлено не менше ніж 36 білкових антигенів, у фракції казеїну — не менше ніж 6. Найбільшу алергенність має бета-лактоглобулін, що становить 10 % білків коров’ячого молока (БКМ), є видоспецифічним і термостабільним. Козяче молоко у 90 % випадків може викликати перехресні алергічні реакції у хворих з алергією до БКМ.
У ранньому дитячому віці провідними тригерами є харчові. Це пов’язано з анатомо-фізіологічними особливостями шлунково-кишкового тракту та становленням імунної системи дитини. Харчова сенсибілізація зустрічається в половини дітей із тяжкою формою АД. Її наявність можна оцінити за допомогою подвійного сліпого плацебо-контрольованого харчового провокаційного тесту. Харчова алергія зустрічається в 30 % дітей з АД [27].
Особливостями бар’єрної функції шкіри в дітей раннього віку є: мала товщина, три шари (у дорослих — п’ять), інтенсивна мікроциркуляція, більш інтенсивні процеси мітозу, слабке сполучення кератиноцитів базального шару між собою, більша васкуляризація, висока гідрофільність рогового шару, насиченість дерми клітинними елементами (у дорослих переважає волокниста структура), посилений обмін речовин, зменшений уміст керамідів (легке висушування), порушення синтезу фосфоліпідів мембран клітин, більш частий розвиток піодермій та кандидозної інфекції за рахунок нейтральної або лужної реакції, неврегульовані функції потових та сальних залоз, парасимпатикотонія (швидке розвинення порушень мікроциркуляції та трофіки), неповне утворення меланіну [27].
Крім того, може відзначатися порушення імунологічної відповіді: генетична схильність до дисбалансу між Th1 та Th2, з перевагою останніх, які виділяють інтерлейкіни, що сприяють синтезу IgE та IgG. Останні, зв’язуючись із рецепторами клітин-мішеней, сприяють їх дегрануляції з виділенням медіаторів алергічного запалення [17, 19].
У 10–30 % хворих АД не супроводжується підвищенням рівня IgE — у цих хворих мають місце інші імунологічні та неімунологічні механізми запалення. З імунологічних механізмів гіперчутливості в шкірі реалізуються всі відомі типи реакцій (окрім IgE-залежного): клітинно-опосередковані, цитотоксичні, імунокомплексні, неімунні (псевдоалергічні) [27].
Визначення та оцінка ознак інтенсивності захворювання проводяться за індексом SCORAD (Scoring of atopic dermatitis).
Принципи лікування АД у дитячому віці:
1. Загальні заходи:
— гіпоалергенний побут, купання, зволоження тощо;
— елімінаційна дієтотерапія, тривале грудне вигодовування, гіпоалергенна дієта.
2. Топічна терапія.
3. Лікування свербежу.
Згідно з сучасним протоколом лікування АД [27], дискутабельним залишається питання ефективності застосування антигістамінних препаратів (АГП), проте вони, як відомо, стабілізують гістамінові рецептори та забезпечують блокування ранньої атопічної реакції. Їх застосування обґрунтоване значенням гістаміну в патогенезі алергічних реакцій. У гострий період, при наявності сильного шкірного свербежу, коли потрібні швидка дія, протисвербіжний і седативний ефект, призначаються препарати першого покоління. Ці препарати можуть бути призначені дітям віком від 1 місяця життя.
Спектр дії диметиндену малеату (антиалергічний, протисвербіжний) і швидкий початок його дії є підставою для призначення препарату перш за все при гострих алергічних реакціях на харчові продукти, лікарські препарати, укуси комах, для купірування шкірного свербежу різного походження, при алергічних захворюваннях із тривалістю симптомів не більше двох тижнів [1, 2].
Відомо, що АД часто супроводжується супутньою патологією, у тому числі лактазною недостатністю (ЛН) [2, 27].
ЛН (МКХ-10: Е73) — це вроджений або набутий стан, що характеризується зниженням рівня ферменту лактази, яка розщеплює молочний цукор у тонкій кишці, та має латентний або маніфестний перебіг.
Хоча непереносимість лактози значно поширена серед населення нашої планети, безумовно, найбільшу значимість проблема має для дітей раннього віку, оскільки саме в цей віковий період молочні продукти становлять основу їх раціону.
Лактаза (лактаза-флоридзин-гідролаза) відноситься до найбільш чутливих ферментів тонкої кишки, концентрація її значно нижча, ніж інших ферментів пристінкового травлення. При дефіциті лактази нерозщеплені вуглеводи накопичуються в просвіті тонкої кишки, унаслідок чого виникає підвищений осмотичний тиск, що призводить до надлишкового надходження води в просвіт кишечника.
Ген, що кодує синтез лактази, локалізується на довгому плечі 2-ї хромосоми. Лактазна активність з’являється внутрішньоутробно в перші 3 місяці гестації, підвищується до моменту народження. У доношених новонароджених активність цього ферменту у 2–4 рази вища, ніж у дітей 10–12 місяців. У наступні роки активність лактази в нормі знижується, становлячи в дорослих лише 5–10 % від початкового рівня, й виявляється в тонкій кишці у вигляді ділянок. Вік, у якому активність лактази знижується, надзвичайно варіабельний і залежить від місця проживання, популяції, особливостей харчування, генетичних механізмів.
Отже, аномальна алель у людській популяції призводить до персистенції активності лактази, а не її дефіциту. Це положення підтверджується також тим, що в інших ссавців лактазна активність зникає після закінчення годування материнським молоком [5, 6].
За ступенем вираженості ЛН ділиться на часткову (гіполактазія) і повну (алактазія); за походженням — на первинну і вторинну. Варіантами первинної ЛН вважаються:
— природжена ЛН — генетично обумовлена, сімейна (зустрічається дуже рідко) [1, 2, 21];
— транзиторна ЛН — у недоношених і незрілих на момент народження дітей;
— ЛН дорослого типу (конституційна) — найбільш поширена, хоча найменшою мірою загрожує здоров’ю, оскільки є не стільки захворюванням, скільки фенотиповою особливістю популяції.
Лактоза є харчовим субстратом для молочнокислих бактерій (переважно лакто- і біфідобактерій), її незначне надходження в товсту кишку необхідне для закислення вмісту і формування нормального біоценозу кишечника, а також для утворення молочної й оцтової кислот та газів — діоксиду вуглецю, метану й водню. Кислоти стимулюють перистальтику кишечника, а кисле середовище запобігає розмноженню гнилісної флори. При надлишковому надходженні лактози в товсту кишку виникають підвищений осмотичний тиск, кількісні і якісні зміни складу кишкової мікрофлори з розвитком клінічних проявів діарейного синдрому [14, 15]. У 10 % грудних дітей із гіпоксичним ураженням центральної нервової системи і спазмом кишок спостерігається так звана закрепна форма ЛН [14, 16], що характеризується відсутністю самостійної дефекації при наявності рідких калових мас і характерних симптомів: рідкого, пінистого випорожнення з великою кількістю води і кислим запахом, а також здуття живота, абдомінальних болів і бурчання, зригувань, вираженого відходження газів.
Вираженість клінічних проявів при ЛН широко варіює, що обумовлене рівнем активності ферменту, кількістю лактози, що надходить в організм із харчуванням, індивідуальною чутливістю кишечника, особливостями кишкового біоценозу тощо.
Лактоза призводить до патологічних процесів в кишечнику: зокрема, надлишкового лактозозалежного бактеріального росту, що може ініціювати розвиток мукозиту із гіперплазією бокалоподібних клітин, інфільтрацією власної пластинки поліморфноядерними клітинами, дезінтеграції слизової оболонки і м’язового шару [1, 2, 21]. Сенсибілізація лімфоцитів у слизово-асоційованій лімфоїдній тканині кишечника призводить до подальшої їх фіксації в слизовій оболонці інших органів і шкірних покривів. У дітей із ЛН на шкірних покривах і в кишечнику збільшується кількість колоній золотистого стафілокока, який виділяє суперантиген — тригер атопічного дерматиту [1, 2, 20]. За даними Gupta et al. (2004), ступінь зниження активності лактази тісно корелює зі ступенем атрофії ворсин і вираженістю запального процесу в слизовій оболонці тонкої кишки. Така ЛН називається вторинною, і причинами її розвитку можуть бути: інфекції (ротавіруси, умовно-патогенна мікрофлора), харчова алергія, целіакія, лямбліоз, ентерити тощо. А оскільки симптоматика ЛН нашаровується на симптоми основного захворювання, діагностика її може бути досить утруднена.
Діагноз встановлюють на підставі характерних клінічних проявів і підтверджених додаткових методів дослідження. Важливою ознакою ЛН є зменшення диспептичних симптомів при переході на безлактозну дієту.
Зважаючи на вищенаведене, ми проаналізували ефективність комплексного лікування АД у дітей раннього віку з ЛН. Як антигістамінний препарат використовували диметиндену малеат (Фенокіт). Дія диметиндену малеату розвивається через 30–60 хвилин, біодоступність становить близько 70 %, максимальна концентрація в плазмі крові досягається через 2 години, період напіввиведення становить майже 6 годин, метаболіти виводяться з жовчю і сечею (5–10 % — у незмінному вигляді). Слід відмітити, що, на відміну від інших АГП першого покоління, диметиндену малеат має слабкий седативний (7,8 % випадків) та антихолінергічний (сухість у роті, порушення сечовиділення тощо) ефект, виражену протисвербіжну дію (до 87 %). До недоліків більшості АГП першого покоління відноситься неселективне й неповне зв’язування з церебральними Н1-рецепторами та феномен тахіфілаксії (поступове зниження ефективності при тривалому застосуванні), що вимагає зміни препарату кожні 7–10 днів [2, 21].
Лікування ЛН проводили лише у випадку клінічних проявів. Основним принципом був диференційований підхід залежно від віку дитини, типу і ступеня тяжкості ферментопатії.
Зважаючи на небажаність виключення молочного харчування в грудному віці, використовували фермент лактазу (Лактазік Сперко), який змішується з молоком й розщеплює лактозу, не впливаючи на інші його властивості. Лактазік Сперко випускається спільним українсько-іспанським підприємством «Сперко Україна» у вигляді оральних крапель, в 1 мл розчину яких міститься 3000 ALU лактази. Дозування підбирається залежно від віку дитини й кількості молока на один прийом їжі.
Лікарський препарат Фенокіт (краплі оральні) виробництва спільного українсько-іспанського підприємства «Сперко Україна» містить діючу речовину диметиндену малеат, що є антагоністом Н1-рецепторів і чинить антикінінову, слабку антихолінергічну й седативну дію, знижує підвищену проникність капілярів, пов’язаних з алергією. Добова доза становить 0,1 мг (тобто 2 краплі) на 1 кг маси тіла, кратність застосування — 3 рази на добу. Краплі додають у пляшечку з теплим дитячим харчуванням безпосередньо перед годуванням, їх можна застосовувати нерозведеними.
Мета роботи: вивчити ефективність комплексної терапії АД у дітей із супутньою ЛН із включенням антигістамінного препарату першого покоління Фенокіт та ферменту лактази Лактазік Сперко («Сперко Україна»).
Матеріали та методи
Під спостереженням перебували 40 дітей (23 хлопчики і 17 дівчаток) із діагностованим АД і супутньою ЛН (транзиторною чи вторинною), віком від 1 до 6 місяців, які знаходилися на лікуванні у відділенні проблем харчування та соматичної патології дітей раннього віку ДУ «Інститут педіатрії, акушерства і гінекології ім. академіка О.М. Лук’янової НАМН України». Діагноз АД верифікували, застосовуючи Протокол МОЗ № 30 від 31.03.2015 р. (у тому числі розрахунок індексу SCORAD) та Уніфікований клінічний протокол медичної допомоги дітям із лактазною недостатністю № 59 від 29.01.2013 р.
Установлення діагнозу АД підтверджене за допомогою обрахунку індексу SCORAD:
Індекс SCORAD = А/5 + 7 ´ В/2 + С,
де А — площа ураженої шкіри (%);
В — сума балів об’єктивних ознак (еритема, набряк, мокнуття, екскоріація, ліхеніфікація, сухість);
С — сума балів суб’єктивних ознак (свербіж, порушення сну, дратівливість).
При сумі балів до 20 перебіг має розцінюватися як легкий, від 20 до 40 балів — середньої тяжкості, понад 40 — тяжкий.
Ступінь вираженості окремих клінічних симптомів ЛН на фоні лікування оцінювали за бальними шкалами від 0 до 3 балів [15].
Рідкі випорожнення (Степанов О.Г., 2009 р.):
— 0 балів — кашкоподібні випорожнення без патологічних домішок;
— 1 бал — нестійкі, розріджені випорожнення до 3 разів на добу;
— 2 бали — нестійкі, розріджені випорожнення до 6 разів на добу;
— 3 бали — нестійкі, розріджені випорожнення понад 6 разів на добу.
Метеоризм (Степанов О.Г., 2009 р.):
— 0 балів – дуже рідко;
— 1 бал — рідко;
— 2 бали — за кожним годуванням;
— 3 бали — дуже часто.
Кишкові коліки (Захарова И.Н., 2008 р.):
— 0 балів — немає;
— 1 бал — тільки у вечірній час;
— 2 бали — після кожного годування та у вечірній час;
— 3 бали — протягом усієї доби.
Характер зригувань і блювання (Бабаян М.Л., 2010 р.):
— 0 балів — немає;
— 1 бал — менше ніж 5 зригувань на добу об’ємом не більше ніж 3 мл;
— 2 бали — більше ніж 5 зригувань на добу об’ємом більше ніж 3 мл;
— 3 бали — більше ніж 5 зригувань на добу об’ємом до 1/2 кількості їжі, введеної за одне годування.
Порушення сну:
— 0 балів — немає;
— 1 бал — пробудження 1–2 рази за ніч;
— 2 бали — пробудження під час денного сну;
— 3 бали — короткочасний денний та нічний сон.
Дратівливість дитини:
— 0 балів — немає;
— 1 бал — незначний короткочасний плач у денний час;
— 2 бали — плач короткочасний у денний і нічний час;
— 3 бали — частий плач удень та вночі.
Закрепи (Степанов О.Г., 2009 р.):
— 0 балів — немає;
— 1 бал — 1 раз на тиждень;
— 2 бали — 2 рази на тиждень;
— 3 бали — частіше 2 разів на тиждень.
Для діагностування ЛН використовувалась проба Бенедикта (вуглеводи в калі) та визначення рН калу. Проба Бенедикта і рН калу (на момент включення і при завершенні дослідження) оцінювались так: блакитна смужка — 0,0 г%, зелена смужка без осаду — 0,05–0,15 г%, зелена смужка з осадом — 0,2–0,4 г%, оливково-жовта смужка — 0,5–0,75 г%, помаранчева смужка 1,0–1,65 г% і світло-червона смужка — 2,0 г% і вище.
Додатковими методами дослідження були загальноклінічні аналізи крові і сечі, УЗД органів черевної порожнини.
Критеріями оцінки ефективності комплексного лікування були:
— об’єктивна оцінка тяжкості перебігу АД за індексом SCORAD у динаміці (на початку лікування, на фоні лікування й на момент завершення дослідження);
— оцінка динаміки клінічних симптомів АД і ЛН за бальними шкалами;
— оцінка динаміки результатів проби Бенедикта і рН калу на момент включення і при завершенні дослідження.
Усі діти, які знаходилися під спостереженням, отримували комплексне лікування, що включало прийом препарату Фенокіт (3 рази на день) і ферменту лактази Лактазік Сперко (під час кожного годування) згідно з інструкцією для медичного застосування та листком-вкладкою відповідно.
Результати та обговорення
Аналіз перинатального анамнезу показав, що всі діти з АД і ЛН мали низку негативних анамнестичних факторів: антенатальна загроза переривання вагітності спостерігалася в 7 (17,5 %) випадках, ранні й пізні гестози — у 8 (20,0 %), анемія 1–2-го ст. — в 11 (27,5 %), професійні шкідливості — у 5 (12,5 %). Патологія вагітності спостерігалась у 12 (30,0 %) матерів, а патологія пологів — у 8 (20,0 %).
Усі обстежені діти народилися вчасно, від 1-ї та 2-ї вагітності. На грудному вигодовуванні була 31 (77,5 %) дитина, а 9 (22,5 %) дітей — на змішаному харчуванні з догодовуванням повноцінними молочними сумішами, окрім безлактозних.
За генеалогічним анамнезом визначали наявність у сім’ї алергічних захворювань та непереносимості молока. У 29 (72,5 %) дітей батьки страждали від того чи іншого алергічного захворювання, а в 7 (17,5 %) — один із батьків в анамнезі мав алергію. Симптоми непереносимості молока (здуття живота, абдомінальні болі, діареї, відраза) відмічалися в батьків 33 (82,5 %) дітей тією чи іншою мірою. Як свідчать анамнестичні дані, спадковість має високу діагностичну інформативність при АД і ЛН.
Шкірні покриви в обстежених дітей характеризувалися наявністю типових за морфологією й локалізацією елементів висипу. У всіх обстежених дітей були виражені набряк й еритема, а також сухість, подразливість у складках шкіри.
За індексом SCORAD у 15 (37,5 %) обстежених дітей був легкий ступінь тяжкості АД із середнім балом 18,5, а у 25 (62,5 %) дітей — середньотяжкий ступінь із середнім балом 32,5.
Динаміку клінічних симптомів ЛН на фоні лікування наведено в табл. 1.
Найвища ефективність комплексної терапії із застосуванням препарату Фенокіт і ферменту лактази Лактазік Сперко відзначена при оцінці динаміки клінічних симптомів в обстежених дітей: оцінка нестійкого розрідженого калу на початку лікування була в середньому 2,80 бала, на 7-й день — 1,67 і на кінець спостереження — 0,28 бала, що демонструє чітку позитивну динаміку.
Була зафіксована й виражена динаміка метеоризму: на початку спостереження оцінка симптому становила 2,27 бала, на 7-й день — 1,67, на кінець дослідження — 0,20 бала. Оскільки основною причиною кишкових кольок у дітей раннього віку є метеоризм, оцінка цього симптому за бальною системою була близькою до оцінки попереднього симптому.
На початку захворювання кишкові коліки відмічалися в усіх 40 дітей, середній бал становив 2,15, на 7-й день спостереження відмічалося значне їх зменшення — 1,45 бала, на кінець лікування періодичні кишкові коліки відмічались лише в 11 дітей (середній бал 0,27).
Зригування і періодичне блювання на початку захворювання із різною мірою прояву відмічалися в 37 дітей (середній бал 2,02), у динаміці спостереження частота їх зменшилася: на 7-й день — майже вдвічі (1,05 бала), на кінець спостереження — 0,12 бала.
Що ж стосується оцінюваних клінічних симптомів неврологічного статусу (порушення сну і дратівливість), то на кінець спостереження ці симптоми зникли не повністю, що потребувало нагляду невролога в подальшому (табл. 1).
Отже, у всіх дітей, які знаходились під спостереженням, уже на 7-й день відмічалося зменшення кількості дефекацій до 2–4 разів на добу, кал набував кашкоподібної консистенції, значно зменшилися газоутворення в кишечнику й болі в животі.
Показники крові були стабільні, число еозинофілів крові не зростало, загальні аналізи сечі знаходились у межах фізіологічної норми. При УЗД органів черевної порожнини ехоструктурні зміни характеризували супутню патологію.
Як показано в табл. 2, на фоні комплексного лікування (на 7-й день) зменшилися як клінічні прояви АД, так і визначений за формулою індекс SCORAD: 23 (57,5 %) дитини мали легкий ступінь тяжкості захворювання із середнім балом 19,5, 17 (42,5 %) дітей — середній ступінь (середній бал 30,5). На момент завершення дослідження у 18 (45,0 %) дітей зникли ознаки АД, у 16 (40,0 %) відзначалися суттєве покращення стану шкіри, зменшення площі ураження, зменшення суми балів об’єктивних і суб’єктивних ознак — 16,0 бала. У 6 дітей (15,0 %) залишалися середньотяжкі прояви АД (23,0 бала), із чіткою позитивною динамікою, але встановлення етіопатогенезу захворювання потребувало подальшого більш глибокого дообстеження й лікування.
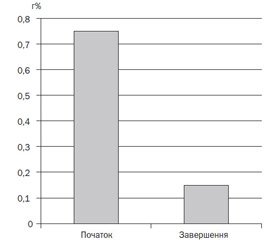
Екскреція вуглеводів із калом на початку дослідження становила 0,75 %, а рН — 5,0 (рис. 1, 2). На момент завершення спостереження вуглеводи калу становили 0,15 %, а рН калу — 6,5 (рис. 1, 2).
Таким чином, використовуючи раціональні дієтологічні підходи в лікуванні АД у дітей першого півріччя життя із супутньою ЛН із застосуванням ферментотерапії (Лактазік Сперко) й антигістамінного препарату першого покоління диметиндену малеату (Фенокіт), можна в короткий строк значно покращити стан дітей, максимально зберігаючи природне вигодування материнським молоком.
Висновки
1. Перебіг АД у дітей грудного віку в значній кількості випадків ускладнюється наявністю ЛН, що потребує комплексного лікування із застосуванням ферменту лактази.
2. Включення антигістамінного препарату першого покоління Фенокіт (диметиндену малеат) коротким курсом є ефективним і не призводить до появи побічних ефектів.
3. Включення в комплексну терапію АД препаратів Фенокіт та дієтичної добавки Лактазік Сперко («Сперко Україна») показало свою ефективність. Випадків побічної дії не встановлено.
Конфлікт інтересів. Не заявлений.
1. Абатуров О.Е., Борисова Т.П. Диференційований підхід до призначення антигістамінних препаратів при алергічних захворюваннях в дитячому віці. Здоровье ребенка. 2016. № 5(73). С. 24-30.
2. Абатуров О.Е., Никулина А.А. Первичный дефицит лактазы и лактазная персистенция у детей. 2019. 158 с.
3. Кондюрина Е.Г., Елкина Т.Н., Грибанова О.А., Татаренко Ю.А. Антигистаминные препараты первого поколения в педиатрической практике. Русский медицинский журнал. 2011. № 22(19). С. 1357-1360.
4. Борисова Т.П. Подход к выбору антигистаминного препарата в лечении аллергических заболеваний и состояний в детской практике. Здоровье ребенка. 2015. № 8(68). С. 33-44.
5. Добмейер Т. Актуальность и опыт более чем 40-летнего применения диметиндена малеата. Врач. 2012. № 4. С. 51-54.
6. Косенко И.М. Антигистаминные препараты: рациональное применение в педиатрической практике. Педиатрия. 2013. № 2. С. 67-71.
7. Малахов А.Б., Волков И.К., Малахова-Капанадзе М.А. Антигистаминные препараты и их место в терапии аллергических заболеваний. Справочник поликлинического врача. 2007. № 1. С. 23-28.
8. Овчаренко Л.С., Вертегел А.А., Андриенко Т.Г. Рациональное использование антигистаминных препаратов в программе терапии клинических проявлений пищевой аллергии у детей. Современная педиатрия. 2012. № 4(44). С. 46-49.
9. Ревякина В.А. Антигистаминные препараты в клинической практике. Дискуссионные вопросы. Взгляд врача на привычные препараты. Лечащий врач. 2010. № 7. С. 71-73.
10. Терек Е., Катона М. Применение диметиндена малеата при различных зудящих заболеваниях кожи в детском возрасте. Лечащий врач. 2011. № 4. С. 86-87.
11. Борисова Т.П. Подход к выбору антигистаминного препарата в лечении аллергических заболеваний и состояний в детской практике. Здоровье ребенка. 2015. № 8(68). С. 33-37.
12. Марушко Ю.В. Опыт применения левоцетиризина в педиатрической практике. Здоровье ребенка. 2014. № 8. С. 43-48.
13. Марушко Ю.В., Шеф Г.Г. Можливості застосування левоцетиризину в терапії бронхітів та пневмоній у дітей з атопічними станами. Здоровье ребенка. 2013. № 4. С. 12-17.
14. Ипатова М.Г., Дубровская М.И., Корнева Т.И., Кургашева Е.К., Мухина Ю.Г. Лактазная недостаточность у детей раннего возраста и особенности питания при патологии. Разбор клинических случаев. Вопросы современной педиатрии. 2012. № 1(11). С. 119-123.
15. Марушко Ю.В., Іовіца Т.В., Тодика Ю.І. Діагностичне значення клінічних симптомів транзиторної лактазної недостатності у дітей першого півріччя життя. Дитячий лікар. 2017. № 3(54). С. 5-8.
16. Шадрін О.Г., Марушко Т.Л., Місник В.П., Фісун В.М., Марушко К.Р. Проблемні питання перебігу та терапії лактазної недостатності у дітей. Современная педиатрия. 2011. № 6(40). С. 157-162.
17. Филипинский Г.К., Климов Л.Я., Возненко А.А. и др. Определение углеводов и органических кислот в кале у детей грудного возраста с непереносимостью лактозы, получающих высоколактозное питание. Педиатрия. 2011. Т. 4. С. 220-259.
18. Овчаренко Л.С., Вертегел А.А., Андриенко Т.Г., Жихарева Н.В., Самохин И.В. Рациональное использование антигистаминных препаратов в программе терапии клинических проявлений пищевой аллергии у детей. Современная педиатрия. 2012. № 4(44). С. 46-49.
19. Березина Т.Г., Синоверська О.Б. Атопічний дерматит у дітей. Методичні рекомендації. 2015. 51 с.
20. Делягин В.М., Каграманова К.Г., Шугурина Е.Г. и др. Полиморфизм гена лактазы у детей с атопическими заболеваниями. Педиатрия. 2008. № 87(4). С. 16-24.
21. Абатуров А.Е., Никулина А.А., Петренко Л.Л. Лактазная недостаточность у детей. Международный журнал педиатрии, акушерства и гинекологии. 2015. Т. 7, № 2. С. 51-61.
22. Yang J.F., Fox M., Chu H., Long Y.-Q., Pohl D., Fried M., Dai N. Four-sample lactose hydrogen breath test for diagnosis of lactose malabsorption in irritable bowel syndrome patient with diarrhea. World J. Gastroenterol. 2015. Vol. 2(24). P.7563-7570.
23. Vandeplans Y. Lactose intolerance. Asia Pac. J. Clin. Nutr. 2015. Vol. 24 (suppl. 1). S. 9-13.
24. Wahlqwist M.L. Lactose nutrition in lactase non-persistence. Asia Pac. J. Clin. Nutr. 2015. Vol. 24(1). P. 21-5.
25. Pediatric Allergy: Principles and Practice. Edited by Donald Y.M. Leung, Hugh A. Sampson, Raif Geha and Stanley J. Szefler. 2nd ed. Philadelphia, PA, Elsevier. 2010. 688 р.
26. Slomski A. Treatment rather than Avoidance may be within reach for children with food allergies. Jama. 2012. Vol. 307(4). P. 345-347.
27. Wollenberg A. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part 1. J. Eur. Acad. Dermatol. Venerol. 2018 May. Vol. 32(5). Р. 657-682.

/23-1.jpg)
/24-2.jpg)
/24-1.jpg)
/25-1.jpg)