Журнал «Здоровье ребенка» Том 14, №5, 2019
Вернуться к номеру
Вибір антибактеріального препарату при інфекціях сечовидільної системи в дітей
Авторы: Абатуров О.Є., Нікуліна А.О.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Інфекції сечовидільної системи в дитячому віці посідають друге місце за частотою звернень по первинну медичну допомогу. Escherichia coli є найбільшим причинно-значимим збудником позалікарняних форм інфекцій сечовидільної системи, що, як правило, мають неускладнений характер і частіше діагностуються в дівчаток після тримісячного віку. Klebsiella pneumoniae превалює при нозокоміальних формах інфекцій сечовивідних шляхів, що характеризуються ускладненим перебігом і частіше діагностуються в хлопчиків до тримісячного віку. Однією з причин повторних епізодів інфекцій сечовивідних шляхів є формування антибіотикорезистентності за рахунок дії β-лактамаз мікроорганізмів до антибактеріальних препаратів групи амінопеніцилінів, що призначаються найбільш часто. У літературному огляді обґрунтовано вибір антибактеріальної терапії інфекцій сечовидільної системи в дитячому віці з урахуванням клінічної ефективності, безпечності й чутливості основних уропатогенів. Узагальнені результати рандомізованих клінічних досліджень стосовно ефективності й безпечності використання цефалоспорину ІІІ покоління цефіксиму в дітей з інфекціями сечовидільної системи. Особливу увагу приділено збереженню бактеріальної чутливості на рівні понад 90 % до дії цефіксиму в Escherichia coli і Klebsiella pneumoniae та високій комплаєнтності при можливості однократного щоденного перорального призначення як самостійної терапії на амбулаторному етапі й потенційного переходу від парентерального використання цефалоспоринів ІІІ покоління до менш інвазивного — перорального прийому, особливо в дітей.
Инфекции мочевыделительной системы в детском возрасте занимают второе место по частоте обращений за первичной медицинской помощью. Escherichia coli — наибольший причинно-значимый возбудитель внебольничных форм инфекций мочевыделительной системы, которые, как правило, носят неосложненный характер и чаще диагностируются у девочек после трехмесячного возраста. Klebsiella pneumoniae превалирует при нозокомиальных формах инфекций мочевыводящих путей, характеризующихся осложненным течением и чаще диагностируемых у мальчиков до трехмесячного возраста. Одной из причин повторных эпизодов инфекций мочевыводящих путей является формирование антибиотикорезистентности за счет действия β-лактамаз микроорганизмов к наиболее часто используемым антибактериальным препаратам группы аминопенициллинов. В литературном обзоре обоснован выбор антибактериальной терапии инфекций мочевыделительной системы в детском возрасте с учетом клинической эффективности, безопасности и чувствительности основных уропатогенов. Обобщены результаты рандомизированных клинических исследований эффективности и безопасности использования цефалоспорина III поколения цефиксима у детей с инфекциями мочевыделительной системы. Особое внимание уделено сохранению бактериальной чувствительности на уровне свыше 90 % к действию цефиксима у Escherichia coli и Klebsiella pneumoniae и высокой комплаентности при возможности однократного ежедневного перорального применения в качестве самостоятельной терапии на амбулаторном этапе и потенциального перехода от парентерального использования цефалоспоринов III поколения к менее инвазивному — пероральному приему, особенно у детей.
Infections of the urinary system in childhood take the second place in the frequency of visits for primary medical care. Escherichia coli is the most causative agent of community-acquired forms of infections of the urinary system, which, as a rule, are uncomplicated and are more often diagnosed in girls after three months of age. Klebsiella pneumoniae prevails in nosocomial forms of urinary tract infections, characterized by a complicated course and more often diagnosed in boys up to three months of age. One of the causes of repeated episodes of urinary tract infections is the formation of antibiotic resistance due to the action of β-lactamases of microorganisms on the most commonly used antibacterial drugs of the aminopenicillin group. The literature review substantiates the antibiotic choice for the treatment of urinary infections in children, taking into account the clinical efficacy, safety and sensitivity of the main uropathogens. The results of the randomized clinical trials on the efficacy and safety of the use of the third generation cephalosporin — cefixime in children with urinary tract infections are summarized. Particular attention is paid to maintaining bacterial sensitivity at a level of over 90 % to the action of cefixime in Escherichia coli and Klebsiella pneumoniae, and high compliance with the possibility of a single daily oral administration as an independent therapy on an outpatient basis and the possibility of switching from parenteral use of the third generation cephalosporins to a less invasive, especially in children, oral method.
інфекції сечовидільної системи; діти; цефалоспорини ІІІ покоління; цефіксим; огляд
инфекции мочевыделительной системы; дети; цефалоспорины III поколения; цефиксим; обзор
urinary tract infections; children; third generation cephalosporins; cefixime; review
Вступ
Інфекції сечовидільної системи (ІСВС) — найбільш часті документально підтверджені бактеріальні інфекції в дітей, що посідають друге місце за рівнем звернень по первинну медичну допомогу після інфекцій респіраторного тракту. Поширеність ІСВС у дитячій популяції становить 18 випадків на 1000 осіб. До 3-місячного віку ІСВС частіше зустрічаються у хлопчиків, після 3-місячного віку — у дівчаток. До семи років 8,4 % дівчаток і 1,7 % хлопчиків мають як мінімум один епізод ІСВС [26].
За даними різних авторів, бактерії Escherichia coli майже в 90 % випадків викликають позалікарняну ІСВС, тоді як Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus miribalis, деякі види Enterococcus, Enterobacter cloacae, Citrobacter freundii — найбільш значимі уропатогени в дітей із нозокоміальною формою ІСВС. У новонароджених відносно частою причиною ІСВС є стрептококи типів А і В. Цікавим є той факт, що у віковій групі дітей від 0 до 14 років відмічається превалювання коменсальної Escherichia coli як причинно-значимого патогену серед 80,2 % дівчаток і розвиток неускладненої ІСВС, тоді як у 19,8 % хлопчиків того ж віку частіше діагностується нозокоміальна мікрофлора й розвиток ускладненої ІСВС (р < 0,0001) [13].
Інфікування сечовивідних шляхів відбувається висхідним шляхом або при транслокації уропатогенів з вихідного біотопу (кишечник, мигдалики, зуби тощо) в нирки. Колонізація уропатогенів характеризується подоланням мікроорганізмами імунобіологічних бар’єрів господаря і їх закріпленням у тканині сечовивідних шляхів, у тому числі на канальцевому й чашково-мисковому уроепітелії [1].
Чинне керівництво Американської академії педіатрії з ведення ІСВС у дітей з лихоманкою і дітей раннього віку пропонує давати пероральні або парентеральні (потім покроково замінені на пероральні) антибіотики протягом 7–14 днів. Цефтріаксон, цефотаксим, цефтазидим, гентаміцин, тобраміцин і піперацилін є препаратами вибору для парентеральної терапії. На відміну від них амоксицилін/клавуланат, сульфонаміди (триметоприм/сульфаметоксазол або сульфісоксазол) або цефалоспорини (цефіксим, цефподоксим, цефпрозил, цефуроксиму аксетил або цефалексин) рекомендуються як пероральні препарати [6, 23].
В усьому світі реєструється розширений спектр антибіотикорезистентності за рахунок дії ферментів b-лактамаз мікроорганізмів (extended spectrum betalactamases — ESBL). За даними Європейського нагляду за резистентністю до антибактеріальних препаратів (EARS-Net) 2017 р., відбувається значне зростання середньозваженої частки дорослого населення в ЄС з антибіотикорезистентністю до амінопеніцилінів, що призначаються найбільш часто для лікування ІСВС (58,7 %), за ними йдуть фторхінолони (25,7 %), цефалоспорини (14,9 %) і аміноглікозиди (11,4 %) [9, 17]. На сьогодні, за даними дослідження Fardod O’Kelly та співавт. [21], ESBL кишкової палички до амоксициліну/клавуланату становить 94,74 %. Доведено, що ризик антибіотикорезистентності збільшується серед дітей з неврологічною патологією, попереднім прийомом антибіотиків протягом останніх 3 місяців, госпіталізацією, що передувала ІСВС протягом 1 місяця (р < 0,001) [10], а також за наявності міхурово-сечовідного рефлюксу (співвідношення шансів (СШ) = 2,79; 95% довірчий інтервал (ДІ) 1,39–5,58) [11].
Формування розширеного спектра антибактеріальної резистентності пояснюється точковими мутаціями в локусі «� Witte W, 20» ферментів b-лактамаз мікроорганізмів, що надає здатності до гідролізу антибіотиків вузького спектра й значного поширення цих ферментів за рахунок їх кодування в плазмідах [8, 19].
Доведено, що частка ESBL-уропатогенів вища в чоловіків (4,8 %), ніж у жінок (3,0 %), і збільшується з віком: від 2 % у дітей до 5,4 % в осіб віком понад 80 років [16]. Водночас, за даними дослідження Tahir Kamal Hameed та співавт. [13], загальна частка ESBL-продукуючої Escherichia coli серед дітей становить 7,9 %, стійка до ампіциліну — виявляється в 68 % клінічних ізолятів, до ко-тримоксазолу — в 54 %, до нітрофурантоїну — у 12,6 %, до гентаміцину — у 7,6 %, із проміжною чутливістю до амоксициліну/клавуланату — в 30 %. Тоді як рівень антибіотикорезистентності до цефалоспоринів ІІІ покоління залишається низьким — 4,4 %.
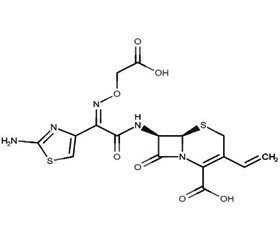
Цефіксим — представник цефалоспоринів III покоління
Цефіксим є першим представником пероральних цефалоспоринів III покоління й одним з рекомендованих антибіотиків для лікування неускладнених інфекцій сечовивідних шляхів у дітей (табл. 1).
Фармакодинамічна характеристика цефіксиму
Цефіксим в умовах in vitro проявляє значну бактерицидну активність відносно широкого спектра як грампозитивних, так і грамнегативних мікроорганізмів. Має високий ступінь стабільності в присутності b-лактамаз.
Клінічно ефективний при лікуванні інфекцій, спричинених найбільш частими патогенними мікроорганізмами, включаючи Streptococcus pneumoniae, Streptococcus pyogenes, E.coli, Proteus mirabilis, Klebsiella species, Haemophilus influenzae (бета-лактамази — позитивні й негативні), Branhamella catarrhalis (бета-лактамази — позитивні й негативні) і Enterobacter species.
Найбільшу чутливість до цефіксиму, що за рекомендаціями Національного комітету Інституту клінічних лабораторних стандартів (CLSI) США визначається як висока при мінімальній інгібуючій, або пригнічуючій, концентрації (МПК), що викликає гальмування зростання 90 % бактерій (MIC90) < 1 мкг/мл, серед грампозитивних мікроорганізмів мають стрептококи (MIC90 штамів S.pyogenes становить 0,12, S.agalactiae — 0,25). MIC90 серед ентеробактерій: E.coli — 0,25; Proteus mirabilis — 0,03; Klebsiella species — 0,06 [3], включно зі штамами, що продукують b-лактамази.
Фармакокінетична характеристика цефіксиму
Абсорбція. Абсолютна біодоступність після перорального застосування цефіксиму становить 22–54 %. Оскільки наявність їжі не порушує абсорбцію, цефіксим можна призначати незалежно від її прийому. Спільне застосування цефіксиму й антацидів, що містять магній або алюміній, значимо не впливає на величину пікової концентрації препарату в крові або площі під фармакокінетичною кривою. Максимальний рівень у сироватці крові після прийому рекомендованих доз для дорослих або дітей становить від 1,5 до 3 мкг/мл і досягається через 3–5 годин. При повторному дозуванні відбувається незначне накопичення або практично не відбувається накопичення цефіксиму [24].
Обсяг розподілу. Стаціонарний обсяг розподілу цефіксиму становить 16,8 л. Цефіксим майже повністю зв’язується з фракцією альбуміну, середня вільна фракція становить близько 30 %.
Метаболізація. Метаболіти цефіксиму не були ізольовані із сироватки крові або сечі людини.
Шлях елімінації. Цефіксим виводиться в основному в незміненому вигляді із сечею. Переважаючим механізмом є клубочкова фільтрація. Немає даних про проникнення цефіксиму в грудне молоко.
Період напіввиведення: найбільш тривалий період напіввиведення (3,7 години) порівняно з іншими пероральними цефалоспоринами. При тяжкій нирковій недостатності (кліренс креатиніну від 5 до 20 мл/хв) період напіввиведення збільшується в середньому до 11,5 години, що вимагає корекції дози [7].
Механізм дії цефіксиму
В основі дії цефіксиму, як і інших цефалоспоринових антибіотиків [2], лежить здатність його молекули зв’язуватися з пеніцилінзв’язуючими протеїнами бактерій (penicillin-binding proteins — PBP), що призводить до пригнічення транспептидації, інгібування синтезу мукопептидів у клітинній стінці під час реплікації бактерій.
Безпечність прийому цефіксиму
У серії клінічних випробувань продемонстровано, що можливі небажані реакції, спричинені прийомом цефіксиму, зустрічались досить рідко (в 1,2–13,8 %) і не загрожували життю. Найчастіше як у дорослих, так і в дітей реєструвалась діарея та нестійкість випорожнень [15, 18].
Спосіб застосування й дози
Курс лікування становить 7–14 днів. При лікуванні неускладнених циститів курс лікування становить 3 дні. Інфекції, викликані S.pyogenes, необхідно лікувати як мінімум 10 днів.
Для дітей віком від 6 місяців до 10 років із масою тіла до 50 кг рекомендована доза становить 8 мг/кг на добу одноразово або 4 мг/кг кожні 12 годин залежно від тяжкості захворювання.
Дорослим і дітям віком від 10 років (або масою тіла понад 50 кг) рекомендована доза становить 400 мг на добу одноразово або 200 мг кожні 12 годин залежно від тяжкості захворювання.
Дозування при нирковій недостатності: цефіксим можна застосовувати при порушенні функції нирок. Пацієнтам із кліренсом креатиніну 20 мл/хв або вище слід призначати звичайну дозу й режим дозування. Для пацієнтів із кліренсом креатиніну нижче від 20 мл/хв рекомендується добову дозу зменшити на 50 %. Це також стосується пацієнтів, які знаходяться на постійному амбулаторному перитонеальному діалізі або гемодіалізі.
Клінічно доведена ефективність призначення препарату цефіксим при інфекціях сечовидільної системи
Цефіксим має доказову високу активність проти всіх тестованих бактеріальних ізолятів, виділених із сечовивідних шляхів хворих, створює високі концентрації в нирках, які в кілька разів перевищують MПК основних уропатогенів.
За даними дослідження, проведеного у Франції, під час якого цефіксим застосовувався для лікування циститу й пієлонефриту, домогтися клінічного ефекту вдалося більше ніж у 90 % пацієнтів. David Martin та співавт. [16], виконавши ретроспективне дослідження серед літніх пацієнтів із будинків тривалого перебування, спостерігали таку чутливість найбільш поширених збудників ІСВС до дії цефіксиму: Escherichia coli (n = 51 463) — в 95 %, Klebsiella pneumoniae (n = 3495) — у 93,2 % клінічних ізолятів.
Цефіксим має високу активність порівняно з багатьма іншими антибіотиками, зокрема, однакову з фторхінолонами MIC90 щодо CFT073 і KTE181 уропатогенних штамів Esherichia coli [20]. У паралельному рандомізованому клінічному дослідженні було встановлено пригнічення цефіксимом близько 80–90 % ципрофлоксацин-резистентних 293 ізолятів Escherichia coli (40 з яких були продуцентами ESBL), 54 ізолятів Klebsiella pneumoniae (10 продуцентів ESBL) і 53 ізолятів Proteus mirabilis [22].
Було також доведено, що цефіксим більш ефективний у профілактиці рецидивуючих інфекцій сечовивідних шляхів у дітей, ніж нітрофурантоїн (СШ 0,74, 95% ДІ 0,13–4,10) [25].
За даними метааналізу двадцяти трьох досліджень (3295 дітей) доведено, що діти з гострим пієлонефритом можуть ефективно лікуватися пероральним антибіотиком (цефіксимом) або покроково — після короткого курсу парентеральної антибіотикотерапії (від 2 до 4 днів) з наступним його призначенням для перорального введення [14].
При лікуванні ІСВС цефіксим може бути рекомендований як препарат емпіричного вибору з достатньо низьким рівнем антибіотикорезистентності й високим рівнем безпечності [5, 12].
Висновки
Збільшення частки уропатогенних бактеріальних штамів, що мають розширену антибіотикорезистентність, в етіологічній структурі інфекцій сечовивідних шляхів у дітей зумовлює необхідність використання антибактеріальних препаратів, які мають високий ступінь стабільності в присутності b-лактамаз, зокрема антибактеріального препарату цефіксим (Сорцеф®, «Алкалоїд АД-Скоп’є», Республіка Македонія).
Вибір препарату Сорцеф® для лікування ІСВС базується на трьох основних критеріях: природній активності антибіотика in vitro проти основних збудників захворювання (Escherichia coli та Klebsiella pneumoniae); низькому рівні набутої резистентності мікроорганізмів у популяції і доведеній клінічній ефективності препарату в контрольованих порівняльних дослідженнях.
Безумовною перевагою препарату Сорцеф® є не тільки перевірена часом клінічна ефективність, а й високий рівень комплаєнтності при його використанні: широкий спектр дії проти більшості причино-значимих збудників ІСВС у дітей, найбільш тривалий період напіввиведення серед наявних на фармацевтичному ринку пероральних цефалоспоринів, що зумовлює одноразовий прийом на добу, мінімальний рівень побічних ефектів і можливість використання в амбулаторних умовах як самостійного препарату, а також і після стаціонарної парентеральної терапії для продовження курсу лікування цефалоспоринами ІІІ покоління.
Конфлікт інтересів: автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Абатуров А.Е., Герасименко О.Н., Агафонова Е.А., Высочина И.Л., Кривуша Е.Л., Никулина А.А. Ранняя диагностика и антибактериальная терапия инфекций мочевыводящих путей у детей. Здоровье ребенка. 2012. № 2(37). С. 99-104.
2. Абатуров А.Е. Новые препараты цефалоспоринов, рекомендуемые для лечения нозокомиальных пневмоний. Педиатрия. Восточная Европа. 2018. № 7(1). С. 154-164.
3. Белов Б.С. Цефиксим в терапии бактериальных инфекций: вопросы эффективности и безопасности. РМЖ. 2013. № 2. С. 143.
4. Çoban B., Ülkü N., Kaplan H. et al. Five-year assessment of causative agents and antibiotic resistances in urinary tract infections. Turk Pediatri Ars. 2014 Jun 1. № 49(2). P. 124-9. doi: 10.5152/tpa.2014.1505.
5. Cohen R., Raymond J., Launay E. et al. Antimicrobial treatment of urinary tract infections in children. Arch. Pediatr. 2017 Dec. № 24(12S). P. 22-25. doi: 10.1016/S0929-693X(17)30514-6.
6. DrugBank Online Catalog: Cefixime Cefixime [Електронний ресурс]. URL: https://www.drugbank.ca/drugs/DB00671 (дата звернення 17.08.2019).
7. Edoo Z., Arthur M., Hugonnet J.E. Reversible inactivation of a peptidoglycan transpeptidase by a b-lactam antibiotic mediated by b-lactam-ring recyclization in the enzyme active site. Sci Rep. 2017 Aug 22. № 7(1). P. 9136. doi: 10.1038/s41598-017-09341-8.
8. El-Jade M.R., Parcina М., Schmithausen R.M. et al. ESBL Detection: Comparison of a Commercially Available Chromogenic Test for Third Generation Cephalosporine Resistance and Automated Susceptibility Testing in Enterobactericeae. PLoS One. 2016 Aug 5. № 11(8). e0160203. doi: 10.1371/journal.pone.0160203.
9. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2017. Annual report of the European antimicrobial resistance surveillance network (EARS-Net) [Електронний ресурс]: [EARS-Net]. 2018. URL: https://ecdc.europa.eu/en/publications-data/surveillance-antimicrobial-resistance-europe-2017 (дата звернення 15.08.2019).
10. Fan N.C., Chen H.H., Chen C.L. et al. Rise of community-onset urinary tract infection caused by extended-spectrum b-lactamase-producing Escherichia coli in children. J. Microbiol. Immunol. Infect. 2014 Oct. № 47(5). P. 399-405. doi: 10.1016/j.jmii.2013.05.006.
11. Flokas M.E., Detsis М., Alevizakos М. et al. Prevalence of ESBL-producing Enterobacteriaceae in paediatric urinary tract infections: A systematic review and meta-analysis. J. Infect. 2016 Dec. № 73(6). P. 547-557. doi: 10.1016/j.jinf.2016.07.014.
12. Gunduz S., Uludağ Altun H. Antibiotic resistance patterns of urinary tract pathogens in Turkish children. Glob. Health Res. Policy. 2018 Mar 16. № 3. P. 10. doi: 10.1186/s41256-018-0063-1.
13. Hameed T., Al Nafeesah А., Chishti S. et al. Community-acquired urinary tract infections in children: Resistance patterns of uropathogens in a tertiary care center in Saudi Arabia. Int. J. Pediatr. Adolesc. Med. 2019 Jun. № 6(2). P. 51-54. doi: 10.1016/j.ijpam.2019.02.010.
14. Hodson E.M., Willis N.S., Craig J.C. Antibiotics for acute pyelonephritis in children. Cochrane Database Syst. Rev. 2007 Oct 17. № 4. CD003772.
15. Imran M., Shah M.R., Ullah F. et al. Double-tailed acyl glycoside niosomal nanocarrier for enhanced oral bioavailability of Cefixime. Artif. Cells Nanomed. Biotechnol. 2017 Nov. № 45(7). P. 1440-1451. doi: 10.1080/21691401.2016.1246451.
16. Martin D., Fougnot S., Grobost F. et al. Prevalence of extended-spectrum beta-lactamase producing Escherichia coli in community-onset urinary tract infections in France in 2013. J. Infect. 2016 Feb. № 72(2). P. 201-6. doi: 10.1016/j.jinf.2015.11.009.
17. Mazzariol A., Bazaj А., Cornaglia G. Multi-drug-resistant Gram-negative bacteria causing urinary tract infections: a review. J. Chemother. 2017 Dec. № 29 (supрl.). P. 2-9. doi: 10.1080/1120009X.2017.1380395.
18. Moustafa F., Nguyen G., Mathevon Т. Evaluation of the efficacy and tolerance of a short 7 day third-generation cephalosporin treatment in the management of acute pyelonephritis in young women in the emergency department. J. Antimicrob. Chemother. 2016 Jun. 71(6). 1660-4. doi: 10.1093/jac/dkw021.
19. Naber K.G., Wagenlehner F.M. Novel Antibiotics in the Treatment of Urinary Tract Infections. Eur. Urol. Focus. 2019 Jan. № 5(1). P. 10-12. doi: 10.1016/j.euf.2018.11.012.
20. Niu H., Yee R., Cui P. et al. Identification and Ranking of Clinical Compounds with Activity against Log-phase Growing Uropathogenic Escherichia coli. Curr. Drug Discov. Technol. 2018 Aug 7. № 15. P. 24. doi: 10.2174/1570163815666180808115501.
21. O’Kelly F., Kavanagh S., Manecksha R. Characteristics of gram-negative urinary tract infections caused by extended spectrum beta lactamases: pivmecillinam as a treatment option within South Dublin, Ireland. BMC Infect Dis. 2016 Nov 3. № 16(1). P. 620. doi: 10.1186 / s12879-016-1797-3.
22. Pistiki A., Tsaganos T., Galani I. et al. In Vitro Activity of Oral Cephalosporins (Cefprozil and Cefixime) Against Ciprofloxacin-Resistant Enterobacteriaceae from Community-Acquired Urinary-Tract Infections. Infect. Dis. Ther. 2015 Dec. № 4(4). P. 425-32. doi: 10.1007/s40121-015-0089-3.
23. Robinson J.L., Finlay J.C., Lang M.E. et al. Canadian Paediatric Society, Infectious Diseases and Immunization Committee, Community Paediatrics Committee. Urinary tract infections in infants and children: Diagnosis and management. Paediatr. Child Health. 2014 Jun. № 19(6). P. 315-25. doi: 10.1093/pch/19.6.315.
24. Wang H., Huang H., Cao J., Chui D., Xiao Sh. Mass Spectral Profile for Rapid Differentiating Beta-Lactams from Their Ring-Opened Impurities. Biomed. Res Int. 2015. 2015. 697958. doi: 10.1155/2015/697958.
25. Williams G.J., Craig J.C., Carapetis J.R. Preventing urinary tract infections in early childhood. Adv. Exp. Med. Biol. 2013. № 764. P. 211-8. doi: 10.1007 / 978-1-4614-4726-9_18.
26. Williams G.J., Wei L., Lee A., Craig J.C. Long-term antibiotics for preventing recurrent urinary tract infection in children. Cochrane Database Syst. Rev. 2006 Jul. № 19(3). CD001534.

/45-1.jpg)