Журнал «Здоровье ребенка» Том 14, №5, 2019
Вернуться к номеру
Клінічний випадок неонатального гострого лімфобластного лейкозу
Авторы: Артьомова Н.С.(1), Цвіренко С.М.(1), Похилько В.І.(1), Калюжка О.О.(1), Вернигора С.І.(2)
(1) — Вищий державний навчальний заклад України «Українська медична стоматологічна академія», м. Полтава, Україна
(2) — Комунальне підприємство «Дитяча міська клінічна лікарня Полтавської міської ради», м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В статті подано клінічний випадок неонатального гострого лімфобластного лейкозу у дитини 22 діб життя з залученням центральної нервової системи та тестикулярним ураженням. Маніфестація клінічних ознак в неонатальному періоді відбувалася у вигляді жовтяничного синдрому з ранньою анемією новонародженого, гідроцеле. Під час первинного візиту до лікаря та обстеження з приводу неонатальної жовтяниці виявлено лейкоцитоз, бластоз з наявністю проміжних форм нейтрофілів, анемію (Hb — 108 г/л). При дослідженні кісткового мозку виявлено гіпоцелюлярність кісткового мозку, бласти — 79,6 %, при цитохімічному дослідженні бластних клітин установлено FAB типу L1 з імунофенотипом pro-B ALL. Проведене молекулярно-генетичне дослідження кісткового мозку виявило транслокацію AF4/MLL t (4; 11) (q21; q23). За даними дослідження спинномозкової рідини виявлені бластні клітини 48 × 106/л, що вказує на наявність залучення до патологічного процесу центральної нервової системи. Після встановлення клінічного діагнозу «вроджений гострий лімфобластний лейкоз, варіант ФАБ L1, тип pro-BALL, з тестикулярним ураженням, залученням ЦНС, позитивний І гострий період» розпочато лікування за протоколом для вроджених лейкемій INTERFANT-06. Зважаючи на його рекомендації, враховуючи вік дитини < 6 міс., доза поліхіміопрепаратів була скорегована та призначено 2/3 від загальної терапевтичної дози з паралельним проведенням супровідної терапії в повному обсязі. Даний пацієнт протягом практично всього періоду лікування не демонстрував будь-якого поліпшення гематологічної картини, та летальний результат внаслідок злоякісного процесу настав у віці дитини 48 діб. Описаний клінічний випадок підтверджує необхідність ранньої адекватної діагностики, що дозволяє уникнути низки діагностичних і терапевтичних помилок та підвищити ймовірність успішного лікування даної патології.
В статье представлен клинический случай неонатального острого лимфобластного лейкоза у ребенка 22 суток жизни с поражением центральной нервной системы и вовлечением в патологический процесс тестикул. Манифестация клинических признаков в неонатальном периоде была в виде синдрома желтухи с ранней анемией новорожденного, гидроцеле. Во время первичного визита к врачу и обследования по поводу неонатальной желтухи обнаружен лейкоцитоз, бластоз с наличием промежуточных форм нейтрофилов, анемия (Нb — 108 г/л). При исследовании костного мозга выявлена гипоцеллюлярность костного мозга, бласты — 79,6 %, при цитохимическом исследовании бластных клеток установлен FAB типа L1 с иммунофенотипом pro-B ALL. Проведенное молекулярно-генетическое исследование костного мозга выявило транслокацию AF4/MLL t (4; 11) (q21; q23). По данным исследования спинномозговой жидкости были выявлены бластные клетки 48 × 106/л, что указывало на вовлечение в патологический процесс центральной нервной системы. После установления диагноза «врожденный острый лимфобластный лейкоз, ФАБ вариант L1, тип pro-B ALL, с тестикулярным поражением, вовлечением ЦНС, положительный І острый период» начато лечение по протоколу для врожденных лейкемий INTERFANT-06. Опираясь на рекомендации протокола, учитывая возраст ребенка < 6 мес., дозировка полихимиопрепаратов была скорригирована и назначено 2/3 от общетерапевтической дозы с параллельным проведением сопроводительной терапии в полном объеме. Представленный пациент практически в течение всего периода лечения не демонстрировал улучшения гематологической картины, и летальный исход вследствие злокачественного процесса произошел в возрасте ребенка 48 суток. Описанный клинический случай подтверждает необходимость ранней адекватной диагностики, что позволяет избежать ряда диагностических и терапевтических ошибок, а также повысить вероятность успешного лечения данной патологии.
The article presents a clinical case of neonatal acute lymphoblastic leukemia in a child aged 22 days, with damage to the central nervous system and testicular involvement in the pathological process. The manifestation of clinical signs in the neonatal period was in the form of jaundice syndrome with early neonatal anemia, hydrocele. During the initial visit to the doctor and examination for neonatal jaundice, leukocytosis was found, as well as blastosis with the presence of intermediate forms of neutrophils, anemia (Hb 108 g/l). According to the myelogram, bone marrow hypocellularity was revealed, blasts — 79.6 %, cytochemical study of blast cells detected FAB-L1 type with pro-B-ALL-type immunophenotype. The molecular genetic study of the bone marrow revealed AF4/MLL t (4; 11) (q21; q23) translocation. According to cerebrospinal fluid study, blast cells (48 × 106/l) were detected, indicating the involvement of the central nervous system (CNS) in the pathological process. After making a diagnosis: congenital acute lymphoblastic leukemia, FAB L1 variant, pro-B-ALL type, testicular lesion, CNS involvement, positive І acute period, treatment was initiated according to the INTERFANT-06 protocol for congenital leukemia. Based on the recommendations of this protocol, taking into account the age of the child < 6 months, the dosage of polychemotherapy was corrected and 2/3 of the general therapeutic dose was prescribed along with accompanying therapy on a full scale. This patient during virtually the whole period of treatment did not show any hematologic improvement and died at the age of 48 days due to predominance of malignant process. The described clinical case confirms the need for early adequate diagnosis, which helps avoid a number of diagnostic and therapeutic errors, as well as increases the likelihood of successful treatment for this pathology.
неонатальний лімфобластний лейкоз; неонатальна лейкемія; вроджений лейкоз
неонатальный лимфобластный лейкоз; неонатальная лейкемия; врожденный лейкоз
neonatal lymphoblastic leukemia; neonatal leukemia; сongenital leukemia
Вступ
Вроджений та неонатальний лейкоз належить до групи гематологічних захворювань, що виникають внутрішньоутробно, а лейкозний процес може проявитися уже під час пологів або протягом короткого проміжку часу після них (до 28 діб) [1, 2]. Дана група захворювань досить рідко зустрічається в популяції (1 випадок на 5 млн пологів) [2]. Більшість випадків неонатального лейкозу мають мієлоїдну складову із залученням мієлоцитарного паростку в проліферативний процес, на відміну від лейкозів в інших дитячих вікових групах, із яких переважну більшість становлять лімфоїдні лейкози.
Пропонуємо власне клінічне спостереження випадку неонатального гострого лімфобластного лейкозу у дитини 22 діб життя.
Клінічне спостереження
Дитина Ф., від першої вагітності, що перебігала на фоні вираженого раннього гестозу протягом І триместру вагітності. Пологи в строк, фізіологічні. Маса тіла при народженні — 3150 г. Виписаний з пологового будинку на 3-тю добу. У ранньому неонатальному періоді — рання жовтяниця новонародженого. Вигодовування природне. Дані про проведення профілактичних щеплень відсутні. Спадковий анамнез не обтяжений. Алергічних реакцій у дитини мати не відмічала. Травм, оперативних втручань, трансфузії препаратів та компонентів крові не відзначалось.
Амбулаторно протягом тижня спостерігався у дільничного педіатра з приводу кон’югаційної жовтяниці новонародженого, отримував урсодезоксихолієву кислоту, ентеросорбенти. Під час медичного обстеження 20.07.17 з приводу неональної жовтяниці виявлено лейкоцитоз з бластозом (лейкоцити 20,7 ´ 109/л, бластних клітин 20 %) з наявністю проміжних форм нейтрофілів, анемію (Hb — 108 г/л). Для виключення гострого лейкозу дитина госпіталізована до гематологічного відділення дитячої міської клінічної лікарні.
На момент госпіталізації загальний стан дитини тяжкий за рахунок жовтяничного та анемічного синдрому, виражених симптомів інтоксикації (дитина млява, відмовляється від годування). Температура тіла на момент огляду — 36,7 °С. Шкіра та видимі слизові оболонки іктеричного забарвлення, чисті, геморагічний синдром відсутній. Підшкірний жировий шар розвинений задовільно. Слизова зіву, ротової порожнини інтактна, блідо-рожевого кольору. Велике тім’ячко розміром 2,0 ´ 2,0 см, не напружене. Дефігурації кісток черепа, викривлень хребта та кінцівок не виявлено.
Носове дихання вільне, ЧДР — 44 на хвилину. Грудна клітка звичайної конфігурації. Перкуторно над легенями вислуховується ясний легеневий звук, аускультативно — пуерильне дихання симетрично з обох боків.
Ps — 146 на хв, АТ — 85/50 мм рт.ст. Серцева діяльність правильна, тони приглушені, ритмічні, систолічний шум на верхівці серця. Язик вологий, чистий. Живіт округлий, під час поверхневої та глибокої пальпації — м’який, безболісний у всіх відділах. Розміри печінки: +3,5 см від краю реберної дуги, нижній край щільноеластичної консистенції, гладкий, під час пальпації болісних відчуттів у дитини не виникає. Селезінка не пальпується. Фізіологічні відправлення — самостійні, кашкоподібні, без патологічних домішок, діурез — без особливостей.
Дитина обстежена у відділенні. Аналіз крові клінічний (від 20.07): L — 20,7 ´ 109/л; Hb — 124 г/л; Тr — 400 ´ 109/л; Er — 3,95 ´ 1012/л; п/яд — 4 %, с/яд — 25 %, л. — 37 %, м. — 6 %; еоз. — 3 %; ШОЕ — 2 мм/год. Rt — 53 %, бласти — 20 %. Б/х крові (від 20.07): загальний білок — 50 г/л; білірубін — 94,9–7,8–87,1 мкмоль/л; сечовина — 3,2 ммоль/л; креатинін — 31,0 мкмоль/л; АлАТ — 74 МОД/л, АсАТ — 38 МОД/л. УЗД ОЧП та нирок (від 20.07): структурних змін не виявлено. Нейросонографія (від 20.07): шлуночки мозку не розширені. ЕКГ (від 20.07): синусовий ритм, прискорений. ЕВС типу SІ-SІІ-SІІІ. Переважання електричних потенціалів міокарда правого шлуночка. ЕхоКС (від 20.07): порожнини серця не збільшені. ВОВ (2 мм).
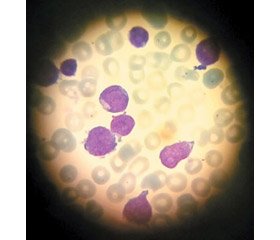
При дослідженні кісткового мозку (мієлограма, 0d, рис. 1): стан еритропоезу — еритробласти: нормобласти базофільні — 0,4 %, нормобласти поліхроматофільні — 1,2 %, нормобласти оксифільні — 4,0 %, сума ЕП — 5,6, моноцити — 1,6 %, лімфоцити — 2,0 %, плазматичні клітини — 0. Стан гранулопоезу: промієлоцити — 0,2 %, мієлоцити — 3,8 %, метамієлоцити — 2,0 %; п/яд нейтрофіли — 0,6 %; с/яд нейтрофіли — 3,4 %; еозинофільні гранулоцити — 1,2 %. Сума ГП — 11,2. Бласти — 79,6 %.
Цитохімічне дослідження бластних клітин: мієлопероксидаза — негатив.; ШИК-реакція на глікоген (PAS): 6 % — специф., 55 % — неспециф. Неспецифічна естереза (ANAE) — негативна. Кістковий мозок гіпоцелюлярний, дизеритропоез, дизмієлопоез, дизтромбопоез — не виявлено; мегакаріоцити — 36 ´ 10 п/з; палички Ауера — не виявлені. Гранулоцити — 11,2 %, моноцитарний компонент — 1,6 %, еритрон — 5,6 %, мієлопероксидаза (РОХ) — негатив., FAB — тип L1. Імунофенотип (рис. 2): CD45+ (100 %) CD34+ (80 %) CD38+ (100 %) HLA-Dr+ (84 %) anti-MPO– anti-TdT+ (77 %) CD19+ (100 %) CD22+ (98 %) cCD79a+ (98 %) CD58+ (94 %). Молекулярно-генетичне дослідження кісткового мозку: виявлено транслокацію AF4/MLL t (4; 11) (q21; q23).
Молекулярно-цитогенетичне дослідження кісткового мозку: виявлено реаранжировку MLL-гена в 79 % нуклейованих клітин, картина гібридизації nuc ish (MLLх2) (5’MLLsep3’MLLх1) [79/100]; не виявлено транслокації t (9; 22) (q34; q11). Картина гібридизації: nuc ish 9q34 (ABLх2) 22q11 (BCRх2) [100]; не виявлено транслокації t (12; 21) (р13; q22) TEL/AML1 (ETV6/RUNX). Картина гібридизації: nuc ish 12р13 (ETV6х2), 21q22 (RUNХ1х2) [100]. Не виявлено змін кількості сигналів 15q22 та 17q21.1. Висновок: гострий мієлобластний лейкоз, варіант FAB L1, тип pro-B ALL, асоційований із транслокацією AF4/MLL t (4; 11) (q21; q23).
В клінічному аналізі крові в динаміці зберігався лейкоцитоз до 79,8 ´ 109/л із бластозом.
ЕКГ: ритм синусовий. ЕВС вертикальна. Уповільнено проведення збудження по правій ніжці пучка Гіса. УЗД ОЧП від 20.07: структурних змін не виявлено. Нейросонографія від 20.07: шлуночки мозку не розширені. ЕхоКС від 20.07: порожнини серця не збільшені. ВОВ (2 мм).
При ультразвуковому дослідженні мошонки виявлено зміни у вигляді гідроцеле та потовщення оболонок. При дослідженні рідини, отриманої під час пункційної біопсії мошонки, виявлено наявність бластних клітин, що свідчило про тестикулярне ураження при гострому лімфобластному лейкозі.
Проведене цитологічне дослідження ексудату мошонки: в препаратах виявлено бластні клітини, моноцити та лімфоцити в невеликій кількості. Еритроцити відсутні.
Дитині встановлено клінічний діагноз: вроджений гострий лімфобластний лейкоз, варіант FAB L1, тип pro-B ALL, з тестикулярним ураженням, залученням ЦНС, позитивний І гострий період. Після встановлення діагнозу було розпочато лікування за протоколом для вроджених лейкемій INTERFANT-06; зважаючи на рекомендації протоколу, враховуючи вік дитини < 6 міс., доза поліхіміотерапії становила 2/3 від загальної терапевтичної дози з паралельним проведенням супровідної терапії.
Оцінка 8-го дня протокольної терапії: лейкоцити знизились до 30,6 ´ 109/л, бласти — 54 %, що становило 16 200 мм3. З огляду на вік, клінічні та лабораторні критерії дитину віднесено до групи високого ризику по 8-му дню (HGR8d). Після 8-го дня терапії та зниження рівня лейкоцитів дитині проведено спинномозкову пункцію. За даними дослідження ліквору виявлені бластні клітини 48 ´ 106/л, що підтверджує ЦНС-позитивний статус гострого лімфобластного лейкозу, інтратекально введено 6 мг МТХ. В подальшому дитині проводилась протокольна поліхіміотерапія з терапією супроводу.
З огляду на стан хворого, появу абдомінального та інтоксикаційного синдрому на тлі лікування здійснювалось відстрочення проведення ПХ-терапії до стабілізації стану дитини. 11.08 стан дитини погіршився: пацієнт був більш млявим, відмовлявся від їжі, відзначалася сонливість. У другій половині дня температура тіла підвищилась до фебрильних цифр. Проведено корекцію лікування — призначено системну антибактеріальну та антимікотичну терапію, інфузійну терапію.
В динаміці після проведеного лабораторного обстеження виявлено трьохпаросткову аплазію кроветворення, що потребувало проведення замісної трансфузійної терапії, яка проводилась щоденно паралельно з корекцією терапії щодо змін стану пацієнта. Незважаючи на проведення терапії, стан дитини прогресивно погіршувався, зростала поліорганна недостатність (мієлосупресія ІІІ ступеня). У зв’язку з погіршенням дихальної функції дитину переведено на ШВЛ 14.08 о 14:00.
Проводилась активна замісна терапія компонентами крові: еритроцитарна маса, тромбоконцентрат та системна антибактеріальна, антимікотична терапія, КСФ, симптоматична терапія. На фоні зростання серцево-судинної недостатності з тенденцією до брадикардії на тлі ШВЛ 16.08 в 1:30 діагностовано асистолію. Проведені протягом 30 хвилин реанімаційні заходи ефекту не дали, серцевий ритм відновити не вдалось. В 02:00 встановлено біологічну смерть дитини.
Під час проведення патанотомічного обстеження виявлено: вроджений гострий лімфобластний лейкоз, набряк головного мозку, гепатоспленомегалія, дистрофія та недокрів’я внутрішніх органів.
Обговорення
«Вроджений лейкоз» — термін, що використовують для визначення лейкемій, які діагностовані при народженні або протягом першого місяця життя [4]. Випадки неонатального лейкозу поодинокі [5], проте наданий випадок відповідає критеріям постановки діагнозу «неонатальний лейкоз» [6], які включають проліферацію недиференційованих лімфобластів та інфільтрацію цими клітинами кісткового мозку, відсутність будь-якого захворювання, що здатне викликати лейкемоїдну реакцію, яка може імітувати кістково-мозкову проліферацію лімфоїдного пулу клітин (TORCH-інфекції, септичний стан, несумісність по АВО-системі тощо). Етіологічні фактори включають хромосомні аберації, внутрішньоутробні впливи на плід, вірусне навантаження матері під час вагітності [7].
Клінічні ознаки лейкозу можуть бути наявними одразу при народженні: гепатоспленомегалія, шкірний геморагічний синдром у вигляді петехіальних та екхіматозних елементів на шкірі, що в наданому клінічному випадку не спостерігалось. Інфільтрація бластних клітин в поверхневі шари шкіри (лейкеміди, хлорома) зазвичай виявляється при народженні, проте найчастіше наявна у передчасно народжених дітей з уродженим лейкозом [5]. Практично завжди в патологічний процес залучається центральна нервова система. В ранньому неонатальному періоді у більшості випадків виникають ускладнення періоду новонародженості: респіраторний дистрес (що виникає внаслідок інфільтрації бластами тканини легень, що може спричинити навіть ателектаз або пов’язано з лейкостазом в легеневих судинах). У тих дітей, в яких симптоми захворювання розвиваються протягом першого місяця життя, основні симптоми захворювання погано визначаються та диференціюються як неспецифічні: гіпотермія, діарея, гепатомегалія, погана прибавка маси тіла. При цьому ураження шкіри визначається рідше [7]. В наданому випадку розвиток захворювання був більш поступовим — протягом неонатального періоду, ураження шкіри не спостерігалось, проте виявлено ураження тестикул.
Під час вивчення мієлограм пацієнтів з неонатальним гострим лімфобластним лейкозом часто констатується, що бластні клітини походять із В-клітин, коммітованих на ранніх стадіях, не експресують загальний антиген гострого лейкозу (CD10), часто мають характеристики, які властиві бластним клітинам плода, мають експресію антигенів мієлоїдних клітин. Під час цитогенетичного дослідження вродженого (неонатального) лейкозу часто виявляється одразу декілька генетичних аномалій, зокрема в band 11q23 (місце розташування MLL/ALL 1), моносомія сьомої пари хромосом, трисомія дев’ятої пари, синдром Дауна, 11q23, t (9; 18), t (11; 19), t (9, 11) та t (X; 6) [1, 2]. Такі цитогенетичні порушення також досить часто визначаються не тільки у пацієнтів, а й у батьків під час вивчення їх каріотипів [8, 9].
Для неонатального лейкозу є характерною уповільнена реакція на індукцію ремісії, повна ремісія досягається рідко, тільки під час використання високоінтенсивної поліхіміотерапії, ремісії нетривалі, та в подальшому рецидив проявляється екстрамедулярними симптомами (в тому числі й ізольований нейролейкоз). Маркерами несприятливого прогнозу перебігу лікування є лейкоцитоз 75 ´ 109/л та більше, а також відсутність експресії на бластних клітинах CD10 [7]. Термін життя при наявності у пацієнта неонатального (вродженого) лейкозу нетривалий. За даними літературних джерел, більшість дітей помирали через розвиток вторинного респіраторного дистресу та бронхопневмонії, мукозиту, ниркової недостатності [9]. В поданому нами випадку конкретна причина смерті (вторинні ускладнення) верифікована як поліорганна недостатність внаслідок сепсису на тлі аплазії кісткового мозку.
При наявності тільки клінічних проявів анемічного та жовтяничного синдрому важко диференціювати неонатальний лейкоз від інших лейкоеритробластичних станів, що виникають у відповідь на бактеріальні інфекції, гіпоксемію та тяжкий гемоліз у новонароджених внаслідок АВО- та/або Rh-несумісності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Подяка. Автори публікації висловлюють щиру подяку завідуючій клінічною лабораторією КП «Дитяча міська клінічна лікарня Полтавської міської ради» Захарчук О.Ю. та завідуючій онкогематологічним відділенням КП «Дитяча міська клінічна лікарня Полтавської міської ради» Шевченко С.М. за сприяння підготовці матеріалу для публікації статті.
1. Raj A., Talukdar S., Das S. et al. Congenital Leukemia. Indian Journal of Hematology and Blood Transfusion. 2014. Vol. 30 (Suppl. 1). P. 159-161. doi: 10.1007/s12288-013-0307-7.
2. Rana S., Jairajpuri Z., Garg S. Congenital leukemia in Down’s syndrome — A rare case report. Banglad. J. Med. Sci. 2012. Vol. 11. № 2. P. 134-136. doi: http://dx.doi.org/10.3329/bjms.v11i2.9656.
3. Van der Linden M.H., Creemers S., Pieters R. Diagnosis and management of neonatal leukaemia. Seminars in Fetal and Neonatal Medicine. 2012. Vol. 17. Issue 4. P. 192-195. doi: 10.1016/j.siny.2012.03.003.
4. Shrivastava J.P., Magnani K.K., Tripathi L., Mangal K.S. Congenital acute myeloid leukemia: A rare diagnostic enigma case report with review of literature. South Asian J. Cancer. 2016. Vol. 5. Issue 4. P. 212-213. doi: 10.4103/2278-330X.195349.
5. Roberts I., Fordham N.J., Rao A., Bain B.J. Neonatal leukaemia. Br. J. Haematol. 2018. Vol. 182. Issue 2. P. 170-184. doi: 10.1111/bjh.15246.
6. Tewari V.V., Mehta R., Tewari K. Congenital Acute Leukemia: A Rare Hematological Malignancy. J. Neonatal. Biol. 2017. Vol. 6. Issue 3. P. 265. doi: 10.4172/2167-0897.1000265.
7. Prakash K.P., Rau A., Bhat S.T., Rau A.R. Congenital leukemia — A diagnostic dilemma. Indian J. Med. Paediatr. Oncol. 2008. Vol. 29. Issue 4. P. 41-43. doi: 10.4103/0971-5851.51408.
8. Bas Suárez M.P., López Brito J., Santana Reyes C. et al. Congenital acute lymphoblastic leukemia: a two-case report and a review of the literature. Eur. J. Pediatr. 2011. Vol. 170. Issue 4. P. 531-534. doi: 10.1007/s00431-010-1339-8.
9. Kandukuri M.K. Congenital leukemia diagnosed on day one of life — A rare entity: Case report. IAIM. 2015. Vol. 2. Issue 7. P. 152-156.
10. Bayoumy M., Wynn T., Jamil A. et al. Prenatal presentation supports the in utero development of congenital leukemia: A case report. J. Pediatr. Hematol. Oncol. 2003. Vol. 25. Issue 2. P. 148-152. PubMed ID: 12571468.

/75-1.jpg)
/76-1.jpg)