Журнал «Здоровье ребенка» Том 14, №5, 2019
Вернуться к номеру
Роль галектину-3 у розвитку нефропатій
Авторы: Сорокман Т.В., Попелюк Н.О., Макарова О.В., Колєснік Д.І.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Метою огляду є аналіз даних літератури щодо ролі галектину-3 (Gal-3) у розвитку нефропатій. Проведено огляд наукової літератури за ключовими словами «галектини», «галектин-3», «функція галектину-3», «структура галектину-3», «хронічна хвороба нирок» з використанням як пошукової системи PubMed. Беручи до уваги дослідження, проведені в останні 10 років, проаналізовано 257 статей. Критерієм відбору статей для дослідження був їх тісний зв’язок із темою. Більш детально вивчено результати дослідження, висвітлені у 51 статті. У цьому огляді обговорюються загальні характеристики і функції Gal-3. У даний час є 15 різних галектинів, що були охарактеризовані та пронумеровані згідно з порядком їх відкриття. Gal-3 — це 32–35-кДа багатофункціональний лектиновий білок, що експресується епітеліальними, ендотеліальними клітинами і макрофагами. Gal-3 переважно секретується у цитоплазмі, однак може також секретуватися позаклітинно або внутрішньоядерно. Позаклітинний Gal-3 модулює важливі взаємодії між епітеліальними клітинами та позаклітинним матриксом і відіграє певну роль у ембріональному розвитку збірних проток нирок. Внутрішньоклітинний Gal-3 має важливе значення для виживання клітин завдяки його здатності блокувати власний апоптотичний шлях, а внутрішньоядерний Gal-3 сприяє проліферації клітин. Клітинна адгезія і проліферація за рахунок Gal-3 можуть перетворюватися на патологічні процеси, такі як фіброз і прогресування раку. Більш конкретну увагу зосереджено на ролі Gal-3 у виникненні та розвитку нефропатій. Проведено аналіз експериментальних та клінічних досліджень. Завдяки своєму функціональному характеру галектін-3 відіграє ключову роль в інтерстиційному фіброзі та прогресуванні хронічної хвороби нирок. Gal-3, ймовірно, не може бути використаний як діагностичний (скринінговий) біомаркер при хронічній хворобі нирок через відсутність чутливості та специфічності, але може мати потенціал для прогнозування прогресуючого зниження функції нирок.
Цель обзора — анализ данных литературы о роли галектина-3 (Gal-3) в развитии нефропатий. Проведен обзор научной литературы по ключевым словам «галектины», «галектин-3», «функция галектина-3», «структура галектина-3», «хроническая болезнь почек» с использованием в качестве поисковой системы PubMed. Принимая во внимание исследования, проведенные в последние 10 лет, проанализированы 257 статей. Критерием для отбора статей для исследования являлась их тесная связь с темой. Более подробно изучены результаты исследования, освещенные в 51 статье. В этом обзоре обсуждаются общие характеристики и функции Gal-3. В настоящее время известны 15 различных галектинив, которые были охарактеризованы и пронумерованы в соответствии с порядком их открытия. Gal-3 — это 32–35-кДа многофункциональный лектиновый белок, который экспрессируется эпителиальными, эндотелиальными клетками и макрофагами. Gal-3 преимущественно секретируется в цитоплазме, однако может также секретироваться внеклеточно или внутриядерно. Внеклеточный Gal-3 модулирует важные взаимодействия между эпителиальными клетками и внеклеточным матриксом и играет определенную роль в эмбриональном развитии собирательных протоков почек. Внутриклеточный Gal-3 имеет важное значение для выживания клеток вследствие его способности блокировать собственный апоптотических путь, а внутриядерные Gal-3 способствует пролиферации клеток. Клеточная адгезия и пролиферация за счет Gal-3 могут превращаться в патологические процессы, такие как фиброз и прогрессирование рака. Более конкретное внимание сосредоточено на роли Gal-3 в возникновении и развитии нефропатий. Проведен анализ экспериментальных и клинических исследований. Благодаря своему функциональному характеру галектин-3 играет ключевую роль в развитии интерстициального фиброза и прогрессировании хронической болезни почек. Gal-3, вероятно, не может быть использован как диагностический (скрининговый) биомаркер при хронической болезни почек из-за отсутствия чувствительности и специфичности, но может иметь потенциал для прогнозирования прогрессирующего снижения функции почек.
The purpose of this review was to analyse literature on the role of galectin-3 (Gal-3) in the development of nephropathy. We searched for published and unpublished data using Pubmed as the search engine by the keywords: galectin, galectin-3, galectin-3 function, galectin-3 structure, chronic kidney disease, taking into consideration studies conducted in the last 10 years, citation review of relevant primary and review articles, conference abstracts, personal files, and contact with expert informants. The criterion for the selection of articles for the study was based on their close relevance to the topic, thus out of 257 analyzed articles, the findings of the researchers covered in 28 articles were crucial. In this review, we discuss the general characteristics and functions of galectin-3. There are now 15 different galectins, which were characterized and numbered according to their opening order. Gal-3 is a 32–35-kDa multifunctional lectin protein expressed by epithelial, endothelial cells and macrophages. Gal-3 is mainly secreted in the cytoplasm, extracellularly or intranuclearly. The extracellular Gal-3 modulates important interactions between epithelial cells and the extracellular matrix and plays certan role in the embryonic development of kidney ducts. The intracellular Gal-3 is important for cell survival because of its ability to block its own apoptotic pathway, and intracellular Gal-3 promotes cell proliferation. Cell adhesion and proliferation due to Gal-3 can be transformed into pathological processes such as fibrosis and cancer progression. More specifically, we focus on the role of galectin-3 in the onset and development of nephropathies. The analysis of experimental and clinical studies is carried out. Due to its multifunctional character, galectin-3 plays a pivotal role in interstitial fibrosis and progression of chronic kidney disease. Gal-3 can probably not be used as a diagnostic (screening) biomarker for chronic kidney disease due to lack of sensitivity and specificity, but may has the potential to predict progressive renal dysfunction.
галектин-3; нефропатії; огляд
галектин-3; нефропатии; обзор
galectin-3; nephropathy; review
Вступ
Галектин-3 (Gal-3) є членом близькоспорідненої родини лектинів, що виявляється в декількох типах епітеліальних і мієлоїдних клітин. Цей розчинний білок відіграє важливу роль у багатьох біологічних процесах, у тому числі й у фіброзоутворенні, що призводить до хронічної хвороби нирок.
Історія відкриття
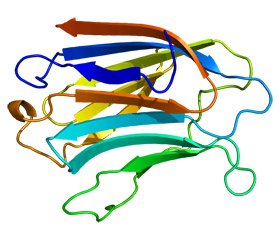
Еволюційно галектини є b-галактозидзв’язуючими білками з доменом розпізнавання вуглеводів (carbohydrate recognition domain, CRD) приблизно у 130 амінокислот [1, 3]. Вперше виділені у 1976 році. У даний час є 15 різних галектинів, що були охарактеризовані та пронумеровані згідно з порядком їх відкриття (від галектину-1 до галектину-15). У ссавців 15 членів родини галектинів ідентифіковані та класифіковані на три підтипи згідно зі структурою CRD: прототип, тандемний повторний тип і химерні галектини [3]. Недавні дослідження виявили унікальні плейотропні та контекстно-залежні функції Gal-3, який є єдиним химерним галектином у ссавців, що містить один CRD, пов’язаний із незвичайним довгим N-термінальним доменом, який відображає нелектинозалежну активність [4, 5].
Структура галектину-3
Gal-3 — це 32–35-кДа багатофункціональний лектиновий білок, що експресується епітеліальними, ендотеліальними клітинами та макрофагами [6].
Gal-3 переважно секретується у цитоплазмі, однак може також секретуватися позаклітинно або внутрішньоядерно. Екстрацелюлярний Gal-3 взаємодіє через CRD [7, 8] з gal-галактозидними залишками декількох позаклітинних матриксів і глікопротеїнів клітинної поверхні (класична лектин-глікокон’югатна взаємодія) [9, 10]. Навпаки, взаємодії внутрішньоклітинного Gal-3 відбуваються за допомогою пептидно-пептидних асоціацій, опосередкованих його N-термінальним доменом, хоча на цьому рівні може бути залучений і CRD. Існує кілька відомих лігандів, включаючи різні глікозильовані матричні білки (тобто ламінін, фібронектин і інтегрини) для Gal-3 [11].
Експресія Gal-3 у тканинах регулюється у великих кількостях під час ембріогенезу та розвитку, на відміну від дорослого життя, коли вона виявляється в різних епітеліальних клітинах, хрящах і кістках, а також у запальних клітинах [12].
Функція галектину-3
Gal-3 регулює численні біологічні процеси через свій вуглеводний домен із використанням вуглевод-незалежних механізмів [13–18]. Вивчено роль Gal-3 у клітинному апоптозі, адгезії, міграції, ангіогенезі та запаленні [19].
Позаклітинний Gal-3 модулює важливі взаємодії між епітеліальними клітинами та позаклітинним матриксом і відіграє певну роль у ембріональному розвитку збірних проток нирок [20].
Навпаки, внутрішньоклітинний Gal-3 є важливим для виживання клітин завдяки його здатності блокувати власний апоптотичний шлях, тоді як внутрішньоядерний Gal-3 сприяє проліферації клітин. Клітинна адгезія і проліферація за рахунок Gal-3 можуть перетворюватися на патологічні процеси, такі як фіброз і прогресування раку.
У низці клінічних і експериментальних доказів галектин-3 залучений до фіброзу, серцевої недостатності, ожиріння, порушення метаболізму глюкози і раку. Галектин-3 також був залучений до патогенезу шлуночкового ремоделювання, інфекцій, різних автоімунних і запальних процесів [21–28].
Хоча більшість досліджень погоджуються з поглядом на Gal-3 як на маркер запалення і фіброзу, дослідження експериментальних моделей метаболічних розладів на тваринах дозволяють припустити, що підвищена експресія Gal-3 може бути частиною адаптивної реакції на пошкодження тканин, що сприяє розсмоктуванню запалення і протидіє хронізації запального процесу. Послідовно Gal-3-абляція індукує прозапальний фенотип, що характеризується підвищеною системною та панкреатичною запальною реакцією на метаболічні подразники і посилене пошкодження судинної та ниркової тканини, викликане діабетом і пов’язаними з ним розладами.
З огляду на ці міркування існує потреба у великих проспективних дослідженнях, що конкретно вивчають співвідношення плазмових рівнів Gal-3 з довгостроковими комбінаціями у хворих на цукровий діабет. Однак перш ніж досліджувати дію селективних інгібіторів циркулюючого Gal-3 у хворих на цукровий діабет та без нього, необхідні подальші дослідження на моделях тварин, щоб визначити, чи є цей лектин посередником ушкоджень органів, простим спостерігачем або захисним агентом при даних хронічних станах і, отже, піддається він фармакологічній блокаді чи ні. Загалом, фактори, що беруть участь у визначенні кінцевого результату, який сприяє Gal-3, — це тип шкідливого стимулу, контекст пошкодження органів і клітинна локалізація.
Gal-3 регулює ріст клітин, проліферацію, диференціацію та запалення [29]. Однак при повторному ушкодженні тканини Gal-3 також виявляється тісно залученим у розвиток хронічного запалення (фіброгенез та рубцювання органів) [30].
Всередині клітини Gal-3 розподіляється між цитоплазмою та ядром залежно від типів клітин і умов [23]. Внутрішньоклітинно Gal-3 виявляється опосередковано через білково-білкову взаємодією, а не білково-вуглеводну. Він активує Akt [31, 32], інгібує або активує Erk 1/2 [23] і підвищує рівні b-катеніну [33] серед інших функцій залежно від оцінюваних типів клітин. У ядрі Gal-3 має вирішальне значення для сплайсингу пре-мРНК, оскільки він включений до сплайсосоми шляхом зв’язування з малим ядерним рибонуклеопротеїном (snRNP) комплексу U1. Було також показано, що Gal-3 сприяє транскрипції певних генів або пригнічує її [22].
Внутрішньоклітинний Gal-3 є важливим білком для виживання клітин через його здатність блокувати власний апоптичний шлях, в той час як у ядрі Gal-3 сприяє проліферації клітин через механізми, що не залежать від вуглеводів.
Позаклітинний Gal-3 модулює важливі взаємодії між епітеліальними клітинами і позаклітинним матриксом через його вуглеводний домен і відіграє важливу роль під час ембріонального розвитку збираючих канальців.
У кількох дослідженнях також показано, що Gal-3 відіграє важливу роль в альтернативній активації макрофагів, фагоцитозі макрофагів і кліренсі кінцевих продуктів глікірування [34–36]. Роль Gal-3 завдяки його функціональній різноманітності залишається спірною. Внутрішньоклітинний Gal-3 пригнічує активацію каспаз, аналогічну Bcl2. Однак позаклітинний Gal-3 може утворювати олігомери та зв’язуватися з рецепторами клітинної поверхні залежно від вуглеводів і сприяти апоптозу.
Роль галектину-3 у нефрогенезі
Під час метанефросу, попередника дорослої нирки, Gal-3 виявляється в апікальних ділянках гілок сечоводу. Він також інтенсивно експресується в плодових медулярних і сосочкових колекторних протоках обох цитоплазматичних і плазматичних мембран. Низькі рівні Gal-3 також виявляються в цитоплазмі клітин у дозрілих збірних протоках [37]. Пізніше він виявляється при дозріванні нирок плода у базальних ділянках медулярних збірних канальців [38]. Повідомляють про експресію Gal-3 на пізніх стадіях нефрогенезу, коли його експресія обмежується зачатками сечоводів, таких як збірні протоки і сполучні сегменти дистальних канальців [39]. У нормальних дозрілих нирках він обмежений колекторними канальцями.
Роль галектину-3 у розвитку хронічної хвороби нирок
Хронічна хвороба нирок (ХХН) є значною глобальною проблемою зі здоров’ям, на сьогодні відома лише невелика кількість терапевтичних варіантів, що уповільнюють її прогресування [40]. Поступове порушення ниркової функції виникає внаслідок тріади патологічних процесів: гломерулярного склерозу, тубулоінтерстиційного фіброзу і судинного склерозу [41]. Субклінічний тубулоінтерстиційний фіброз може бути важливим на ранніх стадіях ХХН. Патогенез ниркового інтерстиційного фіброзу зумовлений реорганізацією клітинних взаємодій із позаклітинним матриксом, активацією фібробластів, запаленням і характеризується епітеліально-мезенхімальним переходом (ЕМП). ЕМП стимулюють цитокіни, такі як трансформуючий фактор росту бета 1 (TGF-b1) або фактор росту сполучної тканини (CTGF) [42].
Експериментальні та клінічні дослідження ролі галектину-3 у розвитку хронічної хвороби нирок
Дослідження проведено на дорослих самцях щурів лінії Wistar вагою 150 г із застосуванням інгібітора активності Gal-3 [43]. Першу групу тварин розподілено на дві підгрупи. Перша отримувала дієту з високим вмістом жирів (33,5 %), друга — стандартну дієту (3,5 % жиру) протягом 6 тижнів. Половина тварин кожної підгрупи приймала інгібітор активності Gal-3, модифікований цитрусовий пектин (EcoNugenics 100 мг/кг/день) у питній воді за той же період. Друга група щурів була розподілена на три підгрупи: контрольні щури, щури з частковою оклюзією висхідної аорти та щури з частковою оклюзією висхідної аорти, які одержували інгібітор Gal-3 100 мг/кг/день у питній воді. Досліджувалися фіброзні маркери (колаген, CTGF, TFG-b), епітеліально-мезенхімальні перехідні молекули (фібронектин, a-гладком’язовий актин, b-catenin, E-cadherin), медіатор запалення (остеопонтин) і маркер пошкоджень нирок (NGAL, молекула пошкодження нирок 1). Гістологічні спостереження нирок опасистих щурів і щурів із частковою оклюзією висхідної аорти вказували на розвиток тубулоінтерстиційного фіброзу. Отже, в експериментальних моделях помірного пошкодження нирок спостерігалося збільшення ниркової Gal-3-експресії паралельно з нирковим фіброзом, запаленням і пошкодженням нирок, в той час як ці зміни були попереджені блокадою Gal-3. Ці дані свідчать про те, що Gal-3 може стати новим індикатором молекулярних, гістологічних та функціональних змін на ранніх стадіях пошкодження нирок.
Дослідники [44] оцінювали зв’язок Gal-3 із клітинною травмою і регенерацією при ішемічній і токсичній гострій нирковій недостатності (ГНН). За допомогою імуногістохімії Gal-3 почав виділятися в проксимальних звивистих канальцях через 2 год після реперфузії. З 6 до 48 год автори також спостерігали Gal-3 у проксимальних прямих і дистальних канальцях і збірних протоках, а потім у макрофагах на пізніх стадіях регенерації. Таким чином, автори дійшли висновку, що виділення Gal-3 помітно регулюється як у ішемічних, так і в токсичних типах ГНН, що свідчить про те, що він може відігравати важливу роль при гострих травмах та у подальшій регенерації.
Макрофаги є основним клітинним типом у патогенезі фіброзу нирок. Gal-3 підвищується в експериментальній моделі прогресуючого фіброзу нирок (одностороння обструкція сечоводу). Його відсутність захищає від накопичення та активації міофібробластів нирок і фіброзу, але його секреція макрофагами є важливою для активації фібробластів нирок. У дослідженні [45] при прогресуючому фіброзі Gal-3 не тільки захищав ниркові канальці від хронічної травми, обмежуючи апоптоз, але й також призводив до посилення ремоделювання матриксу і послаблення фіброзу.
Повідомляється, що у мишей із дефіцитом Gal-3 розвинулася гломерулопатія з більш вираженим збільшенням протеїнурії, експресією гена позаклітинного матриксу і розширенням мезангіальних клітин, що були пов’язані з більш високим накопиченням гліколізованих кінцевих продуктів (Advanced Glycation End-Products, AGE) у ниркових клубочках. У свою чергу, це було пов’язано з відсутністю функціонуючих рецепторів Gal-3/AGE. Припускають, що у мишей із дефіцитом Gal-3/AGE-рецепторів діабетична гломерулопатія розвивалася швидше [24].
Крім того, морфологічна оцінка нирок у мишей без Gal-3 показала значний гломерулярний склероз із періодичними кислотними позитивними відкладеннями Шиффа в мезангії і потовщенням клубочкової базальної мембрани та капсули Боумена. Встановлено зв’язок між зниженим Gal-3 і більшою сприйнятливістю до AGE-індукованого ниркового захворювання, підвищеним рівнем AGE і сигналізації, а також зміненими структурами AGE-рецепторів, що свідчить про те, що Gal-3 функціонує як рецептор AGE in vivo, забезпечуючи тим самим захист проти AGE-залежного пошкодження тканин. Досліджували [46] експресію Gal-3 у зразках ниркових біоптатів у хворих на діабетичну, мембранозну та IgA-нефропатію, гломерулонефрит і мінімальний нефротичний синдром. У нормальних людських нирках Gal-3 було виявлено тільки в дистальних канальцях. У біоптатах нирок, взятих у пацієнтів із діабетичною нефропатією, було значно більше Gal-3-позитивних клітин у клубочках, ніж у біоптатах, взятих у пацієнтів з іншими нефропатіями. Співвідношення Gal-3-позитивних клітин із загальною кількістю макрофагів у канальцях також значно збільшувалося при діабетичній нефропатії.
Kang et al. [47] обстежили 88 пацієнтів із СЧВ-нефритом для визначення експресії Gal-3 у ниркових тканинах хворих на СЧВ-нефрит. Експресію гломерулярного Gal-3 відзначали у 81,8 % (72 із 88) пацієнтів з СЧВ. Рівні експресії Gal-3 корелювали з показниками гістологічної активності, титрами анти-dsDNA та рівнями комплексів 3 і 4. Ці дані свідчать про те, що Gal-3 може сприяти запальному процесу при СЧВ.
У хворих на цукровий діабет спостерігалася вірогідна кореляція між числом Gal-3-позитивних клітин в екскреції білків клубочків і сечі, але негативна — між числом Gal-3-позитивних клітин у клубочках і швидкістю регресії функції ниркових клітин. Ці результати свідчать про те, що інфільтрація Gal-3-позитивних клітин може відігравати важливу роль у прогресуванні діабетичної нефропатії, і ступінь експресії Gal-3 може бути предиктором несприятливого прогнозу.
Останніми роками в літературі дискутується питання про застосування Gal-3 у лікуванні ХХН. Повідомляється, що Gal-3 сприяє нефрогенезу та сильно експресується в зачатках сечоводу і його похідних. Крім того, повідомляється, що підвищений рівень Gal-3 пов’язаний з підвищеним ризиком зниження функції нирок і розвитком ХХН.
Результати дослідження вказують на те, що Gal-3 є потужним активатором фібробластів у нирках. Sun et al. [48] досліджували вплив AGE і розиглітазону на експресію і секрецію Gal-3 у культивованих ниркових мезангіальних клітинах людини. Розиглітазон підвищував експресію і секрецію Gal-3 залежним від дози способом — це свідчить про те, що він може відігравати певну роль у ренозахисті за допомогою регулювання Gal-3.
Результати проведених [49] досліджень показали, що Gal-3 захищає нирку від прогресуючого пошкодження через хронічну травму, модулюючи два важливих шляхи: трубчастий апоптоз і ремоделювання позаклітинного матриксу. Нирковий трубчастий епітеліальний клітинний апоптоз і подальша трубчаста атрофія є важливою причиною втрати нефронів, що викликає прогресуюче функціональне погіршення. Незалежно від того, чи пов’язана клітина з долею апоптозу або одужанням після травми або важкого стресу, результат визначається балансом між проапоптотичними і антиапоптотичними факторами. Внутрішньоклітинний Gal-3 є вірогідно встановленим антиапоптотичним фактором, що може блокувати як внутрішні, так і зовнішні шляхи. Рівні експресії Gal-3 у нормальних нирках низькі. З настанням пошкодження, викликаного обструкцією сечоводу, трубчаста експресія Gal-3 різко підвищується протягом першого тижня. Хоча Gal-3 не є членом сімейства Bcl-2, він має значну структурну схожість із Bcl-2: обидва білки багаті на залишки проліну, гліцину й аланіну в їх NH2-термінальних доменах і містять послідовність Asp-Trp-Gly-Arg (NWGR) в кінці COOH, що є критичною для антиапоптотичних функцій. Крім того, Gal-3 може посилювати проліферацію епітеліальних клітин, що є важливим компонентом адаптивної відповіді при обструктивному пошкодженні нирок. Ядерний Gal-3, як відомо, є важливим регулятором клітинної проліферації через його здатність регулювати клітинний цикл і виступати як фактор заломлення мРНК. У сукупності ці дані підтверджують, що внутрішньоклітинна експресія Gal-3 підвищується в трубчастих клітинах під час хронічного пошкодження нирок, де вона, мабуть, функціонує як важливий фактор виживання, блокуючи апоптоз і сприяючи проліферації трубчастих клітин. Антифіброзні ефекти Gal-3 можуть бути пов’язані зі збільшенням обороту позаклітинного матриксу.
На сьогодні є незначна кількість клінічних досліджень щодо можливого використання Gal-3 як маркера фіброзу. Зокрема, дослідження [50] показали, що профібротичні маркери (трансформуючий фактор росту В1, Gal-3) збільшувалися з наростанням ступеня активності пієлонефриту в дітей. Існує відповідність між зміною ультрасонографічного індексу у дітей з пієлонефритом на тлі міхурово-сечовідного рефлюксу та рівнем трансформуючого фактора росту В1 та Gal-3 щодо розвитку фібротичних змін: при збільшенні ренально-кортикального індексу відбувається збільшення рівня названих біохімічних маркерів на 38 та 45 % відповідно [51].
Висновки
Існуюча література вказує, що Gal-3 є універсальною молекулою, яка служить модифікатором біологічної відповіді широкого спектра. Як наслідок, вона надає численні й іноді протилежні функції. Фізіологічне значення родини галектинів, в тому числі і галектину-3 (Gal-3), полягає в тому, що вони виступають як фактори сплайсингу пре-мРНК, регулятори клітинного циклу, клітинного росту й апоптозу, беруть участь в епітеліальному гомеостазі, а також розглядаються як регуляторні молекули, що впливають на різні стадії — від гострого до хронічного запалення і тканинного фіброгенезу.
У клінічних дослідженнях вони можуть бути використані як маркер диференціювання. Gal-3, ймовірно, не може бути використаний як діагностичний (скринінговий) біомаркер ХХН через відсутність чутливості та специфічності, але може мати потенціал для прогнозування прогресуючого зниження функції нирок. Gal-3 може прогнозувати пошкодження нирок за кілька років до того, як ХХН буде виявлено клінічно, що полегшить цілеспрямоване лікування та профілактику захворювань. Комерційні ж імуноаналізи Gal-3 існують для застосування в клінічних лабораторіях, що робить можливим їх клінічне використання. Однак на сьогодні міжнародна стандартизація все ще відсутня.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Dumic J., Dabelic S., Flogel M. Galectin-3: an open ended story. Biochim Biophys Acta. 2006. 1760. 616-635. doi: 10.1016/j.bbagen.2005.12.020.
2. Vijayakumar S., Peng H., Schwartz G.J. Galectin-3 mediates oligomerization of secreted hensin using its carbohydrate-recognition domain. Am. J. Physiol. Renal. Physiol. 2013. 305. F90-F99. doi: 10.1152/ajprenal.00498.2012.
3. Desmedt V., Desmedt S., Delanghe J.R., Speeckaert R., Speeckaert M.M. Galectin-3 in Renal Pathology: More Than Just an Innocent Bystander? Am. J. Nephrol. 2016. 43. 305-317 doi: 10.1159/000446376.
4. Funasaka T., Balan V., Raz A., Wong R.W. Nucleoporin Nup98 mediates galectin-3 nuclear-cytoplasmic trafficking. Biochem. Biophys. Res. Commun. 2013. 434. 155-61. doi: 10.1016/j.bbrc.2013.03.052.
5. Hönig E., Schneider K., Jacob R. Recycling of galectin-3 in epithelial cells. Eur. J. Cell Biol. 2015. 94. 309-315. doi: 10.1016/j.ejcb.2015.05.004.
6. Pugliese G., Iacobini C., Ricci C. et al. Galectin-3 in diabetic patients. Clin. Chem. Lab. Med. 2014. 52 (10). 1413-1423.
7. Dange M.C., Agarwal A.K., Kalraiya R.D. Extracellular galectin-3 induces MMP9 expression by activating p38 MAPK pathway via lysosome-associated membrane protein-1 (LAMP1). Mol. Cell. Biochem. 2015. 404. 79-86. doi: 10.1007/s11010-015-2367-5.
8. Thomas L., Pasquini L.A. Extracellular Galectin-3 Induces accelerated oligodendroglial differentiation through changes in signaling pathways and cytoskeleton dynamics. Mol. Neurobiol. 2018. 1. 14. doi: 10.1007/s12035-018-1089-6.
9. Iacobini C., Fantauzz C.B., Pugliese G., Menini S. Role of galectin-3 in bone cell differentiation, bone pathophysiology and vascular osteogenesis. Int. J. Mol. Sci. 2017. 18. E2481. doi: 10.3390/ijms18112481.
10. Itabashi T., Arima Y., Kamimura D. et al. Cell- and stage-specific localization of galectin-3, a b-galactoside-binding lectin, in a mouse model of experimental autoimmune encephalomyelitis. Neurochem. Int. 2018. 118. 176-184. doi: 10.1016/j.neuint.2018.06.007.
11. de Boer R.A., van Veldhuisen D.J., Gansevoort R.T. et al. The fibrosis marker galectin-3 and outcome in the general population. J. Intern. Med. 2012. 272. 55-64. https://doi.org/10.1111/j.1365-2796.2011.02476.x.
12. Danella Polli C., Alves Toledo K., Franco L.H. et al. Monocyte migration driven by galectin-3 occurs through distinct mechanisms involving selective interactions with the extracellular matrix. ISRN Inflamm. 2013. 1. 259256. doi: 10.1155/2013/259256.
13. Koca S.S., Akbas F., Ozgen M. et al. Serum galectin-3 level in systemic sclerosis. Clin. Rheumatol. 2014. 33. 215-220. doi: 10.1002/brb3.773.
14. Yabuta C., Yano F., Fujii A. et al. Galectin-3 enhances epithelial cell adhesion and wound healing in rat cornea. Ophthalmic. Res. 2015. 51. 96-103. doi: 10.1016/j.exer.2015.06.010.
15. Liu-cheng Li, Jun Li, Jian Gao. Functions of Galectin-3 and Its Role in Fibrotic Diseases. The journal of pharmacology and experimental therapeutics. 2014. 351. 336-343. doi.org/10.1124/jpet.114.218370.
16. von Mach T., Carlsson M.C., Straube T. et al. Ligand binding and complex formation of galectin-3 is modulated by pH variations. Biochem. J. 2014. 457. 107-115. doi: 10.1042/BJ20130933.
17. Pugliese G., Iacobini C., Pesce C.M., Menini S. Galectin-3: an emerging all-out player in metabolic disorders and their complications. Glycobiology. 2015. 25. 136-150. doi: 10.1093/glycob/cwu111.
18. Thomas L., Pasquini L.A. Galectin-3-Mediated Glial Crosstalk Drives Oligodendrocyte Differentiation and (Re)myelination. Front. Cell. Neurosci. 2018. 12. 297. doi: 10.3389/fncel.2018.00297.
19. Li L.C., Li J., Gao J. Functions of Galectin-3 and Its Role in Fibrotic Diseases. Journal of Pharmacology and Experimental Therapeutics. 2014. 351 (2). 336-343. doi: https://doi.org/10.1124/jpet.114.218370.
20. Bänfer S., Schneider D., Dewes J. et al. Molecular mechanism to recruit galectin-3 into multivesicular bodies for polarized exosomal secretion. Proc. Natl. Acad. Sci. U.S.A. 2018. 115. E4396-E4405. doi: 10.1073/pnas.1718921115.
21. Brittoli A., Fallarini S., Zhang H. et al. “In vitro” studies on galectin-3 in human natural killer cells. Immunol. Lett. 2018; 194:4–12. doi: 10.1016/j.imlet.2017.12.004.
22. Zhou W., Chen X., Hu Q. et al. Galectin-3 activates TLR4/NF-κB signaling to promote lung adenocarcinoma cell proliferation through activating lncRNA-NEAT1 expression. BMC Cancer. 2018. 18. 580. doi: 10.1186/s12885-018-4461-z.
23. Haudek K.C., Spronk K.J., Voss P., Arnoys E.J. Dynamics of galectin-3 in the nucleus and cytoplasm. Biochim. Biophys. Acta. 2010. 1800. 181-189. doi: 10.1016/j.bbagen.2009.07.005.
24. Téllez-Sanz R., García-Fuentes L., Vargas-Berenguel A. Human galectin-3 selective and high affinity inhibitors. Present state and future perspectives. Curr. Med. Chem. 2013. 20. 2979-2990. PMID: 23834183.
25. de Boer R.A., Edelmann F., Cohen-Solal A. et al. Galectin-3 in heart failure with preserved ejection fraction. Eur. J. Heart Fail. 2013. 15. 1095-101. doi: 10.1093/eurjhf/hft077.
26. Ho J.E., Liu C., Lyass A., Courchesne P. et al. Galectin-3, a marker of cardiac fibrosis, predicts incident heart failure in the community. J. Am. Coll. Cardiol. 2012. 60. 1249-56. doi: 10.1016/j.jacc.2012.04.053.
27. Anand I.S., Rector T.S., Kuskowski M. et al. Baseline and serial measurements of galectin-3 in patients with heart failure: relationship to prognosis and effect of treatment with valsartan in the Val-HeFT. Eur. J. Heart Fail. 2013. 15. 511-8. doi: 10.1093/eurjhf/hfs205.
28. Traber P.G., Chou H., Zomer E. et al. Regression of fibrosis and reversal of cirrhosis in rats by galectin inhibitors in thioacetamide induced liver disease. PLoS One. 2013. 8. e75361. https://doi.org/10.1371/journal.pone.0075361.
29. Chen S.C., Kuo P.L. The Role of Galectin-3 in the Kidneys. Int. J. Mol. Sci. 2016 Apr. 17 (4). 565. doi: 10.3390/ijms17040565.
30. Dang Z., MacKinnon A., Marson L.P., Sethi T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 2012. 93. 477-84. doi: 10.1097/TP.0b013e318242f40a.
31. Kariya Y., Oyama M., Hashimoto Y., Gu J., Kariya Y. b4-Integrin/PI3K signaling promotes tumor progression through the galectin-3-N-glycan complex. Mol. Cancer Res. 2018. 16. 1024-1034. doi: 10.1158/1541-7786.MCR-17-0365.
32. Ruvolo P.P. Galectin 3 as a guardian of the tumor microenvironment. Biochim. Biophys. Acta. 2018. 1863. 427-437. doi: 10.1016/j.bbamcr.2015.08.008.
33. Hu K., Gu Y., Lou L. et al. Galectin-3 mediates bone marrow microenvironment-induced drug resistance in acute leukemia cells via Wnt/b-catenin signaling pathway. J. Hematol. Oncol. 2015. 8. 1. doi: 10.1186/s13045-014-0099-8.
34. McLeod K., Walker J.T., Hamilton D.W. Galectin-3 regulation of wound healing and fibrotic processes: insights for chronic skin wound therapeutics. J. Cell Commun. Signal. 2018. 12. 281-287. doi: 10.1007/s12079-018-0453-7.
35. More S.K., Chiplunkar S.V., Kalraiya R.D. Galectin-3-induced cell spreading and motility relies on distinct signaling mechanisms compared to fibronectin. Mol. Cell. Biochem. 2016. 416. 179-191. doi: 10.1007/s11010-016-2706-1.
36. Nishihara H., Shimizu F., Kitagawa T. et al. Identification of galectin-3 as a possible antibody target for secondary progressive multiple sclerosis. Mult. Scler. 2017. 23. 382-394. doi: 10.1177/1352458516655217.
37. Savic J., Zeljkovic A., Bogavac-Stanojevic N. et al. Association of small, dense low-density lipoprotein cholesterol and galectin-3 in patients with chronic kidney disease. Scand. J. Clin. Lab. Invest. 2014. 74. 637-643. doi: 10.1186/s12944-015-0143-x.
38. Bansal N., Katz R., Seliger S. et al. Galectin-3 and soluble ST2 and kidney function decline in older adults: the Cardiovascular Health Study (CHS). Am. J. Kidney Dis. 2016. 67 (6). 994-6. doi: 10.1053/j.ajkd.2015.12.022.
39. Iacoviello M., Aspromonte N., Leone M. et al. Galectin-3 serum levels are independently associated with microalbuminuria in chronic heart failure outpatients. Res. Cardiovasc. Med. 2015. 5. e28952. doi: 10.5812/cardiovascmed.28952.
40. O’Seaghdha C.M., Hwang S.J., Ho J.E. et al. Elevated galectin-3 precedes the development of CKD. J. Am. Soc. Nephrol. 2013. 24. 1470-7. doi: 10.1681/ASN.2012090909.
41. Calvier L., Miana M., Reboul P. et al. Galectin-3 mediates aldosterone-induced vascular fibrosis. Arterioscler. Thromb. Vasc. Biol. 2013. 33. 67-75. doi: 10.1161/ATVBAHA.112.300569.
42. Rahimian R., Béland L.C., Kriz J. Galectin-3: mediator of microglia responses in injured brain. Drug Discov. Today. 2018. 23. 375-381. doi: 10.1016/j.drudis.2017.11.004.
43. Martinez-Martinez E., Ibarrola J., Calvier L. et al. Galectin-3 Blockade Reduces Renal Fibrosis in Two Normotensive Experimental Models of Renal Damage. PLoS ONE. 2016. 11 (11). e0166272. doi: 10.1371/journal.pone.0166272.
44. Bertocchi A.P.F., Campanhole G., Wang P.H.M. et al. A Role for galectin-3 in renal tissue damage triggered by ischemia and reperfusion injury Journal compilation. European Society for Organ Transplantation. 2008. 1. 999-1007. https://doi.org/10.1111/j.1432-2277.2008.00705.x
45. Kinnon M., Farnworth S.L., Hodkinson P.S. et al. Regulation of Alternative Macrophage Activation by Galectin-31 Alison C. The Journal of Immunology. 2008. 180. 2650-2658.
46. Kikuchi K., Tancharoen S., Ito T. et al. Potential of the Angiotensin Receptor Blockers (ARBs) Telmisartan, Irbesartan, and Candesartan for Inhibiting the HMGB1/RAGE Axis in Prevention and Acute Treatment of Stroke. Int. J. Mol. Sci. 2013. 14. 18899-18924. https://doi.org/10.3390/ijms15045410.
47. Kang E.H., Moon K.C., Lee E.Y. et al. Renal expression of galectin-3 in systemic lupus erythematosus patients with nephritis. Lupus. 2009. 18 (1). 22-8. doi: 10.1177/0961203308094361.
48. Sun Z., Ma Ch., Jin H., Yuan Y. Effects of advanced glycosylation end products and rosiglitazone on the expression and secretion of galectin-3 in human renal mesangial cells. Chinese medical journal 2009. 122 (9). 1067-71. doi: 10.3760/cma.j.issn.0366-6999.2009.09.011.
49. Tampe D., Zeisberg M. Potential approaches to reverse or repair renal fibrosis. Nat. Rev. Nephrol. 2014. 10. 226-237. doi: 10.1038/nrneph.2014.14. Epub 2014 Feb 11.
50. Tokarchuk N.I., Odarchuk I.V. The comparative characteristic of indicators of activity of inflammatory process with pyelonephritis on the background of vesicoureteral reflux in children of early age. Journal of Education, Health and Sport. 2016. 8. 734-746.
51. Токарчук Н.І., Одарчук І.В., Вижга Ю.В. та ін. Характеристика показників галектину 3 при пієлонефриті на тлі міхурово-сечовідного рефлюксу у дітей раннього віку. Неонатологія, хірургія та перинатальна медицина. 2017. 3 (25). 68-74.