Журнал «Травма» Том 20, №4, 2019
Вернуться к номеру
Перспективи кількісної оцінки результатів однофотонної емісійної комп’ютерної томографії кісткової системи (огляд літератури)
Авторы: Король П.О.(1, 2), Самохін А.В.(2), Ткаченко М.М.(1)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — Київська міська клінічна лікарня № 12, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
В огляді літератури розглянуто питання перспективи кількісної оцінки результатів однофотонної емісійної комп’ютерної томографії (ОФЕКТ) кісткової системи. Синтез функціональної інформації, отриманої за допомогою ОФЕКТ у комплексі з високою роздільною здатністю КТ, дозволяє ефективно визначати патологічний метаболізм у кістках з одночасною оцінкою співіснуючих структурних змін. Показники максимального відсотка стандартизованого накопичення (ВСН) радіофармпрепарату (РФП) та пікового відсотка стандартизованого накопичення слід вважати найбільш оптимальними параметрами кількісного визначення фокального поглинання РФП. У подальшому необхідно залучати більш вузькі підгрупи хворих (наприклад, за віком, зростом, масою, статтю тощо), які мають специфічні умови, для того щоб створити відповідну доказову базу. Проте необхідні подальші технологічні вдосконалення для того, щоб розрахунок кількісних параметрів ОФЕКТ шляхом обчислення ВСН став частиною звичайної медичної практики.
В обзоре литературы рассмотрены вопросы перспективы количественной оценки результатов однофотонной эмиссионной компьютерной томографии (ОФЭКТ) костной системы. Синтез функциональной информации, полученной с помощью ОФЭКТ в комплексе с высоким разрешением КТ, позволяет эффективно определять патологический метаболизм в костях с одновременной оценкой сосуществующих структурных изменений. Показатели максимального процента стандартизированного накопления (ПСН) радиофармпрепарата (РФП) и пикового процента стандартизированного накопления следует считать наиболее оптимальными параметрами количественного определения фокального поглощения РФП. В дальнейшем необходимо привлекать более узкие подгруппы больных (например, по возрасту, росту, массе, полу и т.д.), имеющих специфические условия, для того чтобы создать соответствующую доказательную базу. Однако необходимы дальнейшие технологические усовершенствования для того, чтобы расчет количественных параметров ОФЭКТ путем вычисления ПСН стал частью обычной медицинской практики.
The review of the literature examines the prospects for the quantitative assessment of the results of single-photon emission computed tomography (SPECT) of the skeletal system. Synthesis of functional information obtained using SPECT together with high resolution computed tomography allows you to effectively determine the pathological metabolism in the bones with the simultaneous assessment of coexisting structural changes. Indicators of the maximum standardized uptake value of the radiopharmaceutical and the peak standardized uptake value should be considered the most optimal parameters for the quantitative determination of the focal absorption of radiopharmaceutical. In the future, it is necessary to attract narrower subgroups of patients (for example, by age, height, weight, sex, etc.) that have specific conditions in order to create an appropriate evidence base. However, further technological improvements are needed to make the calculation of quantitative SPECT parameters, by determining the standardized uptake value, a part of normal medical practice.
однофотонна емісійна комп’ютерна томографія; радіофармпрепарат; відсоток стандартизованого накопичення; огляд
однофотонная эмиссионная компьютерная томография; радиофармпрепарат; процент стандартизированного накопления; обзор
single-photon emission computed tomography; radiopharmaceutical; standardized uptake value; review
Вступ
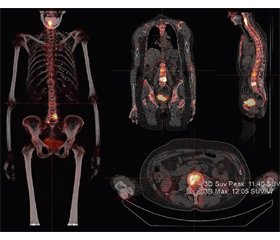
Кількісна візуалізація ОФЕКТ
Перспективи застосування кількісних параметрів ОФЕКТ кісток скелета
1. Al-Riyami K., Vöö S., Gnanasegaran G. et al. The role of bone SPECT/CT in patients with persistent or recurrent lumbar pain following lumbar spine stabilization surgery. Eur. J. Nucl. Med. Mol. Imaging. 2018. Vol. 73. P. 968. doi: 10.1007/s00259-018-4141-x.
2. Armstrong A.J., Anand А., Edenbrandt L. et al. Phase 3 Assessment of the Automated Bone Scan Index as a Prognostic Imaging Biomarker of Overall Survival in Men With Metastatic Castration-Resistant Prostate Cancer. JAMA Oncol. 2018. Vol. 4. № 7. P. 944-951. doi: 10.1001/jamaoncol.2018.1093.
3. Armstrong I.S., Hoffmann S.A. Activity concentration measurements using a conjugate gradient (Siemens xSPECT) reconstruction algorithm in SPECT/CT. Nucl. Med. Commun. 2016. Vol. 37. № 11. P. 1212-1217. doi: 10.1097/MNM.0000000000000586.
4. Bailey D.L., Willowson K.P. An evidence-based review of quantitative SPECT imaging and potential clinical applications. J. Nucl. Med. 2013. Vol. 54. P. 83-89. doi: 10.2967/jnumed.112.111476.
5. Beck M., Sanders J.C., Ritt P. et al. Longitudinal analysis of bone metabolism using SPECT/CT and 99mTc-diphosphono-propanedicarboxylic acid: comparison of visual and quantitative analysis. EJNMMI Res. 2016. Vol. 6. P. 60. doi: 10.1186/s13550-016-0217-4.
6. Beheshti M., Mottaghy F.M., Paycha F. et al. 18F-NaF PET/CT: EANM procedure guidelines for bone imaging. Eur. J. Nucl. Med. Mol. Imaging. 2015. Vol. 42. P. 1767-1777. doi: 10.1007/s00259-015-3138-y.
7. Buchbender C., Hartung-Knemeyer V., Forsting M. et al. Positron emission tomography (PET) attenuation correction artefacts in PET/CT and PET/MRI. Br. J. Radiol. 2013. Vol. 86. № 1025. Р. 20120570. doi: 10.1259/bjr.20120570.
8. Cachovan M., Vija A.H., Hornegger J. et al. Quantification of 99mTc-DPD concentration in the lumbar spine with SPECT/CT. EJNMMI Res. 2013. Vol. 3. P. 45. doi: 10.1186/2191-219X-3-45.
9. Chicco A., Lin Р., Som S. Assessment and correction of partial volume effect in SPECT/CT. J. Intern. Med. 2015. Vol. 45. P. 1-2. doi: 10.1088/0031-9155/56/16/018.
10. Chirindel A., Alluri K.C., Tahari A.K. et al. Liver standardized uptake value corrected forlean body mass at FDG PET/CT: effect of FDG uptake time. Clin. Nucl. Med. 2015. Vol. 40. P. 17-22. doi: 10.1097/RLU.0000000000000446.
11. Choi J., Kim J.W., Jeon T.J. et al. The 18F-FDG PET/CT response to radiotherapy for patients with spinal metastasis correlated with the clinical outcomes. PLoS One. 2018. Vol. 13. P. 0204918. doi: 10.1371/journal.pone.0204918.
12. De Laroche R., Simon Е., Suignard N. et al. Clinical interest of quantitative bone SPECT-CT in the preoperative assessment of knee osteoarthritis. Medicine (Baltimore). 2018. Vol. 97. P. 11943. doi: 10.1097/MD.0000000000011943.
13. Fonager R.F., Zacho H.D., Langkilde N.C. et al. Diagnostic test accuracy study of 18F-sodium fluoride PET/CT, 99mTc-labelled diphosphonate SPECT/CT, and planar bone scintigraphy for diagnosis of bone metastases in newly diagnosed, high-risk prostate cancer. Am. J. Nucl. Med. Mol. Imaging. 2017. Vol. 7. P. 218-227.
14. Haraldsen A., Bluhme Н., Røhl L. et al. Single photon emission computed tomography (SPECT) and SPECT/low-dose computerized tomography did not increase sensitivity or specificity compared to planar bone scintigraphy for detection of bone metastases in advanced breast cancer. Clin. Physiol. Funct. Imaging. 2016. Vol. 36. № 1. P. 40-46. doi: 10.1111/cpf.12191.
15. Helyar V., Mohan H.K., Barwick T. et al. The added value of multislice SPECT/CT in patients with equivocal bony metastasis from carcinoma of the prostate. Eur. J. Nucl. Med. Mol. Imaging. 2010. Vol. 37. P. 706-713. doi: 10.1007/s00259-009-1334-3.
16. Hetzel M., Arslandemir С., König Н.-Н. et al. F-18 NaF PET for detection of bone metastases in lung cancer: accuracy, cost-effectiveness, and impact on patient management. J. Bone Miner. Res. 2003. Vol. 18. P. 2206-2214. doi: 10.1359/jbmr.2003.18.12.2206.
17. Holman B.F., Cuplov V., Millner L. et al. Improved correction for the tissue fraction effect in lung PET/CT imaging. Phys. Med. Biol. 2015. Vol. 60. P. 7387-7402. doi: 10.1088/0031-9155/60/18/7387.
18. Huang S.C. Anatomy of SUV. Standardized uptake value. Nucl. Med. Biol. 2000. Vol. 27. P. 643-646.
19. Jarritt P.H., Whalley D.R., Skrypniuk J.V. et al. UK audit of single photon emission computed tomography reconstruction software using software generated phantoms. Nucl. Med. Commun. 2002. Vol. 23. P. 483-491.
20. Kaneta T., Ogawa М., Daisaki Н. et al. SUV measurement of normal vertebrae using SPECT/CT with Tc-99m methylene diphosphonate. Am. J. Nucl. Med. Mol. Imaging. 2016. Vol. 6. P. 262-268.
21. Korol P., Tkachenko M. The role of bone scintigraphy in differential diagnosis of knee inflammatory processes. Fundamental and applied sciences today. 2014. Vol. 1. P. 53-55 (in Ukrainian).
22. Kim J., Lee Н.-Н., Kang Y. et al. Maximum standardised uptake value of quantitative bone SPECT/CT in patients with medial compartment osteoarthritis of the knee. Clin. Radiol. 2017. Vol. 72. P. 580-589. doi: 10.1016/j.crad.2017.03.009.
23. Kuji I., Yamane Т., Seto А. et al. Skeletal standardized uptake values obtained by quantitative SPECT/CT as an osteoblastic biomarker for the discrimination of active bone metastasis in prostate cancer. European J. Hybrid. Imaging. 2017. Vol. 1. P. 1-16. doi: 10.1186/s41824-017-0006-y.
24. López Buitrago D.F., Ruiz Botero J., Corral C.M. Comparison of 99mTc-MDP SPECT qualitative vs quantitative results in patients with suspected condylar hyperplasia. Rev. Esp. Med. Nucl. Imagen. Mol. 2017. Vol. 36. P. 207-211. doi: 10.1016/j.remn.2017.01.003.
25. Miyaji N., Miwa К., Motegi К. et al. Validation of cross-calibration schemes for quantitative bone SPECT/CT using different sources under various geometric conditions. Nihon Hoshasen Gijutsu Gakkai Zasshi. 2017. Vol. 73. № 6. P. 443-450. doi: 10.6009/jjrt.2017_JSRT_73.6.443.
26. Nakahara T., Daisaki H., Yamamoto Y. et al. Use of a digital phantom developed by QIBA for harmonizing SUVs obtained from the state-of-the-art SPECT/CT systems: a multicenter study. EJNMMI Res. 2017. Vol. 7. P. 53. doi: 10.1186/s13550-017-0300-5.
27. O’Mahoney E., Murray I. Evaluation of a matched filter resolution recovery reconstruction algorithm for SPECT-Cti-maging. Nucl. Med. Commun. 2013. Vol. 34. № 3. P. 240-248. doi: 10.1097/MNM.0b013e32835ce5b5.
28. Palmedo H., Marx С., Ebert А. et al. Whole-body SPECT/CT for bone scintigraphy: diagnostic value and effect on patient management in oncological patients. Eur. J. Nucl. Med. Mol. Imaging. 2014. Vol. 41. P. 59-67. doi: 10.1007/s00259-013-2532-6.
29. Sanderson T., Gear J.I., Murray I. et al. The impact of background ratios in calibration phantoms on the accuracy of dosimetry for Y-90 DOTATATE. Nucl. Med. Commun. 2015. Vol. 36. № 5. Р. 512-547.
30. Schirrmeister H., Glatting G., Hetzel J. et al. Prospective evaluation of the clinical value of planar bone scans, SPECT, and 18F-labeled NaF PET in newly diagnosed lung cancer. J. Nucl. Med. 2001. Vol. 42. P. 1800-1804.
31. Segall G., Delbeke D., Stabin M.G. et al. SNM practice guideline for sodium18F-fluoride PET/CT bone scans 1.0. J. Nucl. Med. 2010. Vol. 51. № 11. P. 1813-1820. doi: 10.2967/jnumed.110.082263.
32. Sher A., Lacoeuille F., Fosse P. et al. For avid glucose tumors, the SUV peak is the most reliable parameter for [18F]FDG-PET/CT quantification, regardless of acquisition time. EJNMMI Res. 2016. Vol. 6. P. 21. doi: 10.1186/s13550-016-0177-8.
33. Stauss J., Hahn К., Mann М. et al. Guidelines for paediatric bone scanning with99mTc-labelled radiopharmaceuticals and18F-fluoride. Eur. J. Nucl. Med. Mol. Imaging. 2010. Vol. 37. № 8. P. 1621-1628. doi: 10.1007/s00259-010-1492-3.
34. Stokke C., Gabiña P.M., P. Solný et al. Dosimetry-based treatment planning for molecular radiotherapy: a summary of the 2017 report from the Internal Dosimetry Task Force. EJNMMI Phys. 2017. Vol. 4. P. 27. doi: 10.1186/s40658-017-0194-3.
35. Suh M.S., Lee W.W., Kim Y.-K. et al. Maximum standardized uptake value of 99mTc hydroxymethylene diphosphonate SPECT/CT for the evaluation of temporomandibular joint disorder. Radiology. 2016. Vol. 280. № 3. P. 890-896. doi: 10.1148/radiol.2016152294.
36. Tkachenko M., Korol Р. The role of three/phase bone scintigraphy in arthroplasty of hip and knee joints of clean/up workers of Chornobyl accident. Problems of radiation medicine and radiobiology. 2017. Vol. 22. P. 476-483 (in Ukrainian).
37. Tsujimoto M., Shirakawa S., Teramoto А. et al. Fluctuation of quantitative values on acquisition time and the reconstruction conditions in 99mTc-SPECT. Nucl. Med. Commun. 2018. Vol. 39. P. 601-609. doi: 10.1097/MNM.0000000000000854.
38. Umeda T., Koizumi М., Fukai S. et al. Evaluation of bone metastatic burden by bone SPECT/CT in metastatic prostate cancer patients: defining threshold value for total bone uptake and assessment inradium-223 treated patients. Ann. Nucl. Med. 2018. Vol. 32. P. 105-113. doi: 10.1007/s12149-017-1224-x.
39. Van den Wyngaert T., Strobel К., Kampen W.U. et al. The EANM practice guidelines for bone scintigraphy. Eur. J. Nucl. Med. Mol. Imaging. 2016. Vol. 43. P. 1723-1738. doi: 10.1007/s00259-016-3415-4.
40. Wang R., Duan Х., Shen С. et al. A retrospective study of SPECT/CT scans using SUV measurement of the normal pelvis with Tc-99m methylenediphosphonate. J. Xray Sci. Technol. 2018. Vol. 26. № 6. Р. 895-908. doi: 10.3233/XST-180391.
41. Yamane T., Kuji I., Seto A. Quantification of osteoblastic activity in epiphyseal growth plates by quantitative bone SPECT/CT. Skelet Radiol. 2018. Vol. 47. № 6. P. 805-810. doi: 10.1007/s00256-017-2861-9.
42. Zacho H.D., Biurrun Manresa J.A., Aleksyniene R. et al. Three-minute SPECT/CT is sufficient for the assessment of bone metastasis as add-on to planar bone scintigraphy: prospective head-to-head comparison to 11-min SPECT/CT. EJNMMI Res. 2017. Vol. 7. P. 1. doi: 10.1186/s13550-016-0252-1.

/17.jpg)
/19.jpg)
/20.jpg)