Архив офтальмологии Украины Том 7, №3, 2019
Вернуться к номеру
Особливості мікрофлори ран пацієнтів із травматичними пошкодженнями допоміжного апарату окаі здатність виділених штамівдо утворення біоплівок
Авторы: Петренко О.В.(1), Дранко М.М.(2), Голубнича В.М.(3), Грицай Л.В.(2)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — Сумська обласна клінічна лікарня, м. Суми, Україна
(3) — Сумський державний університет, Медичний інститут, м. Суми, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Актуальність. Проблема гнійно-запальних ускладнень при травмах допоміжного апарату ока залишається актуальною для клінічної офтальмохірургії, оскільки дані стани нерідко обумовлюють тяжкий перебіг перед- і післяопераційного періоду, що проявляється порушенням загальних і місцевих механізмів регулювання, генералізацією процесу та затримкою загоєння ран. Мета дослідження полягала у вивченні видового складу мікрофлори ран допоміжного апарату ока, визначенні чутливості виділених мікроорганізмів до найчастіше вживаних антибіотиків та їх здатності утворювати біоплівки. Матеріали та методи. У роботі дослідили видовий склад мікрофлори ран 53 пацієнтів із травматичними пошкодженнями допоміжного апарату ока впродовж 2018–2019 років. Здійснено обстеження мазків із ран із подальшим дослідженням видового складу й ідентифікацією мікроорганізмів, які проводили з використанням класичних бактеріологічних методик. Результати. Ідентифікували 67 штамів мікроорганізмів. Домінуючим виявився Staphylococcus aureus, друге місце зайняв Acinetobacter spp., третє — Micrococcus spp. Частота виділення мікроорганізмів у монокультурі з ран становила 33 (66 %), у 17 (34 %) випадках — в асоціаціях. Досліджували чутливість виділених штамів до найчастіше вживаних антибіотиків, серед яких найбільш активним виявився гатифлоксацин. Провели оцінку формування біоплівок штамами S. aureus, оскільки він є коменсалом і превалює в етіології ранової інфекції (31 %). Висновки. Встановлено, що у штамів S. aureus (n = 21), які виділили з ран пацієнтів, в 15 випадках (71 %) спостерігалась висока здатність до формування біоплівок, в 6 випадках (29 %) відмічалось помірне біоплівкоутворення.
Актуальность. Проблема гнойно-воспалительных осложнений при травмах вспомогательного аппарата глаза остается актуальной для клинической офтальмохирургии, поскольку данные состояния нередко обусловливают тяжелое протекание пред- и послеоперационного периода, которое проявляется нарушением общих и местных механизмов регулирования, генерализацией процесса и задержкой заживления ран. Цель исследования заключалась в изучении видового состава микрофлоры ран вспомогательного аппарата глаза, определении чувствительности выделенных микроорганизмов к наиболее часто используемым антибиотикам и их способность образовывать биопленки. Материалы и методы. В работе исследовали видовой состав микрофлоры ран 53 пациентов с травматическими повреждениями вспомогательного аппарата глаза за 2018–2019 годы. Осуществлено исследование мазков с ран с последующим определением видового состава и идентификацией микроорганизмов, которые проводили с использованием классических бактериологических методик. Результаты. Идентифицировали 67 штаммов микроорганизмов. Доминирующим оказался Staphylococcus aureus, второе место занял Acinetobacter spp., третье — Micrococcus spp. Частота выявления микроорганизмов в монокультуре с ран составила 33 (66 %), в 17 (34 %) случаях — в ассоциациях. Исследовали чувствительность выделенных штаммов к наиболее часто используемым антибиотикам, среди которых наиболее активным оказался гатифлоксацин. Провели оценку формирования биопленок штаммами S. aureus, поскольку он является комменсалом и превалирует в этиологии раневой инфекции (31 %). Выводы. Установлено, что у штаммов S. aureus (n = 21), которые выделили из ран пациентов, в 15 случаях (71 %) наблюдалась высокая способность к формированию биопленок, в 6 случаях (29 %) отмечалось умеренное биопленкообразование.
Background. The purulent inflammatory complications associated with ocular adnexal injuries is a relevant problem for eye surgery. These conditions often cause severe course of pre- and post-operative period, which could lead to violation of general and local regulation mechanisms, generalization of the process and delayed wound healing. The purpose was to study the composition of the microflora of ocular adnexal wounds, to determine the sensitivity of isolated microorganisms to the most commonly used antibiotics and their biofilm-forming ability. Materials and methods. Composition of the wound microflora was studied in 53 patients with ocular adnexal injuries in 2018–2019. The examination of wound swabs was carried out using classical bacteriological techniques with the further investigation of species composition and identification of microorganisms. Results. Sixty-seven strains of microorganisms were identified. The dominant strain was Staphylococcus aureus, the second place belonged to Acinetobacter spp., the third — to Micrococcus spp. The frequency of isolating microorganisms in monoculture from wounds was 33 (66 %), in 17 (34 %) cases — in associations. The sensitivity of selected strains to the most commonly used antibiotics was studied, among them gatifloxacin was the most active one. The evaluation of the biofilm formation by S.aureus strains was carried out because it is a commensal and predominates in the etiology of wound infection (31 %). Conclusions. It is found that S.aureus strains (n = 21) isolated from the wounds of patients in 15 cases (71 %) are characterized by high biofilm-forming ability, in 6 cases (29 %) — by moderate one.
біоплівки; мікрофлора; ранова інфекція; допоміжний апарат ока
биопленки; микрофлора; раневая инфекция; вспомогательный аппарат глаза
biofilms; microflora; wound infection; ocular adnexa
Вступ
Проблема гнійно-запальних ускладнень при травмах допоміжного апарату ока (ДАО) залишається актуальною для клінічної офтальмохірургії [1]. Увага до даної проблеми пояснюється нерідко тяжким перебігом перед- і післяопераційного періоду у хворих із травматичними пошкодженнями ДАО, що проявляється тривалою місцевою інфекцією, затримкою загоєння рани, порушенням загальних і місцевих механізмів регулювання, генералізацією процесу. Це в кінцевому підсумку призводить до незадовільних функціонально-косметичних результатів лікування [6].
Шкіра та слизові оболонки органа зору є нестерильними біотопами, де одночасно знаходяться різні види мікроорганізмів. Відомо, що мікроорганізми в природніх середовищах проживання існують переважно у вигляді складно організованих мікробних спільнот, які називаються біоплівками (biofilms). Згідно із сучасними уявленнями біоплівка — це сукупність мікроорганізмів, які співіснують разом у межах одного біотопу і прикріплені до поверхні та одна до одної за допомогою рецепторів та біополімерного матриксу [2, 5]. Такі спільноти можуть бути утворені не лише бактеріями одного або кількох видів, а й іншими представниками мікросвіту — грибами, вірусами, найпростішими. Вони можуть складатися як з активних функціонуючих клітин, так і із «спочиваючих», або некультивованих, форм. Біоплівки можуть бути утворені непатогенними та патогенними представниками мікрофлори шкіри і слизової оболонки. Також біоплівки колонізують усі імплантати, які застосовують у медичній практиці, шовний матеріал, дренажі, контактні лінзи і т.п. Такий спосіб існування зумовлює численні проблеми в хірургічній практиці, оскільки встановлено, що формування біоплівок мікроорганізмами є однією з причин низки хронічних інфекцій і сповільнює загоєння ран.
З огляду на важливість проблеми метою нашого дослідження було дослідити видовий склад мікрофлори ран ДАО, чутливість виділених мікроорганізмів до найчастіше вживаних антибіотиків, здатність цих мікроорганізмів утворювати біоплівки.
Матеріали та методи
Упродовж 2018–2019 років нами було обстежено 53 пацієнти з травматичними пошкодженнями ДАО, які зверталися за допомогою до кабінету невідкладної допомоги при відділенні мікрохірургії ока Сумської обласної клінічної лікарні. Хворим проводили обстеження і лікування згідно зі стандартами надання медичної допомоги. Процедура обстеження даних осіб відповідала нормативам етичного комітету. Для встановлення наявності мікроорганізмів у травмованих тканинах і вивчення їх видового складу було проведено дослідження мазків із ран. Для вивчення мікрофлори проводився забір досліджуваного матеріалу від хворого під час першого звернення до проведення первинної хірургічної обробки і призначення та здійснення антибактеріальної терапії. Дослідження передбачало визначення видового складу та популяційного рівня мікрофлори відповідно до вимог [3] із модифікацією кількісного визначення бактерій за методикою секторних посівів на базі бактеріологічної лабораторії Медичного інституту СумДУ. Діагностично значущими вважали ізоляти мікроорганізмів у кількості понад 102 КУО/мл. Видову ідентифікацію проводили з використанням класичних методів виділення та ідентифікації мікроорганізмів. Для вивчення чутливості виділених мікроорганізмів до антибактеріальних препаратів було використано метод паперових дисків (виробництво ТОВ «Аспект», Україна). Досліджували чутливість до таких антибіотиків: цефтріаксону, гентаміцину, меропенему, доксицикліну, гатифлоксацину. В роботі керувались наказом МОЗ України № 167 від 05.04.2007 р. про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів» [4].
Також через добу аналізували, який характер утворення біомаси спостерігається при різних ступенях інтенсивності розвитку мікробного конгломерату. Для цього визначали оптичну щільність елюату генціанвіолету/етанолу. Оцінка результатів через 2, 4, 6, 18 і 48 годин інкубації необхідна для дослідження динаміки накопичення біомаси й основної речовини.
Дослідження біоплівок проводили за допомогою забарвлення генціан-віолетом (crystal violet). Метод O’Toole and Kolter (1998) базується на здатності барвника кристалічного фіолетового (CV) зв’язуватися з клітинами і матриксом біоплівок і дозволяє отримати відносні показники щільності всієї біоплівки на поверхні підложки [7, 8].
Хід роботи. Після культивування бактерій впродовж необхідного терміну з лунок планшетки відбирали середовище з планктонними клітинами. Для видалення планктонних клітин, які залишились, лунки з біоплівками промивають упродовж 2–3 хвилин стерильним буфером PBS у тому ж об’ємі, в якому проходило культивування. Буфер повністю видаляється. В лунку 24-лункового планшета вносили 1–4 мл відфільтрованого 0,1% розчину генціанвіолету. Інкубували біоплівки з барвником упродовж 10–15 хвилин при кімнатній температурі. Потім видалили з лунки барвник. Той барвник, який не зв’язався, ретельно вимивали проточною водою. Планшети перевертали на фільтрувальний папір і висушували. Після цього в лунки додавали 95% розчин етанолу в об’ємі 1–4 мл. Розчинник відбирали, поміщали в чисті плоскодонні планшети і вимірювали оптичну щільність при довжині хвилі 590 нм. Інтерпретацію результатів проводили згідно з оптичною щільністю зафарбованого розчинника [2, 7, 8].
Результати проведених досліджень піддавали статистичній обробці. Для проведення обчислень використовували програму Graph Pad Quik Calcs із визначенням критерію t Стьюдента.
Результати
Після обстеження 53 пацієнтів із травматичними пошкодженнями ДАО у трьох випадках росту мікрофлори не було, що, можливо, пов’язано з попередньою обробкою рани до звернення до кабінету невідкладної допомоги. Загалом було ізольовано та ідентифіковано 67 штамів мікроорганізмів із ран пацієнтів із травмами ДАО. Видова структура збудників гнійно-запальних процесів подана в табл. 1.
При дослідженні мікробного складу встановлено, що мікробна спільнота представлена переважно грампозитивними бактеріями, за винятком Acinetobacter spp., який є представником грамнегативної флори. Аналізуючи отримані результати, слід відмітити, що домінантними мікроорганізмами були стафілококи (43 %), серед яких перше місце посів S. аureus (72 %). Отриманий результат змушує по-новому оцінити патогенний потенціал даного мікроорганізму, оскільки він є умовно-патогенним представником мікрофлори шкіри й очей і за певних умов може викликати гнійно-запальні процеси, оскільки є коменсалом і превалює в етіології ранової інфекції. Наявність багатьох факторів вірулентності обумовлює його роль у патогенезі інфекційних ран за рахунок наявності факторів адгезії, які забезпечують прикріплення даного мікроорганізму до різних білків, в тому числі до фібриногену і колагену [9]. Стафілокок легко колонізує тканини рани, а також глибоко проникає за рахунок пошкоджуючої дії мембранних токсинів, що негативно впливає на процес загоєння рани. Acinetobacter spp. посів друге місце (16,5 %) після S. аureus за частотою виявлення.
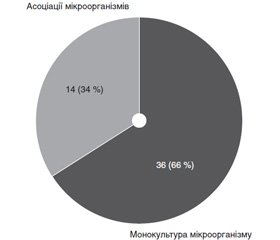
Частота виділення мікроорганізмів у монокультурі з ран становила 36 (66 %), в 14 (34 %) випадках були виділені асоціації 2–3 мікроорганізмів. Наочно це відображено на рис. 1.
Досліджували чутливість виділених мікроорганізмів до найбільш часто вживаних у нашій клінічній практиці антибіотиків (гатифлоксацин, доксициклін, меропенем, цефтріаксон, гентаміцин). При вивченні чутливості виділених мікроорганізмів до антибіотиків були отримані результати, які відображені в табл. 2.
Як видно з табл. 2, найбільш активним антибіотиком щодо всіх досліджуваних мікроорганізмів виявився гатифлоксацин (рис. 2), до якого був нечутливим лише Acinetobacter spp. Вказаний антибіотик призначався у вигляді таблетованої форми по 1 таблетці (400 мг) 1 раз на добу впродовж 5 днів. Цікаво, що саме Acinetobacter spp. серед усіх ідентифікованих бактерій виділявся найбільшою резистентністю до антибактеріальних препаратів.
Враховуючи, що S. aureus домінуючим виділявся найчастіше з ран у пацієнтів із травматичними пошкодженнями ДАО, ми провели оцінку формування біоплівки штамами даного мікроорганізму, які виділені від пацієнтів при первинному зверненні до очного травматологічного центру.
При аналізі отриманих даних і визначенні різних варіантів здатності формувати біоплівки (відсутня, низька, помірна і виражена) ми керувались передусім значеннями оптичної щільності (OD), які вимірювались для етанольних екстрактів генціанвіолету, який було використано для забарвлення біоплівок. Виявлено, що для штамів S. aureus (n = 21), які виділили з ран пацієнтів, у 15 випадках (71 %) характерна висока здатність до формування біоплівок. Спостерігалось поступове збільшення значень оптичної щільності елюатів із максимумом через 24 години інкубації (р < 0,005) і зниженням через 48 годин. Найбільш активні адгезія і проліферація бактерій відбувалися між 2-ю і 4-ю годинами інкубації (p =0,01), далі біомаса залишалась стабільною. В 6 випадках (29 %) відмічалась помірна здатність S. aureus формувати біоплівку. Абсорбція генціанвіолету досягала максимуму на 6-й годині (p = 0,05).
Висновки
1. Виявлено, що при сучасних пошкодженнях допоміжного апарату ока мікробне середовище представлене переважно грампозитивними бактеріями, за винятком Acinetobacter spp., що є представником грамнегативної флори.
2. Частота виділення мікроорганізмів у монокультурі з ран становила 36 (66 %), в асоціаціях — 14 (34 %) випадків. Найбільш активним антибіотиком щодо всіх досліджуваних мікроорганізмів виявився гатифлоксацин.
3. За частотою виділення мікроорганізмів із ран пацієнтів із травматичними ушкодженнями допоміжного апарату ока перше місце посів S. аureus (31 %).
4. Установлено, що для штамів S. aureus (n = 21), які виділили з ран пацієнтів, в 15 випадках (71 %) характерна висока здатність до формування біоплівок, в 6 випадках (29 %) відмічалась помірна здатність до біоплівкоутворення.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Красновид Т.А. Офтальмотравматология в современных условиях. Актуальные вопросы офтальмологии: научно-практическая конференция офтальмологов Черновицкой, Ивано-Франковской, Тернопольской и Хмельницкой областей Украины, 20–21 сентября 2017, Черновцы, Украина. С. 38-42.
2. Марданова А.М., Кабанов Д.А, Рудакова Н.Л., Шарипова М.Р. Биопленки: основные принципы организации и методы исследования: Учебное пособие. Казань: К(П)ФУ, 2016. 42 с.
3. Методы бактериологического исследования в клинической микробиологии: Методические рекомендации (17 января 1983 года).
4. Наказ МОЗ України № 167 від 05.04.2007 р. про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів».
5. Окулич В.К., Кабанова А.А., Плотніков Ф.В. Микробные биопленки в клинической микробиологии и антибактериальной терапии. Витебск: ВГМУ, 2017. 300 с.
6. Петренко О.В. Особливості клініки та лікування післятравматичних дефектів допоміжного апарату ока. Архів офтальмології України. 2015. Т. 3, № 2. С. 38-43.
7. Сідашенко О., Воронкова О., Сірокваша О., Вінніков А. Методи вивчення динаміки формування біоплівок умовно-патогенними бактеріями. Вісник Львівського університету. Серія біологічна, 2014. Випуск 65. С. 20-33.
8. Симонова И.Р., Головин С.Н., Веркина Л.М., Березняк Е.А., Титова С.В. Методы культивирования и изучения бактериальных биопленок. Известия ВУЗов. Северо-Кавказский регион. 2017. Вып. 1. С. 73-79.
9. Чеботарь И.В. Биопленки Staphylococcus aureus: структурно-функциональные характеристики и взаимоотношение с нейтрофилами: Дисс… д-ра мед. наук. Н. Новгород, 2014. 43 с.
10. Percival S.L., McCarty S.M., Lipsky B. Biofilms and wounds: an overview of the evidence. Advances in Wound Care. 2015. № 7. Vol. 4. P. 373-381.

/26-1.jpg)
/27-1.jpg)