Вступ
Криптоспоридіоз (ICD-10, A07.2; ICD-11, 1A32 Cryptosporidiosis) — група убіквітарно поширених і різноманітних за клінічними проявами хвороб, спричинюваних найпростішими роду Cryptosporidium (тип Apicomplexa), які здатні до інвазії, розмноження та паразитування в епітеліоцитах слизових оболонок шлунково-кишкового тракту (переважно тонкого кишечника), дихальних шляхів, протоків підшлункової залози і жовчовивідної системи. Разом із безсимптомною формою криптоспоридіозу найбільш типовим його клінічним проявом є водяниста діарея з широким спектром варіацій тяжкості перебігу — від гострих самообмежуючих субклінічних і легких (в імунокомпетентних осіб) до хронічних тяжких захворювань із летальним наслідком (в осіб з імунними порушеннями) [1, 2].
На сьогодні криптоспоридіоз визнано глобальною біологічною загрозою, що вражає широкі верстви населення, завдає значних економічних збитків тваринницькій сфері виробництва і потребує скоординованих зусиль Всесвітньої організації охорони здоров’я (ВООЗ), Міжнародного епізоотологічного бюро (з травня 2003 р. — ВООЗ тварин), національних систем охорони здоров’я та ветеринарної медицини для протидії поширенню цього паразитозу і зниження його соціально-медичного тягаря [3–6].
У цілому всі люди сприйнятливі до зараження криптоспоридіями. Проте групами найвищого ризику щодо ймовірності виникнення обумовлених цими паразитами захворювань визнано дітей молодшого віку, ВІЛ-інфікованих та хворих на СНІД, фермерів і працівників тваринницького виробництва, а також осіб, які відвідували регіони із високим рівнем ендемічної захворюваності на криптоспоридіоз [2, 6–9].
Для з’ясування сучасних епідемічних тенденцій і розробки обґрунтованих заходів боротьби з криптоспоридіозом рівень його поширеності серед певних груп населення (у тому числі й дітей) конкретних країн чи їх регіонів найчастіше визначають за показниками частоти екскреції ооцист (ЧЕО) Cryptosporidium spp. (рідше — їх антигенів і нуклеїнових кислот) у фекаліях та протикриптоспоридійних (специфічних) імуноглобулінів (сумарних — Ig∑, або їх різних класів, переважно IgG, IgM, IgA, рідко — IgD та IgE) у сироватці крові обстежуваних когорт осіб [10–15]. При цьому показник ЧЕО є нижньою межею інвазованості популяції крипто–споридіями (англ. oocysts excretion prevalence, OEP, або cases per se, CPS), а показник популяційної частоти специфічних Ig, який також називають індексом серопоширеності (ІСП), — відповідною верхньою межею поширеності криптоспоридіозу (англ. sero-prevalence index, SPI, або cases post-infection, CPI) [12–17].
Мета дослідження: встановити поширеність криптоспоридіозу у дітей з гострою кишковою інфекцією (ГКІ) в Донецькій області України за показниками частоти фекальної екскреції ооцист паразитів і наявності специфічних імуноглобулінів у сироватці крові.
Матеріали та методи
Когорту обстежених становили 295 дітей віком до 17 років із ознаками гострої кишкової інфекції з водянистою діареєю (далі — діти із ГКІ), яким надавалась стаціонарна медична допомога (квітень 2015 — березень 2019 р.) в інфекційному відділенні № 2 КМУ «Дитяче територіальне медичне об’єднання» м. Краматорська Донецької обл., Україна.
Мікроскопічне дослідження зразків фекалій (ЗФ) (n = 295) для виявлення ооцист Cryptosporidium spp. було проведено із застосуванням процедур збагачення (відцентрової седиментації у формалін-етилацетатній суміші з використанням фекального концентратора Mini Parasep® SF — EU Facal Parasite Concentrator виробництва Apacor Ltd., Англія) [18], виготовлення мазків, їх фарбування модифікованим (холодним) методом за Цилем — Нільсеном та світлової мікроскопії препаратів для візуалізації притаманних пошуковим ооцистам диференційних ознак, як викладено нами раніше [19].
Виявлення специфічних Ig (Ig∑, IgG, IgM, IgA) та визначення їх рівнів (титрів) у зразках сироватки крові (ЗСК) (n = 78) проведено за допомогою реакції непрямої імунної флуоресценції (РНІФ) із використанням експериментального діагностикуму ПОАгCrypto (абревіатура від «повний ооцистний антиген C.parvum»), виготовленого в лабораторії нових і маловивчених інфекційних захворювань ДУ «Інститут мікробіології та імунології ім. І.І. Мечникова НАМН України» за технологією, детально описаною в [20]. Діагностикум ПОАгCrypto являє собою предметні скельця (76 × 26 × 1 мм) з епоксидним покриттям синього кольору та ізольованими реакційними лунками (діаметром 12 × 5 мм), до поверхні яких іммобілізовано калібровану кількість очищених ооцист (на рівні 30–60 у кожному полі зору за умови сумарного збільшення мікроскопу ×1000) регіонального штаму C.parvum ЛНМІЗ 3/2018, видову приналежність якого попередньо було ідентифіковано методом стандартної полімеразної ланцюгової реакції (ПЛР) з використанням «Набору реагентів для ампліфікації ДНК Cryptosporidium parvum. Gene Pak®PCR test» виробництва фірми IsoGene Lab. ltd (РФ).
Основний методичний принцип застосованого типового формату РНІФ ґрунтується на можливості утворення специфічного комплексу: ПОАгCrypto + специфічні Ig досліджуваної сироватки + антивидові Ig проти Ig∑, IgG, IgM, IgА людини, які мічені флуоресцентним барвником (флуоресцеїн-ізотіоціанатом, ФІТЦ), що дозволяє при проведенні люмінесцентної мікроскопії виявляти (візуалізувати) вказаний об’єднаний комплекс [20]. Як антивидові флуоресціюючі Ig було використано комерційні сухі Ig проти Ig∑, IgG та IgM людини виробництва філіалу «МЕДГАМАЛ» ДУ «НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН» (РФ), а також експериментальні антивидові Ig флуоресціюючі рідкі проти IgА людини, виготовлені в лабораторії імунології, патоморфології та молекулярної генетики ДУ «Інститут дерматології та венерології НАМН України» і люб’язно надані д-ром мед. наук О.П. Білозоровим.
При позитивних результатах РНІФ (коли досліджувана сироватка містить специфічні Ig) спостерігається характерне світіння ПОАгCrypto (смарагдово-зелене з більшою яскравістю по зовнішньому краю стінки ооцист C.parvum) на темному тлі препарату. Інтенсивність зазначеної флуоресценції оцінювали за 4-хрестовою системою (від «4+» до «–»), при цьому за титр специфічних Ig∑, IgG, IgM та IgА приймали останнє (найбільше) розведення сироватки, яке ще обумовлює інтенсивність флуоресценції ПОАгCrypto не нижче від «3+».
Визначення титру специфічних Ig у досліджуваних ЗСК проведено з використанням 2-крокової тактики: спочатку тестувались усі ЗСК у початковому розведенні 1 : 8 для виявлення специфічних Ig∑, а у подальшому визначали рівень специфічних Ig∑, IgG, IgM та IgА лише у тих ЗСК (з послідовним дворазовим їх розведенням від 1 : 16 до 1 : 1024), з якими РНІФ була позитивна у початковому розведенні. Для підвищення специфічності і чутливості РНІФ (зниження ймовірності помилкових позитивних реакцій) перше розведення ЗСК робили у 0,15 М фосфатно-сольовому буфері (ФСБ) з рН = 7,2, що містив 0,2 % (маса/об’єм) альбуміну сироватки бика, а наступні розведення у ФСБ без додавання останнього.
Статистичну обробку експериментальних даних проведено відповідно до правил альтернативної і рядової варіаційної статистики [21].
Результати
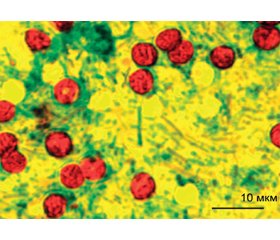
За результатами мікроскопічного дослідження ЗФ від 295 дітей із ГКІ, ооцисти Cryptosporidium spp. було виявлено в 11 (4,2 %) із них. Ооцисти мали однотипні морфологічні і тинкторіальні характеристики: правильну округлу форму з товстою стінкою, діаметр близько 4,5 × 5,5 мкм, притаманну внутрішню структурованість, стійке збереження забарвлення карболовим фуксином (у різні відтінки яскраво-червоного кольору) після дії кислотного деколайзера (рис. 1).
Визначені за допомогою світлової мікроскопії характеристики ооцист криптоспоридій не дозволяють надійно ідентифікувати їх види. Тому приналежність виявлених ооцист до виду C.parvum встановлено на основі позитивного результату ПЛР відповідного призначення (рис. 2).
На першому етапі скринінг-тестування 78 ЗСК (у розведенні 1 : 8) від дітей із ГКІ, виконаного методом РНІФ із застосуванням діагностикуму ПОАгCrypto, було отримано 68 (87,2 %) позитивних результатів реакції виявлення специфічних Ig∑ (рис. 3).
Результати виконання другого етапу досліджень ЗСК від дітей із ГКІ дозволили встановити як загальну частоту виявлення специфічних Ig різних класів, так і варіацію їх титрів, які в жодному випадку не досягали рівня 1 : 128 (табл. 1).
Обговорення
Виявлення ооцист Cryptosporidium spp. у випорожненнях є одним із (чотирьох існуючих) лабораторних критеріїв, що найбільш активно застосовується у світовій медичній практиці для встановлення діагнозу криптоспоридіозу та вивчення його поширеності на певних територіях чи серед конкретних груп населення, у тому числі й дітей [1, 2, 10, 11, 22–24]. Нами при цільовому обстеженні 295 дітей із ГКІ Донецької обл. частота фекальної екскреції ооцист криптоспоридій встановлена на рівні 4,2 %. Виявлені ооцисти мали типові морфологічні та тинкторіальні ознаки (рис. 1) і методом ПЛР ідентифіковані як C.parvum (рис. 2). Цей вид найчастіше є етіологічним чинником зоонозного/зооантропонозного криптоспоридіозу у аграрних та аграрно-індустріальних країнах світу, тоді як філогенетично близький вид C.hominis переважає у країнах із індустріальною та індустріально-аграрною економікою, спричинюючи антропонозну інвазію [3, 5–7, 26, 27]. Визначена нами частота виявлення ооцист криптоспоридій у ЗФ від дітей із ГКІ є досить близькою до аналогічного показника (OEP 1,4–4,1 %), який притаманний економічно розвинутим країнам світу із відносно низьким рівнем спорадичної захворюваності на криптоспоридіоз (США, Канада, Англія, Німеччина, Нідерланди тощо) [4, 5, 27]. Проте середній щорічний рівень захворюваності на криптоспоридіоз населення у цих країнах (з урахуванням офіційно зареєстрованих випадків) становить у цілому 1,29–8,25, а серед дітей — 6,6–10,5, на 100 тис., тоді як в Україні, згідно з даними, представленими у «Щорічних доповідях про стан здоров’я населення, санітарно-епідемічну ситуацію та результати діяльності системи охорони здоров’я України» за 2013–2016 роки, ці інтенсивні показники є нижчими більш ніж у 60 разів і досягають значень 0,04–0,11 та 0,11–0,20 на 100 тис. відповідно. За висновком фахівців Міністерства охорони здоров’я України, вказані вище показники щорічного рівня захворюваності населення на криптоспоридіоз «…не відображають істинної інвазованості, що сприяє появі його можливих спалахів».
Перепонами для з’ясування реального рівня поширеності криптоспоридіозу в Україні є чисельні як суб’єктивні, так і об’єктивні чинники. Основні серед останніх — періодичність екскреції ооцист Cryptosporidium spp., що відображає особливість життєвого циклу цих найпростіших та змушує для їх виявлення збільшувати кратність повторюваного відбору і дослідження ЗФ (при 3-разовому дослідженні через добу кожне наступне додає близько 20 % позитивних результатів від частоти отриманих у першому/одноразовому аналізі); домінування (> 60–80 %) субклінічних і легких швидкоплинних форм перебігу криптоспоридіозу із невисоким рівнем фекальної екскреції ооцист, які зазвичай залишаються недіагностованими; відносно низька чутливість мікроскопічного методу, що навіть за оптимальних умов його застосування дозволяє виявляти ооцисти паразитів у концентрації ≥ 104 у 1 г/мл досліджуваного зразка біоматеріалу; неможливість за допомогою мікроскопії надійно ідентифікувати види Cryptosporidium, у тому числі й найбільш клінічно значущі у патології людини C.parvum і C.hominis (спричинюють > 90 % випадків захворювань), які характеризуються ідентичною морфологією і тинкторіальними властивостями ооцист, подібною антигенною структурою, але не здатні обмінюватись генетичним матеріалом, певною мірою різняться за патогенезом і клінічним проявом обумовлених хвороб та епідеміологічними особливостями їх поширення [1, 6, 23–27]. Тому саме показники частоти виявлення у досліджуваній популяції специфічних Ig, які в силу зазначених вище та низки інших обставин більш адекватно відображають інтенсивність епідемічного процесу криптоспоридіозу і відіграють провідну роль при оцінці соціально-медичної значимості цього паразитозу та при визначенні пріоритетних заходів для протидії його поширенню [12–17].
Наскільки нам відомо, це перше дослідження серопоширеності криптоспоридіозу як серед населення в Україні взагалі, так і у когорті дітей з ГКІ зокрема. Із даних табл. 1 видно, що у ЗСК від дітей із ГКІ загальна частота виявлення специфічних Ig∑ (87,2 %) перевищувала (р ≤ 0,05) відповідну частоту будь-якого їх класу (IgG, IgM та IgА). У свою чергу, показник наявності специфічних IgG (50 %) є вірогідно вищим (р ≤ 0,05) відносно значень аналогічних показників для IgM (30,8 %) і IgА (17,9 %), а деяка відмінність між частотою виявлення двох останніх класів специфічних Ig не набула статистичної значущості (р ≥ 0,05). Результати аналізу кореляційної залежності між одночасною наявністю (в одних і тих самих ЗСК, n = 78) сумарних і різних класів специфічних Ig показали, що IgG виявлялись тільки у певній частині ЗСК (57,4 %), які дали позитивний результат РНІФ щодо присутності відповідних Ig∑ (коефіцієнт кореляції Фехнера, rф, становить +0,26); IgМ (у 61,5 %) та IgА (у 35,9 %) — лише сумісно із специфічними IgG (rф набув значень +0,23 та –0,28 відповідно), а IgА (у 58,3 %) — разом із IgМ (rф = +0,17). Тільки три ЗСК походили від дітей із ГКІ, у фекаліях яких було виявлено ооцисти C.parvum. У цих ЗСК встановлена наявність специфічних Ig∑, IgG та IgМ, а у двох із них — додатково IgА. При цьому їх титри не були помітно вищими, ніж у ЗСК від дітей без виявленої фекальної екскреції ооцист паразитів.
В аспекті обговорення отриманих нами результатів дослідження необхідно підкреслити, що до сьогодні виявлення специфічних Ig не набуло статусу окремого лабораторного критерію для діагностики криптоспоридіозу (особливо його гострих клінічно виражених форм) в силу багатьох причин: недостатньо вивчено особливості імунної відповіді хазяїна при криптоспоридійній інвазії, і, як наслідок цього, залишаються нез’ясованими низка притаманних їй «нетипових» імунологічних феноменів; не налагоджено виробництво комерційних (валідних) тест-систем для кількісного визначення специфічних Ig, що, у свою чергу, обумовлює відсутність уніфікованих протоколів виконання тематичних досліджень та загальноприйнятих діагностично-значимих титрів (концентрацій) пошукових Ig; ретроспективна спрямованість отримуваних результатів аналізів, яка спричинена відомою «динамікою відставання» утворення специфічних Ig на початковій стадії клінічних проявів хвороби та найбільш інтенсивної екскреції паразитів; недостатній рівень співпадіння (≤ 41–82 %) як позитивних, так і негативних результатів виявлення у сироватці крові специфічних Ig із відповідними результатами мікроскопічного виявлення у фекаліях ооцист криптоспоридій, їх антигенів — імунологічними і нуклеїнових кислот — молекулярно-генетичними методами [12, 14, 15, 20, 23–25, 28].
Зазначене певною мірою стосується і проведення сероепідеміологічних досліджень з метою вивчення поширеності криптоспоридіозу. Так, для визначення частоти наявності і титрів специфічних Ig у ЗСК обстежуваних груп населення іноземними науковцями продовжують застосовуватись декілька авторських (експериментальних) варіантів імуноферментного аналізу (переважно твердофазного — ТІФА), верстерн-блоту (ВБ) та РНІФ, які мають свої переваги і недоліки та різняться між собою за чутливістю, специфічністю і відтворюваністю результатів, що є причиною незадовільної співставності останніх [14–16, 29]. Хоча за рівнем чутливості, специфічності та можливістю нівелювання впливу суб’єктивного чинника на оцінку результату досліджень РНІФ поступається методам ТІФА і ВБ, проте її перевагами є відносна простота технології відтворення і можливість використання для виготовлення ПОАгCrypto регіональних штамів C.parvum.
Проведене нами визначення наявності специфічних Ig у ЗСК від дітей із ГКІ підтверджує висновок зарубіжних науковців щодо придатності РНІФ для вивчення серопоширеності криптоспоридіозу у цілому [15, 20]. Інший важливий висновок іноземних фахівців полягає у тому, що самі величини титру специфічних Ig мають другорядне значення, тоді як частота їх виявлення (SPI) у досліджуваних популяціях осіб є основним показником для аналізу ризиків поширення криптоспоридіозу [12–15, 20, 29]. Тому на сьогодні в різних країнах світу при проведенні досліджень імуноструктури населення з метою визначенням SPI криптоспоридіозу найчастіше застосовується оптимізований методичний підступ оцінки популяційної поширеності специфічних IgG (рідше — через нижчу біомаркерну надійність, специфічних Ig∑, IgМ та IgА) із тестуванням ЗСК лише у певному розведенні для встановлення наявності/відсутності порогового титру зазначених Ig (англ. threshold titer Ig). При цьому, виконуючи такі дослідження у регіонах із відносно низьким рівнем спорадичної захворюваності на криптоспоридіоз, пороговий титр специфічних IgG переважно визначають у ЗСК при їх розведені від 1 : 10 до 1 : 40, а здійснюючи такі ж самі скринінг-тестування ЗСК від людей із регіонів з високим ендемічним рівнем цього паразитозу, розведення сироватки підвищують до 1 : 50 (або 1 : 100) [12–15, 29, 30].
З урахуванням проаналізованих чисельних даних зарубіжних науковців і результатів наших власних досліджень (частину з яких не відображено у цій статті) при вивченні серопоширеності криптоспоридіозу серед різних груп населення в Україні наявність специфічних IgG доцільно визначати у пороговому титрі 1 : 16 (або 1 : 20). За таких умов значення ІСП криптоспоридіозу серед обстеженої нами когорти дітей із ГКІ Донецької обл. становить 21,8 %, що істотно перевищує (р ≤ 0,05) визначений у них показник ЧЕО (4,2 %). Встановлене нами значення ІСП криптоспоридіозу у дітей із ГКІ є близьким до результатів (SPI 20 %) подібних досліджень, отриманих науковцями Федеративної Республіки Бразилія (ФРБ), якими теж було використано РНІФ для виявлення у сироватці крові від груп осіб високого ризику специфічних IgG [20]. Проте, згідно із представленими в їх роботі даними, у ФРБ рівень ЧЕО у імунокомпетентних дітей з діареєю (OEP 12,1 %) є в 2,9 раза вищим від визначеного нами.
Висновки
1. Криптоспоридіоз є актуальною проблемою сучасної інфектології, що обґрунтовує необхідність вивчення його поширеності, насамперед серед груп населення з високим ризиком виникнення хвороби, до яких належать і діти.
2. За результатами мікроскопічного дослідження зразків фекалій від 295 дітей із ГКІ Донецької обл. частота екскреції ооцист криптоспоридій становила 4,2 %. Виявлені ооцисти мали характерні морфологічні і тинкторіальні властивості та методом ПЛР ідентифіковані як C.parvum.
3. У 78 ЗСК від цих дітей методом РНІФ із використанням діагностикуму ПОАгCrypto визначено частоту наявності і титри специфічних Ig∑, IgG, IgM та IgА, що дозволило встановити індекс серопоширеності криптоспоридіозу на рівні 21,8 % (при пороговому титрі специфічних IgG 1 : 16).
4. За показниками частоти екскреції ооцист паразитів та наявності специфічних IgG Донецьку область слід віднести до регіонів із відносно невисоким рівнем спорадичної захворюваності дітей на криптоспоридіоз.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Дослідження виконано за рахунок бюджетного фінансування НАМН України (КПКВК 6561040) прикладної НДР «Удосконалення методів лабораторної діагностики криптоспоридіозу», № державної реєстрації 0117U002283.
Список литературы
1. Chalmers RM, Davies AP. Minireview: clinical cryptosporidiosis. Exp Parasitol. 2010;124(1):138-146. DOI: 10.1016/j.exppara.2009.02.003.
2. Wang RJ, Li JQ, Chen YC, Zhang LX, Xiao LH. Widespread occurrence of Cryptosporidium infections in patients with HIV/AIDS: Epidemiology, clinical feature, diagnosis, and therapy. Acta Trop. 2018;187:1617-1625. DOI: 10,1016/j.actatropica.2018.08.018.
3. Pisarski K. The global burden of disease of zoonotic parasitic diseases: Top 5 Contenders for priority consideration. Trop Med Infect Dis. 2019;4(1)44. DOI: 10.3390/tropicalmed4010044.
4. Bamaiyi PH, Redhuan EM. Prevalence and risk factors for cryptosporidiosis: a global, emerging, neglected zoonosis. Asian Biomed. 2017;10(4):309-325. DOI: 10.5372/1905-7415.1004.493.
5. Cacciò SM, Chalmers RM. Human cryptosporidiosis in Europe. Clin Microbiol Infect. 2016;22(6):471-480. DOI: 10.1016/j.cmi.2016.04.021.
6. Putignani L, Menichella D. Global distribution, public health and clinical impact of the protozoan pathogen Cryptosporidium. Interdisciplinary Perspectives Infect Dis. 2010;2010(ID 753512):39. DOI: 10.1155/2010/753512.
7. Cacciò SM, Putignani L. Epidemiology of human cryptosporidiosis. In Cryptosporidium: Parasite and Disease. Springer-Verlag Wien. 2014:43-79. DOI: 10.1007/978-3-7091-1562-6_2.
8. Sánchez A, Prats-van der Ham M, Tatay-Dualde J et al. Zoonoses in Veterinary Students: A Systematic Review of the Literature. PLOS One. 2017;12(1):e0169534. DOI: 10.1371/journal.pone.0169534.
9. Khalil IA, Troeger C, Rao PC et al. Morbidity, mortality, and long-term consequences associated with diarrhoea from Cryptosporidium infection in children younger than 5 years: a meta-analyses study. Lancet Global Health. 2018;6(7):e758-e768. DOI: 10.1016/S2214-109X(18)30283-3.
10. Korpe PS, Valencia C, Haque R et al. Epidemiology and Risk Factors for Cryptosporidiosis in Children From 8 Low-income Sites: Results From the MAL-ED Study. Clin Infect Dis. 2018;67(11):1660-1669. DOI: 10.1093/cid/ciy355.
11. Kotloff KL, Nataro JP, Blackwelder WC et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): a prospective, case-control study. Lancet. 2013;382(9888):209-222. DOI: 10.1016/S0140-6736(13)60844-2.
12. Exum NG, Pisanic N, Granger DA et al. Use of Pathogen-Specific Antibody Biomarkers to Estimate Waterborne Infections in Population-Based Settings. Curr Environ Health Rep. 2016;3(3):322-334. DOI: 10.1007/s40572-016-0096-x.
13. Becker DJ, Oloya J, Ezeamama AE. Household socioeconomic and demographic correlates of Cryptosporidium seropositivity in the United States. PLoS Negl Trop Dis. 2015;9(9):e0004080. DOI: 10.1371/journal.pntd.0004080.
14. Elwin K, Chalmers RM, Hadfield SJ et al. Serological responses to Cryptosporidium in human populations living in areas reporting high and low incidences of symptomatic cryptosporidiosis. Clin Microbiol Infect. 2007;13(12):1179-1185. DOI: 10.1111/j.1469-0691.2007.01823.x.
15. Casemore D. Towards a US national estimate of the risk of endemic waterborne disease — sero-epidemiologic studies. J Water Health. 2006;4(2):121-163. DOI: 10.2166/wh.2006.021.
16. Elshahawy I. A serological survey on cryptosporidiosis in Najran region, Southwestern Saudi Arabia with reference to some epidemiological features of the infection. Int J Adv Med. 2017;4(4):887-893. DOI: 10.18203/2349-3933.ijam20172606.
17. Khan A, Shams S, Khan S, Khan MI, Khan S, Ali A. Evaluation of prevalence and risk factors associated with Cryptosporidium infection in rural population of district Buner, Pakistan. PLoS ONE. 2019;14(1):e0209188. DOI: https://doi.org/10.1371/journal.pone. 0209188.
18. Pokhil SI, Tymchenko OM, Yakovenko DV, Chigirinskaya NA, Kostyria IA, Nesterenko AM. Practical experlence in using the Mini Parasep faecal parasite concentrator for Cryptosporidium spp. oocysts detection in stool. Annals of Mechnikov Institute. 2018;3:33-40. DOI: 10.5281/zenodo.1456534.
19. Yakovenko DV, Pokhil SI, Tymchenko OM, Chigirinskaya N.A, Kostyria IA. Evaluation of differential efficiency of staining methods for Cryptosporidium oocysts. Bulletin of Problems Biology and Medicine. 2018;4(146):198-213. DOI: 10.29254/2077-4214-2018-4-1-146-198-203 (in Ukrainian).
20. Braz LM, Amato VN, Ferrari CI et al. Human cryptosporidiosis: detection of specific antibodies in the serum by an indirect immunofluorescence. Rev Saude Publica. 1996;30(5):395-402. DOI: 10.1590/s0034-89101996000500001.
21. Lakin GF. Biometrics: guide. 4th ed., revised and updated. Moscow: Higher school, 1990. 352 p. ISBN 5-06-000471-6 (in Russian).
22. Order of the Ministry of Health of Ukraine No. 905 dated December 28, 2015 «On approval of the criteria for determining the cases of infectious and parasitic diseases that are subject to registration». www.moz.gov.ua/ua/portal/dn_20151228_0905.html (in Ukrainian).
23. Checkley WA, White AC, Jaganath D et al. A review of the global burden, novel diagnostics, therapeutics, and vaccine targets for cryptosporidium. Lancet Infect Dis. 2015;15(1):85-94. DOI: 10.1016/S1473-3099(14)70772-8.
24. Ghazy AA, Abdel-Shafy S, Shaapan RM. Cryptosporidiosis in animals and man: 2. Diagnosis Asian J Epidemiol. 2015;8(4):84-103. DOI: 10.3923/aje.2015.84.103.
25. Chalmers RM, Katzer F. Looking for Cryptosporidium: the application of advances in detection and diagnosis. Trends Parasitol. 2013;29(5):237-251. DOI: 10.1016/j.pt.2013.03.001.
26. Ryan U, Fayer R, Xiao L. Cryptosporidium species in humans and animals: current understanding and research needs. Parasitol. 2014;141:1667-1685. DOI: 10.1017/S0031182014001085.
27. Painter JE, Hlavsa MC, Collier SA, Xiao L, Yoder JS. Centers for Disease Control and Prevention. Cryptosporidiosis Surveillance — United States, 2011-2012. MMWR Surveillance Summaries. 2015;64(3):1-14. Available from: https://www.cdc.gov/mmwr/pdf/ss/ss6403.pdf.
28. Lee J-K, Han E-T, Huh S, Park W-Y, Yu J-R. A Hospital-Based Serological Survey of Cryptosporidiosis in the Republic of Korea. Korean J Parasitol. 2009;47(3):219-225. DOI: 10.3347/kjp.2009.47.3.219.
29. Farkas K, Plutzer J, Moltchanova E et al. Serological responses to Cryptosporidium antigens in inhabitants of Hungary using conventionally filtered surface water and riverbank filtered drinking water. Epidemiol Infect. 2015;143(13):2743-2743. DOI: 10.1017/S0950268814003859.
30. Priest JW, Bern C, Xiao L, et al. Longitudinal analysis of cryptosporidium species-specific immunoglobulin G antibody responses in Peruvian children. Clin Vaccine Immunol. 2006;13(1):123-131. DOI: 10.1128/CVI.13.1.123-131.2006.
/39.jpg)
/39_2.jpg)
/40.jpg)

/40_2.jpg)