Резюме
Актуальність. На сьогодні є перспективним пошук доступних показників для якомога більш раннього визначення несприятливих ознак прогресування хронічної серцевої недостатності (ХСН), які з високою чутливістю і специфічністю дозволять виділити хворих на ішемічну хворобу серця (ІХС) у поєднанні з цукровим діабетом (ЦД) 2-го типу з високим ризиком несприятливого перебігу ХСН, що дозволить вибрати адекватне і своєчасне лікування, а також планувати організацію медичного і соціального обслуговування цієї категорії хворих. Мета: вивчення особливостей зміни структурно-функціонального стану серця при різних варіантах несприятливого перебігу серцевої недостатності у хворих на ІХС у поєднанні з ЦД 2-го типу. Матеріали та методи. Після курсу стаціонарної терапії обстежені 34 чоловіки з ХСН ішемічного генезу на тлі поєднаного перебігу ІХС і ЦД 2-го типу з несприятливим перебігом ХСН. Хворі розділені на три групи залежно від ступеня прогресування ХСН: I (n = 7) — померлі протягом року спостереження, II (n = 13) — зі зниженням LV EF, III (n = 14) — з порушенням стану діастолічної функції серця. Проводився аналіз скарг, кардіологічного анамнезу, об’єктивного дослідження, виконувалася трансторакальна ехокардіографія, досліджували ендотелійзалежну вазодилатацию плечових артерій. Для визначення відмінностей між незалежними вибірками використовували U-критерій Манна — Уїтні. Частоту ознак у групах порівнювали за допомогою критерію χ2. Результати. Тривалість спостереження становила 12 місяців. Усі хворі отримували стандартне лікування. Несприятливий перебіг ХСН у хворих на ішемічну хворобу серця і СД 2-го типу, яка прогресувала і закінчилася летальним результатом, асоціювався з вірогідно старшим віком чоловіків, з більш тривалим анамнезом за ІХС та ЦД 2-го типу, зниженою фізичною активністю, високим рівнем артеріальної гіпертензії (АГ), яка доказово є потенційною причиною розвитку ХСН. I ступінь діастолічної дисфункції, незважаючи на те, що розміри лівого передсердя не виходили за межі нормальних, відзначався у всіх пацієнтів, але середні розміри були вірогідно більшими у померлих. Вірогідно меншим у цих пацієнтів був LV EDV, що свідчить про більше порушення процесів діастолічного наповнення LV. У всіх пацієнтів відзначалася ендотеліальна дисфункція, проте у померлих вона була більш вираженою, що свідчить про значні процеси ремоделювання судин. Висновки. Тяжкість перебігу ХСН у хворих на ІХС і ЦД 2-го типу із збереженою LV EF при летальному результаті асоціюється з тривалістю ІХС та ЦД 2-го типу, більш високим рівнем АГ; ранніми ультразвуковими маркерами несприятливого перебігу ХСН є: збільшення LALD навіть у межах нормальних значень і зниження LV EDV.
Актуальность. Сегодня является перспективным поиск доступных показателей для как можно более раннего определения неблагоприятных признаков прогрессирования хронической сердечной недостаточности (ХСН), которые с высокой чувствительностью и специфичностью позволят выделить больных ишемической болезнью сердца (ИБС) в сочетании с сахарным диабетом (СД) 2-го типа с высоким риском неблагоприятного течения ХСН, что позволит выбрать адекватное и своевременное лечение, а также планировать организацию медицинского и социального обслуживания этой категории больных. Цель: изучение особенностей изменения структурно-функционального состояния сердца при различных вариантах неблагоприятного течения ХСН у больных ИБС в сочетании с СД 2-го типа. Материалы и методы. После курса стационарной терапии обследованы 34 мужчины с ХСН ишемического генеза на фоне сочетанного течения ИБС и СД 2-го типа с неблагоприятным течением ХСН. Больные разделены на три группы в зависимости от степени прогрессирования ХСН: I (n = 7) — умершие в течение года наблюдения, II (n = 13) — со снижением LV EF, III (n = 14) — с нарушением состояния диастолической функции сердца. Проводился анализ жалоб, кардиологического анамнеза, объективного исследования, выполнялась трансторакальная эхокардиография, исследовали эндотелийзависимую вазодилатацию плечевых артерий. Для определения различий между независимыми выборками использовали U-критерий Манна — Уитни. Частоту признаков в группах сравнивали при помощи критерия χ2. Результаты. Длительность наблюдения составила 12 месяцев. Все больные получали стандартное лечение. Неблагоприятное течение ХСН у больных с ИБС и СД 2-го типа, которая прогрессировала и закончилась летальным исходом, ассоциировалось с достоверно старшим возрастом мужчин, с более длительным анамнезом ИБС и СД 2-го типа, сниженной физической активностью, высоким уровнем артериальной гипертензии (АГ), которая доказательно является потенциальной причиной развития ХСН. I степень диастолической дисфункции, несмотря на то, что размеры левого предсердия не выходили за границы нормальных, отмечалась у всех пациентов, но средние размеры были достоверно большими у умерших. Достоверно меньшим у этих пациентов был LV EDV, что свидетельствует о большем нарушении процессов диастолического наполнения левого желудочка. У всех пациентов отмечалась эндотелиальная дисфункция, однако у умерших она была более выраженной, что свидетельствует о значительных процессах ремоделирования сосудов. Выводы. Тяжесть течения ХСН у больных с ИБС и СД 2-го типа с сохраненной LV EF при летальном исходе ассоциируется с длительностью ИБС и СД 2-го типа, более высоким уровнем АГ, ранними ультразвуковыми маркерами неблагоприятного течения ХСН: увеличением LALD даже в пределах нормальных значений и снижением LV EDV.
Background. Nowadays the search for simple measurements of early signs of chronic heart failure (CHF) progression is challenging; that will allow determining the patients with a high risk of an unfavorable outcome of coronary heart disease (CHD) and diabetes mellitus (DM) type II, and doing this with high sensitivity and specificity. This will allow providing appropriate treatment in time, decreasing complications rate, and will also help with proper medical and social services planning. The purpose of the study: to investigate changes in myocardial morphofunctional state in different types of unfavorable chronic heart failure outcomes among patients with coronary heart disease and diabetes mellitus type II. Materials and methods. After conventional in-hospital treatment, 34 males with CHF combined with CHD and DM type II were examined. The patients were divided into three groups depending on CHF progression degree during the observational period: I group (N = 7) — exitus letalis within the observation period, II group (N = 13) — with LV EF decreased, III group (N = 14) — with signs of diastolic dysfunction. Complaints, cardiologic anamnesis, physical examination data, carbohydrate and lipid panel were assessed, homeostatic model assessment index (HOMA-ir) was calculated. The instrumental examination included transthoracic echocardiography (TTE) and endothelium-dependent dilation of brachial arteries. The differences between independent samples were assessed using Mann-Whitney U-criteria. Frequency of signs occurrence in groups was compared by χ2 criteria. Results. The follow-up period was 12 months. All patients received standard treatment. In group I, unfavorable outcome was strongly associated with age, longer history of CHD and DM type II, impaired physical exertion tolerance, high level of arterial hypertension. The last one is proven to be a potential cause of CHF. First-degree diastolic dysfunction was observed in all patients, despite normal left atrial linear dimensions (LALD). The patients in group I has significantly larger LALD, but still at the upper range of normal values. End-diastolic left ventricle volume (EDV) in group I was significantly lower, that shows more severe disturbances in left ventricle diastolic filling. All study population had endothelium dysfunction, but the group I was characterized by most severe impairment, that shows the severity of remodelling in vessels. Conclusions. The outcome of CHF among patients with CHD and DM type II with preserved LV EF in case of death is strongly associated with duration of CHD and DM type II, higher arterial hypertension level. Early TTE signs of unfavorable outcome include LA enlargement even if values are normal, EDV decreased.
Вступ
Серцева недостатність (СН) — це стан, при якому міокард нездатний задовольнити потребу всього організму в крові і кисні, викликаний складними і множинними факторами. Через високу захворюваність і смертність серцева недостатність стає однією з найсерйозніших небезпек для здоров’я в усьому світі. За оцінками, глобальна поширеність серцевої недостатності може перевищувати 26 мільйонів, а число нових пацієнтів збільшується [1]. Клінічно хворі люди спочатку мають діастолічну дисфункцію, що прогресує до тяжкої діастолічної серцевої недостатності зі збереженою фракцією викиду (HFpEF), а потім до систолічної дисфункції (серцевої недостатності зі зменшеною фракцією викиду (HFrEF)) [1]. Дані спостережень дозволяють припустити, що гіперглікемія пов’язана з розвитком серцевої недостатності. Таким чином, такі дані можуть також свідчити про те, що поліпшення глікемічного контролю відіграє важливу роль у профілактиці діабетичної кардіоміопатії [2, 3]. Швидкість розвитку серцевої недостатності у 2–5 разів вища у пацієнтів, які страждають від цукрового діабету (ЦД), порівняно з людьми без діабету [4]. Також було висловлено припущення, що загальне глікемічне навантаження, а не просто HbA1c на момент встановлення діагнозу є найкращим предиктором ризику серцевої недостатності [5].
Діастолічна дисфункція лівого шлуночка може зустрічатися в 75 % безсимптомних, нормотензивних пацієнтів з діабетом [1, 6]. Діабет пов’язаний з підвищеним ризиком серцево-судинної смерті та госпіталізації з приводу СН в осіб з HFpEF і HFrEF [7]. Ті, у кого і СН, і діабет, мають більш тяжкі симптоми класу NYHA порівняно з особами, які не страждають від діабету, з подібною фракцією викиду лівого шлуночка (LV) [8]. За результатами європейського клінічного дослідження ESC-HF Pilot Study, частота летальних випадків від усіх причин протягом наступних 12 міс. у госпіталізованих і стабільних/амбулаторних хворих із СН становила 17 і 7 % відповідно, а частота госпіталізацій за той самий період — 44 і 32 % відповідно [9]. У пацієнтів із СН (як госпіталізованих, так і амбулаторних) більшість летальних випадків зумовлена серцево-судинними причинами — переважно раптовою смертю та прогресуванням СН.
Встановлено численні прогностичні маркери летальних випадків і/або госпіталізацій із приводу СН, включаючи демографічні дані, тяжкість СН, клінічний статус, ремоделювання міокарда і тяжкість його ураження, біомаркери нейрогуморальної активації, серцево-судинні та екстракардіальні супутні захворювання тощо [9].
Одними із проявів ураження серця при ЦД 2-го типу є діастолічна і систолічна дисфункція лівого шлуночка, гіпертрофія міокарда лівого шлуночка, безсимптомні зони ішемії міокарда. Для виявлення кардіальної патології сьогодні широко використовуються ультразвукові методи діагностики, основною перевагою яких є неінвазивність, безпека і доступність [8–10]. На жаль, дані прояви виявляються вже після появи перших симптомів ураження міокарда. Актуальним питанням є своєчасне раннє виявлення кардіальної патології у хворих з ЦД 2-го типу за рахунок використання ехокардіографії (ЕхоКГ), зіставлення з глікемічними показниками з метою визначення ранніх специфічних показників порушення структури міокарда для призначення необхідної медикаментозної корекції і запобігання прогресуванню хронічної серцевої недостатності (ХСН).
У сучасних умовах важливими є питання вивчення механізмів формування та специфіки проявів ХСН ще на ранній стадії її виникнення. Наукові дослідження спрямовані на поглиблене вивчення ХСН у контексті серцево-судинної патології, що має сприяти розробці нових методів і засобів її профілактики та лікування [11].
На сьогодні є перспективним пошук доступних показників для якнайбільш раннього виявлення несприятливих ознак прогресування ХСН, які б із високою чутливістю та специфічністю визначали хворих із високим ризиком несприятливого перебігу ХСН серед пацієнтів з ішемічною хворобою серця (ІХС) у поєднанні із ЦД 2-го типу вже на початку встановлення діагнозу [12]. Прогностична оцінка ризику виникнення ускладнень та летального результату допоможе обрати адекватне й своєчасне лікування, а також планувати організацію медичного та соціального обслуговування.
Мета дослідження: вивчення особливостей зміни структурно-функціонального стану серця при різних варіантах несприятливого перебігу серцевої недостатності у хворих на ІХС в поєднанні з ЦД 2-го типу.
Матеріали та методи
Проведено комплексне обстеження 34 пацієнтів чоловічої статі з ХСН ішемічного генезу на тлі поєднаного перебігу ІХС і ЦД 2-го типу з несприятливим перебігом ХСН. Середній вік становив 60,0 [55,8; 63,3] року. Обстеження всіх хворих проводилося на базі терапевтичного та кардіологічного відділень комунального некомерційного підприємства «Міська клінічна лікарня швидкої та невідкладної медичної допомоги ім. проф. О.І. Мещанінова» Харківської міської ради, після курсу стаціонарної терапії.
Критерії включення: вік від 50 до 70 років, ХСН I–II функціонального класу (ФК) за класифікацією NYHA (Нью-Йоркської асоціації серця), LV EF ≥ 50 % (згідно з критеріями European Society of Cardiology, 2016) [13], постінфарктний кардіосклероз, в поєднанні з ЦД 2-го типу (за критеріями American Diabetes Association, Diabetes Care 2017), зі швидкістю клубочкової фільтрації (ШКФ) ≥ 60 мл/хв/1,73 м2.
Критерії виключення: вік понад 70 років, резистентна артеріальна гіпертензія (АГ), вторинна АГ, легенева АГ, вроджені та набуті вади серця, наявність життєзагрожуючих ектопічних аритмій, стабільна стенокардія вище II ФК з потребою в застосуванні короткодіючих нітратів більше двох разів на тиждень, некоронарогенні захворювання міокарда, хронічне захворювання нирок із ШКФ < 60 мл/хв/1,73 м2, супутні некардіальні захворювання: хронічні обструктивні захворювання легенів, неконтрольована бронхіальна астма, анемія з рівнем гемоглобіну < 90 г/л, гострі і хронічні запальні захворювання міокарда, післяопераційні стани, доброякісні та злоякісні пухлини, запальні захворювання травної системи, хвороби крові, травматичні ушкодження опорно-рухового апарату, зловживання алкоголем.
Усі обстежені хворі були розділені на три групи залежно від характеру перебігу ХСН: група I (n = 7) — пацієнти, які померли протягом року спостереження (середній вік — 63,0 [60,5; 65,0] року), група II (n = 13) — пацієнти зі зниженням LV EF до кінця 12-го місяця спостереження (середній вік — 63,0 [60,5; 65,0] року, група III — пацієнти з порушенням діастолічної функції серця в кінці періоду спостереження (середній вік — 54,5 [52,0; 57,0] (n = 14) (табл. 1).
При обстеженні проводився аналіз скарг, анамнезу, факторів судинного ризику, даних об’єктивного дослідження, клініко-лабораторних та клініко-інструментальних методів дослідження. Глікозильований гемоглобін (HbA1c) визначався в сироватці крові турбідиметричним методом з використанням набору Liquidirect (Human GmbH, Німеччина). Рівень глюкози сироватки крові досліджувався на біохімічному аналізаторі Flexor E (Vital Scientific N.V., Нідерланди) набором «Глюкоза СПЛ» колориметричним методом GOD-POD. Рівень інсуліну визначався за допомогою набору реагентів Insulin Rapid AccuBind ELISA Kits (Monobind Insulin, США) методом твердофазного імуноферментного аналізу. Розраховували індекс інсулінорезистентності (НОМА) за формулою: HOMA = рівень інсуліну сироватки × рівень глюкози / 22,5. Значення індексу більше 2,5 визначали як інсулінорезистентність.
Трансторакальна ехокардіографія виконувалася на ультразвуковому апараті Siemens AcUSONSC 2000 (Siemens Medical Solution, Mountain View, США) датчиком від 3,5 до 7 МГц за загальноприйнятою методикою. Оцінювалися найбільш інформативні показники, такі як: кінцево-діастолічний об’єм LV (left ventricle end-diastolyc volume, LV EDV), кінцево-систолічний об’єм LV (left ventricle end-systolic volume, LV ESV), лінійний розмір лівого передсердя (left atrium linear dimension, LALD), фракція викиду лівого шлуночка (left ventricle ejection fraction, LV EF), час уповільнення потоку раннього діастолічного наповнення лівого шлуночка (transmitral deceleration time, Dt), час изоволюмічної релаксації LV (left ventricle isovolumic relaxation time, IVRT), співвідношення максимальних швидкостей раннього і пізнього наповнення LV в діастолу (the ratio of peak velocity blood flow in early diastole to peak velocity flow in late diastole, E/A), співвідношення максимальних швидкостей раннього наповнення LV за даними спектрального та тканинного допплерівського дослідження (the ratio of transmitral Doppler early filling velocity to tissue Doppler early diastolic mitral annular velocity, E/e’), середній тиск в легеневій артерії (mean pulmonary artery pressure, PA MP).
Визначали також ендотелійзалежну вазодилатацію плечових артерій (endothelium dependent dilation, EDD). Ступінь EDD визначався в пробі з реактивною гіперемією лінійним широкосмуговим датчиком 5–12 МГц в допплерівскому режимі з кольоровим картуванням тричі на лівій і правій плечових артеріях з 15-хвилинною перервою між спробами за методикою D.S. Celermajer [14] в модифікації О.В. Іванової [15].
Тривалість спостереження становила 12 місяців. Усі хворі отримували стандартне лікування: β-блокатор бісопролол — 2,5–5 мг один раз вранці, інгібітор АПФ раміприл — 5–10 мг один раз увечері, амлодипін — 2,5–10 мг увечері, аспірин — 75 мг один раз після обіду, аторвастатин 20 мг один раз після обіду, за необхідності додаткового зниження артеріального тиску індапамід — 2,5 мг один раз уранці.
Статистичну обробку результатів проводили з використанням комп’ютерної програми SPSS 19 для Windows. Кількісні змінні описували такими параметрами: медіана (Мe), 25-й і 75-й процентилі (Me [Q1; Q3]); якісні ознаки — у вигляді частоти подій (відсоток від нормального числа спостережень). Для визначення відмінностей між незалежними вибірками використовували U-критерій Манна — Уїтні. Частоту ознак в групах порівнювали за допомогою критерію χ2.
Результати
Середній вік пацієнтів з різними варіантами несприятливого перебігу ХСН становив 60,0 [55,8; 63,3] року. Вірогідно молодшими за віком були пацієнти групи III порівняно з пацієнтами групи I (р = 0,001) і групи II (р = 0,001) (табл. 1).
Тривалість ІХС у загальній популяції пацієнтів варіювала від 5 до 10 років і в середньому становила 7,0 [5,0; 10,0] року, тривалість ЦД 2-го типу — 6,0 [5,0; 9,0] року. При аналізі клініко-анамнестичних показників у досліджуваних групах хворих з різними варіантами несприятливого перебігу ХСН був встановлений вірогідно більш тривалий анамнез ІХС у групі I порівняно з пацієнтами групи II (р = 0,001) і групи III (р = 0,001). У хворих групи III також був вірогідно коротший анамнез за ІХС порівняно з пацієнтами групи II (р = 0,001). Аналогічна картина спостерігалася і при порівнянні тривалості анамнезу за СД 2-го типу. Більш тривалий анамнез ЦД 2-го типу був у пацієнтів групи I порівняно з пацієнтами групи II (р = 0,007) і групи III (р = 0,001). У хворих групи III також був вірогідно коротший анамнез за ІХС порівняно з пацієнтами групи II (р = 0,001). Вірогідно вищий ІМТ був у пацієнтів групи III порівняно з пацієнтами групи I (р = 0,001) і групи II (р = 0,001), пацієнти групи I і групи II за ІМТ не відрізнялися (р > 0,05) (табл. 1).
Спадковість за ІХС, згідно з анамнезом, була зафіксована у 58,8 % пацієнтів, а спадковість за ЦД 2-го типу — у 58,8 %. Кількість курців становила 84,4 %, фізична активність була знижена у 91,2 % пацієнтів. При аналізі такого показника, як ступінь АГ, було виявлено, що АТ від 160/100 до 179/99 мм рт.ст. реєструвався у 47,1 % пацієнтів, у той час як АТ 180/110 мм рт.ст. і вище відзначався в 52,9 % пацієнтів у загальній групі хворих на ІХС з ЦД 2-го типу і несприятливим перебігом ХСН.
При аналізі показників в групах з різними варіантами перебігу ХСН згідно з критерієм χ2 спостерігалися вірогідні відмінності в групах за наявністю обтяженої спадковості за ЦД 2-го типу між пацієнтами II і III груп (р = 0,04). Відзначалася тенденція до більшої за частотою обтяженої спадковості за ІХС у померлих пацієнтів (р > 0,05). АТ 180/110 мм рт.ст. і вище відзначався у всіх пацієнтів I групи, що було вірогідно частіше, ніж у пацієнтів II (р = 0,04) і III груп (р = 0,04). У переважної більшості хворих в групах рівень фізичної активності був знижений, за частотою цього показника групи не відрізнялися (р > 0,05), також групи не відрізнялися і за частотою куріння (р > 0,05) (табл. 2).
/128.jpg)
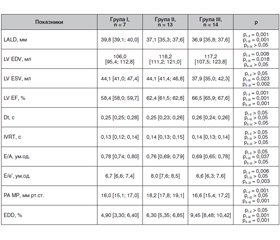
У всіх хворих на ІХС і ЦД 2-го типу при несприятливому перебігу ХСН LV EDV в середньому відповідав 37,2 [36,0; 38,2] мм, LV EDV — 115,5 [107,3; 118,9] мл, LV ESV — 41,9 [37,9; 45,0] мл, LV EF — 62,8 [60,8; 66,4] %, Dt — 0,25 [0,24; 0,26] с , IVRT — 0,14 [0,13; 0,14] с, E/A — 0,69 [0,64; 0,74], E/e’ — 7,38 [6,61; 7,9], PA MP — 17,0 [16,0; 18,3] мм рт.ст., EDD — 6,85 [5,48; 9,25] %.
При аналізі цих показників у групах з різними варіантами несприятливого перебігу ХСН слід зазначити вірогідно більший LALD у пацієнтів I групи порівняно з пацієнтами групи II (р < 0,001) і групи III (р = 0,001), а також вірогідно менший LV EDV порівняно з пацієнтами групи II (р = 0,008) і групи III (р = 0,018). Вірогідно нижчий LV ESV відзначався у пацієнтів групи III порівняно з пацієнтами групи I (р = 0,023) і групи II (р = 0,002), LV ESV у пацієнтів групи I і групи II вірогідно не відрізнявся (р > 0,05) (табл. 3).
LV EF була збереженою у всіх групах несприятливого перебігу ХСН, однак найбільш низькою вона була у пацієнтів групи I порівняно з пацієнтами групи II (р < 0,001) і групи III (р < 0,001) (табл. 3).
Dt і IVRT у досліджуваних групах не відрізнялися (р > 0,05). Співвідношення E/A було вірогідно нижчим у пацієнтів III групи порівняно з показником у пацієнтів I групи (р = 0,037), вірогідних відмінностей цього показника у пацієнтів II групи з показником у пацієнтів I і III груп не відзначалося (р > 0,05). Співвідношення E/e’ було вірогідно вищим у пацієнтів групи II порівняно з пацієнтами групи I (р = 0,006) і групи III (р = 0,003). PA MP не перевищувало в усіх групах 20 мм рт.ст., проте вірогідно вищим воно було у пацієнтів групи II порівняно з пацієнтами групи I (р = 0,001) і групи III (р = 0,001). Вірогідних відмінностей значень показників E/e’ і PA MP у пацієнтів групи I і групи III не відзначалося (р > 0,05). EDD була вірогідно вищою у пацієнтів групи III порівняно з пацієнтами групи I (р = 0,001) і групи II (р = 0,001). Вірогідних відмінностей показника EDD у пацієнтів групи I і групи II не відзначалося (р > 0,05) (табл. 3).
Обговорення
Несприятливий перебіг ХСН у хворих на ІХС з ЦД 2-го типу, що закінчився летальним результатом, асоціювався з вірогідно більшим віком чоловіків, з вірогідно більшою тривалістю анамнезу за ІХС та ЦД 2-го типу, тенденцією до більшої частоти обтяженої спадковості за ЦД 2-го типу і зниженою фізичною активністю, вірогідно більш високим рівнем артеріального тиску — 180 мм рт.ст. і вище, який доказово є потенційною причиною розвитку ХСН. Отримані результати збігаються з опублікованими даними зарубіжних авторів [16, 17].
Виявлення порушень діастолічної функції LV за допомогою ЕхоКГ є основою ідентифікації діастолічної СН у пацієнтів із ХСН та збереженою LV EF, а отже, показане в усіх випадках підозри на останню. Найважливішим параметром внутрішньосерцевої гемодинаміки є LV EF — інтегральний показник систолічної функції серця, що демонструє, яка частка кінцево-діастолічного об’єму LV викидається в аорту під час систоли [8, 9].
У пацієнтів, які померли протягом 12 місяців спостереження, навіть в умовах збереженої фракції викиду вихідна величина LV EF була вірогідно меншою, ніж в II і III групах, тобто у пацієнтів з прогресуючими протягом року порушеннями стану систолічної та діастолічної функцій серця, що асоціювалося з гіршим прогнозом [17, 18].
Незважаючи на те, що розміри лівого передсердя не виходили за межі нормальних у всіх пацієнтів, середні розміри лівого передсердя в діастолу були вірогідно більшими у померлих пацієнтів. Вірогідно меншим у цих пацієнтів був LV EDV, що свідчило про більше ремоделювання лівих відділів серця у пацієнтів з найгіршим прогнозом перебігу ХСН при спостереженні протягом року [16].
У всіх групах пацієнтів відзначалася ендотеліальна дисфункція, проте в групі померлих вона була більш вираженою, що свідчило про значні процеси судинного ремоделювання.
Висновки
Тяжкість перебігу ХСН у хворих на ІХС з ЦД 2-го типу і збереженою LV EF при летальному результаті протягом 12 місяців спостереження асоціюється зі збільшенням тривалості ІХС та ЦД 2-го типу, більш високим рівнем артеріального тиску і більш низькими LV EF і EDD плечових артерій.
У хворих на ІХС з ЦД 2-го типу і збереженою LV EF серця ранніми ультразвуковими структурними маркерами несприятливого перебігу ХСН при летальному результаті протягом 12 місяців спостереження є збільшення LALD навіть у межах нормальних значень і зниження LV EDV.
Конфлікт інтересів. Автор повідомляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Savarese G., Lund L.H. Global Public Health Burden of Heart Failure. Card. Fail. Rev. 2017. 3. 7-11 [Google Scholar] [CrossRef].
2. Jia G., Whaley-Connell A., Sowers J.R. Diabetic cardiomyopathy: a hyperglycaemia- and insulin-resistance-induced heart disease. Diabetologia. 2018. 61(1). 21-28. https://doi.org/10.1007/s00125-017-4390-4
3. Severino P., D’Amato A., Netti L. еt al. Diabetes Mellitus and Ischemic Heart Disease: The Role of Ion Channels. Int. J. Mol. Sci. 2018 Mar 10. 19(3). pii: E802.
4. Kumar R., Kerins D.M., Walther T. Cardiovascular safety of anti-diabetic drugs. European Heart Journal. Cardiovascular Pharmacotherapy. 2015. Р. 202-208. Doi: 10.1093/ehjcvp/pvv035.
5. IDF Diabetes Atlas, 7th ed. 2015. Available at: http://www.diabetesatlas.org/resources/2015-atlas. html.
6. Stratton I.M., Adler A.I., Neil H.A. еt al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective, observational study. BMJ. 2000. 321. 405-412.
7. Wieczór R., Wieczór A.M, Kulwas A., Rość D. Type 2 Diabetes and Cardiovascular Factors Contrasted with Fibrinolysis Disorders in the Blood of Patients with Peripheral Arterial Disease. Medicina (Kaunas). 2019 Jul 22. 55(7); Chatterjee S., Khunti K., Davies M.J. Type 2 diabetes. Lancet. 2017 Jun 3. 389(10085). 2239-2251.
8. Bowes C.D., Lien L.F., Butler J. Clinical aspects of heart failure in individuals with diabetes. Diabetologia. 2019. https://doi.org/10.1007/s00125-019-4958-2
9. Maggioni A.P., Dahlström U., Filippatos G. еt al.; Heart Failure Association of the European Society of Cardiology (HFA). EURObservational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur. J. Heart Fail. 2013 Jul. 15(7). 808-17. doi: 10.1093/eurjhf/hft050. Epub 2013 Mar 28.
10. Yahagi K., Kolodgie F.D., Lutter C. еt al. Pathology of Human Coronary and Carotid Artery Atherosclerosis and Vascular Calcification in Diabetes Mellitus. Arterioscler. Thromb. Vasc. Biol. 2017 Feb. 37(2). 191-204.
11. Saotome M., Ikoma T., Hasan P., Maekawa Y. Cardiac Insulin Resistance in Heart Failure: The Role of Mitochondrial Dynamics. Int. J. Mol. Sci. 2019 Jul 20. 20(14). pii: E3552.
12. Sofa D.A., Hadyana S., Keri L., Rizky A. Medication Adherence Contributes to an Improved Quality of Life in Type 2 Diabetes Mellitus Patients: A Cross-Sectional Study. Diabetes Therapy. 2016. Is.7. P. 1-10.
13. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC). Journal of Heart Failure. 2016. 37. Is. 27. 2129-2200.
14. Celermajer D.S., Sorenson K.E., Gooch V.M. et al. Non-invasive detection of endotelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 1992. 340. 1111-1115.
15. Иванова О.В., Рогоза Т.В., Балахонова Г.Н. Определение чувствительности плечевой артерии к напряжению сдвига на эндотелии как метод оценки состояния эндотелийзависимой вазодилатации с помощью ультразвука высокого разрешения у больных с артериальной гипертонией. Кардиология. 1998. № 3. С. 37-41.
16. Seferovic P.M., Petrie M.C., Filippatos G.S. et al. Type 2 diabetes mellitus and heart failure: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2018. 20(5). 853-872. https://doi.org/10.1002/ejhf.1170CrossRefGoogle Scholar
17. Mentz R.J., Bethel M.A., Gustavson S. et al Baseline characteristics of patients enrolled in the Exenatide study of cardiovascular event lowering (EXSCEL). Am. Heart J. 2017. 187. 1-9. https://doi.org/10.1016/j.ahj.2017.02.005CrossRefGoogle Scholar.
18. Udell J.A., Cavender M.A., Bhatt D.L. еt al. Glucose-lowering drugs or strategies and cardiovascular outcomes in patients with or at risk for type 2 diabetes: A meta-analysis of randomised controlled trials. Lancet Diabetes Endocrinol. 2015. 3. 356-366.
19. 2013 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD : The Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). European Heart Journal. 2013. 34. Is. 39. 3035-3087.

/128.jpg)
/129.jpg)